美洲红点鲑、白斑红点鲑及杂交后代遗传分析
2016-10-26谷伟郭媛户国孙鹏白庆利王炳谦
谷伟,郭媛,户国,孙鹏,白庆利,王炳谦
(中国水产科学研究院黑龙江水产研究所,哈尔滨 150070)
美洲红点鲑、白斑红点鲑及杂交后代遗传分析
谷伟,郭媛,户国,孙鹏,白庆利,王炳谦*
(中国水产科学研究院黑龙江水产研究所,哈尔滨150070)
以美洲红点鲑和白斑红点鲑双列杂交F1及其自交形成的4个群体为试验材料,利用7对微卫星引物分析遗传结构。结果表明,7对引物均表现良好多态性,可作4个群体遗传结构分析;各组合PIC平均值0.5079~0.6467,属高度多态性;有效等位基因数4.3688~5.5764;平均观测杂合度0.6857~0.7143,平均期望观测杂合度0.6290~0.8234,杂交组中杂合度高于双亲,均显示子代高遗传变异水平;4个群体中,美洲红点鲑纯繁群体(AA)和美白杂交群体(AB)间遗传距离最大(0.757343),最小遗传距离(0.366335)。UPGMA系统树显示,美白杂交群体(AB)和白美杂交群体(BA)亲缘关系最近,与白斑红点鲑纯繁群体(BB)聚为一类,达到改良目的,为分子标记辅助选育奠定基础。
美洲红点鲑;白斑红点鲑;微卫星标记
网络出版时间2016-7-21 14:08:58[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160721.1408.002.html
谷伟,郭媛,户国,等.美洲红点鲑、白斑红点鲑及杂交后代遗传分析[J].东北农业大学学报,2016,47(7):48-55.
Gu Wei,Guo Yuan,Hu Guo,et al.Genetic diversity ofSalvelinus fominalis,S.leucomaenisand their hybrid offsprings[J]. Journal of Northeast Agricultural University,2016,47(7):48-55.(in Chinese with English abstract)
红点鲑主要分布在加拿大、瑞士、美国、新西兰、奥地利、芬兰、挪威、日本等地,中国分布较少,主要是花羔红点鲑、美国移入美洲红点鲑(Salvelinus fominalis)和日本引进白斑红点鲑(Salvelinus leucomaenis)[1-3]。美洲红点鲑生长快、肉质鲜美,但易患疖疮病,繁殖期死亡率高,而白斑红点鲑抗病力较强[4-5]。杂交已成为提高产量和品质主要措施,王新成研究牙鲆和石鲽之间杂交,后代成活率和生长速度均显著高于牙鲆和石鲽,杂种优势显著[6]。区又君通过平鲷和黑鲷杂交成功育出幼苗[7]。徐革锋对哲罗和细鳞鲑杂交,正交组苗种生长速度高于双亲[8]。为充分利用红点鲑不同品种生长特点,获得抗病强、生长快速养殖新品种,本研究前期开展两品种间杂交工作,正交组苗种生长指标高[9-10]。
生长、抗逆等属数量性状,由微效多基因控制。寻找与生长性状相关标记,了解群体间遗传多态性遗传改良。微卫星DNA具有等位基因数目多、重复性好、共显性等特点,已广泛应用于不同群体划分、亲缘关系鉴定、基因定位、种群遗传多样性分析等方面[11-13]。国外利用分子标记技术较早,相继开展虹鳟[14]、白斑红点鲑、美洲红点鲑[15-17]遗传多样性及遗传结构等研究;国内黄权和马波等[18-19]对花羔红点鲑遗传多样性作RAPD和微卫星分析,发现其遗传多样性水平较高,选育潜力良好。杨建宝等利用15个微卫星标记对引进美洲红点鲑遗传作多样性分析,认为美洲红点鲑选育潜力较高,是理想育种材料,但尚未进行种间杂交相关研究。本研究利用杂交优势,针对不同品种间性状特点,通过杂交筛选出抗逆性强、生长快速优势组合,为养殖生产提供优良养殖品种,通过微卫星标记技术分析美洲红点鲑和白斑红点鲑及其杂交子代遗传多样性,为开展杂交选育提供理论支持。
1 材料与方法
1.1材料
美洲红点鲑和白斑红点鲑取自中国水产科学研究院黑龙江水产研究所渤海冷水性鱼类实验站。其中,美洲红点鲑源自美国引进发眼卵,多年自群繁育形成养殖群体;为获得可以产生属间种间杂种优势优良种质资源,黑龙江水产研究所于1996年首次从日本引进白斑红点鲑发眼卵,现已建成拥有亲鱼、后备亲鱼2万余尾苗种供应扩繁基地,本试验所用白斑红点鲑源于该群体。随机挑选健壮、发育良好36月龄鱼为试验对象。
1.2试验设计
采用2×2完全双列杂交法[21],建立4个组合(见表1),每个组合10尾鱼。所有试验鱼在同一池塘养殖,PIT标记每尾鱼,试验结束时用0.5 mL·L-1苯氧乙醇水溶液将鱼麻醉,每个组合剪取30尾鳍条样本储存于75%酒精溶液中用于遗传多样性分析。
1.3基因组DNA提取
为开展杂交群体与亲本群体遗传多样性分析,采用Invitrogen公司Genomic DNA Mini Kit,进行DNA抽提试验。具体方法如下:加Genomic Digestion Buffer 180 μL,Proteinase K 20 μL,白斑红点鲑、美洲红点鲑自交及其杂交子代鳍条样品分别取100 mg剪碎,为使白斑红点鲑和美洲红点鲑及其杂交子代细胞充分裂解,用灭菌剪刀将其剪碎,置于55℃恒温水浴锅中消化4 h至细胞完全裂解。在水浴过程中,每隔一段时间颠倒混匀一次,促进细胞裂解充分;12 000 r·min-1离心3 min(室温),吸取上清液到新离心管中;加入20 μL RNase A,颠倒混匀,室温放置2 min;加Genomic Lysis/Binding Buffer 200 μL,颠倒混匀;加入无水乙醇200 μL,颠倒混匀;将溶解产物(约600 μL)用移液枪将液体全部转移到吸附柱中,10 000 r·min-1离心1 min,移除收集管,置于干净离心管中;加500 μL Wash Buffer 1,10 000 r·min-1离心1 min(室温),将吸附柱置于干净1.5 mL离心管中,加入500 μL Wash Buffer 2,12 000 r·min-1离心3 min(室温);将吸附柱置于干净1.5 mL离心管中,加入50 μL Elustion Buffer,12 000 r·min-1离心2 min,即得到样品基因组DNA原液,贮存于-20℃备用。
1.4微卫星引物及PCR扩增
微卫星引物参照文献[17]和[22],选取长度在18~25 bp,扩增率大于80%引物,其中美洲红点鲑8个,白斑红点鲑5个,对美洲红点鲑和白斑红点鲑及其杂交子代基因组DNA引物筛选。挑选其中7个多态性较好微卫星位点分别对白斑红点鲑和美洲红点鲑及其杂交子代120尾(每组30尾)基因组DNA扩增,引物退火温度及序列见表2,由Invitrogen公司合成。
采用Fermentas Taq polymerase进行PCR试验,本试验PCR反应体系为15 μL,包括10×buffer 1.5 μL,Mg2+(25 mmol·L-1)1.2 μL,dNTPs(2 mmol·L-1)1.5 μL,上下游引物(10 mmol·L-1)各0.5 μL,模板DNA 1 μL,Taq DNA聚合酶(5 U·μL-1)0.18 μL,ddH2O 8.62 μL。扩增反应均在BIO-RAD公司梯度PCR仪上完成,PCR反应程序为:94℃预变性5 min;94℃变性30 s,退火温度55~64℃20 s,72℃延伸30 s,30个循环;72℃延伸5 min。将反应后PCR产物用10%非变性聚丙烯酰胺凝胶电泳结合银染法显色检测,扫描成像,分析个体基因型。

表1 2×2完全双列杂交产生F1组合Table 1F1combinations generated by 2×2 full diallel cross

表2 美洲红点鲑和白斑红点鲑微卫星位点引物序列鱼扩增信息Table 2Primer sequence and amplification information in the present experiment of Salvelinus fominalis and Salvelinus leucomaenis
1.5数据处理
利用PopGene(Version 3.2)软件分别统计观测等位基因数(Observed number of alleles,Na)、有效等位基因(Effective number of alleles,Ne)、观测杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)等遗传变异参数。利用Gervus 3.0计算多态信息含量(Polymorphism information content,PIC)。
2 结果与分析
2.1微卫星PCR扩增结果
试验选取13个微卫星标记对白斑红点鲑和美洲红点鲑扩增,经琼脂糖凝胶电泳检测,扩增结果显示其中7个微卫星标记条带清晰。通过筛选得到7个微卫星位点,扩增后结果显示有不同程度多态性,且条带清晰,图1为位点SfoC28(A)、SfoD75(B)、Sle6(C)和SnaMSU01(D)部分电泳结果。
2.2遗传多样性分析
遗传变异参数见表3,经统计分析发现4个试验组中AB组平均等位基因数、平均有效等位基因数最高分别为8.2875和5.5764,BB组最低分别为6.1429和4.3688;AB组和BA组观察杂合度平均值和期望杂合度平均值较高,其中观察杂合度平均值分别为0.7143和0.7095,期望杂合度平均值分别为0.8234和0.7879;BA组多态信息含量最高,平均值为0.6467;其中AA组和AB组中度多态标记(0.25≤PIC≤0.5)2个,高度多态标记(PIC≥0.5)5个,BB组中有1个无多态标记,高度多态标记6个,BA组均为高度多态标记。等位基因分布情况如图2所示,其分布属于典型“L”形状。7个微卫星位点FIS值如表4,群体间固定系数为0.0266。结果表明,本研究4个试验组基本为高度多态性水平。

图1 位点SfoC28(A)、SfoD75(B)、Sle6(C)和SnaMSU01(D)部分扩增结果Fig.1Amplified result of SfoC28,SfoD75,Sle6 and SnaMSU01 loci
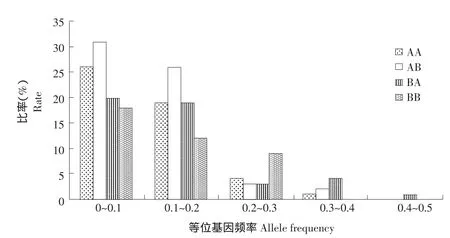
图2 美洲红点鲑和白斑红点鲑及其杂交子代等位基因频率分布Fig.2Allele frequency distribution of Salvelinus fominalis,Salvelinus leucomaenis,and their hybrid offsprings
2.3群体间遗传距离
利用phylip 3.69软件计算群体间遗传距离(见表5),AA组与AB之间遗传距离最大(0.757343),AB组与BA组之间遗传距离最小(0.366335)。
根据遗传距离作UPGMA聚类分析(见图3),由图3可知,4个试验组聚为2支,其中AB组与BA组先聚为一类,然后同BB组聚为一大类,AA组自成一类。
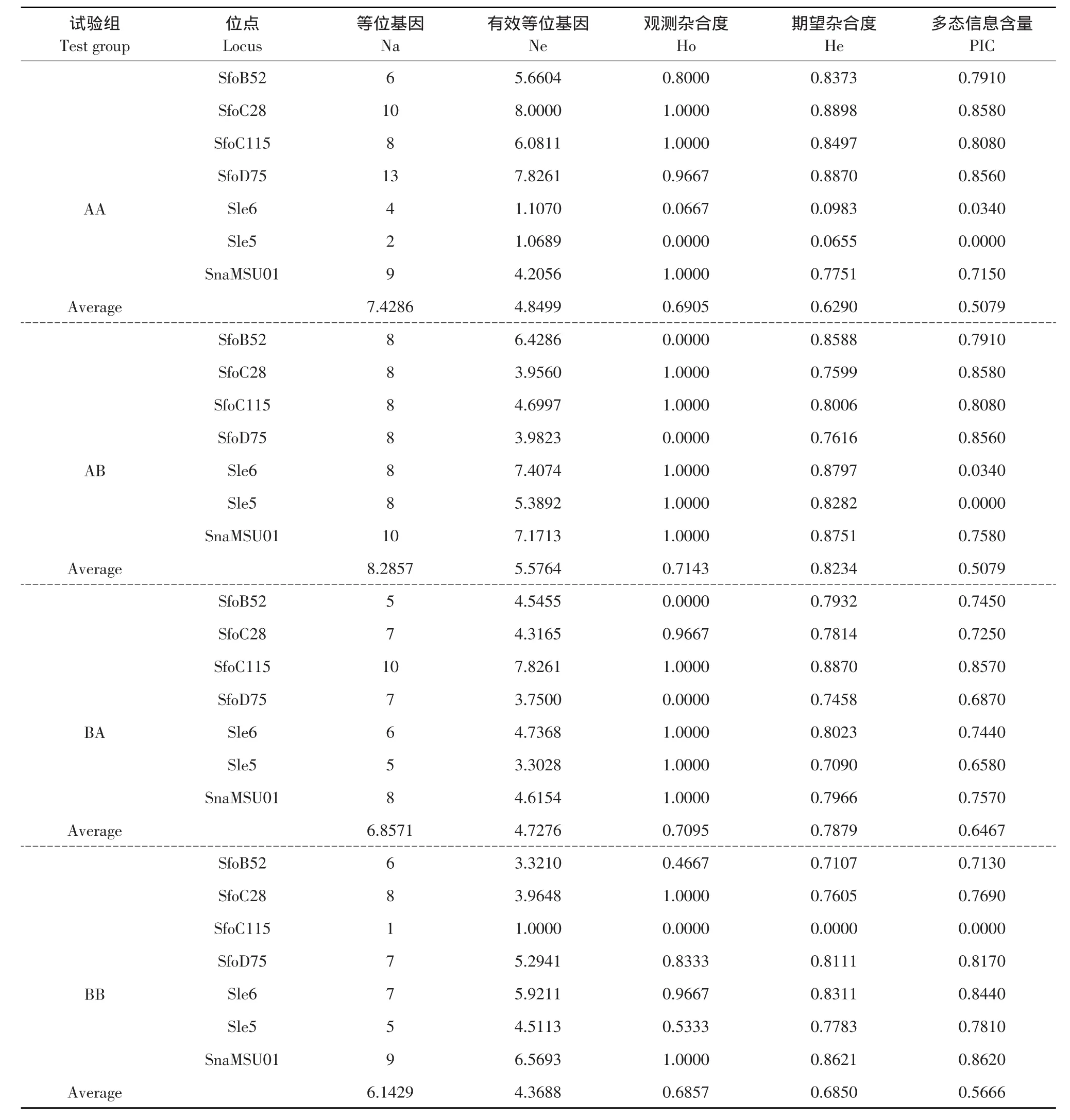
表3 美洲红点鲑和白斑红点鲑及其杂交子代7个微卫星遗传标记位点统计信息Table 3Statistical information of seven microsatellite loci of Salvelinus fominalis and Salvelinus leucomaenis and their hybrid offsprings

图3 美洲红点鲑和白斑红点鲑及其杂交子代群体UPGMA聚类结果Fig.3Population UPGMA cluster of Salvelinus fominalis,Salvelinus leucomaenis,and their hybrid offsprings
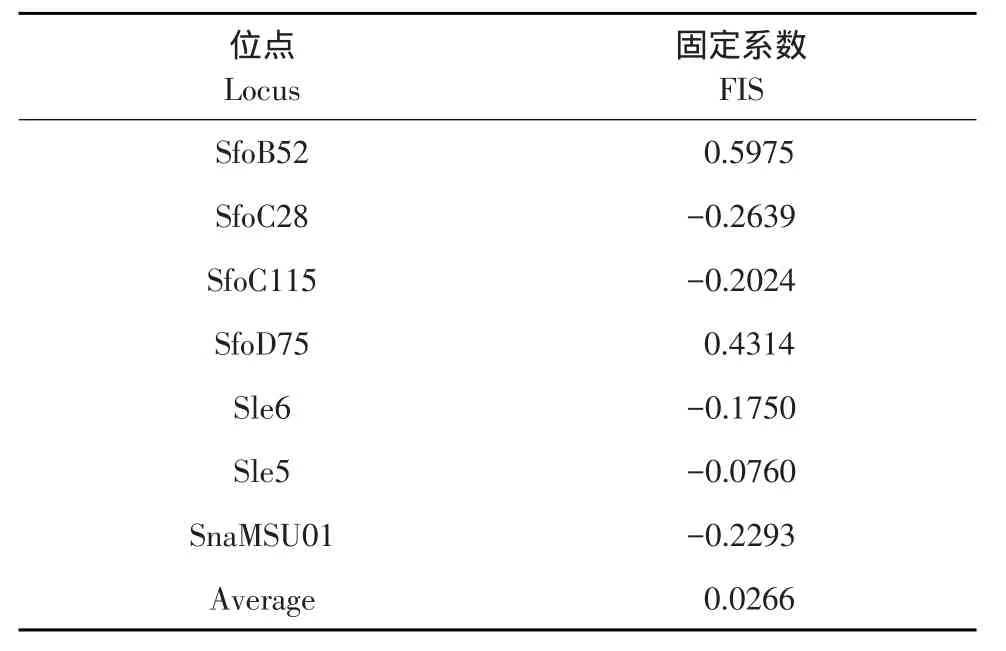
表4 7个微卫星遗传标记位点固定系数Table 4FIS of seven microsatellite loci
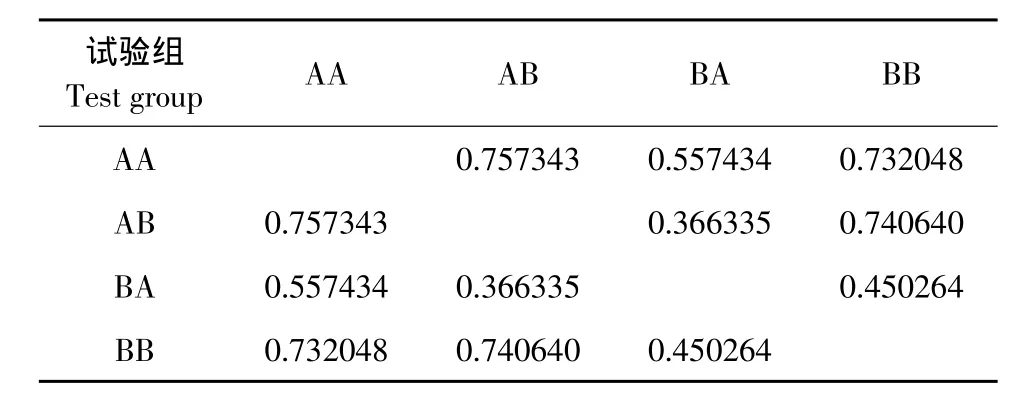
表5 美洲红点鲑和白斑红点鲑及其杂交子代间遗传距离Table 5Genetic distance of Salvelinus fominalis,Salvelinus leucomaenis,and their hybrid offsprings
3 讨论
3.1美洲红点鲑和白斑红点鲑及其杂交子代遗传多样性分析
生物多样性中遗传多样性是重要组成部分,每一个物种都具有独特基因型和遗传形式,基因遗传多样性代表物种多样性[23]。王炳谦等用10对SSR引物分析5个虹鳟(Oncorhynchus mykiss)品系平均杂合度为0.8163,通过与配合力结合作杂交优势预测,获得相似结果[24];张玉勇等用13个微卫星分子标记对虹鳟和山女鳟(Oncorhynchusmasou masou)杂交亲本与杂交子代作分子遗传机制研究,认为虹鳟和山女鳟杂交子代遗传符合孟德尔遗传规律,属两性融合生殖,是真正意义杂交种[25]。杨建宝等利用15个微卫星标记进行美洲红点鲑群体遗传多样性分析,结果表明平均期望杂合度为0.664,多态信息含量在0.360~0.719,平均多态信息含量为0.578,认为引进美洲红点鲑遗传多态性水平高,选育潜力巨大[20]。以上研究与本研究结果中AA组相近,但并未深入研究遗传改良方法。
本研究选择7个微卫星位点用于美洲红点鲑和白斑红点鲑及其杂交子代遗传多样性分析,其中AB组平均等位基因数、平均有效等位基因数最高分别为8.2875和5.5764,AB组和BA组观察杂合度和期望杂合度均高于AA组和BB组。杂交子代平均有效等位基因数(Na,Ne)和杂合度(Ho,He)均明显高于亲本,说明杂交群体基因杂合性增加明显。基因杂合性对于机体抗逆性、繁殖性能和生长速度提升具有重要意义,美洲红点鲑与白斑红点鲑种间杂交子代杂种优势明显。本试验中有效等位基因数低于观察等位基因数,表明等位基因在4组群体中分布不均匀。推测由于美洲红点鲑和白斑红点鲑长期处于小群体自繁导致,可增加检测基因位点数[26]。群体内FIS值说明基因分布平衡状态,FIS=0时为平衡状态,FIS>0时则表明杂合子过少,FIS<0时说明杂合子过剩[27]。本研究FIS平均值为0.0266,表明杂合子缺失,推测这种现象与交配父母本有一定亲缘关系。
等位基因频率分布可检验物种是否经历瓶颈效应。经历瓶颈效应会使物种等位基因流失、遗传多样性降低,导致物种衰退。在等位基因频率分布图中,成典型“L”形时,群体为非瓶颈效应[28]。本研究中4个试验组等位基因频率分布在0.0~0.1之间比例大于0.1~0.2之间,属于典型“L”图形,证明美洲红点鲑和白斑红点鲑及其杂交子代未经历瓶颈效应。
PIC能够反映遗传多样性水平,根据Bostein等提出,当PIC≥0.5时为高度多态,0.25≤PIC≤0.5时为中度多态[29]。本研究中高度多态达到5个,中度多态为2个,其中BA组多态信息含量最高,平均值为0.6467。说明在4个组合中利用7对微卫星引物获得多态信息含量比较丰富,美洲红点鲑和白斑红点鲑及其杂交子代遗传多样性分析有效性和可靠性较高。
通过遗传多样性分析4个试验组多态信息含量较丰富,说明美洲红点鲑和白斑红点鲑及其杂交子代具有较为丰富遗传多样性,可利用分子标记辅助育种方法得到优质品系,为今后生产和选育工作提供理论依据。
3.2美洲红点鲑和白斑红点鲑杂交子代遗传偏向性分析
杂交在鱼类育种工作中对增强子代生存力,丰富遗传结构,获得杂种优势有重要作用[30]。杂交子代由于兼具双亲优点,因此在表现型方面,子代在抗病能力、生长速度、体表及存活率等方面均表现杂种优势[23]。前期研究结果表明,BA组合受精率达84.1%,比父本AA组合66.1%高18%,杂种优势较明显,对于改善美洲红点鲑受精率低、繁殖死亡率高效果显著[9];而生长速度正交子代AB组体长和体质量平均值均高于亲本,成活率比反交子代BA组高,与本试验结果一致。本试验属于种间层次远缘杂交,后代在遗传上表现为较明显变异和重组,根据群体间遗传距离可知AA组与其他3组关系较远,AB组、BA组与BB组同属一支,其中AA组与AB组遗传距离最大。显示杂交后代更偏向于白斑红点鲑,白斑红点鲑对杂交子代遗传贡献更大。
目前鱼类杂交试验中杂交后代与亲本遗传距离不对等现象较多,张玉勇通过对虹鳟和山女鳟杂交子代研究显示,在遗传上更偏向父本山女鳟[25];李传阳采用筛选12个种间特异性微卫星标记分析斑鳜、鳜鱼以及斑鳜(Siniperca scherzeri)♀×鳜鱼(S. chuatsi)♂杂交一代、杂交二代群体遗传特征,得出杂交一代遗传表现上偏向鳜鱼,与本试验结果相似[32]。刘颖等对大黄鱼(Pseudosiaena crocea)♀×黄姑鱼(Nibea albiflora)♂杂交子代AFLP分析发现其遗传表现与母本大黄鱼较接近[33];王金龙等研究远缘杂交双亲与子代遗传结构关系,应用RAPD方法进行奥利亚罗非鱼(Oreochromis aurea)(♀)与鳜(Siniperca chuatsi)(♂)杂交子代组合与父母本遗传关系研究,认为其杂交子代中导入父本遗传物质,增加子代组合多态性,并且与母本回交及自交,杂交子代遗传结构向母本靠近[34]。蔡磊等认为亲本遗传物质对后代贡献率不一致因两亲本基因纯合度不同,基因纯度高亲本基因型在后代中被检测几率增加[35],但王金龙认为杂交遗传过程中重组和发育染色体选择性丢失导致双亲遗传给子代比例失衡[34]。
3.3美洲红点鲑和白斑红点鲑杂交亲和性分析
关于硬骨鱼类远缘杂交报道中,大部分杂交亲和性表现较低,具有应用价值杂交组合不足1%成功率[36]。Turelli等认为杂交亲和性低是生殖隔离导致,当两个品种基因相互融合出现相互抑制,会阻碍其杂交亲和性[37]。鱼类远缘杂交杂种胚胎多发育不正常,孵化率极低[30]。徐冬冬等对8种鲆鲽鱼杂交也发现多对通过人工杂交获得胚胎能受精并发育,但发育到一定阶段后胚胎或孵出仔鱼死亡[38]。本试验表明AA组与AB之间遗传距离最大(0.757343),AB组与BA组之间遗传距离最小(0.366335)。说明杂交组遗传白斑红点鲑生长速度快、体型大、抗逆性强优势性状,而从体表形态上遗传美洲红点鲑艳丽体色特征弥补白斑红点鲑不足。
本研究中正交和反交,其子代均能正常发育,父母本杂交具有较高亲和力、杂交第一代摄饵良好、生长率高、抗病力强、成活率高。分析结果与生长曲线拟合结果一致:AB组具有明显生长优势[10]。后续研究将通过回交,强化其生长性能和抗逆性能,克服性状分离,增强杂交优势。
4 结论
本试验杂交后代多样性明显高于亲本,继承双亲优良性状。在生产中,红点鲑种间杂交育种可获得具有较强杂种优势杂交组合。
[1]黄权,张东鸣,吴莉芳,等.红点鲑属鱼类资源现状及保护利用[J].水产学杂志,2000,13(2):14-19.
[2]董崇智,李怀明,牟振波,等.中国淡水冷水性鱼类[M].哈尔滨:黑龙江科学技术出版社,2001:87-89.
[3]户国,谷伟,白庆利,等.主要养殖鲑科鱼类遗传育种的研究进展[J].水产学杂志,2012,25(3):58-62.
[4]孙大江,王炳谦.鲑科鱼类及其养殖状况[J].水产学杂志,2010,23(2):56-63.
[5]张永泉,刘奕,王炳谦,等.白点鲑胚胎与仔鱼发育[J].动物学杂志,2010,45(5):111-120.
[6]王新成,尤锋,倪高田,等.石鲽与牙鲆人工杂交的研究[J].海洋科学,2003,27(1):1-4.
[7]区又君,李加儿,周宏团.鲷科鱼类属间远缘杂交的发育和生长[J].中国水产科学,2000,7(2):110-112.
[8]徐革锋,尹家胜,刘洋,等.哲罗鲑与细鳞鲑属间远缘杂交的初步研究[J].中国水产科学,2009,16(6):959-966.
[9]阿地力,谷伟,户国,等.美洲红点鲑和白斑红点鲑杂交子代及其亲本早期生产性能比较[J].水产学杂志,2013,26(4):8-11.
[10]郭媛,户国,谷伟,等.美洲红点鲑和白斑红点鲑及其杂交子代幼鱼的生长曲线拟合[J].中国水产科学,2015,22(1):51-59.
[11]张文静,余育,沈韫芬.微卫星DNA遗传分析在原生动物学中的研究进展[J].水生生物学报,2003,27(2):185-190.
[12]王桂兴,刘永新,孙效文,等.牙鲆微卫星分子标记与生长性状的相关性分析[J].东北农业大学学报,2009,40(7):77-84.
[13]李雅娟,于卓,张明昭,等.我国三种野生泥鳅遗传多样性的微卫星分析[J].东北农业大学学报,2010,41(12):75-79.
[14]Rexroad C E,Coleman R L,Hershberger W K,et al.Rapid communication:Thirty-eight polymorphic microsatellite markers for mapping in rainbow trout[J].Journal of Animal Science,2002,80(2):541-542.
[15]Kikko T,Kuwahara M,Iguchi K,et al.Mitochondrial DNA population structure of the white-spotted charr(Salvelinus leucomaenis)in the Lake Biwa water system[J].Zoological Science,2008,25(2):146-153.
[16]Yamamoto S,Morita K,Kitano S,et al.Phylogeography of whitespotted charr(Salvelinus leucomaenis)inferred from mitochondrial DNA sequences[J].Zoological Science,2004,21(2):229-240.
[17]Afanas'ev K I,Rubtsova G A,Shaikhaev E G,et al.Microsatellite variation in white-spotted char Salvelinus leucomaenis from Sakhalin oblast[J].Russian Journal of Genetics,2013,49(9):945-949.
[18]黄权,孙晓雨,谢从新.野生与养殖花羔红点鲑群体DNA多态性RAPD分析[J].东北林业大学学报,2009,37(12):68-71.
[19]马波.花糕红点鲑多态性微卫星筛选及鸭绿江种群遗传多样性分析[J].水产学杂志,2012,25(3):7-10.
[20]杨建宝,张艳萍,苏军虎,等.引进美洲红点鲑群体遗传多样性微卫星的分析[J].四川动物,2012,31(3):348-352.
[21]Eisen E J,Bohren B B,McKean H E.Sex-linked and maternal effects in the diallel cross[J].Aust J Biol Sci,1966,19(6):1061-1072.
[22]King T L,Lubinski B A,Burnham-Curtis M K,et al.Tools for the management and conservation of genetic diversity in brook trout(Salvelinusfontinalis):tri-andtetranucleotidemicrosatellite markers for the assessment of genetic diversity,phylogeography,and historical demographics[J].Conservation Genetics Resources,2012,4(3):539-543.
[23]Wang W,You F,Gao T X,et al.Genetic variations at ten microsatellite loci in natural and cultured stocks of left-eyed flounder Paralichthys olivaceus in Shandong coastal waters[J]. Oceanol Limnol Sin,2004,35(6):530-537.
[24]王炳谦,谷伟,高会江,等.利用配合力和微卫星标记预测虹鳟品系间的杂交优势[J].中国水产科学,2009,16(2):206-213.
[25]张玉勇,白庆利,贾智英,等.虹鳟、山女鳟及其杂交子代(虹鳟♀×山女鳟♂)的微卫星分析[J].水产学报,2009,33(2):188-195.
[26]全迎春,孙效文,梁利群.应用微卫星多态分析四个鲤鱼群体的遗传多样性[J].动物学研究,2005,26(6):595-602.
[27]Weir B S,Cockerham C C.Estimating F-statistics for the analysis of population structure[J].Evolution,1984,38(6):1358-1370.
[28]Luikart G,Allendorf F W,Cornuet J M,et al.Distortion of allele frequency distributions provides a test for recent population bottlenecks[J].Journal of Heredity,1998,89(3):238-247.
[29]Botstein D,White R L,Skolnick M,et al.Construction of a genetic linkage map in man using restriction fragment length polymorphisms[J].American Journal of Human Genetics,1980,32(3):314-331.
[30]楼允东,李小勤.中国鱼类远缘杂交研究及其在水产养殖上的应用[J].中国水产科学,2006,13(1):151-158.
[31]Murakami M,Matsuba C,Fujitani H.The maternal origins of the triploid ginbuna(Carassius auratus langsdorfi):phylogenetic relationships within the C.auratus taxa by partial mitochondrial D-loop sequencing[J].Genes Genet Syst,2001,76(1):25-32.
[32]李传阳,许淼洋,赵金良,等.斑鳜(♀)×鳜鱼(♂)杂交后代遗传特征的微卫星分析[J].水产科学,2014,33(2):97-102.
[33]刘颖,蔡明夷,刘贤德,等.大黄鱼♀与黄姑鱼♂杂交F1家系初孵仔鱼的AFLP分析[J].水产学报,2010,31(6):672-678.
[34]王金龙,杨弘,吴婷婷,等.奥利亚罗非鱼(♀)×鳜(♂)远缘杂交子代的遗传结构[J].中国水产科学,2007,14(1):32-38.
[35]蔡磊,白俊杰,李胜杰,等.大口黑鲈北方亚种和佛罗里达亚种及其杂交子代的遗传分析[J].中国水产科学,2012,19(1):70-76.
[36]Hulata G.Genetic manipulations in aquaculture:A review of stock improvement by classical and modern techno logies[J]. Genetica,2001,111(1/3):155-173.
[37]Turelli M,Moyle L C.A symmetric postmating isolation:Darwin's corollary to Haldane's rule[J].Genetics,2007,176(2):1059-1088.
[38]徐冬冬,尤锋,楼宝,等.8种鲆鲽鱼种间遗传距离与杂交亲和性的相关性分析[J].水产学报,2010,34(2):178-184.
Genetic diversity ofSalvelinus fominalis,S.leucomaenisand their hybrid offsprings
GU Wei,GUO Yuan,HU Guo,SUN Peng,BAI Qingli,WANG Bingqian
(Institute of Heilongjiang River Fisheries Research,Chinese Academy of Fishery Sciences,Harbin 150070,China)
We established diallel crosses betweenSalvelinus fominalis(AA)andS.leucomaenis (BB),along with the self-breeding offsprings,and studied the genetic diversity of four populations.In this study,the genetic structure and diversity of these populations were studied with seven polymorphic microsatellite loci.The average number of effective alleles was from 4.3688 to 5.5764.The polymorphic informationcontent(PIC)ofJapanesestrainrangedfrom0.5079to0.6467.Theobserved heterozygosity varied from 0.6857 to 0.7143,and the expected heterozygosity was 0.6290-0.8234.The results indicated that the heterozygosity of hybrid offsrpings were higher than parents,showed a high level of genetic variability in the offspring of the crosses betweenSalvelinus fominalisandS. leucomaenis.The maximum Nei's genetic distance were between AA and AB among the four populations was 0.757343.At the same time,the minimum Nei's genetic distance between AA and AB was 0.366335.Results of UPGMA(unweighted pair-group method with arithmetic means)showed that AB and BA strains had the closest relationship,meanwhile,clustered together with BB.This study could provide the theory basis for the artificial hybrid breeding and protection of sustainable germplasmresources forSalvelinusaquaculture.
Salvelinus fominalis;S.leucomaenis;microsatellite
S917
A
1005-9369(2016)07-0048-08
2015-12-10
中央级公益性科研院所基本科研业务费专项(HSY201404)
谷伟(1978-),男,助理研究员,硕士,研究方向为鲑鳟鱼育种。E-mail:guweineau@126.com
王炳谦,研究员,研究方向为鲑鳟鱼类养殖及育种。E-mail:wbqfish@yahoo.com.cn
