乌苯美司联合紫杉醇与顺铂方案治疗晚期非小细胞肺癌的临床疗效及对免疫功能的影响
2016-10-26麦泽锋
麦泽锋
(海南省人民医院肿瘤内科,海南 海口 570311)
乌苯美司联合紫杉醇与顺铂方案治疗晚期非小细胞肺癌的临床疗效及对免疫功能的影响
麦泽锋
(海南省人民医院肿瘤内科,海南海口570311)
目的探讨乌苯美司联合紫杉醇与顺铂(TP)方案治疗晚期非小细胞肺癌(NSCLC)患者的临床疗效及对免疫功能的影响。方法2012年7月至2015年1月该院收治的晚期NSCLC患者62例,采用随机数字法分为研究组(32例)和对照组(30例),两组患者均给予全身化疗治疗,研究组患者在此基础上给予口服乌苯美司胶囊30 mg/d,连续给药6个月;观察并记录患者治疗的临床疗效、卡氏功能状态量表(KPS)评分与体重改善及免疫功能变化。结果研究组治疗后疾病控制(DCR)25例(78.13%)、有效(RR)18例(56.25%);对照组DCR 20例(66.67%)、RR 11例(36.67%);研究组疗效明显高于对照组(Z=1.938;P=0.026);治疗后研究组KPS评分及体重改善状况明显优于对照组(P<0.05);外周血CD3+、CD4+、CD4+/CD8+和自然杀伤(NK)细胞比例均出现显著升高,且高于对照组,CD8+比例出现显著下降,且低于对照组(P<0.05);治疗过程研究组发生3~4级白细胞减少比例显著低于对照组(P<0.05),而其他不良反应比较无统计学差异。结论乌苯美司联合TP方案治疗晚期 NSCLC 患者,可改善患者机体免疫功能,提高生活质量,减少不良反应的发生率,可作为化疗的辅助性用药。
乌苯美司;紫杉醇;顺铂;非小细胞肺癌
既往研究报道〔1〕,机体免疫力下降是导致非小细胞肺癌(NSCLC)患者病情进展的一个重要原因。目前,化学药物是治疗晚期NSCLC的主要方式,但治疗过程中同样会对机体正常细胞产生一定的细胞毒性,损伤机体免疫力。研究报道〔2〕,乌苯美司是一种免疫调节剂,能够通过抑制CD13的活性,干扰恶性肿瘤细胞的代谢活性,直接抑制肿瘤细胞增殖与侵袭,诱导肿瘤细胞发生凋亡发挥抗肿瘤作用。本研究旨在探究乌苯美司联合紫杉醇+顺铂(TP)方案治疗晚期NSCLC患者的临床疗效及对免疫功能的影响。
1 对象与方法
1.1研究对象我院2012年7月至2015年1月收治的晚期NSCLC患者62例,其中男41例,女21例;年龄44~79〔平均(64.38±6.91)〕岁;平均病程(5.85±3.10)个月;采用随机数字将所有患者随机分为研究组(32例)和对照组(30例)。纳入、排除标准:①经病理组织学或细胞学证实均为不能手术治疗的晚期NSCLC患者;②均为初次治疗,未接受过化疗;③年龄≥40岁,卡氏功能状态量表(KPS)评分≥70分;④排除合并心、肝、肾功能障碍。两组基线资料比较均无统计学意义(P>0.05),见表1。
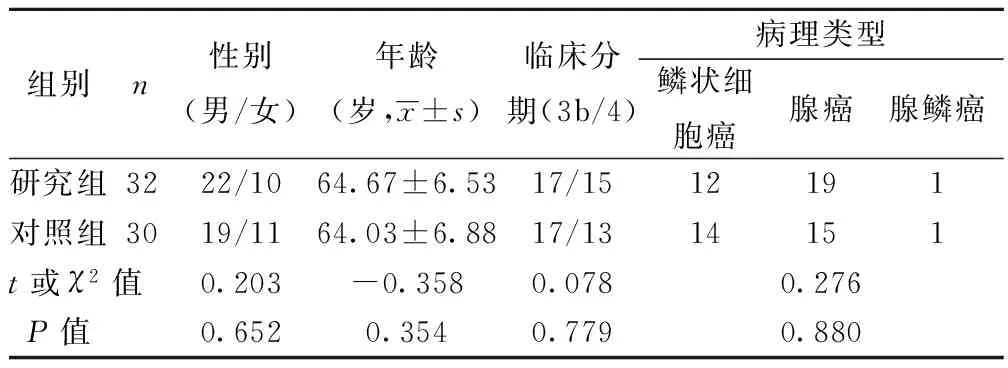
表1 两组一般情况的比较(n)
1.2研究方法
1.2.1治疗方法两组患者均给予全身化疗治疗:第1个疗程给予顺铂(山东罗欣药业股份有限公司,国药准字H20046375)25 mg/m2,第2~4个疗程给予紫杉醇(宁波绿之健药业有限公司,国药准字H20053622)150 mg/m2,每个疗程治疗21 d,化疗药物适当水化。研究组患者化疗第1天起每日清晨空腹口服乌苯美司胶囊(浙江普洛康裕制药有限公司,国药准字H19980092)30 mg/d,连续给药6个月;对照组患者仅进行化疗。所有患者接受2~6个周期的化疗,治疗每个周期后评价患者不良反应,若发生Ⅳ度不良反应,则药物减量25%,若发生病情进展或不耐受等不良反应,则立即停止治疗。所有患者在化疗前后均给予5-羟色胺3(5-HT3)受体拮抗剂,预防患者发生呕吐,监测治疗期间患者血常规、肝肾功能及心电图,若发生异常给予对症处理,采用螺旋CT或磁共振成像(MRI)检查评估患者病灶。在化疗前与化疗结束后采用肝素管采集静脉血2 ml,利用流式细胞仪检测其淋巴细胞免疫分型。
1.2.2疗效评价标准所有患者在治疗2个疗程后评价其治疗疗效:(1)临床疗效:采用RECIST1.1版实体肿瘤疗效评价标准〔3〕对患者的治疗疗效进行评价,分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)和疾病进展(PD)。其中,CR+PR+SD计为疾病控制(DCR),CR+PR计为有效 (RR),疗程后评价疗效,若疗效为CR、PR和SD者,均可继续原方案治疗,CR和PR患者于4 w后进行疗效确认,疗效评价为PD者,则终止治疗。(2)生活质量评价:采用全国肿瘤协作组制定的生活质量表〔4〕,KPS评分:变化<10分计为稳定;,减少≥10分计为降低,治疗后增加≥10分计为改善;体重评价:治疗后体重增加≥1.0 kg为改善,增加或减少<1.0 kg为稳定,减少≥1.0 kg为降低。(3)免疫功能评价:在化疗前和化疗疗程结束后采用流式细胞仪(美国BD公司生产,型号:FACSCalibur;试剂由美国 BD 公司)检测患者外周静脉血中T细胞亚群,如CD3+、CD4+、CD8+、CD4+/CD8+及自然杀伤(NK)细胞的比例,评价患者治疗前后免疫系统的变化情况。
1.2.3不良反应所有患者在治疗2个疗程后,采用WHO抗癌药物分度标准(0~4级)〔5〕,观察并记录患者白细胞、血小板和血红蛋白减少情况,患者发生恶心/呕吐、腹泻、肌肉关节痛等情况。
1.3统计学方法采用SAS9.3软件进行t、χ2、秩和检验。
2 结 果
2.1两组患者治疗的近期疗效研究组治疗有效率〔18例(56.25%)〕明显高于对照组〔11例(36.67%),χ2=4.133;P=0.042〕,两组间肿瘤DCR无显著差异〔25例(78.13%)vs 20例(66.67%),χ2=1.022;P=0.312〕;研究组治疗的疗效明显高于对照组,其中CR 2例(6.25%)vs 0例,PR 18例(56.25%) vs 11例(36.67%),SD 5例(15.63%) vs 9例(30.00%),PD 7例(21.88%) vs 10例(33.33%,Z=1.938;P=0.026)。
2.2两组患者治疗后 KPS 评分和体重变化情况治疗后研究组患者KPS评分及体重改善情况明显优于对照组(P<0.05)。见表2。

表2 两组治疗后 KPS 评分和体重变化情况〔n(%)〕
2.3两组患者治疗前后免疫功能变化情况治疗前两组外周静脉血中各免疫指标比较无统计学差异(P>0.05);治疗后研究组外周血CD3+、CD4+、CD4+/CD8+和 NK细胞比例均出现显著升高(P<0.05),且高于对照组(P<0.05);CD8+比例出现显著下降(P<0.05),且显著低于对照组(P<0.05)。见表3。
2.4两组患者治疗期间不良反应的发生情况采用WHO抗癌药物分度标准(0~4级),治疗过程研究组发生3~4级白细胞减少比例显著低于对照组(P<0.05);两组患者血小板、血红蛋白减少,发生恶心/呕吐、腹泻、肌肉关节痛的发生率比较,无统计学意义(P>0.05)。见表4。
表3 两组患者治疗前后免疫功能变化情况±s)
与治疗前比较:1)P<0.05;与研究组比较:2)P<0.05

表4 两组患者治疗不良反应发生率情况比较(n,0~2级/3~4级)
3 讨 论
研究报道50%以上晚期NSCLC患者年龄超过65岁,其确诊时中位数年龄为70岁〔6〕。目前,化学治疗是晚期NSCLC的主要治疗方式,以铂类为基础的双药方案被认为是治疗晚期NSCLC的一线标准方案。而老年晚期NSCLC患者作为一个特殊群体,其药物代谢和器官功能都出现衰退,给患者的治疗带来较大困难,增加了化疗的风险。机体免疫力下降是导致NSCLC患者病情进展的一个重要原因。因此,选择既能降低化疗对机体正常细胞产生细胞毒性作用,又能够提高机体免疫功能药物对治疗NSCLC尤显重要。
既往研究显示〔2〕,采用全身化疗为主的方式治疗晚期 NSCLC,其目的主要在于缓解患者症状、提高生活质量、延长寿命。紫杉醇作为抗癌药物,其作用机制主要是促使微管和微管蛋白二聚体失衡,影响机体肿瘤细胞有丝分裂,从而引起细胞死亡。本研究与既往报道一致〔7〕,紫杉醇联合化疗治疗过程中,在杀伤癌症的同时,也会对正常细胞和机体功能造成损伤,使患者白细胞大量减少,导致患者生活质量下降;其中,化疗药物既能抑制癌细胞,也能杀伤正常细胞,其产生的毒性反应及肿瘤本身对机体免疫力的影响,直接影响患者治疗疗效。本研究说明化疗联合免疫治疗能够明显提高NSCLC患者的生活质量。与Normando等〔8〕的研究报道相符。
研究发现〔9〕,CD13广泛存在于肺癌细胞膜上,而乌苯美司是有效的化疗辅助用药,其可增强T细胞的功能,使NK细胞的活力增强,且可使集落刺激因子合成增加而刺激骨髓细胞的再生及分化,其中,以CD13为作用靶点诱导肿瘤细胞发生凋亡,切断CD13的传导通路阻止肿瘤侵袭与转移。本研究说明乌苯美司联合TP方案治疗晚期NSCLC能够保护患者机体免疫力,改善因化疗对机体免疫功能造成的损伤,进一步证实了乌苯美司作为有效的化疗辅助用药在治疗晚期NSCLC中的临床价值,与Zhong等〔10〕的报道结论一致。此外,晚期 NSCLC患者本身存在免疫缺陷,乌苯美司能够通过刺激免疫应答抑制肿瘤细胞的发生与发展。本研究说明乌苯美司联合TP方案治疗晚期NSCLC能明显缓解患者骨髓抑制的发生。
1陈卓,于卫江.注射用黄芪多糖对非小细胞肺癌放疗的作用及对机体免疫的影响〔J〕.中国实验方剂学杂志,2013;19(6):309-13.
2于海丰,黄旭,甄春英,等.GRP78的表达与非小细胞肺癌生物学特性及预后的关系〔J〕.现代生物医学进展,2012;12(22):4259-63.
3You Q,Guo H,Xu D.Distinct prognostic values and potential drug targets of ALDH1 isoenzymes in non-small-cell lung cancer〔J〕.Drug Des Devel Ther,2015;9(5):5087-97.
4王静,李峻岭,石远凯,等.吉西他滨联合顺铂在非小细胞肺癌辅助化疗中的应用〔J〕.中国全科医学,2012;15(9):987-9.
5张会娟,侯小萌,张力,等.厄洛替尼治疗NSCLC致急性胆汁淤积型药物性肝病1例〔J〕.癌症进展,2013;11(4):376-8.
6Hirai F.Role of anti-angiogenesis therapy for advanced non-small cell lung cancer-current status and future challenges〔J〕.Gan To Kagaku Ryoho,2015;42(8):940-3.
7杨蕴.TP方案联合同步放疗治疗不能手术的Ⅲ期非小细胞肺癌的临床研究〔J〕.实用医学杂志,2013;29(6):904-6.
8Normando SR,Cruz FM,Del Giglio A.Cumulative meta-analysis of epidermal growth factor receptor-tyrosine kinase inhibitors as first-line therapy in metastatic non-small-cell lung cancer〔J〕.Anticancer Drugs,2015;26(9):995-1003.
9崔林,姜勇,陈珏,等.不同剂量紫杉醇同步放化疗治疗局部晚期非小细胞肺癌的临床疗效〔J〕.现代肿瘤医学,2015;23(12):1682-6.
10Zhong A,Xiong X,Shi M,etal.The efficacy and safety of pemetrexed-based doublet therapy compared to pemetrexed alone for the second-line treatment of advanced non-small-cell lung cancer:an updated meta-analysis〔J〕.Drug Des Devel Ther,2015;9(18):3685-93.
〔2015-12-22修回〕
(编辑袁左鸣/滕欣航)
麦泽锋(1973-),男,副主任医师,主要从事肿瘤内科研究。
R73
A
1005-9202(2016)15-3731-03;doi:10.3969/j.issn.1005-9202.2016.15.056
