共轭亚油酸-吉西他滨偶联物的体外抗肿瘤活性研究
2016-10-26陶小妹顾红燕李丽莉陶巍巍首都医科大学附属北京世纪坛医院药剂科北京00038大连医科大学护理学院辽宁大连6044
陶小妹,顾红燕,李丽莉,陶巍巍(.首都医科大学附属北京世纪坛医院药剂科,北京 00038;2.大连医科大学护理学院,辽宁大连 6044)
共轭亚油酸-吉西他滨偶联物的体外抗肿瘤活性研究
陶小妹1*,顾红燕1,李丽莉1,陶巍巍2#(1.首都医科大学附属北京世纪坛医院药剂科,北京 100038;2.大连医科大学护理学院,辽宁大连 116044)
目的:研究共轭亚油酸-吉西他滨偶联物(CLA-GEM)的体外抗肿瘤活性。方法:考察不同浓度(0.001~100 μmol/L)的CLA-GEM和吉西他滨(GEM)溶液分别与不同肿瘤细胞(乳腺癌MCF-7细胞、乳腺癌MDA-MB-231细胞、肺腺癌A549细胞、小细胞肺癌NCI-H446细胞、脑胶质瘤C6细胞)共同孵育72 h的半数抑制浓度(IC50)和与MCF-7细胞共同孵育24、48、72 h的细胞存活率。将核酸转运载体抑制剂NBMPR(100 μmol/L)和双嘧达莫(4 μg/ml)分别作用于MCF-7细胞和MDA-MB-231细胞,考察0.001~100 μmol/L的CLA-GEM和GEM对核酸转运载体的依赖性(以IC50为指标)。考察1µmol/L的CLA-GEM和GEM与MCF-7细胞共同孵育24 h的细胞周期变化。结果:与GEM比较,CLA-GEM孵育后对MCF-7、MDA-MB-231、NCI-H446细胞的IC50更低(P<0.01),对A549、C6细胞的IC50差异无统计学意义(P>0.05)。GEM孵育48 h后和CLA-GEM孵育24 h后MCF-7细胞存活率开始明显降低,GEM孵育72 h后细胞存活率最低为21%,而CLA-GEM能完全杀死肿瘤细胞。与GEM或CLA-GEM单用比较,经NBMPR、双嘧达莫处理的GEM对MCF-7和MDA-MB-231细胞的IC50明显升高(P<0.01),而CLA-GEM对细胞的IC50差异无统计学意义(P>0.05)。与GEM比较,CLA-GEM可使MCF-7细胞的S期延长约6%(P<0.01)。结论:CLA-GEM较GEM的抗肿瘤活性更强、起效更快,且不受核酸转运载体的影响。
共轭亚油酸-吉西他滨偶联物;抗肿瘤;核酸转运;细胞周期
注射用盐酸吉西他滨(Gemcitabine hydrochloride for injection)是经美国FDA批准的非小细胞肺癌、膀胱癌、胰腺癌、乳腺癌的一线用药。吉西他滨(Gemcitabine,GEM)为新型嘧啶类脱氧核苷类似物,通过抗代谢作用来发挥抗肿瘤效应。但由于其半衰期短、选择性较差、容易产生耐药性以及对骨髓和胃肠道等的副作用限制了其广泛使用。不饱和脂肪酸对细胞及核酸具有良好的亲和性,将不饱和脂肪酸骨架引入到药物分子中,有利于药物到达细胞组织内而有效地发挥作用。共轭亚油酸(Conjugated linoleic acid,CLA)是一种具有天然抗乳腺癌和抗乳腺癌新生血管活性的不饱和脂肪酸。为了降低GEM的毒副作用、提高药效,本课题组设计并合成了不饱和脂肪酸CLA与GEM共价连接的CLA-GEM偶联物,前期已对其合成、表征、理化性质进行了报道[1],本文主要就其体外抗肿瘤活性进行研究。
1 材料
1.1 仪器
TDL-5-A低速台式大容量离心机(上海安亭科学仪器厂);FACSan Flow Cytometer流式细胞仪(美国Becton Dickinson公司);TCS SP5激光共聚焦显微镜(德国Leica公司);HC-2064高速离心机(科大创新股份有限公司中佳分公司);RF-5301荧光分光光度仪(日本Shimadzu公司);Bio-Rad 680酶标仪(美国Bio-Rad公司)。
1.2 药品与试剂
CLA-GEM(北京大学医学部合成,批号:20110522,纯度:99%);GEM(武汉市丰竹林化学医药有限公司,批号:20120911,纯度:99%);CLA(美国Sigma-Aldrich公司,批号:20121205,纯度:99%);硝基苄基硫代肌苷(NBMPR,德国Merck公司,批号:20121009,纯度:99%);双嘧达莫原料药(武汉英和制药有限公司,批号:20111225,纯度:99%);MEM培养基、非必需氨基酸、青霉素、硫酸链霉素均购自北京迈晨科技有限公司;OPTI-MEM培养基(美国Invitrogen公司);Hoechst 33258、磺基罗丹明B(SRB)、三氯乙酸(TCA)均购自美国Sigma公司;其他试剂均为色谱纯。
1.3 细胞
人乳腺癌MCF-7细胞、人乳腺癌MDA-MB-231细胞、人肺腺癌A549细胞、人小细胞肺癌NCI-H446细胞、鼠源脑胶质瘤C6细胞均购自协和医科大学基础医学细胞中心。
2 方法与结果
2.1 细胞抑制试验
2.1.1 不同细胞系的细胞抑制试验 将MCF-7、MDA-MB-231、A549、NCI-H446、C6细胞分别接种于96孔细胞培养板中,每孔2 500个,设3个复孔,于细胞培养箱中在37 ℃、相对湿度95%的条件下孵育24 h,待细胞贴壁生长。然后将稀释好的系列浓度的CLA-GEM、GEM分别加入到MCF-7(0.001、0.01、0.1、0.5、1、5、10、50、100 μmol/L)、MDA-MB-231(0.01、0.1、0.5、1、5、10、50、100 μmol/L)、A549(0.01、0.1、0.25、0.75、1、5、10、50 μmol/L)、NCI-H446(0.01、0.1、0.5、2.5、7.5、10 μmol/ L)和C6细胞(0.001、0.01、0.025、0.075、0.1、0.25、0.5 μmol/L)中,以0.5%二甲基亚砜(DMSO)溶液为空白对照。孵育72 h后按照SRB比色分析法进行处理,采用酶标仪在540 nm波长处测定吸光度(A),用SPSS 17.0计算细胞半数抑制浓度(IC50)。CLA-GEM和GEM与不同细胞共同孵育后的IC50检测结果见表1。
表1 CLA-GEM和GEM与不同细胞共同孵育后的IC50检测结果(±s,n=3,μmol/L)Tab 1 IC50of different cells after treated with CLA-GEM and GEM(±s,n=3,μmol/L)
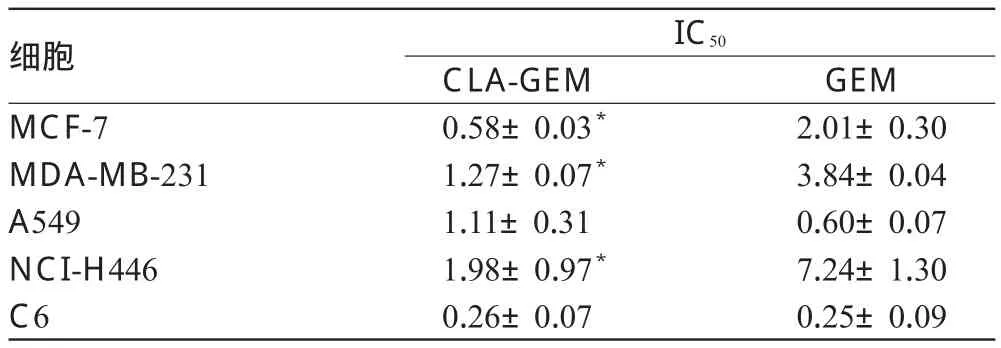
表1 CLA-GEM和GEM与不同细胞共同孵育后的IC50检测结果(±s,n=3,μmol/L)Tab 1 IC50of different cells after treated with CLA-GEM and GEM(±s,n=3,μmol/L)
注:与GEM比较,*P<0.01 Note:vs.GEM,*P<0.01
GEM 2.01±0.30 3.84±0.04 0.60±0.07 7.24±1.30 0.25±0.09细胞MCF-7 MDA-MB-231 A549 NCI-H446 C6 IC50CLA-GEM 0.58±0.03*1.27±0.07*1.11±0.31 1.98±0.97*0.26±0.07
由表1可知,CLA-GEM对MCF-7、MDA-MB-231、NCIH446细胞的IC50远低于GEM(P<0.01),说明对这3种细胞,CLA-GEM比GEM具有更强的抗肿瘤活性;而对于A549、C6细胞,CLA-GEM与GEM对细胞的IC50相似。这说明对于上述5种肿瘤细胞,CLA-GEM比GEM的细胞生长抑制作用更强或者效果相当。
2.1.2 不同孵育时间的细胞抑制试验 将MCF-7细胞接种于96孔细胞培养板中(24 h为10 000个/孔,48 h为5 000个/孔,72 h为2 500个/孔),设3个复孔,于细胞培养箱中在37 ℃、相对湿度95%的条件下孵育24 h,待细胞贴壁生长。然后将0.001、0.01、0.1、0.5、1、5、10、50、100 μmol/L的CLA-GEM、GEM加入到上述的细胞培养孔中,以0.5%DMSO溶液为空白对照。分别孵育24、48、72 h后按照SRB比色分析法测定540 nm波长处的A,按公式计算细胞存活率,存活率(%)=(药物孵育后细胞的A540/空白对照细胞的A540)×100%。CLA-GEM和GEM孵育不同时间后MCF-7细胞的成活率曲线图见图1。
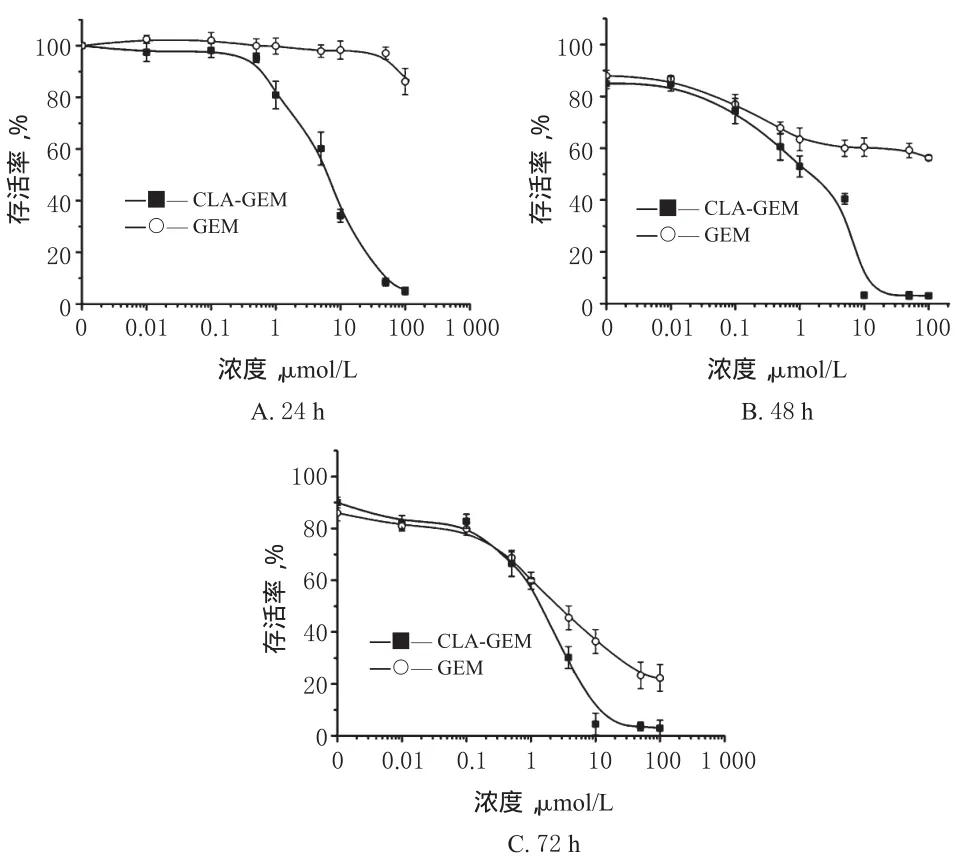
图1 CLA-GEM和GEM孵育不同时间后MCF-7细胞的成活率曲线图(n=3)Fig 1 Survival rate curve of MCF-7 cells after treated with CLA-GEM and GEM for different time(n=3)
由图1可知,GEM只有在共同孵育48 h以上才有显著的细胞毒作用,并且即使共同孵育72 h后,在100 μmol/L的高浓度GEM作用下仍然只能杀死79%的MCF-7细胞,即不能完全杀死肿瘤细胞。而CLA-GEM在共同孵育24 h后,5 μmol/L的CLAGEM(与GEM比较,P<0.01)即有显著的细胞抑制作用,50 μmol/L即可完全杀死MCF-7细胞。共同孵育48 h后,10 μmol/L 的CLA-GEM即可完全杀死MCF-7细胞。这说明相比于原药GEM,CLA-GEM极大地增强了对MCF-7细胞的抑制作用。
2.2 核酸转运载体抑制试验
将MCF-7和MDA-MB-231细胞接种于96孔板中(5 000 个/孔)孵育24 h后,将核酸转运载体抑制剂NBMPR(100 μmol/L)或者双嘧达莫(4 μg/ml)加入细胞[2-3]。30 min后,将核酸转运载体抑制剂吸出,加入0.001、0.01、0.1、0.5、1、5、10、50、100 μmol/L的CLA-GEM和GEM溶液。继续孵育72 h,按“2.1.1”项下方法测定并计算IC50。每个浓度重复3次。NBMPR和双嘧达莫分别与GEM、CLA-GEM联用后对MCF-7、MDA-MB-231细胞的IC50检测结果见表2。
表2 NBMPR和双嘧达莫分别与GEM、CLA-GEM联用后对MCF-7、MDA-MB-231细胞的IC50检测结果(±s,n= 3,μmol/L)Tab 2 IC50of MCF-7 and MDA-MB-231 cells after treated with NBMPR and dipyridamole combined with GEM or CLA-GEM(±s,n=3,μmol/L)

表2 NBMPR和双嘧达莫分别与GEM、CLA-GEM联用后对MCF-7、MDA-MB-231细胞的IC50检测结果(±s,n= 3,μmol/L)Tab 2 IC50of MCF-7 and MDA-MB-231 cells after treated with NBMPR and dipyridamole combined with GEM or CLA-GEM(±s,n=3,μmol/L)
注:与GEM比较,*P<0.01
药物GEM GEM+双嘧达莫GEM+NBMPR CLA-GEM CLA-GEM+双嘧达莫CLA-GEM+NBMPR IC50MDA-MB-231 3.84±0.04 53.30±10.77*89.53±1.05*1.27±0.07 3.24±0.67 1.51±0.37 MCF-7 2.01±0.30 52.10±12.80*79.13±4.21*0.58±0.03 0.83±0.03 0.92±0.08
由表2可知,对MCF-7细胞,NBMPR和双嘧达莫可以显著降低GEM的敏感性(P<0.01),分别使GEM的IC50增加了40倍和24倍;相比之下,CLA-GEM的IC50仅分别增加了1.6倍和1.4倍。在MDA-MB-231细胞上可以看到同样的趋势,NBMPR和双嘧达莫显著降低了GEM的细胞抑制作用(P<0.01),分别使GEM的IC50增加了23倍和14倍,而仅使CLAGEM的IC50分别增加了1.2倍和2.6倍。这提示核酸转运载体抑制剂对GEM有明显抑制作用,而对CLA-GEM基本没有影响。这说明GEM依赖核酸转运载体进入细胞,而CLA-GEM不依赖核酸转运载体进入细胞。
2.3 细胞周期试验
按照碘化吡啶DNA染色法[4]考察GEM和CLA-GEM对MCF-7细胞周期的影响。每次分析所用的细胞数不少于5×105个,收集的细胞数为10 000个。数据使用FCS Express V3软件进行分析。细胞固定,用碘化吡啶染色,通过流式细胞术检测1µmol/L GEM和1µmol/L CLA-GEM对MCF-7细胞周期的影响,并设不加任何药物的对照。GEM和CLA-GEM孵育MCF-7细胞后的细胞周期变化见表3。
表3 GEM和CLA-GEM孵育后MCF-7细胞的周期变化(±s,n=3,%%)Tab 3 Cell cycle of MCF-7 cells after treated with GEM and CLA-GEM(±s,n=3,%%)
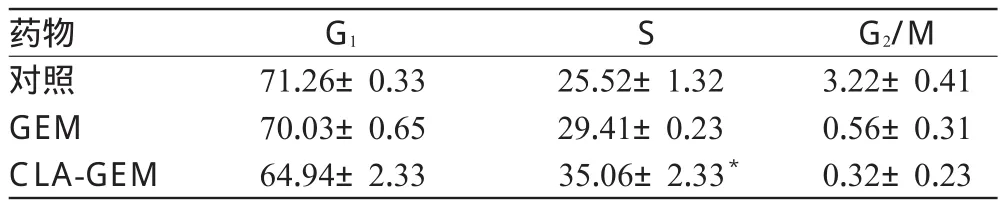
表3 GEM和CLA-GEM孵育后MCF-7细胞的周期变化(±s,n=3,%%)Tab 3 Cell cycle of MCF-7 cells after treated with GEM and CLA-GEM(±s,n=3,%%)
注:与GEM比较,*P<0.01Note:vs.GEM,*P<0.01
G2/M 3.22±0.41 0.56±0.31 0.32±0.23药物对照GEM CLA-GEM G1S 71.26±0.33 70.03±0.65 64.94±2.33 25.52±1.32 29.41±0.23 35.06±2.33*
与对照比较,GEM和CLA-GEM可以阻滞MCF-7细胞周期在S期,分别提高了S期细胞比例约4%和10%;与GEM比较,CLA-GEM可使细胞周期的S期延长约6%,差异有统计学意义(P<0.01)。
3 讨论
由于脂肪族基团CLA的引入大大增加了GEM的脂溶性,CLA-GEM有利于通过被动转运进入细胞内,同时CLA对GEM的N4位氨基的保护作用使CLA-GEM在体外细胞抑制试验中显示出比原药GEM更好的抗肿瘤活性。
GEM是亲水性核苷类似物,不能通过简单扩散进入细胞[5-6],必须借助平衡型核酸转运载体(hENT1)和浓聚型核酸转运载体(hCNT1)才能进入细胞。定量反转录-聚合酶链式反应法测定非小细胞肺癌患者中的hENT1和脱氧胞苷激酶(dCK)表达量的结果表明,hENT1表达量增加,GEM敏感性增加;dCK表达量降低,GEM耐药性增加[7]。Nakano Y等[8]研究表明,胰腺癌的获得性耐药与hENT1、dCK、核糖核苷酸还原酶M1(RRM1)、RRM2的表达量有关。Greenhalf W等[9]研究表明,经免疫标记法检测,有hENT1的胰腺癌患者比没有hENT1的患者生存期更长。另有报道,GEM与硬脂酸形成的偶联物装入纳米粒中可以克服由于RRM1过量表达产生的耐药性[10]。Guzmán-Gutiérrez E等[11]研究表明,耐药肿瘤组织hENT1的表达量明显低于正常组织,表达量降低,意味着依赖核酸转运载体进入细胞的药物吸收减少以及耐药性的产生。耐药性的产生主要是由于核酸转运载体被破坏,MTT试验表明在耐药型细胞系上SQGem(角鲨烯与GEM形成的偶联物)的IC50显著低于GEM[12]。这提示核酸转运载体对GEM造成了较大的作用局限性。
在GEM上引入脂溶性基团可以改变药物进入细胞的方式,如NEO6002,其为GEM与心磷脂形成的偶联物。研究证明,NEO6002是通过被动转运进入细胞内,不依赖核酸转运载体[13]。SQGem通过被动转运的方式进入细胞后主要集中在细胞膜以及以内质网为主的细胞器中,接着SQGem被缓慢释放到细胞浆内,并降解成GEM,部分GEM会被核酸转运载体泵出细胞[14]。
GEM主要作用于S期和G1晚期,并可阻止细胞由G1期进入S期。本研究中CLA-GEM可以显著延长细胞S期;PEG与GEM形成的偶联物(PEG-GEM)也可以有效延长细胞S期滞留时间。有研究用溴脱氧尿苷掺入法进一步验证了这一结果,即作用24 h后,GEM有18%的细胞处于S期,而PEG-GEM 有23.5%细胞处于S期[15]。
综上,CLA-GEM具有良好的体外抗肿瘤活性。
[1]Tao XM,Wang JC,Wang JB,et al.Enhanced anticancer activity of gemcitabine coupling with conjugated linoleic acid against human breast cancer in vitro and in vivo[J].Eur J Pharm Biopharm,2012,82(2):401.
[2]BergmanAM,AdemaAD,Balzarini J,et al.Antiproliferative activity,mechanism of action and oral antitumor activity of CP-4126,a fatty acid derivative of gemcitabine,in in vitro and in vivo tumor models[J].Invest New Drugs,2011,29(3):456.
[3]Shimada T,Nakanishi T,Tajima H,et al.Saturable hepatic extraction of gemcitabine involves biphasic uptake mediated by nucleoside transporters equilibrative nucleoside transporter 1 and 2[J].J Pharm Sci,2015,104(9):3 162.
[4]邱连建,周红祖,余惠旻.附子、黄芩和穿心莲水提物对MPP诱导的SH-SY5Y细胞凋亡的药性学比较研究[J].中国药房,2012,23(37):2 888.
[5]Johnson ZL,Lee JH,Lee K,et al.Structural basis of nucleoside and nucleoside drug selectivity by concentrative nucleoside transporters[J].eLife,2014,doi:10.7554/eLife.03604.
[6]Ohashi A,Sugawara Y,Mamada K,et al.Membrane transport of sepiapterin and dihydrobiopterin by equilibrative nucleoside transporters:a plausible gateway for the salvage pathway of tetrahydrobiopterin biosynthesis[J].Mol Genet Metab,2011,102(1):18.
[7]Binenbaum Y,Na’ara S,Gil Z.Gemcitabine resistance in pancreatic ductal adenocarcinoma[J].Drug Resist Updat,2015,doi:10.1016/j.drup.2015.10.002..
[8]Nakano Y,Tanno S,Koizumi K,et al.Gemcitabine chemoresistance and molecular markers associated with gemcitabine transport and metabolism in human pancreatic cancer cells[J].Br J Cancer,2007,96(3):457.
[9]Greenhalf W,Ghaneh P,Neoptolemos JP,et al.Pancreatic cancer hENT1 expression and survival from gemcitabine in patients from the ESPAC-3 trial[J].J Natl Cancer Inst,2014,106(1):djt347.
[10] Chung WG,Sandoval MA,Sloat BR,et al.Stearoyl gemcitabine nanoparticles overcome resistance related to the over-expression of ribonucleotide reductase subunit M1[J].J Control Release,2012,157(1):132.
[11]Guzmán-Gutiérrez E,Sandoval C,Nova E,et al.Differ-ential expression of functional nucleoside transporters in non-differentiated and differentiated human endothelial progenitor cells[J].Placenta,2010,31(10):928.
[12]Desmaële D,Gref R,Couvreur P.Squalenoylation:a generic platform for nanoparticular drug delivery[J].J Control Release,2012,161(2):609.
[13]Ali SM,Khan AR,Ahmad MU,et al.Synthesis and biological evaluation of gemcitabine-lipid conjugate(NEO-6002)[J].Bioorg Med Chem Lett,2007,15(10):2 571.
[14] Bildstein L,Dubernet C,Marsaud V,et al.Transmembrane diffusion of gemcitabine by a nanoparticulate squalenoyl prodrug:an original drug delivery pathway[J].J Control Release,2010,147(2):163.
[15] Vandana M,Sahoo SK.Long circulation and cytotoxicity of PEGylated gemcitabine and its potential for the treatment of pancreatic cancer[J].Biomaterials,2010,31(35):9 340.
Study on in vitro Anticancer Activity of Conjugated Linoleic Acid-Gemcitabine Conjugate
TAO Xiaomei1,GU Hongyan1,LI Lili1,TAO Weiwei2(1.Dept.of Pharmacy,Beijing Shijitan Hospital,Capital Medical University,Beijing 100038,China;2.School of Nursing,Dalian Medical University,Liaoning Dalian 116044,China)
OBJECTIVE:To study in vitro anticancer activity of conjugated linoleic acid-gemcitabine conjugate(CLA-GEM).METHODS:IC50of different tumor cells(breast cancer MCF-7 cell,breast cancer MDA-MB-231 cell,lung cancer A549 cell,small cell lung cancer NCI-H446 cell,glioma C6 cell)were investigated after treated with different concentrations(0.001-100 μmol/L)of CLA-GEM and gemcitabine(GEM)for 72 h;survival rates of MCF-7 cell were investigated after treated with above solution for 24,48 and 72 h.The dependence of 0.001-100 μmol/L CLA-GEM and GEM to nucleoside transporter was investigated (by IC50)through MCF-7 cells and MDA-MB-231 cells treated with nucleoside transporter inhibitors(NBMPR,100 μmol/L)and dipyridamole(4 μg/ml).The change of MCF-7 cell cycle was investigated after treated with 1µmol/L CLA-GEM and GEM for 24 h.RESULTS:Compared with GEM,IC50of MCF-7,MDA-MB-231 and NCI-H446 cells became lower after treated with CLAGEM(P<0.01),there were no statistical significances in IC50between A549 and C6 cells(P>0.05).Survival rate of MCF-7 cells decreased significantly after treated with GEM for 48 h and CLA-GEM for 24 h.Survival rate of MCF-7 cells was the lowest,being 21%after treated with GEM for 72 h,while tumor cells were sacrificed by CLA-GEM completely.Compared with GEM or CLA-GEM,IC50of MCF-7 and MDA-MB-231 cells increased significantly after treated with NBMPR,dipyridamole combined with GEM(P<0.01);there were no statistical significance in IC50after treated with NBMPR,dipyridamole combined with CLAGEM(P>0.05).Compared with GEM,CLA-GEM could prolong 6%of S stage of MCF-7 cells(P<0.01).CONCLUSIONS:Compared with GEM,CLA-GEM exhibits significant antitumor activity and rapid action,and it isn’t influenced by nucleic acid transportation.
Conjugated linoleic acid-gemcitabine conjugate;Anticancer;Nucleic acid transportation;Cell cycle
R965
A
1001-0408(2016)25-3521-04
10.6039/j.issn.1001-0408.2016.25.20
2015-11-06
2016-02-25)
·民族医药·
*主管药师,博士。研究方向:医院药学、分子药剂学。E-mail:yaoketaoxiaomei@163.com
讲师,硕士。研究方向:医院药学、分子药剂学。E-mail:taoweiwei2003@163.com
