前列地尔对缺氧损伤的人肺微血管内皮细胞中VEGF和eNOS表达的影响
2016-10-26王友俊张玲美莱芜钢铁集团有限公司医院传染科山东莱芜271126
王友俊,张玲美(莱芜钢铁集团有限公司医院传染科,山东莱芜 271126)
前列地尔对缺氧损伤的人肺微血管内皮细胞中VEGF和eNOS表达的影响
王友俊*,张玲美(莱芜钢铁集团有限公司医院传染科,山东莱芜 271126)
目的:研究前列地尔对缺氧损伤的人肺微血管内皮细胞(HPMECs)中血管内皮生长因子(VEGF)和内皮型一氧化氮合成酶(eNOS)表达的影响。方法:将HPMECs分为A组(正常培养)、B组(3%O2培养)、C组(3%O2培养+15 μg/L前列地尔)及D组(3%O2培养+45 μg/L前列地尔),相应培养24 h。观察各组细胞形态,MTT比色法检测细胞活力(以吸光度计),流式细胞仪检测细胞凋亡率,Western blot法检测细胞中VEGF、eNOS相对表达量。结果:A、D组细胞密度较高,B、C组细胞密度较低。与A组比较,B、C、D组细胞活力降低、凋亡率升高、VEGF与eNOS表达增强、eNOS/VEGF减少(P<0.05)。与B组比较,C、D组细胞活力增加、VEGF表达减弱(P<0.05);D组细胞凋亡率降低、eNOS表达减弱、eNOS/VEGF增加(P<0.05)。与C组比较,D组细胞凋亡率降低、VEGF表达减弱、eNOS/VEGF增加(P<0.05)。结论:前列地尔可能通过上调HPMECs的eNOS/VEGF发挥保护作用。
前列地尔;缺氧损伤;人肺微血管内皮细胞;血管内皮生长因子;内皮型一氧化氮合成酶
缺氧可以导致肺血管内皮功能障碍,引起肺血管强烈收缩及血管平滑肌细胞大量增生,促进缺氧性肺动脉高压的发生[1]。血管内皮生长因子(VEGF)可以诱导血管内皮细胞增殖、血管内皮增厚、动脉血压升高;内皮型一氧化氮合成酶(eNOS)具有较强的心血管保护作用,可以抑制血管内皮细胞增生及血管平滑肌迁移,防止肺动脉高压进展[2-3]。既往研究发现,前列地尔的扩血管作用能降低慢性阻塞性肺病并肺动脉高压患者的肺动脉压力,但其机制尚未明确[4]。为此,本文从VEGF和eNOS角度研究前列地尔对缺氧损伤的人肺微血管内皮细胞(HPMECs)的影响机制。
1 材料
1.1 仪器
CX41奥林巴斯显微镜(上海西努光学科技有限公司);FC500 MCL/MPL流式细胞仪、Gallios流式细胞仪(美国贝克曼库尔特有限公司);3-18R高速冷冻离心机(湖南恒诺仪器设备有限公司,离心半径:6 cm);DG5033A酶标仪(南京华东电子集团医疗装备有限责任公司);Image-Pro Insight图像分析软件(广州市明美光电技术有限公司)。
1.2 药品与试剂
前列地尔原料药(大连美仑生物技术有限公司,批号:20140207,纯度:95.00%);DMEM高糖培养基(美国Gibco公司,批号:20140301);胰蛋白酶(杭州沃森生物技术有限公司,批号:20140412);Cellmax澳洲胎牛血清[赛澳美细胞技术(北京)有限公司,批号:20140811];MTT(上海源叶生物科技有限公司,批号:20140207,纯度:98.00%);二甲基亚砜(DMSO,重庆市华雅干细胞技术有限公司,批号:20140315);AnnexinⅤ-异硫氰酸荧光素(FIFC)细胞凋亡检测试剂盒(上海睿时生物科技有限公司,批号:20131204);小鼠抗人VEGF抗体(武汉艾美捷科技有限公司,批号:20140105);小鼠抗人eNOS抗体(上海一研生物科技有限公司,批号:20140597);小鼠抗人β-actin抗体、辣根过氧化物酶(HRP)标记的羊抗鼠多克隆抗体(北京中杉金桥公司,批号:20140307、20140102)。
1.3 细胞
HPMECs购自上海素尔生物科技有限公司。
2 方法
2.1 HPMECs细胞培养
将HPMECs及2 ml含10%胎牛血清的100 u/ml青霉素-0.1 mg/ml链霉素的DMEM培养基置于培养皿中,于37 ℃、5%CO2培养箱中培养,每隔1~2 d换液1次,直至细胞融合90%时进行传代,取3~5代细胞用于试验。
2.2 缺氧损伤模型建立与分组
将HPMECs置于无血清培养基中处理12 h使细胞同步化,将细胞用0.25%培养基中消化2 min,弃上清,加入2 ml血清培养基后吹打至细胞分散后,1 500 r/min(离心半径6 cm,下同)离心5 min,收集沉淀,加入含抗生素及血清的培养基,调节细胞浓度至1.5×102μl-1接种至96孔板,每孔200 μl。试验分为A、B、C、D组,各组细胞均在37 ℃、5%CO2培养箱中培养12 h至细胞贴壁。A组为正常对照,于常氧环境中培养;B、C、D组细胞于3%O2-5%CO2-92%N2的三气培养箱中培养24 h制备缺氧损伤模型[5]。其中C、D组培养前加入前列地尔使其在培养液中质量浓度为15、45 μg/L[6],A、B组培养前加入无血清培养液,各孔中液体体积为(200±20)μl。
2.3 指标检测
2.3.1 倒置显微镜观察细胞形态 各组细胞培养48 h后,将96孔板直接置于倒置荧光显微镜(放大100倍)下观察,比较各组细胞形态的变化,并拍照。
2.3.2 MTT比色法检测细胞活力 各组细胞均弃去上清液,每组设12个复孔,设置空白对照孔(无细胞)调零,加入200 μl无血清培养液及20 μl的MTT+磷酸盐缓冲液(PBS)(5 g/L),于37 ℃下孵育4 h并终止培养。弃上清后每孔加入150 μl的DMSO,振荡10 min,分别用酶标仪于490 nm波长处测定细胞培养0、6、12、24 h后的吸光度(A),绘制细胞生存曲线。
2.3.3 流式细胞仪检测细胞凋亡率 用胰蛋白酶分别消化及收集各组细胞,每个样本调细胞数为1×109~5×109个,1 000 r/min离心5 min,弃上清,用500 μl PBS重悬细胞。每个样本中分别加入5 μl AnnexinⅤ-FIFC和10µl碘化丙啶(PI),避光摇匀后黑暗中室温孵育5 min,1 h内上流式细胞仪检测各组细胞的凋亡率。
2.3.4 Western blot法检测细胞中VEGF及eNOS表达 取各组细胞,加入裂解液,蛋白定量后采用Western blot法检测VEGF及eNOS表达水平,操作严格按照说明书进行:裂解细胞后获取总蛋白,将蛋白定量后经十二烷基苯磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、转膜、封闭、切膜后分别加入1∶500的小鼠抗人VEGF抗体及1∶500的小鼠抗人eNOS抗体和1∶2 000的小鼠抗人β-actin抗体,4 ℃孵育过夜,洗涤后加入HRP标记的羊抗鼠多克隆抗体,室温孵育1.5 h后洗膜,电化学发光(ECL)试剂盒曝光显影。以目标条带与内参β-actin条带的比值作为目标蛋白相对表达量,试验重复3次。
2.4 统计学方法
采用SPSS 16.0软件对数据进行分析。计量资料用均数±标准差(±s)表示。采用单因素方差分析,两组间比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 细胞形态
A、D组细胞的密度较高,细胞生长接近亚融合状态,呈短梭形生长,排列呈铺路石状;B组细胞密度较低,部分细胞呈空泡状,表现出损伤;C组细胞密度较低,损伤不明显。各组细胞的形态图见图1。

图1 各组细胞的形态图(×100)Fig 1 Morphology of cells in each group(×100)
3.2 细胞活力与凋亡率
与A组比较,B、C、D组细胞活力降低,凋亡率升高,差异有统计学意义(P<0.05)。各组细胞的生存曲线见图2,培养24 h时的A值和凋亡率检测结果见表1。

图2 各组细胞的生存曲线Fig 2 Survival curves of cells in each group
表1 各组细胞的A值和凋亡率检测结果(±s,n=12)Tab 1 Detection results of A value and apoptosis rate of cells in each group(±s,n=12)
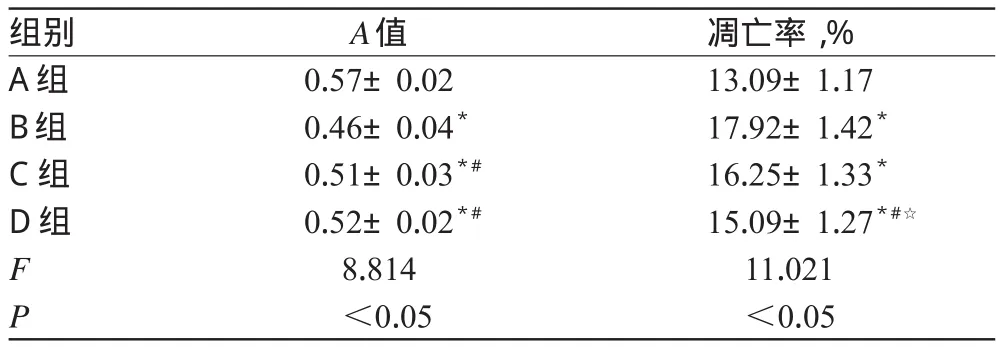
表1 各组细胞的A值和凋亡率检测结果(±s,n=12)Tab 1 Detection results of A value and apoptosis rate of cells in each group(±s,n=12)
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,☆P<0.05Note:vs.group A,*P<0.05;vs.group B,#P<0.05;vs.group C,☆P<0.05
凋亡率,% 13.09±1.17 17.92±1.42*16.25±1.33*15.09±1.27*#☆11.021 <0.05组别A组B组C组D组A值F P 0.57±0.02 0.46±0.04*0.51±0.03*#0.52±0.02*#8.814 <0.05
3.3 细胞中VEGF和eNOS表达
与A组比较,B、C、D组细胞中VEGF和eNOS的表达增强,eNOS/VEGF减少,差异有统计学意义(P<0.05);与B组比较,C组细胞中VEGF表达减弱,D组细胞中VEGF和eNOS的表达减弱、eNOS/VEGF增加,差异有统计学意义(P<0.05);与C组比较,D组细胞的eNOS/VEGF增加,差异有统计学意义(P<0.05)。各组细胞中VEGF、eNOS表达的电泳图见图3,检测结果见表2。
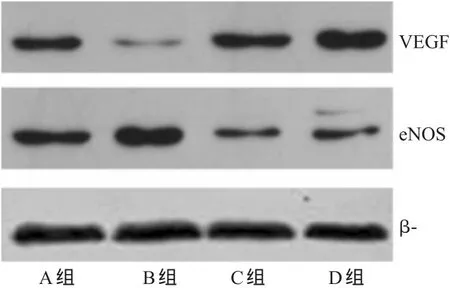
图3 各组细胞中VEGF、eNOS表达的电泳图Fig 3 Electropherogram of the expressions of VEGF and eNOS of cells in each group
表2 各组细胞中VEGF、eNOS表达及eNOS/VEGF的检测结果(±s,n=12)Tab 2 Detection results of expressions of VEGF and eNOS and eNOS/VEGF of cells in each group(±s,n=12)
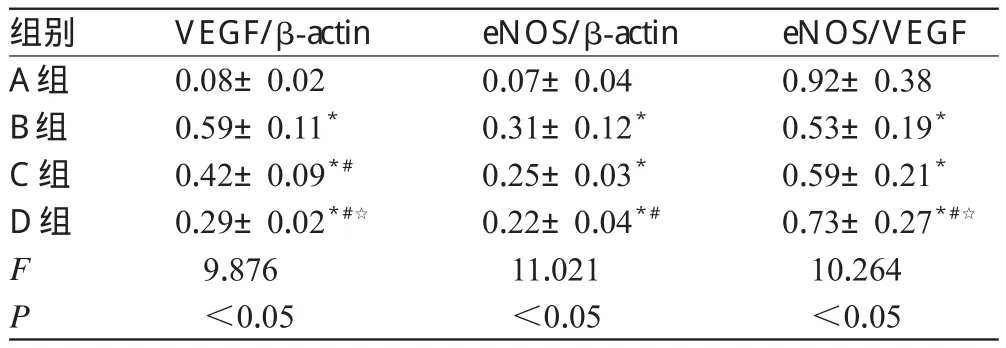
表2 各组细胞中VEGF、eNOS表达及eNOS/VEGF的检测结果(±s,n=12)Tab 2 Detection results of expressions of VEGF and eNOS and eNOS/VEGF of cells in each group(±s,n=12)
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,☆P<0.05Note:vs.group A,*P<0.05;vs.group B,#P<0.05;vs.group C,☆P<0.05
eNOS/VEGF 0.92±0.38 0.53±0.19*0.59±0.21*0.73±0.27*#☆10.264 <0.05组别A组B组C组D组F P VEGF/β-actin 0.08±0.02 0.59±0.11*0.42±0.09*#0.29±0.02*#☆9.876 <0.05 eNOS/β-actin 0.07±0.04 0.31±0.12*0.25±0.03*0.22±0.04*#11.021 <0.05
4 讨论
缺氧可以引起肺血管强烈收缩及血管平滑肌细胞大量增生,促进肺动脉高压的发生。近些年研究发现,缺氧引起的多种血管活性物质平衡失调在肺动脉高压的发病中发挥了重要作用[6-7]。既往研究发现,前列地尔注射液预处理对局部脑缺血模型的大鼠具有保护作用,其机制可能通过下调大脑皮层的诱导型一氧化氮合成酶(iNOS)、上调eNOS有关[8-9]。肺是前列地尔代谢最强及作用最明显的器官,研究认为前列地尔主要通过缓解肺血管局限性狭窄、扩张肺动脉、增加远端肺血流、改善肺通气/血流比,从而达到降低肺动脉压的作用[10],但前列地尔对肺部微血管细胞的保护作用目前无明确研究。
本次研究参照陈小菊等[5]的方法,采用三气培养箱,以3% O2-5%CO2-92%N2环境建立缺氧损伤模型,结果表明前列地尔对缺氧损伤HPMECs细胞具有保护作用。
VEGF与eNOS在缺氧导致的肺微血管损伤中发挥的作用不同:VEGF可以导致血管内皮细胞增殖,促进肺动脉高压的进展;eNOS可以通过合成NO扩张血管,抑制肺动脉高压的进展。既往研究发现,缺氧对VEGF的表达具有重要的意义,细胞缺氧培养几小时内VEGF的表达水平即可明显增高;在体研究发现,缺氧对心、脑、肝、肾等组织的VEGF表达具有强烈的诱导作用[11-12]。eNOS主要表达在大、中血管的内皮细胞上,故正常培养时,肺微血管内皮细胞的eNOS的表达水平较低;缺氧状态下,组织的eNOS表达水平升高,小血管及微血管内也可出现eNOS的表达[13]。故本次研究分别对eNOS、VEGF及二者比值进行分析,发现前列地尔对缺氧损伤HPMECs中 VEGF、eNOS的过度表达具有抑制作用。其中eNOS的结果与既往的研究结果不相符,如包翠芳等[14]研究发现前列地尔可以下调缺氧大鼠大脑皮层的iNOS并上调eNOS,其原因可能是本次研究主要采用离体试验的方法,与在体实验存在差异。此外,缺氧可能主要通过改变细胞内氧化还原状态,导致eNOS表达反应性升高[15]。
综上所述,前列地尔可能通过上调HPMECs的eNOS/ VEGF发挥保护作用。
[1]郑泉,袁雅冬,赵靖,等.雌激素及其代谢产物对去势低氧肺动脉高压大鼠烷烃单加氧酶和低氧诱导因子-1α表达的影响[J].中国循环杂志,2015,doi:10.3969/j.issn.1000-3614.2015.09.015.
[2]陈刚,宋军,相虹,等.γ氨基丁酸对肺动脉高压大鼠肺组织VEGF、MMP-9表达的影响[J].重庆医学,2014,doi:10.3969/j.issn.1671-8348.2014.30.021.
[3]夏世金,吴俊珍,万文斌,等.Gax基因对低氧性肺动脉内皮细胞增殖与ET-1、VEGF和eNOS蛋白表达的影响[J].中国老年学杂志,2013,33(24):6 170.
[4]郭韶梅,喻杰.前列地尔脂微球注射液对慢性阻塞性肺疾病肺动脉高压患者的临床疗效[J].南昌大学学报:医学版,2014,54(7):34.
[5]陈小菊,程德云,樊莉莉.低氧对大鼠肺动脉平滑肌细胞和肺微血管内皮细胞表达及分泌fractalkine的影响[J].四川大学学报:医学版,2012,43(5):661.
[6]王建荣,周英,桑葵,等.缺氧性肺动脉高压新生大鼠肺血管重塑与肺血管HIF-1α、ET-1、iNOS表达的相关性研究[J].中国当代儿科杂志,2013,15(2):138.
[7]周英,王乐,李明霞,等.缺氧诱导因子-1α及其内皮素-1、肾上腺髓质素在缺氧性肺动脉高压新生大鼠中的变化[J].中华实用儿科临床杂志,2013,28(18):1 384.
[8]王龙,林新宇,王丽娜,等.前列地尔联合高频振荡通气治疗新生儿持续肺动脉高压疗效分析[J].中国新生儿科杂志,2015,30(1):51.
[9]杨红群.前列地尔联合肺表面活性物质治疗新生儿肺动脉高压的疗效观察[J].海南医学,2013,24(14):2 082.
[10]章敬玉,罗勇.前列地尔对慢性肺源性心脏病肺动脉高压疗效的临床研究[J].临床肺科杂志,2014,doi:10.3969/j.issn.1009-6663.2014.08.009.
[11]代红,王春茂.血清缺氧诱导因子-1α及血管内皮生长因子与高原肺动脉高压的关系[J].医药前沿,2014,(16):173.
[12]李红英,李军朋,张会军,等.室间隔缺损患儿血浆VEGF、TGF-β1的含量与肺动脉压力的关系[J].实用医学杂志,2015,31(10):1 651.
[13]李岩鹏.17β-雌二醇和2-甲氧基雌二醇对去势及低氧性肺动脉高压大鼠eNOS/NO的影响[D].石家庄:河北医科大学,2015.
[14]包翠芳,刘霞,魏嘉,等.前列地尔对局灶性脑缺血模型大鼠大脑皮层中iNOS和eNOS表达的影响[J].中国药房,2012,23(13):1 166.
[15]毛敏,李倩,邱艳丽,等.线粒体活性氧的产生及调节缺氧性肺动脉高压作用机制[J].哈尔滨医科大学学报,2014,48(6):525.
Effects of Alprostadil on the Expression of VEGF and eNOS in Human Pulmonary Microvascular Endothelial Cells with Hypoxia-induced Injury
WANG Youjun,ZHANG Lingmei(Dept.of Infectious,the Hospital Affiliated of Laiwu Iron and Steel Group Co.,Ltd.,Shandong Laiwu 271126,China)
OBJECTIVE:To study the effects of alprostadil on the expression of vascular endothelial growth factor(VEGF)and endothelial nitric oxide synthase(eNOS)in human pulmonary microvascular endothelial cells(HPMECs)with hypoxia-induced injury.METHODS:HPMECs were divided into group A(normal cultural environment),group B(3%O2),group C(3% O2+15 μg/L alprostadil)and group D(3%O2+45 μg/L alprostadil)for 24 h culture.Cell morphology was observed;MTT method was conducted to detect cell activity(recorded by absorbance);flow cytometry was adopted to detect apoptosis rate;Western blot was used to detect relative expressions of VEGF and eNOS in cells.RESULTS:Cell density in group A and D was relatively high,that in group B and C was low.Compared with group A,cell activities decreased and apoptosis rates increased in group B,C and D,expressions of VEGF and eNOS enhanced,eNOS/VEGF decreased(P<0.05).Compared with group B,cell activities increased in group C and D,VEGF expression decreased(P<0.05);apoptosis rate in group D decreased,eNOS expression decreased and eNOS/VEGF increased.Compared with group C,cell apoptosis rate was decreased in group D,VEGF expression decreased and eNOS/VEGF increased(P<0.05).CONCLUSIONS:Alprostadil maybe play effect on HPMECs with hypoxia-induced injury by up-regulating the expression level of eNOS/VEGF.
Alprostadil;Hypoxia-induced injury;Human pulmonary microvascular endothelial cells;Vascular endothelial growth factor;Endothelial nitric oxide synthase
R965
A
1001-0408(2016)25-3518-03
10.6039/j.issn.1001-0408.2016.25.19
2016-03-07
2016-04-11)
*副主任医师。研究方向:传染病的治疗。E-mail:lgwangxinyan@126.com
