大枣神经保护作用的活性组分筛选及其作用机制研究Δ
2016-10-26陈剑平李中桂张尚斌董婷霞詹华强深圳市中医院深圳市医院中药制剂研究重点实验室广东深圳58033香港科技大学中药研发中心香港
陈剑平,李中桂,张尚斌#,郑 平,董婷霞,詹华强(.深圳市中医院深圳市医院中药制剂研究重点实验室,广东深圳 58033;.香港科技大学中药研发中心,香港)
大枣神经保护作用的活性组分筛选及其作用机制研究Δ
陈剑平1*,李中桂1,张尚斌1#,郑 平1,董婷霞2,詹华强2(1.深圳市中医院深圳市医院中药制剂研究重点实验室,广东深圳 518033;2.香港科技大学中药研发中心,香港)
目的:筛选大枣神经保护作用的活性组分,并初步阐明其作用机制。方法:以大枣多糖富集组分(1 mg/ml)、大枣多糖去除组分(1 mg/ml)、7种大枣黄酮类成分(儿茶素、原花青素B2、表儿茶素、金丝桃苷、芦丁、槲皮素-3-β-D-葡萄糖苷、山柰酚-3-O-芸香糖苷,记为A、B、C、D、E、F、G,浓度均为3、13、30µmol/L)和2种大枣核苷类成分(环磷酸腺苷、环磷酸鸟苷,浓度均为3、13、30 µmol/L)分别培养类神经细胞(PC12细胞)24 h后,以叔丁基过氧化氢(tBHP,150µmol/L)作用于PC12细胞3 h诱导细胞氧化损伤,MTT法检测PC12细胞的存活率。按上述方法培养转染了报告基因质粒(pARE-Luc)的PC12细胞24 h,采用荧光素酶(Luc)法检测各组细胞中抗氧化元件(ARE)的转录水平(以Luc活性反映),以考察各组分抗损伤机制。结果:大枣多糖富集组分能显著提高氧化损伤PC12细胞的存活率,升高转染细胞内ARE转录水平。大枣所含的黄酮类成分中A(30µmol/L)、B(3~30µmol/L)和C (10~30µmol/L)均能显著高细胞存活率,且A(30µmol/L)、B(3~30µmol/L)、C(30µmol/L)、E(30µmol/L)和F(3~30µmol/L)能显著提高转染细胞内ARE转录水平。大枣中核苷类成分环磷酸腺苷和环磷酸鸟苷则无明显提高氧化损伤PC12细胞存活率和和转染细胞内ARE转录水平的作用。结论:大枣多糖类成分和大枣黄酮类成分可能是大枣神经保护作用的活性组分,且其作用机制可能与激活ARE转录相关。
大枣;神经保护;PC12细胞;大枣多糖去除组分;大枣多糖富集组分;抗氧化元件;大枣黄酮;大枣核苷
大枣为鼠李科植物枣(Ziziphus jujuba Mill.)的干燥成熟果实,具有补中益气、养血安神的功效[1]。近年研究不断证实了大枣的神经保护作用,如减轻长爪沙鼠海马组织的缺血性损伤、提高脑内脑源性神经营养因子水平、抗惊厥和改善大鼠认知障碍等[2-3]。但目前国内外对大枣神经保护方面的研究大部分停留在功效分析上,缺乏对其有效物质基础的研究。据文献报道,大枣水提物中主要成分为核苷类、黄酮类和多糖类3种[4-7]。其中,核苷类成分具有抗血小板凝聚和抗心律失常等功效[8-9],黄酮类成分具有抗氧化和抗炎等作用[10-12],多糖类成分则具有增强免疫功能、造血功能和抗氧化等作用[13-15]。而关于这3类成分在神经系统方面作用研究鲜有报道。
近年来,关于氧化应激与神经性疾病的相关性假说引起了相关学者的高度关注。类神经细胞——PC12细胞被广泛用于评价药物基于氧化损伤或其他损伤的神经保护作用中,笔者前期已经利用该细胞成功建立了基于抗氧化反应元件(ARE)的抗氧化作用评价模型[6,16]。在本实验中,笔者在前期建立的模型基础上进一步研究大枣中上述3类组分在神经系统中的作用,初步阐明大枣神经保护作用的物质基础。
1 材料
1.1 仪器
FLUOstar OPTIMA型全自动多功能酶标仪(德国BMG Labtech公司);Sartorius BP 211D型电子天平(十万分之一,德国Sartorius公司);CQ-250-DST型超声波清洗机(上海跃进医用光学器械厂)。
1.2 药材、对照品、载体与试剂
大枣药材采自河北沧州,由香港科技大学中药研发中心董婷霞博士鉴定为鼠李科植物枣(Ziziphus jujuba Mill.)的干燥成熟果实;儿茶素(批号:E-0102)、原花青素B2(批号:E-0511)、表儿茶素(批号:E-0113)、金丝桃苷(批号:E-0193)、芦丁(批号:E-0124)、槲皮素-3-β-D-葡萄糖苷(批号:E-0741)、山柰酚-3-O-芸香糖苷(批号:E-0798)对照品均购自上海同田生物技术股份有限公司,纯度均高于98%;环磷酸腺苷(cAMP,批号:A9501)、环磷酸鸟苷(cGMP,批号:G7504)、维生素C (VC,批号:1043003)、叔丁基氢醌(tBHQ,批号:112941)对照品均购自美国Sigma公司,纯度均高于98%;大枣多糖富集组分和大枣多糖去除组分由香港科技大学中药研发中心提取、富集制得;荧光素酶(Luc)检测试剂盒(批号:BC100L)购自美国应用生物系统中国公司;pGL4.37[luc2P/ARE/Hygro]启动子报告载体[包含4个重复的ARE,序列为5′-TAGCTTGGAAATGACATTGCTAATGGTGACAAAGCA-ACTTT-3′,ARE可激活Luc报告基因luc2P的转录]、报告基因质粒(PARE-Luc)购自美国Promega Corporation公司;其余试剂均为分析纯。
1.3 细胞株
大鼠嗜铬细胞瘤细胞株PC12细胞购于美国ATCC公司。
2 方法
2.1 大枣多糖富集组分与大枣多糖去除组分的制备
取大枣药材80 g,加20倍量水,煎煮2次,每次1 h,滤过,合并2次滤液。滤液加4倍量乙醇沉淀,于4 ℃条件下放置过夜,离心,分取上清液和沉淀物,分别干燥,即得大枣多糖去除组分(2.88 g)和大枣多糖富集组分(58.19 g)。
2.2 大枣中各组分及其他试剂溶液的制备
取儿茶素、原花青素B2、表儿茶素、金丝桃苷、芦丁、槲皮素-3-β-D-葡萄糖苷、山柰酚-3-O-芸香糖苷、cAMP、cGMP对照品适量,精密称定,分别溶于二甲基亚砜(DMSO)溶液中,振摇使其充分溶解,分别制备成浓度为100 mmol/L的贮备液;取大枣多糖富集组分和大枣多糖去除组分适量,精密称定,分别溶于水中,振摇使其充分溶解,分别制备成质量浓度为50、100 mg/ml的贮备液。以上贮备液均贮存在4 ℃冰箱中,临用前根据试验情况再用DMEM培养基进行稀释。
2.3 细胞培养[16]
将PC12细胞加至含6%胎牛血清、6%马血清、100 u/ml青霉素以及100 μg/ml链霉素的DMEM培养基中,然后再置于温度为37 ℃、含7.5%CO2和一定湿度的培养箱中培养。
2.4 大枣各组分对神经细胞的保护作用
将PC12细胞接种到96孔板中,每孔约2×104个细胞,过夜让细胞贴壁。第2天开始取“2.2”项下的大枣不同组分贮备液分别用DMEM培养基稀释,使大枣多糖富集物组分、大枣多糖去除组分质量浓度均为1 mg/ml,各对照品浓度分别为3、10、30 μmol/L,分别加入培养的细胞中,作为给药组;同法加入相同体积的DMEM培养基作为空白组。培养24 h后,各孔均加入tBHP溶液(氧化应激诱导剂,150 μmol/L)3 h诱导细胞损伤,再加入MTT溶液(0.5 mg/ml),继续培养1 h后终止培养。小心吸弃孔内培养液,每孔加入150µl DMSO溶液,在避光条件下置于摇床上低速振荡15 min,使结晶充分溶解。采用酶标仪于570 nm波长处测量各孔的吸光度(A),其中空白组的吸光度为A0、给药组的吸光度为AS。并计算细胞的存活率:存活率(%)=1-(1-AS)/(1-A0)×100%。试验重复3次,结果以3次试验结果的平均值来表示。同时,以VC(1 mmol/L)为阳性对照,同法测定细胞的存活率。
2.5 大枣各组分对转染细胞ARE转录的激活作用
通过Lipofectamine 2000转染技术,将报告基因质粒(pARE-Luc)转染到培养的PC12细胞中,将转染后的PC12细胞接种在24孔板中,每孔约5×105个细胞,过夜让细胞贴壁。从第2天开始,给药组分别按“2.4”项下方法给药,空白组加入相同体积的细胞培养液。给药24 h后取样,按Luc试剂盒说明书操作进行Luc转录活性分析(以此反映细胞内ARE转录水平)。荧光发光反应通过全自动多功能酶标仪进行定量,活性大小采用吸光度(测定波长为560 nm)表示,其中空白组吸光度为A0、给药组为AS,计算相对Luc活性:相对Luc活性(%)= (AS/A0-1)×100%。试验重复3次,结果以3次试验结果的平均值来表示。同时以tBHQ(2 μmol/L)为阳性对照,同法测定其对Luc活性的影响。
2.6 统计学方法
采用SPSS 13.0软件处理试验数据。组间两两比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
3.1 大枣各组分对神经细胞的保护作用测定结果
3.1.1 大枣多糖富集组分与大枣多糖去除组分对神经细胞的保护作用 在相同质量浓度下(1 mg/ml),大枣多糖富集组分能显著减轻由tBHP诱导的神经细胞氧化损伤,细胞存活率为30%,但效果明显不及VC;而在大枣多糖去除组分作用下,细胞存活率约为10%,与大枣多糖富集组分比较,差异有统计学意义(P<0.05)。结果提示,大枣多糖组分可能是大枣神经保护作用的活性组分之一。大枣多糖富集组分和大枣多糖去除组分作用后细胞存活率测定结果见图1。
3.1.2 大枣黄酮类组分和核苷类组分对神经细胞的保护作用 儿茶素(30 μmol/L)、原花青素B2(3、10、30 μmol/L)和表儿茶素(10、30 μmol/L)等均能减轻由tBHP诱导的PC12细胞的氧化损伤,细胞存活率均大于20%,与空白组(细胞存活率为0)比较差异有统计学意义(P<0.05),但效果不及VC;金丝桃苷、芦丁、槲皮素-3-β-D-葡萄糖苷和山柰酚-3-O-芸香糖苷的作用相对较弱。另外,cAMP、cGMP也无明显的保护作用,细胞存活率接近0。结果提示,大枣黄酮类组分也可能是大枣神经保护作用的活性组分之一。大枣黄酮类成分和大枣核苷类成分作用后细胞存活率测定结果见图2。

图1 大枣多糖富集组分和大枣多糖去除组分作用后细胞存活率测定结果Fig 1 The cell survival rate after the actions of the ingredient of Z.jujuba with polysaccharide enriched and that with polysaccharide removed
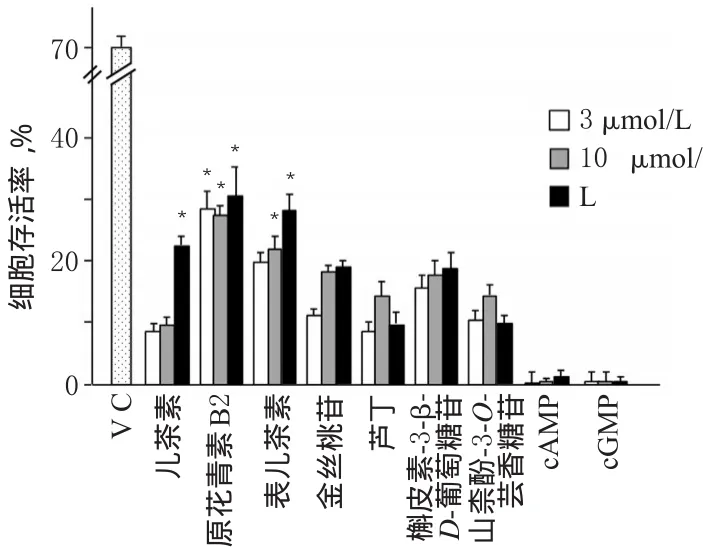
图2 大枣黄酮类成分和大枣核苷类成分作用后细胞存活率测定结果Fig 2 The cell survival rate after the actions of the flavonoid ingredients and the nucleoside ingredients of Z.jujuba
3.2 大枣各组分对转染细胞内ARE转录的激活作用测定结果
3.2.1 大枣多糖类组分对转染细胞内ARE转录的激活作用 在相同质量浓度(1 mg/ml)下,大枣多糖富集组分能显著诱导Luc表达,相对Luc活性明显升高(即ARE转录水平升高);而大枣多糖去除组分则无明显作用,与大枣多糖富集组分比较差异有统计学意义(P<0.05)。结果提示,大枣中多糖类组分的大枣神经保护作用机制与激活细胞内ARE转录相关。大枣多糖富集组分和大枣多糖去除组分作用后转染细胞内相对Luc活性测定结果见图3。
3.2.2 大枣黄酮类组分和核苷类组分对转染细胞内ARE转录的激活作用 儿茶素(30 μmol/L)、原花青素B2(3、10、30 μmol/L)、表儿茶素(10 μmol/L)、芦丁(10 μmol/L)和山柰酚-3-O-芸香糖苷(3、10、30 μmol/L)5个黄酮类成分均能明显提高Luc活性(即ARE转录水平升高),与空白组(相对Luc活性为0)比较差异有统计学意义(P<0.05);而金丝桃苷、槲皮素-3-β-D-葡萄糖苷作用相对较弱。另外,cAMP、cGMP也无显著激活作用。结果提示,黄酮类组分的神经保护作用机制与激活细胞内ARE转录相关。黄酮类成分和核苷类成分作用后转染细胞内相对Luc活性测定结果见图4。
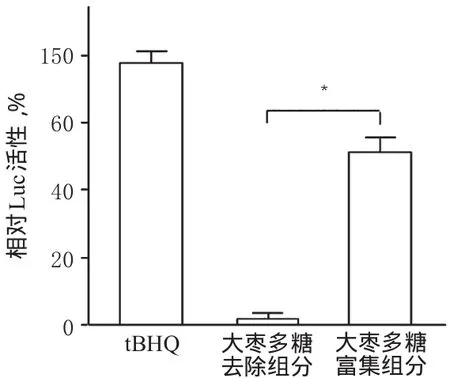
图3 大枣多糖富集组分和大枣多糖去除组分作用后转染细胞内相对Luc活性测定结果Fig 3 The relative activities of Luc in the transfected cells after the actions of the ingredient of Z.jujuba with polysaccharide enriched and that with polysaccharide removed
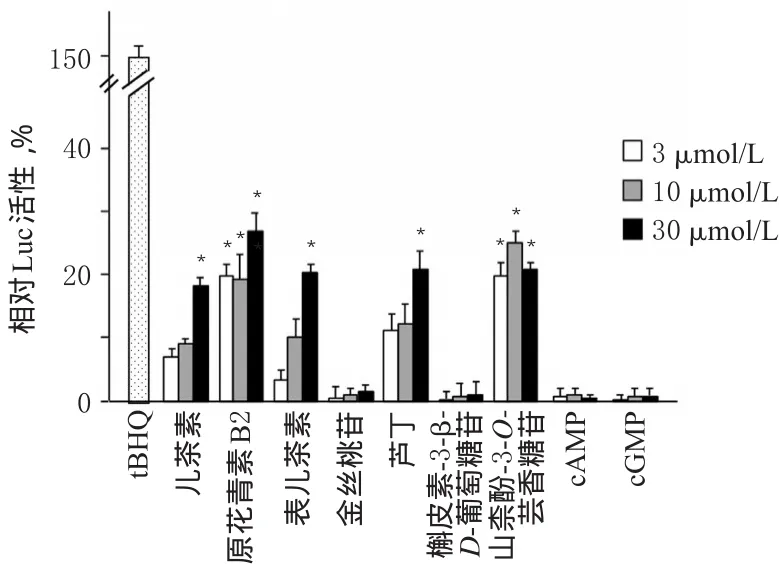
图4 大枣黄酮类成分和大枣核苷类成分作用后转染细胞内相对Luc活性测定结果Fig 4 The relative activities of Luc in the transfected cells after the actions of the flavonoid ingredients and the nucleoside ingredients of Z.jujuba
4 讨论
氧化应激产生的活性氧(ROS)直接或间接地损伤细胞内蛋白质、核酸、脂质等大分子物质的生理功能,有关氧化应激与神经系统疾病的相关性假说越来越受到研究者的重视。Keep-Nrf2-ARE抗氧化信号通路是迄今为止发现的最重要的内源性抗氧化应激通路,其通过调节下游的抗氧化酶和Ⅱ相解毒酶等蛋白的表达而发挥抗氧化作用。在抗氧化酶和Ⅱ相解毒酶基因的上游启动区有一非常保守的基因调控序列,被称为ARE,调动以上基因的表达主要是通过激活ARE实现的[17]。目前,以ARE为靶序列的细胞水平药物筛选模型在国内报道相对较少,但相比于经典的抗氧化筛选模型有其独特的优势,比如可进行高通量和微量化检测等。
在前期研究中,笔者发现大枣水提物可抵御tBHP诱导的PC12细胞的氧化损伤,提高氧化损伤PC12细胞的存活率,并且大枣水提取物可激活转染细胞内ARE的转录水平[6]。在本研究中,笔者进一步对大枣神经保护作用的活性组分进行筛选。黄酮类成分目前被认为具有广泛的抗氧化活性,目前已鉴定出大枣中含有的黄酮类成分有17种[18-19]。本研究选取其中7种主要黄酮成分进行神经细胞抗氧化损伤的评价,发现儿茶素、原花青素B2和表儿茶素等黄酮类成分具有神经保护作用(氧化损伤细胞存活率升高)。大枣多糖作为大枣特异性成分也是目前研究的重点。在抗氧化活性方面,有研究采用阴离子自由基测定方法、羟基自由基清除法等方法考察大枣多糖的抗氧化作用[20]。本文以PC12细胞为研究对象,进一步验证了大枣多糖的抗氧化作用,其可能也是发挥神经保护作用的有效成分。但是本文只研究了大枣多糖富集组分对神经细胞的保护作用,具体是大枣多糖中哪种多糖成分起作用尚未阐明。另外,本研究结果显示,核苷类主要成分cAMP、cGMP无明显的神经保护作用,但是否可通过其他途径发挥神经保护作用有待进一步考察。
综上所述,大枣多糖类成分和大枣黄酮类成分可能是大枣神经保护作用的活性组分,且其作用机制与激活ARE转录相关。
[1]国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:22.
[2] Chen J,Yan AL,Lam KY,et al.A chemically standardized extract of Ziziphus jujuba fruit(Jujube)stimulates expressions of neurotrophic factors and anti-oxidant enzymes in cultured astrocytes[J].Phytother Res,2014,28 (11):1 727.
[3] Pahuja M,Mehla J,Reeta KH,et al.Hydroalcoholic extract of Zizyphus jujuba ameliorates seizures,oxidative stress,and cognitive impairment in experimental models of epilepsy in rats[J].Epilepsy Behav,2011,21(4):356.
[4]Mahajan RT,Chopda MZ.Phyto-pharmacology of Ziziphus jujuba Mill:a plant review[J].Phcog Rev,2009,3(6):320.
[5]Gao QH,Wu C S,Wang M.The jujube(Ziziphus jujube Mill.)fruit:a review of current knowledge of fruit composition and health benefits[J].J Agric Food Chem,2013,61(14):3 351.
[6]Chen JP,Li ZG,Maiwulanjiang M,et al.Chemical and biological assessment of Ziziphus jujuba fruits from China:different geographical sources and developmental stages[J].J Agric Food Chem,2013,61(30):7 315.
[7]Guo S,Duan JA,Zhang Y,et al.Contents changes of triterpenic acids,nucleosides,nucleobases,and saccharides in Jujube(Ziziphus jujuba)fruit during the drying and steaming process[J].Molecules,2015,20(12):22 329.
[8]Schmidt AP,Lara DR,Maraschin JD,et al.Guanosine and GMP prevent seizures induced by quinolinic acid in mice[J].Brain Res,2000,864(1):40.
[9]Conti JB,Belardinelli L,Utterback DB,et al.Endogenous adenosine is an antiarrhyhmic agent[J].Circulation,1995,91(6):1 761
[10]Goyal R,Sharma PL,Singh M.Possible attenuation of nitric oxide expression in anti-inflammatory effect of Ziziphus jujuba in rat[J].J Nat Med,2011,65(3/4):514.
[11] Xue ZP,Feng WH,Cao JK,et al.Antioxidant activity and total phenolic contents in peel and pulp of Chinese jujube(Ziziphus jujuba Mill.)fruits[J].J Food Biochem,2009,33(5):613.
[12]Sun YF,Liang ZS,Shan CJ,et al.Comprehensive evaluation of natural antioxidants and antioxidant potentials in Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chou fruits based on geographical origin by TOPSIS method[J].Food Chem,2011,124(4):1 612.
[13] Zhao ZH,Li J,Wu XM,et al.Structures and immunological activities of two pectic polysaccharides from the fruits of Ziziphus jujuba Mill.cv.jinsixiaozao Hort[J].Food Res Int,2006,39(8):917.
[14] Chang SC,Hsu BY,Chen BH.Structural characterization of polysaccharides from Zizyphus jujuba and evaluation of antioxidant activity[J].Int J Biol Macromol,2010,47(4):445.
[15]苗明三,苗艳艳,孙艳红.大枣多糖对血虚大鼠全血细胞及红细胞ATP酶活力的影响[J].中国临床康复,2006,10 (11):97.
[16] Zhu JT,Choi RC,Chu GK,et al.Flavonoids possess neuroprotective effects on cultured pheochromocytoma PC12 cells:a comparison of different flavonoids in activating estrogenic effect and in preventing beta-amyloid-induced cell death[J].J Agric Food Chem,2007,55(6):2 438.
[17]Choi SH,Ahn JB,Kozukue N,et al.Distribution of free amino acids,flavonoids,total phenolics,and antioxidative activities of jujube(Ziziphus jujuba)fruits and seeds harvested from plants grown in Korea[J].J Agric Food Chem,2011,59(12):6 594.
[18] Li JW,Liu YF,Fan LP,et al.Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus jujuba cv.Jinsixiaozao[J].Carbohydr Polym,2011,84(1):390.
[19]陈鑫,刘永刚,王耀欣,等.HPLC法同时测定大枣中芦丁和酸枣仁皂苷B的含量[J].中国药房,2010,21(3):247.
[20]Chen JP,Maiwulanjiang M,Lam KY,et al.A standardized extract of the fruit of Ziziphus jujuba(jujube)induces neuronal differentiation of cultured PC12 cells:a signaling mediated by protein kinase A[J].J Agric Food Chem,2014,62(8):1 890.
Screening for the Active Ingredients of Ziziphus jujuba with Neuroprotective Effects and Their Mechanisms of Action
CHEN Jianping1,LI Zhonggui1,ZHANG Shangbin1,ZHENG Ping1,DONG Tingxia2,ZHAN Huaqiang2(1.Shenzhen Key Laboratory of Hospital TCM Preparation,Shenzhen Hospital of Traditional Chinese Medicine,Guangdong Shenzhen 518033,China;2.Center for Chinese Medicine R&D,the Hong Kong University of Science and Technology,Hong Kong,China)
OBJECTIVE:To conduct screening for the active ingredients of Ziziphus jujuba with neuroprotective effect and to illuminate their mechanisms of action preliminarily.METHODS:After neuron-like cells(PC12 cells)were respectively cultured in the ingredient of Z.jujuba with polysaccharide enriched(1 mg/ml),that with polysaccharide removed(1 mg/ml),7 kinds of flavonoid ingredients of Z.jujuba(catechin,procyanidine B2,epicatechin,hyperoside,rutin,quercetin-3-β-D-glucoside and kaempferol-3-O-rutinoside,represented by A,B,C,D,E,F,G,all at the concentrations of 3,13,30µmol/L)and 2 kinds of nucleoside ingredients of Z.jujuba(cyclic adenosine monophosphate and cyclic guanosine monophosphate,both at the concentrations of 3,13,30µmol/L)for 24 h,tert-butyl hydroperoxide(tBHP,150µmol/L)was used to act on PC12 cells for 3 h to induce oxidative cellular damage,and MTT assay was employed to detect the survival rate of PC12 cells.The PC12 cells transfected with reporter gene plasmid(pARE-Luc)were cultured as above for 24 h,luciferase(Luc)assay was used to detect the transcriptional levels of the antioxidant response element(ARE)of all groups of cells(reflected as the activity of Luc)so as to investigate the anti-injury mechanism.RESULTS:The ingredient of Z.jujuba with polysaccharide enriched could significantly increase the survival rate of PC12 cells to which oxidative damage was caused and the transcriptional level of ARE in the transfected cells.Among the flavonoid ingredients of Z.jujuba,A(30µmol/L),B(3-30µmol/L)and C(10-30µmol/L)could significantly increased the survival rate of the cells,and A(30µmol/L),B(3-30µmol/L),C(30µmol/L),E(30µmol/L)and F(3-30µmol/L)could obviously increased the activation level of ARE in the transfected cells.However,the nucleoside ingredients of Z.jujuba including cyclic adenosine monophosphate and cyclic guanosine monophosphate had no obvious effect of increasing the survival rate of PC12 cells to which oxidative damage was caused or activating the transcription of ARE in the transfected cells.CONCLUSIONS:The polysaccharide and flavonoid ingredients of Z.jujuba may be the active ingredients which account for the neuroprotective effect against oxidative cellular damage,and their mechanisms of action may be related to the activation of ARE transcription.
Ziziphus jujuba;Neuroprotection;PC12 cells;Ingredient of Z.jujuba with polysaccharide removed;Ingredient of Z.jujuba with polysaccharide enriched;Antioxidant response element;Flavonoid of Z.jujuba;Nucleoside of Z.jujuba
R285.5
A
1001-0408(2016)25-3495-04
10.6039/j.issn.1001-0408.2016.25.12
2016-01-14
2016-05-31)
(编辑:林 静)
深圳市卫生计生系统科研项目(No.201505015)
*助理研究员,博士。研究方向:中药药效物质基础及质量评价。E-mail:lycjp@126.com
主任中药师,硕士。研究方向:中药新药研究与开发。E-mail:zsb6383@163.com
