多壁碳纳米管/二氧化硅纳米复合材料的制备及其吸油性能
2016-10-25黄剑坤刘会娥黄扬帆马雁冰丁传芹
黄剑坤,刘会娥,黄扬帆,马雁冰,丁传芹
多壁碳纳米管/二氧化硅纳米复合材料的制备及其吸油性能
黄剑坤,刘会娥,黄扬帆,马雁冰,丁传芹
(中国石油大学(华东)重质油国家重点实验室,山东青岛266580)
以羧化多壁碳纳米管为基体、纳米硅溶胶粒为增强相,通过一步液相共混方法制备多壁碳纳米管/二氧化硅纳米复合材料。利用傅里叶变换红外光谱(FTIR)、电子扫描电镜(SEM)、热重(TGA)、孔结构分析(BET/BJH)对其进行了表征。以水中柴油为研究对象考察了该样品对水中柴油的吸附脱除效果,并与纳米二氧化硅胶粒、原生碳纳米管以及活性炭进行对比。结果表明:硅溶胶粒表面修饰后的多壁碳纳米管的聚团行为得以改善,而且材料具有微孔-介孔双孔道结构。对水中直馏柴油的去除率高达97.79%,并于1 h达到吸附平衡。整个吸附过程遵循准二级动力学模型,吸附体系的表观活化能为11.37 kJ·mol-1,吸附等温线与Freundlich模型较为吻合,吸附效果明显强于其他3种吸附剂。
羧基多壁碳纳米管;硅溶胶;介孔-微孔;吸附动力学;纳米材料;复合材料;制备
引 言
石油资源的开发与利用显著推动了当代经济的快速增长,但石油资源大量使用和泄漏所带来的环境污染等问题也日益严峻[1],同时造成了石油资源的巨大浪费[2]。目前含油污水的处理过程中最为高效的方法当属物理吸附[3],其以快速、有效等特点受到研究者的普遍关注。然而传统吸附剂均存在吸附容量小、再生困难等缺点,限制了其在含油污水处理过程中的应用[4]。因此,研制吸附效率高、性能优良的吸附材料,是推动吸附法处理含油污水技术发展的关键。
碳纳米管是一种新兴纳米材料,自1991年被发现以来[5]在世界范围内引发了研究热潮。已有研究结果表明[6-11]碳纳米管对石油类有机物的吸附量和重复使用性能均显著优于普通活性炭吸附剂。但碳纳米管间存在的较强的范德华力,会影响其在液相的分散效果,进而影响材料吸附效果[12-13]。值得关注的是,在众多无机高分子材料中,硅溶胶[14]因具有较强的聚结稳定性和动力学稳定性,在科研以及工业中应用较广。研究表明,硅溶胶具有大比表面积、高附着性和耐高温的特点[15]。
本文拟将硅溶胶与碳纳米管掺杂制备复合材料,解决碳纳米管的分散问题,改善其吸附性能。采用液相共混法,使用硅溶胶对碳纳米管进行表面修饰,进而起到分散碳管的作用,增强碳管在应用过程中的稳定性。采用一系列表征手段对材料的性能进行测试和表征,进而将所制得的复合材料应用于含油污水的吸附处理过程。以直馏柴油、催化柴油为吸附对象,探索吸附过程的动力学和热力学 特性。
1 实验部分
1.1 药品和试剂
多壁碳纳米管(MWCNT),由清华大学FLOTU实验室提供,采用流化床反应器批量制备。碳管平均外径8~15 nm,平均长度10~30 μm[16];木质粉状活性炭(AC),巩义市金辉活性炭制造厂;碱性硅溶胶(30% SiO2·H2O),青岛海洋化工有限公司;直馏柴油(柴油A)、催化柴油(柴油B),大连西太平洋石油化工有限公司,油品物理性质参见前期研究成果;四氯化碳(CCl4)、无水乙醇(EtOH),分析纯(AR),国药化学试剂有限公司;浓硝酸(HNO3)、浓硫酸(H2SO4)、浓盐酸(HCl),国药化学试剂有限公司;Milli-Q 超纯水,自制;模拟含油污水,自制[7]。
1.2 分析仪器和设备
Nicolet67型傅里叶红外光谱分析仪(FTIR),美国Thermo Nicolet公司;Q100型热重分析仪(TGA),升温速率5℃·min-1,空气氛围,美国TA仪器;S-4800冷场发射扫描电子显微镜(SEM),日本日立公司;ASAP2020M全自动比表面和微孔分析系统,美国Micromeritics Instrument 公司;红外测油仪,上海昂林科学仪器;KQ-400KDE型高功率数控超声波清洗器,常州诺基仪器;电热恒温振荡水槽,上海精宏实验设备;粉末压片机,天津市拓普仪器;真空干燥箱DZF-6020型,青岛Latern仪器有限公司;智能箱式高温炉,北京独创科技有限公司。
1.3 羧基碳纳米管单体的制备
将500 mg多壁碳纳米管置于浓硝酸(225 ml,16 mol·L-1)和浓硫酸(75 ml,18 mol·L-1)的混合液中,在100℃下回流搅拌6 h。混合溶液冷却到室温后,使用去离子水反复冲洗过滤,直至滤液成中性后,采用0.22 μm聚碳酸酯膜过滤,将过滤所得黑色固体在盐酸(12 mol·L-1)中浸泡12 h,再次过滤后,将所得固体于60℃烘干,得到羧基化多壁碳纳米管(CNT-COOH)。反应过程如图1所示,采用FT-IR红外线光谱仪对羧基化效果进行表征。
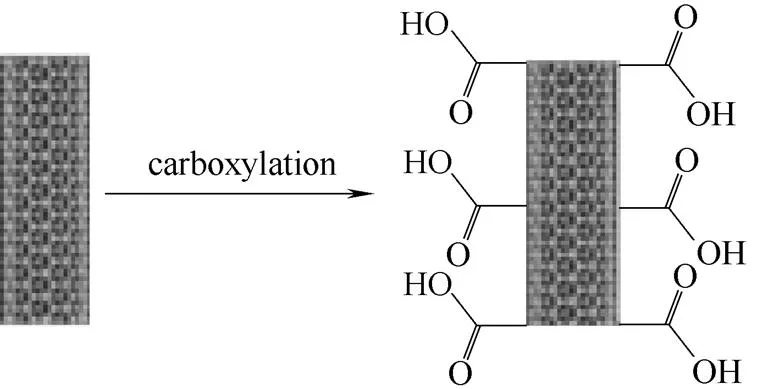
图1 羧基碳纳米管的制备过程
1.4 MWCNT/SiO2纳米复合材料的制备
采用一步液相共混法将1.3节所述酸改性后的多壁碳纳米管通过超声分散法分散于硅溶胶中,置于120℃下真空干燥箱烘干后研磨,制得MWCNT与SiO2质量比为1:1的MWCNT/SiO2复合吸附剂,命名为CS50。制备步骤如图2所示。为对比分析,特将硅溶胶采用上述步骤制备纳米二氧化硅胶粒进行空白吸附实验。

图2 液相共混法制备MWCNT/SiO2纳米复合材料
1.5 吸附特性研究及再生性能研究
在一组50 ml具塞试管中分别加入25 ml浓度为650 mg·L-1的模拟含油污水,然后加入一定量的CS50,在振荡槽中振荡一定时间,取样,采用红外测油仪进行测定。吸附动力学实验中,为减少实验误差,均设置两组平行实验,将结果取平均值。吸附水中柴油的动力学实验详细步骤可参见本课题组前期工作[7]。吸附平衡性能研究在室温298 K下进行,在一组100 ml具塞试管中加入50 ml浓度为1200 mg·L-1的模拟含油污水,分别加入质量为 10、15、20、25、30、35 mg的CS50,在振荡槽中进行恒温振荡,采用红外测油仪测量水中油相浓度。采用柴油A和柴油B作为油样,分析含油污水成分对复合材料吸附性能的影响。
实验结果中吸附量q利用式(1)计算
式中,0、c分别是水中油相的初始浓度和时刻的浓度,mg·L-1;是吸附剂用量,g;是所用含油污水体积,L。
平衡吸附去除率通过式(2)计算
式中,e是吸附达到平衡时的水中的油相浓度,mg·L-1。
采用灼烧法将吸附油品后的CS50再生,具体步骤如下:将CS50吸附剂置于智能箱式高温炉中,在再生温度240℃、再生时间30 min的条件下灼烧。再生后的CS50再次用于吸附特性研究,对复合材料再生性能进行分析。
2 实验结果与讨论
2.1 MWCNT/SiO2纳米复合材料的分析表征
原生多壁碳纳米管和CS50复合吸附剂的SEM照片如图3所示。图3(a)为原生碳纳米管的SEM图,可以看出未掺杂SiO2胶粒的碳管聚团行为较为严重,团簇间隙分布不均,与文献报道的碳管聚团结构类似[17]。图3(b)为样品CS50的SEM照片。从图3(a)和图3(b)可以看出,与聚团严重、管间空隙大小不均的原生碳管团簇相比,大量的纳米SiO2胶粒填充在碳管团簇间隙,生成的SiO2黏结层有效降低了碳管之间的聚团行为,形成了细孔均匀的微观结构,将团簇均匀分散。

图3 CNT与CS50 的SEM照片
在MWCNT/SiO2纳米复合材料的制备过程中羧基碳纳米管的制备是关键步骤,因此采用FTIR表征技术验证碳管表面是否有羧基存在。图4为羧基碳纳米管单体的红外光谱图。图中3400 cm-1和1630 cm-1处分别为OH基团的伸缩振动和弯曲振动特征吸收峰,1760 cm-1处为COOH基团的伸缩振动特征吸收峰,1230 cm-1处为CO基团的伸缩振动特征吸收峰,由此看出碳管表面已成功引入羧基官能团。在CS50复合材料的制备中,羧基碳纳米管在溶液共混中团聚效应得以降低,具有较高的分散度,更易于接枝二氧化硅胶粒[18]。

图4 羧化碳纳米管红外光谱图
为探究MWCNT/SiO2纳米复合材料在高温下的热稳定性和适用的温度范围,将实验中制备的MWCNT/SiO2复合材料在空气气氛下进行热重分析,并与原生碳纳米管、纳米二氧化硅胶粒进行对比,如图5所示。可以看出纳米二氧化硅胶粒在升温过程中的失重量较小。碳纳米管在350℃前曲线下降较缓,所对应的过程为水分和无定形碳的减少[19]。在520℃后曲线斜率突然增大,直至650 ℃后曲线趋于平缓,该现象的原因为碳纳米管在该温度区间内发生燃烧。再通过对比MWCNT/SiO2纳米复合材料,可以看出其热损失质量分数与其中的MWCNT含量相吻合。

图5 热重分析曲线
CS50的氮气吸附脱附等温线和孔径分布曲线如图6和图7所示。图6为CS50与原生碳管的氮气吸附脱附等温线,在相对压力/0值较大时均可观察到明显的H3型迟滞环[18]。相对于原生MWCNT,液相共混法制备出的CS50复合材料具有更大的孔体积。从图7孔径分布曲线可见,未改性的原生碳纳米管的孔径多集中在0~3 nm之间,在加入纳米硅溶胶粒后CS50表现出介孔和微孔特征[20]。同时,基于BET吸附等温线,使用密度泛函理论(DFT)以及孔径分布计算模型[21]可以得到CS50、SiO2胶粒以及MWCNT的总比表面积(SSAtotal)、微孔比表面积(SSAmicro)、介孔比表面积(SSAmeso)、大孔比表面积(SSAmacro)的相关数值,并将结果汇总于表1。数据表明,CS50的孔结构参数,SSAmicro/SSAtotal91.7,SSAmeso/SSAtotal8.3,说明CS50复合材料具有介孔-微孔双重孔道结构特征[21-22]。
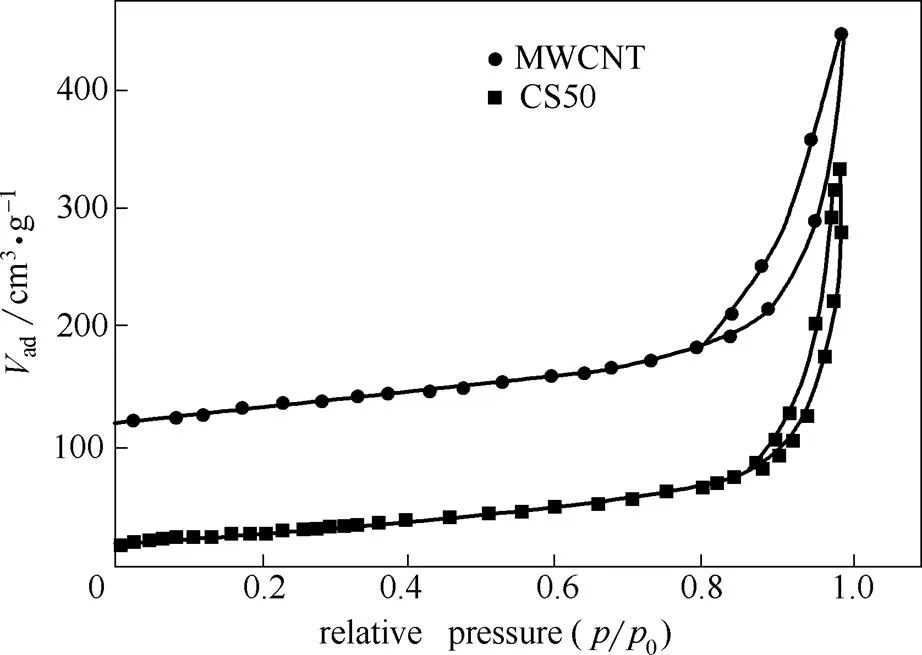
图6 CS50与MWCNT的氮气吸附脱附等温线

图7 CS50和MWCNT的孔径分布曲线

表1 3种吸附剂孔结构特征
2.2 CS50处理含油污水的动力学特性及再生性能研究
在298 K下利用CS50对含有柴油A的模拟含油污水进行吸附处理。图8给出了吸附量随时间的变化过程。可以看出,在298 K下CS50对柴油A的吸附量均随时间增加而增加,而且在1 h内达到吸附平衡。分析曲线可知,吸附开始的前10 min内CS50的吸附量呈现迅速上升趋势,在10~30 min内吸附量呈缓慢上升趋势,在30~40 min内吸附量基本趋于稳定,在60 min后吸附量接近吸附平衡。在开始吸附的前10 min,由于CS50表面存在大量吸附位点,吸附速率较快。随后复合材料的表面吸附位点逐渐减少,吸附过程由材料表面转移至内部孔道,吸附速率逐渐降低,最终吸附达到平衡[17,23]。CS50对柴油A的平衡吸附量为617.26 mg·g-1,平衡吸附去除率为97.79%。图8还对比了不同吸附剂处理含油污水的吸附特性,在298 K下活性炭、碳纳米管、纳米二氧化硅胶粒以及CS50对柴油A的吸附量均随时间延长而增加。起始吸附的前10 min内,前述的4种吸附剂对水中柴油均具有较高的吸附速率,在60 min左右吸附均趋于平衡,可见吸附剂的孔结构不同并没有使其吸附平衡所需的时间表现出显著的差别,故认为吸附平衡时间不仅受吸附剂的空间结构影响,与柴油的复杂组成也应有重要的关系。分析图8中4种吸附剂对水中柴油的去除率,可以得出吸附能力的强弱顺序为CS50>碳纳米管活性炭>纳米二氧化硅胶粒,与现行吸附工段中多用的商品活性炭相比具有吸附效率高、平衡时间短的特点。值得一提的是,结合表1中3种材料的孔容数据,其按从大到小排序与前述吸附能力强弱顺序相同,表明较大的孔容有利于吸附剂对含油污水的吸附脱除。同时,单独使用两种材料进行吸附时,其平衡吸附量总和(428.21 mg·L-1)小于CS50平衡吸附量(617.26 mg·L-1),表面以纳米二氧化硅胶粒作为增强相时与MWCNT存在良好的协同效应,生成的SiO2黏结层有效降低了碳管团簇之间的聚团行为,这种结构有益改善单独使用MWCNT以及纳米二氧化硅胶粒用作吸附剂的吸附能力欠佳的缺点。

图8 298 K下4种吸附剂对柴油A和柴油B的吸附量随时间的变化
图9为CS50对柴油A的吸附特性曲线,CS50随再生次数增加吸附能力有所下降。图3(c)给出了吸附柴油后经灼烧再生5次的CS50 的SEM照片。结合图9和图3(c)可以看出,灼烧法对CS50的空隙结构和吸附位点造成破坏,表面被结焦物质包裹,是导致吸附能力下降的主要原因。

图9 298 K下CS50对柴油A再生吸附特性
对吸附过程分别采用准一级动力学[24]和准二级动力学[25]模型进行拟合分析,模型计算公式见式(3)和式(4)。
准一级动力学方程
准二级动力学方程
式中,1为准一阶动力学方程的吸附速率常数,L·min-1;e为平衡吸附量,mg·g-1;q为MWCNT/SiO2在时刻的吸附量,mg·g-1;2为准二级吸附速率常数,g·mg-1·min-1。
分析发现实验数据与准二级动力学方程吻合较好。将拟合结果汇总于表2,可以看出判定系数2>0.9997,标准差S.D.<7%。同时,采用式(4)准二级动力学方程计算出的e,cal与实验值e,exp偏差较小,进而验证了准二级动力学方程适用于吸附柴油的动力学。
为对比分析含油污水组分对CS50吸附特性的影响,采用CS50对含有柴油B的模拟含油污水进行吸附处理,将吸附量随时间变化的曲线绘制于图8。可以看出,在298 K下CS50对柴油A的吸附速率大于柴油B。对比分析含油污水组分,柴油A主要成分为链烷烃,柴油B主要成分为多环芳烃[7],故分子尺寸是影响吸附反应速率的关键,分子尺寸越小,吸附过程越快[26]。结合表2中CS50对两种柴油的平衡吸附量可以看出密度较大的柴油B的吸附量大于柴油A,这与前期研究结果相一致[27]。

表2 298 K下CS50吸附柴油的准二级动力学参数
进而使用柴油B模拟污水,分别在288、298、308、318 K温度下进行实验,获取不同温度下的准二级吸附速率常数,继而将ln2和-1拟合作图,如图10所示,依据Arrhenius关系求取CS50对水中柴油吸附过程的活化能[25]。根据图10拟合出的直线斜率可求得CS50吸附直馏柴油的表观活化能a11.37 kJ·mol-1,表明该过程为物理吸附[28]。

图10 Arrhenius 关系
2.3 CS50处理含油污水的吸附等温线
在吸附分离过程中,针对不同的吸附对象确定合适的吸附剂[29]是一个复杂的过程,确定吸附剂的平衡曲线有助于研究吸附剂对被吸附体系的合用性及吸附机理。本研究以直馏柴油为研究对象,采用Langmuir吸附等温线模型、Freundlich吸附等温线模型、Tempkin吸附等温线模型这3种模型[30]分析CS50在吸附过程中所呈现的吸附平衡特性。
Langmuir吸附等温线模型是应用最为广泛的吸附等温线方程,该方程假设吸附过程中吸附质间不存在相互作用,而且吸附过程只发生在吸附剂外表面[23]。Langmuir吸附等温线方程见式(5)
式中,e为CS50复合材料的吸附容量,mg·g-1;m为CS50的最大吸附量,mg·L-1;L为Langmuir吸附系数,L·mg-1;e为平衡浓度,mg·L-1。
Freundlich吸附等温线模型也应用较广,该方程从假设吸附剂的表面是不均匀的观点出发,并假定吸附热随覆盖度增加而指数下降[30]。Freundlich模型方程见式(6)
式中,e含义同式(3);f为Freundlich模型常数;为Freundlich模型吸附强度表征量;e含义同前,mg·L-1。该模型中1/值的大小常用来衡量吸附浓度对吸附量影响的强弱,1/值越小吸附剂性能越好,1/值在0.1~0.5之间时吸附过程容易发生,当1/>2时吸附过程难以实现。
Tempkin吸附等温线模型则着眼于吸附过程中吸附剂与吸附溶质之间的相互作用,该模型的假设认为[31],若被吸附的溶质间存在相互作用力,则必会对等温吸附行为产生影响。Tempkin吸附等温线方程见式(7)和式(8)
式中,为热力学温度,K;为通用气体常数,8.314J·mol-1·K-1;T为Tempkin模型平衡常数,L·mg-1;为与吸附热相关的常数,量纲为1;为Tempkin等温线吸附热,J·mol-1。
在298 K下对CS50吸附直馏柴油的数据进行非线性拟合,并将3种模型拟合结果所得数据列于表3。由表中判定系数2大小可知该吸附过程与Freundlich型等温模型较为吻合,分析原因,这可能是由于CS50表面的活性位点分布不均匀造成的。
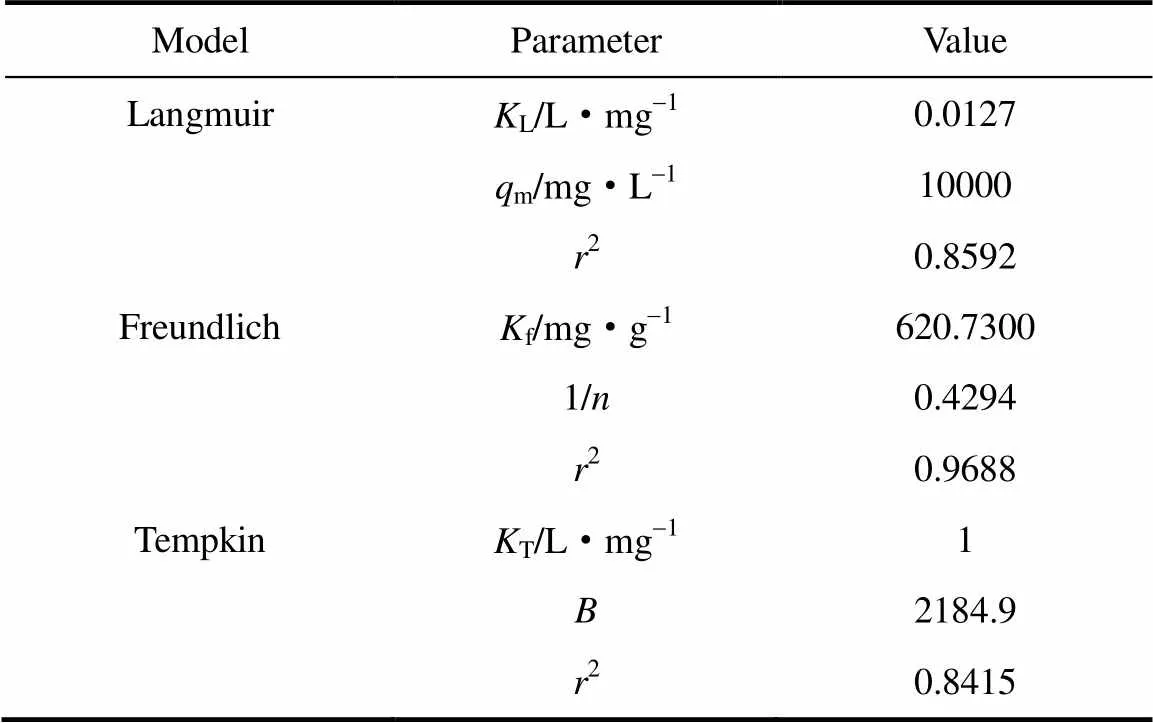
表3 3种吸附等温线模型常数汇总
同时,利用式(5)~式(7)进行拟合处理后,绘制3种吸附等温线模型曲线,见图11。分析图11得出Freundlich模型中量纲1常数1/<0.5,说明水中柴油分子易被CS50吸附[32-33]。

图11 298 K下CS50吸附柴油的吸附等温线
3 结 论
(1)以羧化多壁碳纳米管和纳米二氧化硅胶粒由一步液相共混法制得MWCNT/SiO2复合材料。由SEM及BET/BJH分析结果可知,复合材料中碳纳米管的聚团行为得以改善,形成比表面积大、细孔均匀的介孔-微孔双孔道复合材料。
(2)CS50复合吸附剂可有效吸附处理含油污水,在吸附60 min左右达到吸附稳定,对直馏柴油的平衡吸附去除率高达97.79%。CS50对水中柴油的吸附能力显著强于活性炭、纳米二氧化硅胶粒及原生碳纳米管。纳米二氧化硅胶粒作为增强相时,与MWCNT存在良好的协同效应,生成的SiO2黏结层有效降低了碳管之间的聚团行为,这种结构有效改善了单独使用MWCNT以及纳米二氧化硅胶粒用作吸附剂的吸附能力欠佳的缺点。灼烧法再生后的CS50吸附能力下降较小,而且表面被结焦物质包裹。
(3)CS50对含油污水的处理过程符合准二级动力学方程,Arrhenius公式计算出CS50吸附直馏柴油的活化能为11.37 kJ·mol-1,表明该吸附过程主要为物理吸附。该过程的吸附等温线与Freundlich模型(20.9688)较为吻合,从模型参数1/的数值看出柴油分子易被CS50吸附。
符 号 说 明

A——吸附去除率 c0,ct——分别为液相初始浓度和t时刻浓度,mg·L-1 Ea——吸附表观活化能,kJ·mol-1 Kf——Freundlich模型常数,L·mg-1 KL——Langmuir吸附系数,L·mg-1 KT——Temkin模型方程常数,L·mg-1 k1——准一级吸附速率常数,L·min-1 k2——准二级吸附速率常数,g·mg-1·min-1 qt,qe——分别为t时刻吸附量和平衡吸附量,mg·g-1 R——理想气体常数,J·mol-1·K-1 r2——判定系数 t——吸附时间,min
References
[1] HUANG J, CHEN Q, XU L H,. Problems and countermeasures in the application of constructed wetlands [J]. Environmental Science, 2013, 1 (1): 401-408.
[2] LONG C, KE S, HONG J,. Progress on oil-bearing wastewater treatment processes [J]. Industrial Water Treatment, 2007, 27 (8): 4-7.
[3] 张帆, 李菁, 谭建华, 等. 吸附法处理重金属废水的研究进展 [J]. 化工进展, 2013, 32 (11): 2749-2756. ZHANG F, LI J, TAN J H,. Advance of the treatment of heavy metal wastewater by adsorption [J]. Chemical Industry and Engineering Progress, 2013, 32 (11): 2749-2756.
[4] 王建龙, 刘海洋. 放射性废水的膜处理技术研究进展 [J]. 环境科学学报, 2013, 33 (10): 2639-2656. WANG J L, LIU H Y. Research advances in radioactive wastewater treatment using membrane processes [J]. Journal of Environmental Science, 2013, 33 (10): 2639-2656.
[5] LIJIMA S. Helical microtubules of graphitic carbon [J]. Nature, 1991, 354: 56-58.
[6] 刘涛, 刘会娥, 贺琦,等. 多壁碳纳米管吸油能力和循环使用性探究 [J]. 石油炼制与化工, 2014, 45 (11): 60-64. LIU T, LIU H E, HE Q,. Oil adsorption and reuse performances of multi-walled carbon nanotubes [J]. Petroleum Processing and Petrochemicals, 2014, 45 (11): 60-64.
[7] 朱慧, 刘会娥, 黄剑坤, 等. 多壁碳纳米管吸附处理柴油废水的动力学特性 [J]. 化工学报, 2015, 66 (12): 4865-4873. ZHU H, LIU H E, HUANG J K,. Kinetics for adsorption treatment of diesel oil waste water by multi-walled carbon nanotubes [J]. CIESC Journal, 2015, 66 (12): 4865-4873.
[8] HU H, ZHAO Z, GOGOTSI Y,. Compressible carbon nanotube-graphene hybrid aerogels with superhydrophobicity and superoleophilicity for oil sorption [J]. Environmental Science & Technology Letters, 2014, 1 (3): 214-220.
[9] HU H, ZHAO Z, WAN W,. Ultralight and highly compressible graphene aerogels [J]. Advanced Materials, 2013, 25 (15): 2219-2223.
[10] MUBARAK N M, SAHU J N, ABDULLAH E C,. Removal of heavy metals from wastewater using carbon nanotubes [J]. Separation & Purification Reviews, 2014, 43 (4): 311-338.
[11] REN X, CHEN C, NAGATSU M,. Carbon nanotubes as adsorbents in environmental pollution management: a review [J]. Chemical Engineering Journal, 2011, 170 (2): 395-410.
[12] SMITH B, WEPASNICK K, SCHROTE K E,. Influence of surface oxides on the colloidal stability of multi-walled carbon nanotubes: a structure- property relationship [J]. Langmuir, 2009, 25 (17): 9767-9776.
[13] MATARREDONA O, RHOADS H, LI Z,. Dispersion of single-walled carbon nanotubes in aqueous solutions of the anionic surfactant NaDDBS [J]. Journal of Physical Chemistry B, 2003, 107 (48): 13357-13367.
[14] MORRIS C A, ANDERSON M L, STROUD R M,. Silica sol as a nanoglue: flexible synthesis of composite aerogels [J]. Science, 1999, 284 (5414): 622-624.
[15] MAHLTIG B, BOTTCHER H. Modified silica sol coatings for water-repellent textiles [J]. Journal of Sol-gel Science and Technology, 2003, 27 (1): 43-52.
[16] WEI F, ZHANG Q, QIAN W Z,. The mass production of carbon nanotubes using a nano-agglomerate fluidized bed reactor: a multiscale space-time analysis [J]. Powder Technology, 2008, 183 (1): 10-20.
[17] RAWAT D S, CALBI M M, MIGONE A D. Equilibration time: kinetics of gas adsorption on closed-and open-ended single-walled carbon nanotubes [J]. Journal of Physical Chemistry C, 2007, 111 (35): 12980-12986.
[18] 关诚灏, 金劭, 王涛,等. 酸处理对碳纳米管纹理结构的影响 [J]. 化工学报, 2013, 64 (S1): 182-187. GUAN C H, JIN S, WANG T,. Influence of acid treating on texture and structure of carbon nanotubes [J]. CIESC Journal, 2013, 64 (S1): 182-187.
[19] FAN Z, YAN J, NING G,. Oil sorption and recovery by using vertically aligned carbon nanotubes [J]. Carbon, 2010, 48 (14): 4197-4200.
[20] JAIN A, XU C, JAYARAMAN S,. Mesoporous activated carbons with enhanced porosity by optimal hydrothermal pre-treatment of biomass for supercapacitor applications [J]. Microporous and Mesoporous Materials, 2015, 218: 55-61.
[21] 韩伟, 贾玉心, 熊国兴, 等. 介孔-微孔复合材料的水热稳定性及其催化裂化性能 [J]. 催化学报, 2011, 32 (3): 418-427. HAN W, JIA Y X, XIONG G X,. Hydrothermal stability of meso-microporous composites and their catalytic cracking performance [J]. Chinese Journal of Catalysis, 2011, 32 (3): 418-427.
[22] AND M K, JARONIEC M. Gas adsorption characterization of ordered organic-inorganic nanocomposite materials [J]. Chemistry of Materials, 2001, 13: 3169-3183.
[23] WU F C, TSENG R L, JUANG R S,. Initial behavior of intraparticle diffusion model used in the description of adsorption kinetics [J]. Chemical Engineering Journal, 2009, 153 (1): 1-8.
[24] ALI I. New generation adsorbents for water treatment [J]. Chemical Reviews, 2012, 112 (10): 5073-5091.
[25] HO Y S, MCKAY G. Pseudo-second order model for sorption processes [J]. Process Biochemistry, 1999, 34 (5): 451-465.
[26] PAN B, XING B. Adsorption mechanisms of organic chemicals on carbon nanotubes [J]. Environmental Science & Technology, 2008, 42 (24): 9005-9013.
[27] KABIRI S, TRAN D N H, ALTALHI T,. Outstanding adsorption performance of graphene-carbon nanotube aerogels for continuous oil removal [J]. Carbon, 2014, 80 (1): 523-533.
[28] NOLLET H, ROELS M, LUTGEN P,. Removal of PCBs from wastewater using fly ash [J]. Chemosphere, 2003, 53 (6): 655-665.
[29] YAN H, YANG H, LI A,. pH-tunable surface charge of chitosan/graphene oxide composite adsorbent for efficient removal of multiple pollutants from water [J]. Chemical Engineering Journal, 2016, 284: 1397-1405.
[30] HUANG G, WANG W, MI X,. Preparation of graphene oxide aerogel and its adsorption for Cu2+ions [J]. Carbon, 2012, 50 (13): 4856-4864.
[31] TEMKIN M I, PYZHEV V. Kinetic of ammonia synthesis on promoted iron catalysts [J]. Acta Physiochim URSS, 1940, 12 (3): 327-356.
[32] HOKKANEN S, BHATNAGAR A, REPO E,. Calcium hydroxyapatite microfibrillated cellulose composite as a potential adsorbent for the removal of Cr(Ⅵ) from aqueous solution [J]. Chemical Engineering Journal, 2016, 283: 445-452.
Facile synthesis of MWCNT/SiO2nano-composites as high-performance oil adsorbents
HUANG Jiankun, LIU Hui’e, HUANG Yangfan, MA Yanbing, DING Chuanqin
(State Key Laboratory of Heavy Oil Processing, China University of Petroleum, Qingdao 266580, Shandong, China)
Multi-walled carbon nanotubes-silica (MWCNT/SiO2)nano-composites were prepared from carboxylated MWCNTs and silica sol-gel nanoparticlesone-step scalable precipitation. Structure and physical properties of the nano-composite were characterized by Fourier transform infrared spectroscopy (FTIR), scanning electron microscope (SEM), thermogravimetric analysis (TGA), and porous surface area and pore size distribution analysis (BET & BJH). Adsorption removal of oil was evaluated in diesel water on the nano-composite in comparison with SiO2sol-gel nanoparticles, pristine MWCNTs, and activated carbon. The nano-composite improved MWCNT agglomeration after surface modification by silica nanoparticles and formed dual microporous and mesoporous structures. The diesel removal efficiency of the nano-compositecould be up to 97.79% with adsorption equilibrium reached within 1 h. The adsorption process followed the pseudo second-order kinetics with the apparent activation energy at 11.37 kJ·mol-1and the adsorption isotherms were fitted well with the Freundlich model. Overall, the nano-composite MWCNT/SiO2showed stronger adsorption capacity than the other three adsorbents.
carboxylated carbon nano-tubes; silica sol; mesoporous-microporous; adsorption kinetics; nanomaterials; composites; preparation
2016-02-02.
Prof.LIU Hui’e, liuhuie@upc.edu.cn
10.11949/j.issn.0438-1157.20160148
TQ 013.2
A
0438—1157(2016)10—4485—08
中央高校基本科研业务费专项项目(14CX05031A);黄岛区科技项目(201-1-49)。
2016-02-02到初稿,2016-05-11收到修改稿。
联系人:刘会娥。第一作者:黄剑坤(1992—),男,硕士研究生。
supported by the Fundamental Research Funds for the Central Universities (14CX05031A) and the Huangdao District Science and Technology Project (201-1-49).
