聚丙烯酸钠包覆Fe3O4磁性交联聚合物的制备及其对Pb(Ⅱ)和Cd(Ⅱ)的吸附性能
2016-10-25贺盛福张帆程深圳汪伟
贺盛福,张帆,程深圳,汪伟
聚丙烯酸钠包覆Fe3O4磁性交联聚合物的制备及其对Pb(Ⅱ)和Cd(Ⅱ)的吸附性能
贺盛福,张帆,程深圳,汪伟
(吉首大学化学化工学院,湖南省锰锌钒产业技术2011协同中心,矿物清洁生产与绿色功能材料开发湖南省重点实验室,湖南吉首 416000)
采用溶液分散聚合和Ca2+表面交联制备了聚丙烯酸钠包覆Fe3O4的磁性交联聚合物(CPAANa@Fe3O4),对其进行了XRD、FT-IR、SEM和TGA等表征。以CPAANa@Fe3O4为吸附剂研究了CPAANa@Fe3O4对水溶液中Pb2+、Cd2+的静态吸附,考察了溶液pH、吸附剂投加量、金属离子初始浓度对吸附的影响。结果表明:CPAANa@Fe3O4在pH2~6范围内均具有较好的吸附性能,当吸附剂投加量分别为1.0 g·L-1和1.6 g·L-1时对初始浓度分别为200 mg·L-1的Pb2+和100 mg·L-1的Cd2+的去除率达到最大,可使Pb2+实现达标排放(GB 8978—1996);CPAANa@Fe3O4对Pb2+和Cd2+的吸附动力学符合准二级模型,吸附等温线符合Langmuir模型,对Pb2+和Cd2+的最大吸附量分别为454.55 mg·g-1和275.48 mg·g-1。将CPAANa@Fe3O4用于处理实际电解矿浆废水,发现能有效吸附其中的Pb2+和Cd2+,具有潜在实用价值。
复合物;制备;吸附;磁性聚合物;铅离子;镉离子;动力学
引 言
Pb2+和Cd2+广泛存在于非铁金属采选、有色金属冶炼、造纸、电池、涂料、颜料、特种钢和合金等制造行业产生的废水及垃圾渗滤液中[1]。Pb2+和Cd2+具有毒性大、不可生物降解和易富集等特点,同Hg2+、Cr(Ⅵ)、As(Ⅲ)一起被我国环保部列为工业废水中的I类污染物。含Pb2+和Cd2+的废水若不经有效处理而直接排放到环境中,会对生物多样性和人类健康造成严重危害。目前,处理重金属离子废水的技术主要有化学沉淀法、离子交换法、吸附法、膜分离法和电化学法等[1-2]。吸附法成本低廉、吸附速率快、吸附效果好、不产生污泥,甚至能实现吸附剂的再生重复利用[2-3],离子交换树脂[4]、活性炭[5]、沸石[6]和壳聚糖[7-8]等材料已广泛应用于重金属废水处理。虽然目前已涌现大量用于处理重金属废水的吸附材料,但是制备出吸附效率高、无二次污染和重复利用性能好的吸附剂依然是一项挑战[9]。
近几年磁性聚合物材料应运而生。磁性聚合物用于水处理,能对达到饱和吸附的吸附剂实现快速分离和回收,防止二次污染,并实现对吸附剂的多次再生和重复利用[9-13]。目前大部分磁性聚合物是关于磁性壳聚糖的[10-12],而鲜有关于交联聚丙烯酸钠磁性聚合物材料用于吸附重金属的报道。针对含有多羧基官能团的聚合物对重金属离子表现出优异的吸附性能[3,10,14-15],本工作由原料易得的丙烯酸单体出发,通过溶液分散聚合及Ca2+后交联制备出表面含有较多羧酸盐基团的聚丙烯酸钠包覆Fe3O4磁性交联聚合物(CPAANa@Fe3O4), 对样品进行了FT-IR、SEM、TGA-DSC等表征,并较系统地研究了其对Pb2+和Cd2+的吸附去除性能。
1 实验部分
1.1 原料与设备
丙烯酸(AA)、硝酸铅[Pb(NO3)2]、四水合硝酸镉[Cd(NO3)2·4H2O]、氯化钙(CaCl2,分析纯),均购自天津光复精细化工研究所;NaOH,购自天津永大化学试剂厂;过硫酸钾(K2S2O8),购自上海强顺化学试剂厂;,-亚甲基双丙烯酰胺(MBA),优级纯,购自上海伊卡生物有限公司;氯化铁(FeCl3),购自天津科密欧化学试剂厂;七水合硫酸亚铁(FeSO4·7H2O),购自汕头西陇化工股份有限公司。以上试剂未经特别说明均为分析纯,所用水均为蒸馏水。
SHA-C型恒温水浴振荡仪,天津赛得利斯实验分析仪器制造厂;D8 Advance 型X射线衍射仪,德国布鲁克公司;iS10型红外光谱仪,美国Thermo Nicolet 公司;Hitachi S-4800场发射扫描电子显微镜,日本日立公司;AA6300C型火焰原子吸收分光光谱仪(FAAS),日本岛津公司;Spectro Xepos型X射线荧光光谱仪(XRF),德国斯派克分析仪器公司;TG-DSC热分析仪,瑞士梅特勒托利多仪器公司。
1.2 CPAANa@Fe3O4的制备
(1)参照文献[16],采用共沉淀法,在90℃下反应2 h制备Fe3O4微粒。
(2)中和度80%的AA单体的配制和预处理:取一定体积的AA单体溶液,置于200 ml烧杯中,在5℃的冰水浴中与适量的NaOH溶液[(NaOH):(AA)0.8]缓慢混合,获得中和度为80%的AA单体溶液。在45℃下以活性炭脱除阻聚剂,获得AA质量浓度为0.315 g·ml-1的AANa单体 溶液。
(3)PAANa@Fe3O4磁性聚合物的制备:①取64 ml AANa单体溶液,与适量的去离子水混合,缓慢滴加0.5 mol·L-1NaOH溶液至pH10.0左右,加入0.06 g交联剂MBA和0.15 g引发剂K2S2O8,混合均匀后转移到带有N2导入管、机械搅拌装置和冷凝管的三口烧瓶中;②准确称取0.5 g Fe3O4,与50 ml去离子水混合,经20 min超声分散后加入到三口瓶中与AANa溶液混合;③通N2除氧30 min后升温至65℃开始聚合反应,待聚合2 h后混合溶液黏度明显增大时将反应物移至烧杯中,用5 ml不带针孔的注射器吸取聚合物液体,逐滴加入到质量分数5%的CaCl2溶液中交联成小球;④用甲醇浸泡聚合物微球使之变硬后置于鼓风干燥箱中60℃干燥12 h,再置于真空干燥箱中80℃干燥6 h,研磨后过40目(420 μm)筛,得到磁性交联聚合物。Ca2+交联PAANa,在第③步中不加Fe3O4,按以上相同的方法制备, 用于TGA分析中计算磁性交联聚合物中Fe3O4的含量。未交联PAANa的制备既不加MBA也不滴入CaCl2溶液,其他条件相同。CPAANa@Fe3O4的制备路径如图1所示。
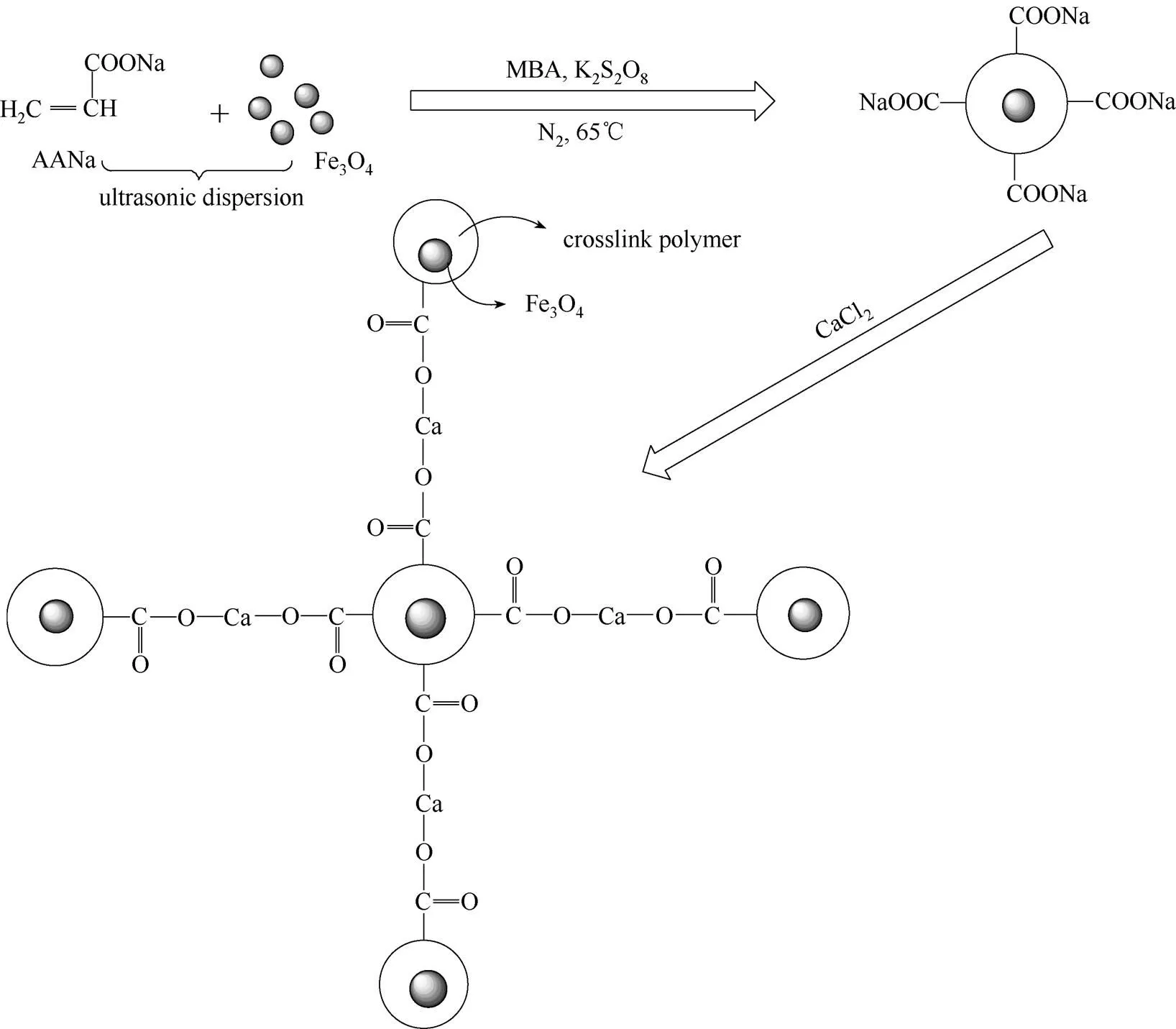
图1 CPAANa@Fe3O4材料的制备路线
1.3 材料表征
采用粉末衍射法对Fe3O4和磁性交联聚合物样品进行XRD测试,采用Cu靶Kα辐射(1.5406 nm),工作电压40 kV,管电流40 mA, 扫描范围5°~80°,步长0.02(°)·s-1;采用KBr压片法在 400~4000 cm-1范围测试样品表面的官能团;对Fe3O4和PAANa@Fe3O4样品表面喷金处理后进行SEM测试;采用TG-DSC热分析仪对交联聚合物和磁性交联聚合物样品在25~800℃范围以空气为反应气体进行热稳定性测试,升温速率10℃·min-1。
1.4 磁性PAANa@Fe3O4对Pb2+和Cd2+的吸附实验
以适量分析纯Pb(NO3)2和Cd(NO3)2配成1000 mg·L-1的Pb2+和500 mg·L-1的Cd2+储备液,用去离子水稀释至所需要的浓度,缓慢滴加0.1 mol·L-1HNO3和0.1 mol·L-1NaOH溶液,在pH计下调节到适当的pH。
磁性PAANa@Fe3O4对Pb2+和Cd2+的静态吸附,以50 ml Pb2+或Cd2+溶液在100 ml锥形瓶中与50 mg吸附剂混合,置于水浴恒温振荡仪中,在30℃下以120 r·min-1的搅拌速率振荡吸附6 h,磁分离后取上清液,用火焰原子吸收分光光度计测定滤液中Pb2+或Cd2+的残余浓度,按式(1)和式(2)计算Pb2+或Cd2+的吸附量(e,mg·g-1)和去除率(,%)。
吸附剂投加量的影响:在0.02~0.15 g范围内改变吸附剂投加量,对200 mg·L-1Pb2+溶液和100 mg·L-1Cd2+溶液进行吸附实验(pH均为5.0)。
重金属离子初始浓度的影响:分别在 60~480 mg·L-1和40~300 mg·L-1范围内改变Pb2+和Cd2+溶液的初始浓度(pH均为5.0),进行吸附实验。
接触时间的影响:对一系列200 mg·L-1Pb2+溶液和100 mg·L-1Cd2+溶液进行静态吸附实验,分别在振荡后的20~420 min范围内间断取样。
吸附剂的重复利用实验:对150 mg·L-1Pb2+溶液和80 mg·L-1Cd2+溶液(pH均为5.0)静态吸附2 h,磁分离后取上清液,测定Pb2+和Cd2+的残余浓度;磁分离收集吸附后的吸附剂,用20 ml 0.055 mol·L-1HCl溶液解吸5 min,磁分离后收集解吸液,测定解吸液中Pb2+、Cd2+浓度。用去离子水洗涤吸附剂至pH为中性后再次吸附150mg·L-1Pb2+溶液和80mg·L-1Cd2+溶液,重复上述吸附和解吸附各2次。
按式(2)计算循环吸附时Pb2+和Cd2+的去除率,按式(3)计算解吸率。
1.5 CPAANa@Fe3O4处理实际电解废水
取静置24 h的实验室矿浆电解废水(矿样来自湘西花垣县某铅锌矿厂)上清液,电解废水的pH为1.05,用0.1 mol·L-1NaOH溶液将电解废水调到pH5.0左右后,各取50 ml装入若干100 ml锥形瓶中,依次投加0.05~0.30 g CPAANa@Fe3O4吸附剂,置于水浴恒温振荡仪中,30℃下以120 r·min-1的搅拌速率振荡吸附2 h,磁分离后取上清液测定Pb2+和Cd2+浓度。
2 结果与讨论
2.1 材料表征
2.1.1 XRD分析 图2是采用共沉淀法制备的Fe3O4样品和采用溶液分散聚合法制备的CPAANa@Fe3O4样品的XRD谱图。由图可知,Fe3O4样品在30.2°、35.6°、43.3°、53.6°、57.0°和62.8°出现Fe3O4的特征峰,分别对应Fe3O4晶体的(220)、(311)、(400)、(422)、(511)和(440)晶面[9-10,17],根据Scherrer公式[17],在最强峰35.6°处对应的(311)对应的晶面可求得Fe3O4的晶粒尺寸约为8.33 nm,说明实验过程中制备的Fe3O4具有纳米尺寸,容易在聚合过程中被交联聚合物包覆。同时从图中可以看出CPAANa@Fe3O4的XRD谱图中也出现了与Fe3O4对应的完整特征峰,说明Fe3O4的晶型结构在复合物中保持完好。

图2 Fe3O4和CPAANa@Fe3O4的XRD谱图
2.1.2 FT-IR分析 图3是Fe3O4、未交联PAANa、Ca2+交联PAANa和CPAANa@Fe3O4的红外光谱图。如图所示:在谱线a、b、c和d中共同出现的3415 cm-1处的宽峰和1640 cm-1处的强峰分别归属样品中表面OH的伸缩振动和水分子OH的弯曲振动[18],530 cm-1可归属FeO键的特征峰[19-20];谱线b、c和d中同时在1384 cm-1处出现的强峰归属甲基上CH键的对称弯曲振动,1258、1117和1051 cm-1指纹区的3个峰归属COO-中CO键的特征峰,1458 cm-1处的峰对应COO-的对称伸缩振 动[21-22];谱线c中1718 cm-1处的峰归属羧基中CO的伸缩振动;谱线d中在1588 cm-1处出现了新的峰,对应交联后MBA分子中NH键的变形振 动[23],1718 cm-1的峰消失了,530 cm-1处出现了FeO键的弯曲振动峰,说明Fe3O4表面的OH可能与聚合物分子链上的羧基在碱性催化条件下发生了脱水缩合反应(因部分磁性铁氧化物可能以FeOOH[24]的形式存在)。综上FT-IR分析表明成功制备了磁性聚合物。

图3 Fe3O4 (a)、未交联PAANa (b)、Ca2+交联PAANa (c)和CPAANa@Fe3O4 (d)的FT-IR谱图
2.1.3 SEM分析 图4是Fe3O4和磁性交联聚合物放大500倍的电镜图。由图可知Fe3O4和磁性交联聚合物都呈现出粒状分布,由于部分团聚原因,SEM得到的Fe3O4和磁性交联聚合物的粒径分别为5~10 μm和50~100 μm。Fe3O4与PAANa复合后粒径明显变大,有利于有效阻止Fe3O4纳米粒子的团聚现象而提高吸附剂的吸附性能。

图4 Fe3O4 (a)与CPAANa@Fe3O4 (b)的SEM照片
2.1.4 热稳定性分析 图5 是未交联PAANa、Ca2+交联PAANa和CPAANa@Fe3O4在空气氛围中的热失重曲线。3种物质在25~150℃以下的少量失重归于样品中残留的水分的蒸发;未交联PAANa在300~450℃的迅速失重和Ca2+交联PAANa与CPAANa@Fe3O4在450~500℃的迅速失重可归于含氧官能团和聚合物分子骨架的分解[13,23];未交联PAANa在450~700℃的继续失重归于积炭被氧化逸出CO2气体;Ca2+交联PAANa与CPAANa@Fe3O4在500~700℃的继续失重可归于积炭和Fe3O4被氧化逸出CO2气体[25]。3种物质在800℃扣除水分后的质量保持率分别为27.26%、26.67%和28.07%,可分别归于Na2O、CaO和CaOFe2O3的质量,根据文献[25]中的算法可算得磁性交联聚合物中Fe3O4的含量为1.41%。

图5 未交联PAANa、Ca2+交联PAANa和CPAANa@Fe3O4在空气氛围中的热重曲线
2.1.5 磁分离效果 如图6所示,CPAANa@Fe3O4能较好地分散在水溶液中,在外加磁场下CPAANa@Fe3O4能在30 s内实现与水溶液的分离,这显示该吸附剂应用于水处理领域有利于避免二次污染和回收吸附剂。

图6 CPAANa@Fe3O4与水的混合液在外加磁场下的分离效果
2.2 吸附性能的影响因素
2.2.1 pH的影响 溶液的pH是影响吸附剂吸附性能的一项重要参数,它不仅影响重金属离子的存在形式,而且决定吸附剂的表面电荷[2-3]。如图7所示,当吸附剂投加量为1.0 g·L-1时,CPAANa@Fe3O4在溶液初始pH2.0~5.0范围内对初始浓度为200 mg·L-1的Pb2+的去除率均在98.0%以上,而且在pH4.5时去除率出现较大值99.8%;CPAANa@Fe3O4在溶液初始pH3.0~6.0范围内对初始浓度为100 mg·L-1的Cd2+的去除率均在95.0%以上,而且在pH5.5时去除率出现较大值97.17%,而在溶液初始pH2.0时Cd2+的去除率只有86.2%,这可能是因为在低pH下的Cd2+溶液中H+与Cd2+竞争吸附剂上的活性位点作用较明显。总地来说,CPAANa@Fe3O4对Pb2+和Cd2+的吸附具有一个较宽的pH适应性,在pH3.0~6.0范围内均表现出较好的吸附性能。

图7 溶液初始pH对重金属离子去除率的影响
2.2.2 吸附剂投加量的影响 如图8所示,CPAANa@Fe3O4在溶液初始pH5.0的条件下对初始浓度为200 mg·L-1的Pb2+和初始浓度为100 mg·L-1的Cd2+的去除率均随吸附剂投加量增大先增大后减小,Pb2+的去除率在吸附剂投加量为1.0 g·L-1时达到最大值99.87%,Cd2+的去除率在吸附剂投加量为1.6 g·L-1时达到最大值94.13%。
2.1.2 进样方法的选择 毛细管电泳的进样方法常有压力进样和电动进样两种方式。相对于样品无差别进样的压力进样方式,电动进样对样品中目标检测品有一定的选择性。当采用压力进样,自然水体中存在的泥沙胶体、腐殖质等小粒径悬浮物也进入进样端,使得检测时基线不稳、毛刺增多,干扰严重。本方法采用了正极端进样,在电动进样方式下,自然水体中的悬浮颗粒受电场影响,进入进样端的量大大降低,可使基线噪声降低、色谱峰峰形变好,能达到在线样品净化效果,降低干扰,提高检测灵敏度和准确度。因此,本方法选择了电动进样方式。

图8 吸附剂投加量对重金属离子去除率的影响
2.2.3 重金属离子初始浓度的影响 如图9所示,在一定吸附剂投加量1.0 g·L-1的条件下,Pb2+和Cd2+的去除率均随初始浓度增大先缓慢下降后显著下降,Pb2+和Cd2+的吸附容量均先线性增大后保持不变,说明吸附达到了饱和。这是由于,Pb2+或Cd2+浓度较低时吸附剂上的吸附位点较充足,吸附量不断增大,而Pb2+或Cd2+浓度较高时吸附位点开始出现不足,吸附量增幅变小,直至不再增大。其中Pb2+初始浓度低于200 mg·L-1时,吸附后的Pb2+残余浓度低于1.0 mg·L-1,符合国家工业污水综合排放标准(GB 8978—1996);Cd2+浓度低于120 mg·L-1时去除率也在90%以上。

图9 重金属离子初始浓度对去除率和平衡吸附量的影响
2.3 接触时间的影响与吸附动力学
如图10所示,初始浓度分别为200 mg·L-1的Pb2+和100 mg·L-1的Cd2+溶液分别在120 min和300min趋近吸附平衡。为了更好地理解CPAANa@Fe3O4对Pb2+和Cd2+吸附速率的控制步骤,将吸附动力学数据进行了准一级模型和准二级模型[10,12]的拟合。
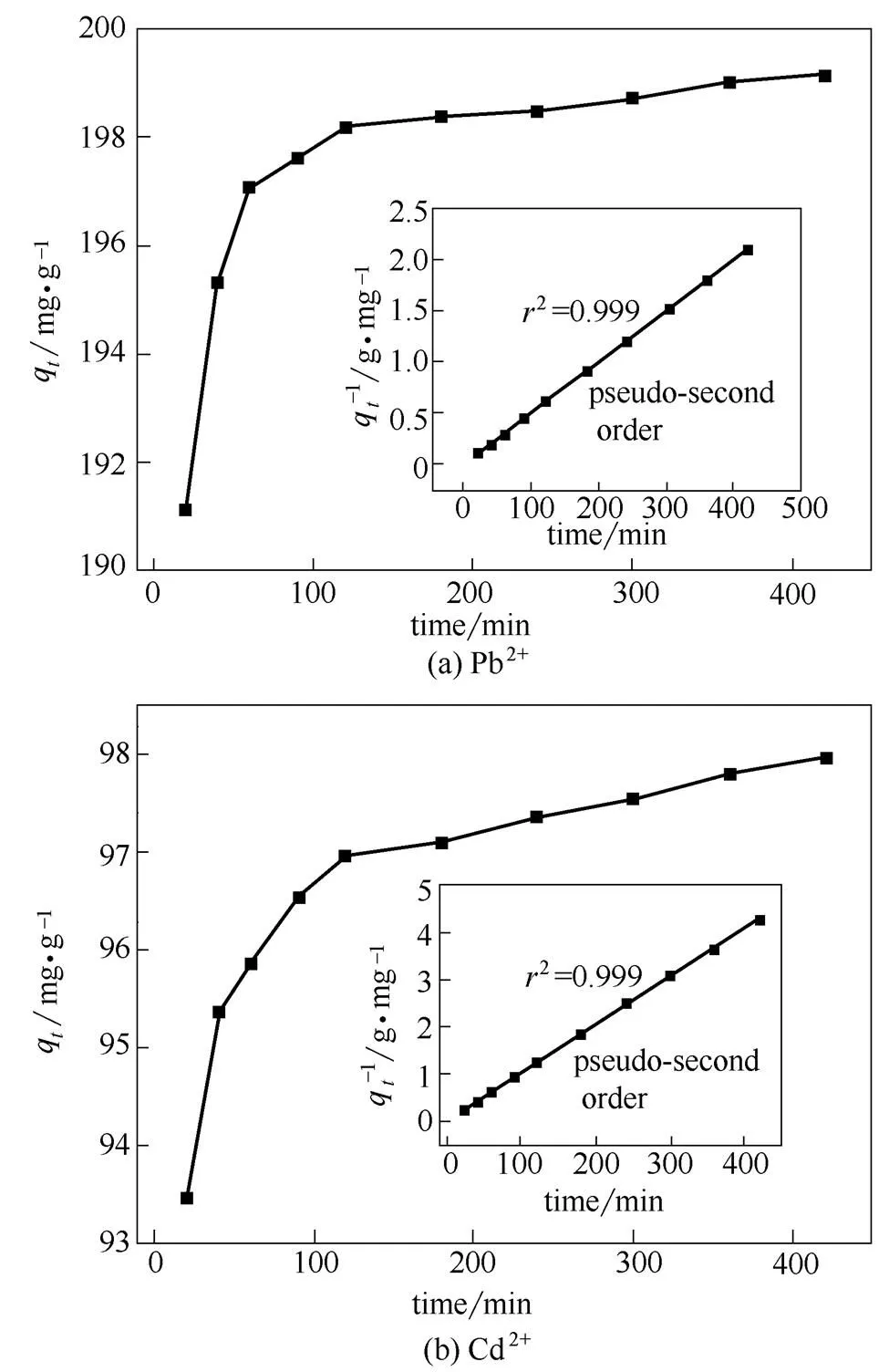
图10 Pb2+与Cd2+的吸附动力学及其准二级动力学模型线性拟合
准一级模型
准二级模型
由图10和表1可知,准二级动力学模型拟合的曲线与实际的Pb2+和Cd2+吸附动力学具有很高的相关性,相关系数2>0.99;而准一级模型拟合的曲线与Pb2+和Cd2+的实际吸附动力学相关性较差,2<0.95。因此,CPAANa@Fe3O4对Pb2+和Cd2+的吸附速率控制步骤以表面化学反应为主[26]。

表1 准一级、准二级动力学模型参数
2.4 等温吸附线
Langmuir和Freundlich等温吸附模型常用来对等温吸附数据进行拟合,Langmuir和Freundlich等温吸附模型分别对应单分子层吸附和多分子层吸附[1,10,12]。本工作也对等温吸附数据进行了Langmuir和Freundlich模型的拟合,结果列于表2。由表2可知,在303 K下对Pb2+和Cd2+的等温吸附符合Langmuir模型,相关系数2>0.98, 表明Pb2+和Cd2+在CPAANa@Fe3O4上的吸附属于单分子层吸附;由Langmuir模型得出的Pb2+和Cd2+的最大吸附容量分别为454.55 mg·g-1和275.48 mg·g-1。同时,Pb2+和Cd2+的等温吸附数据也能被Freundlich模型较好地拟合,1/介于0.1~0.5, 表明吸附容易进行,属于优惠型吸附[27]。
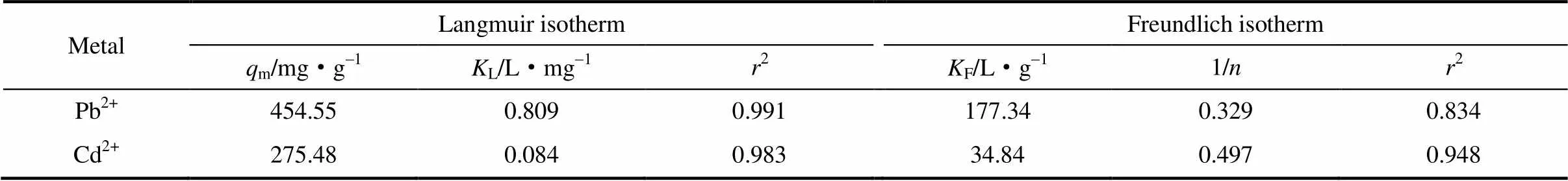
表2 Langmuir和Freundlich等温吸附模型参数
2.5 磁性交联聚合物对Pb2+的再生和重复利用性能

图 11 CPAANa@Fe3O4再生重复利用性能:对Pb2+和Cd2+的吸附与解吸
以上吸附-解吸附循环实验结果表明:CPAANa@Fe3O4具有一定的重复利用性能,但是重复使用性能还不够好。这可能是由于CPAANa@Fe3O4的化学交联度不够高,吸附剂耐酸性较差,导致部分Fe3O4溶解,同时吸附剂上的Pb2+和Cd2+并没有完全解吸下来而占据了吸附位点[23],它们一起造成了吸附剂的重复利用性能不够高。
2.6 磁性交联聚合物处理实际电解废水
矿浆电解废水经XRF测出含有较高含量的Mg(24200 mg·L-1)、Cl(72400 mg·L-1)、Si(2870 mg·L-1)、 S(2830 mg·L-1)、Ca(737 mg·L-1)和P(621 mg·L-1)等杂质。由表3可知,电解矿浆废水中Pb2+和Cd2+的残余浓度均随吸附剂投加量增大而先显著下降,吸附剂投加量超过一定值后变化不大。当吸附剂投加量从0增大到6.0 g·L-1时,Pb2+浓度由954.5 mg·L-1下降到0.9 mg·L-1,去除率达到99.85%;当吸附剂投加量由0增大到4.0 g·L-1时,Cd2+浓度由167.1 mg·L-1下降到9.0 mg·L-1,去除率达到94.61%,投加量超过4.0 g·L-1时Cd2+浓度不再改变。以上分析表明,该CPAANa@Fe3O4吸附剂在实际工业废水处理中具有潜在的应用价值。

表3 不同吸附剂投加量的CPAANa@Fe3O4吸附电解废水中Pb2+和Cd2+的效果
3 结 论
(1)以AANa为单体、K2S2O8为引发剂、MBA为化学交联剂、Fe3O4微粒为磁性载体,采用溶液分散聚合法和Ca2+后交联制备磁性交联聚合物,XRD、FT-IR、SEM和TGA测试表明实验成功制备了磁性交联聚合物CPAANa@Fe3O4。
(2)CPAANa@Fe3O4对水溶液中Pb2+和Cd2+的吸附具有较宽的pH适应性,在pH2.0~5.0和pH 3.0~6.0范围内分别对Pb2+和Cd2+具有较好的吸附性能;CPAANa@Fe3O4在吸附剂投加量为1.0 g·L-1时,可使初始浓度低于200 mg·L-1的Pb2+废水实现达标排放(GB 8978—1996)。
(3)CPAANa@Fe3O4对200 mg·L-1的Pb2+和100 mg·L-1的Cd2+分别在120 min和300 min左右达到吸附平衡。CPAANa@Fe3O4对Pb2+和Cd2+的吸附动力学符合准二级动力学模型,吸附等温线符合Langmuir模型,属于单分子层吸附。对Pb2+和Cd2+的最大吸附容量分别为454.55 mg·g-1和275.48 mg·g-1。
(4)0.055 mol·L-1HCl溶液能使Pb2+和Cd2+从吸附后的CPAANa@Fe3O4上有效解吸,实现富集回收,但重复利用性能还有待改善。CPAANa@Fe3O4能有效吸附实际电解废水中的Pb2+、Cd2+及其他有毒重金属离子,具有实际应用价值。
符 号 说 明

c0,ce——分别为重金属离子初始浓度和平衡浓度,mg·L-1 K——Scherrer公式常数,0.89 KL,KF——与吸附强度有关的常数,单位分别为L·mg-1和L·g-1 k1,k2——动力学常数,单位分别为min-1和mg·g-1·min-1 m——吸附剂干重,g 1/n——与吸附强度有关的Freundlich常数 qe1,qe2——分别为吸附剂吸附和解吸的重金属离子容量,mg·g-1 qt,qe,qm——分别为t时刻、吸附平衡时的重金属离子吸附量和吸附剂最大重金属离子吸附量,mg·g-1 R——重金属离子去除率,% RD——重金属离子解吸率,% V——溶液体积,ml β——最强峰半高宽,rad λ——CuKα辐射波长,0.15406 nm
References
[1] GAUTAM R K, MUDHOO A, LOFRANO G,. Biomass-derived biosorbents for metal ions sequestration: adsorbent modification and activation methods and adsorbent regeneration [J]. J. Env. Chem. Eng., 2014, 2: 239-259.
[2] ZHOU G Y, LIU C B, TANG Y H,. Sponge-like polysiloxane-graphene oxide gel as a highly efficient and renewable adsorbent for lead and cadmium metals removal from wastewater [J]. Chem. Eng. J., 2015, 280: 275-282.
[3] CHU L, LIU C B, ZHOU G Y,. A double network gel as low cost and easy recycle adsorbent: highly efficient removal of Cd(Ⅱ) and Pb(Ⅱ) pollutants from wastewater [J]. J. Hazard. Mater., 2015, 300: 153-160.
[4] 鲁雪梅, 熊鹰, 张广之. 树脂在重金属水处理中的应用 [J]. 北京大学学报(自然科学版), 2012, 48 (6): 1030-1038. LU X M, XIONG Y, ZHANG G Z. Application of resins on the treatment of waters polluted by heavy metals [J]. Acta Scientiarum Naturalium Universitatis Pekinensis (Natural Science Edition), 2012, 48 (6): 1030-1038.
[5] MOHAMMADI S Z, KARIMI M A, AFZALI D,. Removal of Pb(Ⅱ) from aqueous solutions using activated carbon from sea-buckthorn stones by chemical activation [J]. Desalination, 2010, 262: 86-93.
[6] MIYAJI F, MASUDA S, SUYAMA Y. Adsorption removal of lead and cadmium ions from aqueous solution with coal fly ash-derived zeolite/sepiolite composite [J]. J. Ceram. Soc. Jpn., 2010, 118 (11): 1062-1066.
[7] SARGIN A I, ARSLAN G. Chitosan/sporopollenin microcapsules: preparation, characterization and application in heavy metal removal [J]. Int. J. Biol. Macromol., 2015, 75: 230-238.
[8] BOAMAH P O, HUANG Y, HUA M Q,. Sorption of heavy metal ions onto carboxylate chitosan derivatives: a mini-review [J]. Ecotox. Environ. Safe., 2015, 116: 113-120.
[9] LIU Y M, JU X J, XIN Y,. A novel smart microsphere with magnetic core and ion-recognizable shell for Pb2+adsorption and separation [J]. ACS Appl. Mater. Inter., 2014, 6: 9530-9542.
[10] LI X L, QI Y X, LI Y F,. Novel magnetic beads based on sodium alginate gel crosslinked by zirconium (Ⅳ) and their effective removal for Pb2+in aqueous solutions by using a batch and continuous systems [J]. Bioresource Technol., 2013, 142: 611-619.
[11] XIE M J, ZENG L X, ZHANG Q Y,. Synthesis and adsorption behavior of magnetic microspheres based on chitosan/organic rectorite for low-concentration heavy metal removal [J]. J. Alloy. Compds., 2015, 647: 892-905.
[12] ZHOU Y M, FU S Y, ZHANG L L,. Use of carboxylated cellulose nanofibrils-filled magnetic chitosan hydrogel beads as adsorbents for Pb(Ⅱ) [J]. Carbohyd. Polym., 2014, 101: 75-82.
[13] ZHAO F P, TANG W Z, ZHAO D B,. Adsorption kinetics, isotherms and mechanisms of Cd(Ⅱ), Pb(Ⅱ), Co(Ⅱ) and Ni(Ⅱ) by a modified magnetic polyacrylamide microcomposite adsorbent [J]. Water Process Eng., 2014, 4: 47-57.
[14] 程亮, 侯翠红, 徐丽, 等. 纳米腐殖酸基离子交换复合树脂动态吸附-脱附冶金镍镉废水 [J]. 化工学报, 2016, 67 (1): 349-357. CHENG L, HOU C H, XU L,. Dynamic adsorption-desorption of nickel or cadmium from metallurgical wastewater by nanoscale humic acid based ion exchange composite resin [J]. CIESC Journal, 2016, 67 (1): 349-357.
[15] LI M, LI M Y, FENG C G,. Preparation and characterization of multi-carboxyl-functionalized silica gel for removal of Cu(Ⅱ), Cd(Ⅱ), Ni(Ⅱ) and Zn(Ⅱ) from aqueous solution [J]. Applied Surface Science, 2014, 314: 1063-1069.
[16] NIU J M, ZHENG Z G. Effect of temperature on Fe3O4magnetic nanoparticles prepared by coprecipitation method [J]. Adv. Mater. Res., 2014, 900: 172-176.
[17] HUA R, LI Z K. Sulfhydryl functionalized hydrogel with magnetism: synthesis, characterization, and adsorption behavior study for heavy metal removal [J]. Chem. Eng. J., 2014, 249: 189-200.
[18] SHUBHA K P, RAJI C, ANIRUDHAN T S. Immobilization of heavy metals from aqueous solutions using polyacrylamide grafted hydrous tin(Ⅳ) oxide gel having carboxylate functional groups [J]. Wat. Res., 2001, 35 (1): 300-310.
[19] SINGH D, GAUTAM R K, KUMAR R,. Citric acid coated magnetic nanoparticles: synthesis, characterization and application in removal of Cd(Ⅱ) ions from aqueous solution [J]. J. Water Process Eng., 2014, 4: 233-241.
[20] BADRUDDOZA A Z M, SHAWON Z B Z, DANIEL T W J,. Fe3O4/cyclodextrin polymer nanocomposites for selective heavy metals removal from industrial wastewater [J]. Carbohyd. Polym., 2013, 91: 322-332.
[21] 吴刚. 材料结构表征及应用[M]. 北京: 化学工业出版社, 2002: 16-17. WU G. Characterization and Application of Material Structure [M]. Beijing: Chemical Industry Press, 2002: 16-17.
[22] IRANI M, ISMAIL H, AHMAD Z,. Synthesis of linear low-density polyethylene--poly(acrylic acid)--starch/organo- montmorillonite hydrogel composite as an adsorbent for removal of Pb(Ⅱ) from aqueous solutions [J]. J. Environ. Sci., 2015, 27: 9-20.
[23] ZHOU G Y, LUO J M, LIU C B,. A highly efficient polyampholyte hydrogel sorbent based fixed-bed process for heavy metal removal in actual industrial effluent [J]. Wat. Res., 2016, 89: 151-160.
[24] ZHANG F S, ITOH H. Iron oxide-load slag for arsenic removal from aqueous system [J]. Chemosphere, 2005, 60 (3): 319-325.
[25] 黄祝杰, 徐宏, 古宏晨. 磁性聚合物微球的制备及其热重曲线的特征分析 [J]. 功能高分子学报, 2011, 24 (2): 137-142. HUANG Z J, XU H, GU H C. Preparation and thermogravimetry feature analysis of magnetic polymer microspheres [J]. Journal of Functional Polymers, 2011, 24 (2): 137-142.
[26] 曾雪, 罗学刚, 周建. 负载Zr(Ⅳ)的水解废弃皮革对氟离子的吸附性能 [J]. 化工学报, 2016, 67 (4): 1368-1377. ZENG X, LUO X G, ZHOU J. Adsorption of fluorion onto hydrolyzed leather waste impregnated with zirconium (Ⅳ) [J]. CIESC Journal, 2016, 67 (4): 1368-1377.
[27] 孙媛媛, 曾希柏, 白玲玉. Mg/Al双金属氧化物对As(Ⅴ)吸附性能的研究 [J]. 环境科学学报, 2011, 31 (7): 1377-1385. SUN Y Y, ZENG X B, BAI L Y. Adsorption of arsenate from aqueous solution by Mg/Al layered double oxide [J]. Acta Scientiae Circumstantiae, 2011, 31 (7): 1377-1385.
Preparation and Pb2+/Cd2+adsorption of encapsulated Fe3O4/sodium polyacrylate magnetic crosslinking polymer
HE Shengfu, ZHANG Fan, CHENG Shenzhen, WANG Wei
(Collaborative Innovation Center of Manganese-Zinc-Vanadium Industrial Technology (2011 Plan of Hunan Province), Key Laboratory of Mineral Cleaner Production and Exploit of Green Functional Materials, College of Chemistry and Chemical Engineering, Jishou University, Jishou 416000, Hunan, China)
A magnetic crosslinking polymer, Fe3O4encapsulated by sodium polyacrylate (CPAANa@Fe3O4), was prepareddispersed solution polymerization followed by Ca2+surface-crosslinkingand characterized by techniques of XRD, FT-IR, SEM and TGA. Static adsorption of Pb2+and Cd2+ions to the polymer in aqueous solutions was investigated by varying solution pH, polymer adsorbent dosage, and initial concentration of heavy metal ions. The CPAANa@Fe3O4magnetic crosslinking polymer showed good adsorption performance in solutions with pH in the range of 2—6. The maximum adsorptions for Pb2+and Cd2+were observed at adsorbent dosage of 1.0 and 1.6 g·L-1for initial Pb2+concentration of 200 mg·L-1and initial Cd2+concentration of 100 mg·L-1, respectively, such that the residual Pb2+concentration could meet the standard for discharge (GB 8978—1996). The adsorption kinetics of both Pb2+and Cd2+on CPAANa@Fe3O4polymer followed pseudo-second order model and their adsorption isotherms obeyed the Langmuir model. Maximum adsorption capacities of the polymer for Pb2+and Cd2+were 454.55 and 275.48 mg·g-1, respectively. The CPAANa@Fe3O4polymer effectively removed Pb2+and Cd2+from complex electrolytic pulp wastewater, indicating its potential application advantages as an efficient adsorbent.
composites; preparation; adsorption; magnetic polymer; Pb2+; Cd2+; kinetics
2016-03-07.
ZHANG Fan, chemfzhang@163.com
10.11949/j.issn.0438-1157.20160259
TQ 028.3
A
0438—1157(2016)10—4290—10
湖南省教育厅重点项目(15A150);矿物清洁生产与绿色功能材料开发湖南省重点实验室开放基金项目;湖南省高校科技创新团队支持计划项目;吉首大学校级科研项目研究生专项项目(2014JDY052)。
2016-03-07收到初稿,2016-05-12收到修改稿。
联系人:张帆。第一作者:贺盛福(1988—),男,硕士研究生。
supported by the Key Projects of the Education Department of Hunan Province (15A150), the Open Fund from Key Laboratory of Mineral Cleaner Production and Exploit of Green Functional Materials in Hunan Province, the Aid Program for Science and Technology Innovative Research Team in Higher Educational Institutions of Hunan Province and the Special Scientific Research Project from Jishou University (2014JDY052).
