2-甲基咪唑/乙二醇体系常温脱除天然气中的二氧化碳
2016-10-25童雄师潘勇王慕宇史家亮陈光进刘蓓
童雄师,潘勇,王慕宇,史家亮,陈光进,刘蓓
2-甲基咪唑/乙二醇体系常温脱除天然气中的二氧化碳
童雄师1,潘勇1,王慕宇2,史家亮1,陈光进1,刘蓓1
(1中国石油大学(北京)重质油国家重点实验室,北京 102249;2中国石油大连石化公司,辽宁大连 116011)
将2-甲基咪唑溶于乙二醇中形成混合溶液体系,利用该体系常温下实现对天然气中二氧化碳的脱除。首先分别测定单组分甲烷和二氧化碳在体系中的吸收容量,在0.1 MPa下,CO2在2-甲基咪唑/乙二醇混合溶液中溶解度约为0.87 mol·L−1,高于同等条件下CO2在大部分离子液体中的溶解度,二氧化碳的吸收容量远大于甲烷的; 然后对混合气CH4/CO2进行分离,发现该体系能较好吸收分离CH4/CO2。最后考察了体系的再生性和重复利用性,得出2-甲基咪唑/乙二醇溶液体系能完全再生并且能重复使用。
甲烷;二氧化碳;乙二醇;2-甲基咪唑;吸收;分离;天然气净化
引 言
随着经济社会的发展,煤和石油的消耗与日俱增,随之而来的环境问题也越来越突出。人们迫切希望找到一种环境友好的可替代能源。天然气作为一种优质清洁燃料,与其他燃料相比,具有方便、经济、热值高、污染小等优点。并且,以天然气作为燃料能够有效减少CO、CO2、NO以及烃类等的排放,利于保护环境[1]。天然气的主要成分一般为CH4和CO2,其中CO2的存在却带来诸多危害[2-5]:CO2是酸性气体,遇水易形成酸性溶液而腐蚀管道设备;降低天然气的燃烧热值;低温易形成水合物,从而堵塞天然气运输管道等。
目前,工业上脱除天然气中的CO2主要采用化学吸收法。其中,醇胺法是以醇胺类溶剂[如一乙醇胺(MEA),二乙醇胺(DEA)等]为吸收剂。由于吸收效率高、工艺成熟而得到广泛应用。但是由于存在吸收/再生温差大、溶剂再生能耗高、设备腐蚀、胺的高温降解和易挥发等缺陷,此方法的应用受到一定程度的制约[6-8]。亟需改善或者找到一种新的吸收剂替代醇胺溶液,实现更加有效地吸收分离CO2。
针对醇胺法脱除天然气中CO2所存在的缺陷,本工作中采用2-甲基咪唑/乙二醇混合形成的溶液作为吸收剂吸收捕集天然气中的CO2。
1 实验部分
1.1 实验装置
图1为分离实验装置,主要由一个高压盲釜和一个高压透明蓝宝石釜两部分构成。其中,盲釜和蓝宝石釜的工作体积分别为112、60 ml,最大工作压力分别为40、20 MPa。整个系统的温度由带视窗的恒温空气浴控制,控制精度为±0.1 K。空气浴中配备有Pt-100型冷光源以方便观察宝石釜中的实验现象。另外,通过压力传感器来测定盲釜和宝石釜中的压力,测量精度为±0.01 MPa。整个体系的压力数据由计算机系统自动采集。实验装置所测数据的可靠性见文献[9-11]。
1.2 实验材料
本研究中所用材料包括去离子水、2-甲基咪唑、乙二醇、CH4(99.99%)和CO2(99.99%)。其中,去离子水为本实验室生产,2-甲基咪唑和乙二醇购自Sigma公司,配制实验所用天然气的高纯原料气CH4和CO2购自北京氦谱北分气体有限公司。本工作配制了一个天然气模拟气样CH4/CO2(摩尔比76.50/23.50),原料气和分离平衡气组成采用HP7890B型色谱仪分析确定。
1.3 实验步骤和数据处理方法
实验开始前称量质量比为2:3的2-甲基咪唑和乙二醇,将2-甲基咪唑固体分批加入乙二醇中,不断搅拌,直至溶解完全。然后,卸下蓝宝石釜,用去离子水洗净并用试纸擦干,再用量筒量取配制好的2-甲基咪唑/乙二醇混合溶液15 ml加入蓝宝石釜中。重新将蓝宝石釜固定在空气浴的气体分离装置上,确定气密性良好后,对蓝宝石釜以及所连管线系统抽真空并用原料气置换3次后保持真空状态。同样,对盲釜及所连管线系统抽真空,并用原料气置换3次后打入原料气至预定压力。启动恒温空气浴设定实验温度为20℃。等空气浴达到设定温度并且盲釜中气体压力平衡后,记下对应压力值1。轻调盲釜与宝石釜之间的连接阀,从盲釜放出一定的原料气进入宝石釜后迅速关闭连接阀。启动磁力搅拌系统促进分离过程中传质的进行。待宝石釜中压力稳定30 min以上可认为气液达到平衡,分别记下此时盲釜和宝石釜中压力数值2、E。通过推动与蓝宝石釜下方相连的手推泵维持压力恒定,采集平衡釜中的平衡气进行色谱分析。
本实验采用的解吸方法为常温抽真空解吸。具体解吸步骤如下:吸收分离实验结束后,对混合体系进行解吸。先倒回手推泵,再关闭与之相连管线的阀门。然后缓慢拧开蓝宝石釜上方的阀门,排放出平衡气。开动磁力搅拌,加快混合体系的解吸。待体系中气体脱除到一定程度后,搅拌的同时使用真空泵抽真空(约1 h)使体系再生,并准备下次吸收实验。
本工作采用物料衡算法计算分离达到平衡之后乙二醇/2-甲基咪唑体系吸收的气体容量。先计算由高压盲釜进入宝石釜的混合气总物质的量t,后计算宝石釜中平衡气总物质的量E
式中,为实验温度;为摩尔气体常数,=8.3145 J·mol−1·K−1;1和2分别为高压盲釜放入一定量原料气进入宝石釜前后的平衡压力;1和2分别为压力为1和2对应状态下的压缩因子;E、E分别为平衡状态下蓝宝石釜中气体的压力和压缩因子。上述压缩因子均由BWRS状态方程计算。b为高压盲釜体积,g为分离平衡后蓝宝石釜上方气相体积。
汽液平衡后,液相中吸收的CO2(1)和CH4(2)的物质的量分别为
式中,1和1分别为气体在原料气和平衡气中的摩尔分数。由此,可算得平衡液相中的CO2和CH4的摩尔组成分别为
分离因子是衡量分离过程中CO2对CH4的选择性,定义为
CO2在浆液中吸收量用v(mol·L−1)表示。溶解度系数也是衡量整个分离过程的一个重要指标,以[mol·(L·MPa)−1]表示,v和H(=1,2)计算公式如下
初始气-液体积比率定义为
其中,V为液相体积。
2 实验结果与讨论
2.1 CH4和CO2在乙二醇/2-甲基咪唑体系中的吸收容量比较
在293.15 K、0~4 MPa,分别测试了2-甲基咪唑/乙二醇体系对单一组分CO2和CH4的吸收容量。测定结果见表1,吸收曲线如图2所示。由图2可看出,在0~4 MPa范围内,随着压力的升高,体系对CO2吸收能力明显增加。其中,0~2.5 MPa范围内,体系对CO2的吸收量虽然不断增加,但是曲线斜率却不断下降;而在2.5~4.0 MPa压力区间,体系对CO2的吸收量随压力增加近似直线上升。体系始终保持对CO2具有较高的吸收能力。而体系对CH4的吸收量随压力增加虽略有增加但始终维持在较低的水平,远低于相同压力下该体系对CO2的吸收量[12-13]。鉴于此,采用2-甲基咪唑/乙二醇体系来分离CH4/CO2混合气。

表1 293.15 K下2-甲基咪唑/乙二醇体系对单组分CO2(1)和CH4(2)的吸收容量
该体系之所以对CO2吸收量远大于CH4是由于体系对CO2既有物理溶解亦有化学反应吸收,而对于CH4只有单纯的物理溶解。图3为混合体系吸收CO2前后的远红外光谱图[14],可以看出体系吸收CO2后在1639 cm−1出现新的羰基吸收峰,这是因为CO2容易与咪唑上的N自由电子对作用生成羰基,2-甲基咪唑和CO2可能发生了如下化学反应[15-17]
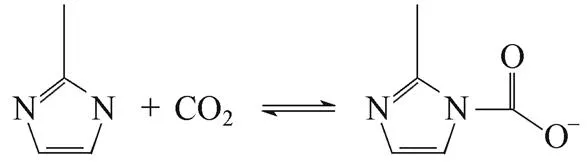
图4、图5分别为单组分CO2和混合体系吸收CO2的动力学曲线,反应开始时,较高浓度的2-甲基咪唑化学吸收CO2,体系表现出对CO2较快的吸收速率。而随着反应的进行,2-甲基咪唑和CO2浓度降低,反应速率随之下降,最终达到稳定的动态化学反应平衡状态[18]。此外,进气压力越高,CO2的分压越大,平衡向右移动,亦有利于CO2的吸收。
2.2 2-甲基咪唑/乙二醇体系对CH4/CO2分离效果研究
表2为293.15 K下,测得的CO2和CH4在乙二醇中的溶解度系数。表3是温度为293.15 K,压力在0~3 MPa范围内,使用2-甲基咪唑/乙二醇体系CO2对CH4的分离选择性。由表3可以看出,随着初始气液体积比和操作压力的增加,分离因子均匀增加,CO2在液相中的溶解量随之增加,而平衡气中CO2含量始终维持在较低水平(<7%)。这表明增加操作压力有利于分离混合气,实际操作中可根据产品指标要求和操作成本适当增加压力。对比表2和表3,发现CO2在混合体系中随操作压力的增加,溶解度系数虽由7.276 mol·(L·MPa)−1缓慢递减至4.707 mol·(L·MPa)−1,但仍然远高于相同温度下CO2在乙二醇中的溶解度系数[0.519 mol·(L·MPa)−1]。这进一步说明了体系吸收CO2过程中2-甲基咪唑起主要作用[19-20]。

表2 293.15 K时CH4和CO2在乙二醇中的溶解度系数

表3 不同压力与气液比下2-甲基咪唑/乙二醇体系分离CH4/CO2结果(293.15 K)
2.3 乙二醇/2-甲基咪唑体系吸收分离的重复性研究
体系能够循环利用是实现其工业化的必要前提。为此先后测试了体系对单组分CO2的吸收重复性和对混合气CO2/CH4的分离重复性,测试结果如表4和表5所示。将表4中体系3次重复吸收CO2的实验数据绘成图6,容易发现,3组实验点具有很高的重复性,说明每次实验后CO2解吸完全,不影响体系下次实验对CO2的吸收能力,吸收重复性良好。表4为4次分离CH4/CO2重复性实验。每次实验结束后,于常温、抽真空的条件下解吸1 h(实际的工业化应用中,可提高解吸温度,缩短解吸时间),再进行下一次实验。可以看出4次实验的初始进气压力均为1.5 MPa左右,气液吸收达到平衡之后压力均在1.2 MPa附近,分离因子均为60左右。这表明每次实验中体系的吸收分离能力基本不变,每次吸收的气体经过常温抽真空可解吸完全,再生条件比较温和。

表4 不同压力下2-甲基咪唑/乙二醇体系对单组分CO2的吸收重复性吸收测定(293.15 K)

表5 293.15 K和进气压力1.5 MPa左右时2-甲基咪唑/乙二醇体系分离CH4/CO2的重复性测定
根据本实验室最新的研究成果,303.15 K下乙二醇/二甲基咪唑体系中CO2的吸收反应热仅为-34 kJ·mol-1,而相同条件下醇胺类吸收剂的吸收反应热大多在-100 kJ·mol-1左右[9]。因此,该体系除了重复应用性能好,还具有再生能耗低的优点,能有效降低操作成本。
常温常压下,CO2在2-甲基咪唑/乙二醇混合溶液中溶解度约为0.87 mol·L-1,2-甲基咪唑/乙二醇浆液的吸着量小于同等条件下的MEA和MEDA的,但仍高于一些有应用前景的离子液体的吸着量[19],如是[p5mim][bFAP](0.048 mol·L-1在298.15 K)离子液体的18倍[21],是[bmim][PF6](约0.108 mol·L-1在298.15 K)的8倍[22]。
虽然混合体系的黏度(表6)比醇胺溶液高很多,但仍然具有良好的流动性能,且已经远低于相同条件下大多数离子液体的黏度。另外体系的黏度对温度比较敏感,温度每升高10℃,体系黏度大约下降40%,实际的工业化应用中可根据需要适当提高吸收温度从而降低体系黏度。

表6 2-甲基咪唑/乙二醇溶液黏度实验测定值
一般处理低CO2分压气体(10~100 kPa),优先选用醇胺法(可以MEA或者环丁砜法),但是当处理高浓度CO2的天然气,CO2分压较高,从能耗和净化气要求考虑,本方法优势就比较明显。
3 结 论
常温下,用乙二醇/2-甲基咪唑体系对一个模拟天然气组分(CH4/CO2)进行了分离实验研究。结果表明:常温下,相对于单组分CH4,体系化学反应吸收CO2,对CO2具有更大的吸收容量,故对CH4具有较高的选择性;适当增加操作压力,有利于增加体系的分离选择性;另外,由于乙二醇和2-甲基咪唑本身具有较高的沸点,体系除基本不挥发外,在常温和抽真空条件下吸收的气体可解吸完全,再生条件比较温和,可循环使用,具有良好的工业化应用前景。
符 号 说 明

H——溶解度系数,mol·(L·MPa)-1 nt, nE——分别为高压盲釜中进入宝石釜中的混合气和宝石釜汽液平衡时气相总物质的量,mol p1, p2, pE——分别为平衡釜内前、后压力及宝石釜平衡压力,kPa Sv——溶解度,mol·L-1 Vb, Vg , Vl——分别为平衡釜体积、宝石釜中气相体积及宝石釜中液相体积,ml Z1, Z2, ZE——分别为平衡釜内前、后压缩因子及宝石釜平衡压缩因子 f——气液初始体积比率
References
[1] WANG D Y. Natural Gas Processing and Technology [M]. Beijing: Petroleum Industry Press, 1994.
[2] BAKER R W, LOKHANDWALA K. Natural gas processing with membranes: an overview [J]. IndustrialEngineering Chemistry Research, 2008, 47(7): 2109-2121.
[3] BATES E D, MAYTON R D, NTAI I,. CO2capture by a task- specific ionic liquid [J]. Journal of the American Chemical Society, 2002, 124(6): 926-927.
[4] YUAN Q, SUN C Y, YANG X,. Recovery of methane from hydrate reservoir with gaseous carbon dioxide using a three-dimensional middle-size reactor [J]. Energy, 2012, 40(1): 47-58.
[5] OMOLE I C, AdAMS R T, MILLER S J,. Effects of CO2on a high performance hollow-fiber membrane for natural gas purification [J]. IndustrialEngineering Chemistry Research, 2010, 49(10): 4887-4896.
[6] JING G, ZHOU L, ZHOU Z. Characterization and kinetics of carbon dioxide absorption into aqueous tetramethylammonium glycinate solution [J]. Chemical Engineering Journal, 2012, 181: 85-92.
[7] ZHANG F, FANG C G, WU Y T,. Absorption of CO2in the aqueous solutions of functionalized ionic liquids and MDEA [J]. Chemical Engineering Journal, 2010, 160(2): 691-697.
[8] KARADAS F, ATILHAN M, APARICIO S. Review on the use of ionic liquids (ILs) as alternative fluids for CO2capture and natural gas sweetening [J]. EnergyFuels, 2010, 24(11): 5817-5828.
[9] LIU H, LIU B, LIN L C,. A hybrid absorption-adsorption method to efficiently capture carbon [J]. Nature Communications, 2014, 5: 5147.
[10] LIU H, MU L, LIU B,. Experimental studies of the separation of C2compounds from CH4+C2H4+C2H6+N2gas mixtures by an absorption-hydration hybrid method [J]. IndustrialEngineering Chemistry Research, 2013, 52(7): 2707-2713.
[11] MU L, LIU B, LIU H,. A novel method to improve the gas storage capacity of ZIF-8 [J]. Journal of Materials Chemistry, 2012, 22(24): 12246-12252.
[12] RAMDIN M, AMPLIANITIS A, BAZHENOV S,. Solubility of CO2and CH4in ionic liquids: ideal CO2/CH4selectivity [J]. IndustrialEngineering Chemistry Research, 2014, 53(40): 15427-15435.
[13] ZHANG X, ZHANG S J, BAO D,. Absorption degree analysis on biogas separation with ionic liquid systems [J]. Bioresource Technology, 2015, 175: 135-141.
[14] GAO F, ZHANG J B, NIU Y X,. Desorption property and spectral investigation of dilute sulfur dioxide in ethylene glycol+,-dimethylformamide system [J]. IndustrialEngineering Chemistry Research, 2014, 53(19): 7871-7876.
[15] JESSOP P G, HELDEBRANT D J, LI X,. Green chemistry: reversible nonpolar-to-polar solvent [J]. Nature, 2005, 436(7054): 1102-1102.
[16] XUE Z M, ZHANG Z F, HAN J,. Carbon dioxide capture by a dual amino ionic liquid with amino-functionalized imidazolium cation and taurine anion [J]. International Journal of Greenhouse Gas Control, 2011, 5(4): 628-633.
[17] ZHANG J, JIA C, DONG H,. A novel dual amino-functionalized cation-tethered ionic liquid for CO2capture [J]. IndustrialEngineering Chemistry Research, 2013, 52(17): 5835-5841.
[18] GURKAN B E, GOHNDRONE T R, MCCREADY M J,. Reaction kinetics of CO2absorption in to phosphonium based anion-functionalized ionic liquids [J]. Physical Chemistry Chemical Physics, 2013, 15(20): 7796-7811.
[19] SHANNON M S, TEDSTONE J M, DANIELSEN S P O,. Properties and performance of ether-functionalized imidazoles as physical solvents for CO2separations [J]. EnergyFuels, 2013, 27(6): 3349-3357.
[20] ZENG S J, WANG J, BAI L,. Highly selective capture of CO2by ether-functionalized pyridinium ionic liquids with low viscosity [J]. EnergyFuels, 2015, 29(9): 6039-6048.
[21] WILCOX J. Carbon Capture [M]. New York: Springer Science & Business Media, 2012.
[22] ANTHONY J L, MAGINN E J, BRENNECKE J F. Solubilities and thermodynamic properties of gases in the ionic liquid 1--butyl-3-methylimidazo-lium hexafluorophosp-hate [J]. Journal of Physical Chemistry B, 2002,106(29): 7315-7320.
Removal of CO2from natural gas by 2-methylimidazole/ethylene glycol system at room temperature
TONG Xiongshi1, PAN Yong1, WANG Muyu2, SHI Jialiang1, CHEN Guangjin1, LIU Bei1
(1State Key Laboratory of Heavy Oil Processing, China University of Petroleum, Beijing 102249, China;2Petro-China Co. Ltd. Dalian Petrochemical Co., Dalian 116011, Liaoning, China)
A binary liquid mixture system of 2-methylimidazole and ethylene glycol was used to remove carbon dioxide (CO2)from natural gas at room temperature. The measurement on absorption capacity of methane (CH4) and CO2in this system shows the CO2solubility about 0.87 mol·L−1at 0.1 MPa, which is higher than that in most ionic liquids under the same condition, and the absorption capacity of CO2was greater than that of CH4. Further experimental results demonstrate that the liquid mixture could effectively separate CO2/CH4gas mixture and could be regenerated and reused. After several cycles of absorption/desorption operations, the absorption capability was found barely changed, indicating good stability and application prospective of this binary system.
methane; carbon dioxide; ethylene glycol; 2-methylimidazole; absorption; separation; natural gas purification
2016-03-29.
Prof. LIU Bei, liub@cup.edu.cn
10.11949/j.issn.0438-1157.20160366
TE 645
A
0438—1157(2016)10—4240—06
国家自然科学基金项目(21276272,21522609)。
2016-03-29收到初稿,2016-06-28收到修改稿。
联系人:刘蓓。第一作者:童雄师(1989—),男,硕士研究生。
supported by the National Natural Science Foundation of China (21276272, 21522609).
