高效液相色谱法研究怀山药啤酒中的山药素类成分
2016-10-25张彭湃王松廷杨生玉朱金花侯亚彬
张彭湃,王松廷,杨生玉,朱金花,侯亚彬
(1.河南大学 生命科学学院,河南 开封 475004; 2.河南大学 化学化工学院,河南 开封 475004;3.河南大学 实验室与设备处,河南 开封 475004)
高效液相色谱法研究怀山药啤酒中的山药素类成分
张彭湃1,王松廷1,杨生玉1,朱金花2,侯亚彬3*
(1.河南大学 生命科学学院,河南 开封 475004;2.河南大学 化学化工学院,河南 开封 475004;3.河南大学 实验室与设备处,河南 开封 475004)
建立一种有效的高效液相色谱方法,以期对怀山药啤酒中的山药素类成分进行分析. 测定方法为:色谱柱为Cosmosil 5C18-PAQ型(4.6 mm×250 mm,5 μm),流动相为甲醇:水(体积比60:40),流速为1.0 mL/min,紫外检测波长为274 nm,柱温30 ℃. 在选定的色谱条件下,最终得到了稳定、效果较好的怀山药啤酒的液相色谱图,并检测到怀山药啤酒中含有山药素Ⅰ衍生物成分,其平均回收率为87.71%.
高效液相色谱法;怀山药啤酒;山药素化合物
山药在我国已经有2000多年的食用历史,随着现代食品加工业的发展,以山药为原料或添加山药的食品和保健品越来越多. 例如,山药啤酒、山药醋、山药酸奶等山药发酵制品在我们的日常生活中越来越常见[1]. 这些山药发酵制品能在保证食物良好口感的同时有效地利用山药的药理活性和保健功能,使所生产出的食品具有更丰富的营养,更好的滋补健身、养颜美容之功效[2]. 由于这些产品中添加有山药,故推测其中应该含有某些山药中的活性成分如山药素类化合物,但生产山药啤酒、山药醋等产品需经过微生物发酵过程,山药中所含的山药素类成分有可能在发酵过程中发生了变化[3]. 因此,本文中我们以怀山药啤酒为研究对象,探讨怀山药啤酒中山药素化合物含量的变化.
山药素类化合物是一种酚类化合物,高效液相色谱被认为是研究多酚类化合物最常用的方法[4]. YOON建立了HPLC分析方法来测定山药素Ⅰ,HPLC条件是:色谱柱:Columbus 5μC18100A(4.6 mm×300 mm,5 μm),流动相:0.025%的乙酸溶液(A)和0.025%的乙酸乙腈溶液(B),检测波长260 nm,流速2 mL/min,梯度洗脱[5].
本文中选择山药中含量较高的山药素Ⅰ和山药素Ⅰ衍生物(2,4-二甲氧基-6,7-二羟基菲)为参考指标,同时由于山药素Ⅳ和山药素Ⅰ衍生物分离时间较接近,将山药素Ⅳ也作为参考指标. 山药素Ⅰ、山药素Ⅰ衍生物、山药素Ⅳ结构如图1所示.
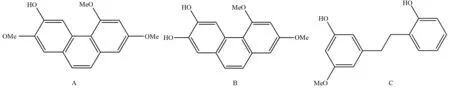
A:山药素Ⅰ, B:山药素Ⅰ衍生物, C:山药素Ⅳ.图1 山药素及其衍生物的结构式Fig.1 Structural formula of batatasin and its derivatives
1 材料与方法
1.1材料与试剂
小麦啤酒、怀山药啤酒均由河南大学生命科学学院生物工程实验室提供;甲醇(天津市四友精细化学品有限公司出品,分析纯);山药素Ⅰ(1.067 g/L),山药素Ⅰ衍生物(1 g/L),山药素Ⅳ(1 g/L)均由甲醇配制;高效液相色谱甲醇(德国默克公司,色谱纯);实验中所用水均为超纯水.
1.2仪器设备
依利特P230Ⅱ型高效液相色谱仪,配备UV230Ⅱ型紫外检测器,ZWⅡ温度控制器,色谱工作站软件型号为EC2006(大连依利特分析仪器有限公司);KQ5200E型超声波清洗器 (昆山市超声仪器有限公司);Anke离心机 (上海安亭科学仪器厂);Cosmosil 5C18-PAQ (4.6 mm×250 mm, 5 μm)色谱柱;Phree Phospholipid Removal小柱(1.5 mL,美国菲罗门科学仪器有限公司).
1.3实验方法
1) 分别量取怀山药啤酒、小麦啤酒各40 mL于2个烧杯中,超声处理30 min,用隔膜真空泵过滤后分别装于离心管中并放4℃冰箱冷藏保存.
2) 取上述样品各150 μL于Phree Phospholipid Removal小柱中,再分别添加600 μL色谱甲醇,振荡混匀,将小柱放于离心管中,使样品溶液以8000 r/mim离心3 min,将离心管中的液体移至1.5 mL试剂瓶中放于4 ℃冰箱保存,即得到2个过柱的样品.
3) 不同浓度标准品溶液配制. 分别取山药素Ⅰ
(1.067 g/L)、山药素Ⅰ衍生物(1 g/L)、山药素Ⅳ(1 g/L)储备液各50 μL于1.5 mL离心管中,再加入850 μL色谱甲醇,即得到50 mg/L的3种标准品混合溶液;用色谱甲醇逐级稀释该混合液2、5、10、20倍得到的25 mg/L、10 mg/L、5 mg/L、2.5 mg/L的3种标准品混合溶液[6].
2 结果与讨论
2.1色谱条件的建立
2.1.1选择检测波长
查阅了相关文献,综合响应值、分离度和稳定性,选择274 nm为检测波长[7].
2.1.2流动相选择
选择甲醇-水作为流动相,考察了甲醇-水的体积比为70:30与60:40的分离情况和出峰时间,选择后者作为流动相.
2.1.3色谱柱选择
测试了Hypesil C18 (3.5 mm×150 mm, 5 μm)色谱柱以及Cosmosil 5C18-PAQ (4.6 mm×250 mm, 5 μm) 色谱柱对样品的分离效果,根据样品分离程度和峰形选择后者.
综上确定了最终的色谱条件:采用COSMOSIL 5C18-PAQ (4.6×250 mm,5 μm) 色谱柱,流动相为甲醇:水(体积比60:40),流速为1.0 mL/min,紫外检测波长为274 nm,柱温30℃,进样量为20 μL. 在最佳色谱条件下,对山药素Ⅰ、山药素Ⅰ衍生物和山药素IV的混合标准品溶液进行分析,如图2所示.
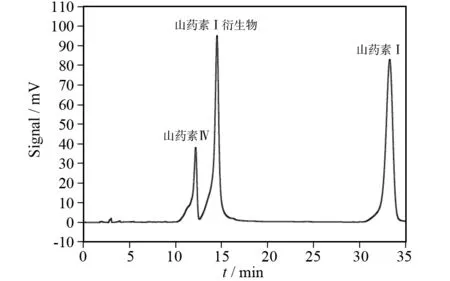
图2 山药素Ⅰ、山药素Ⅰ衍生物及山药素Ⅳ的标准品溶液谱图Fig.2 Standard sample chromatogram of batatasinⅠ,batatasinⅠderivative and batatasin Ⅳ
2.2样品前处理方式比较
之所以对样品进行过小柱处理,是因为样品中含有一些多糖、脂类等大分子物质,这些大分子物质可能会掩盖样品中含量较少的成分,使其检测不出. 过小柱后,样品中的大分子被除去,怀山药啤酒中的山药素类成分出峰的可能性将会大大提高,出峰效果也将有可能会改善[8]. 在上述色谱条件下分别进样未过柱的怀山药啤酒、小麦啤酒,结果如图3、图4所示.
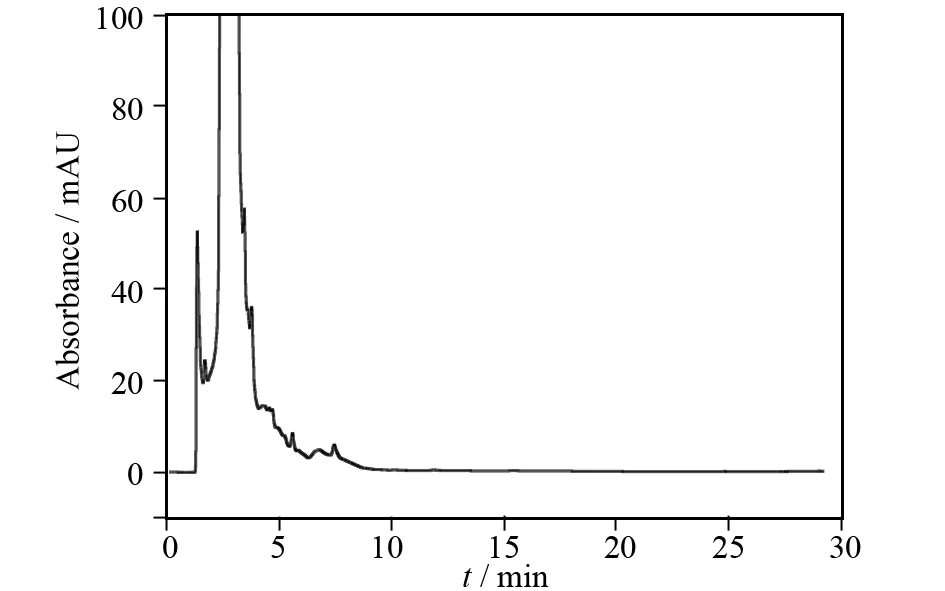
图3 未过柱的小麦啤酒(空白对照)Fig.3 Wheat beer of not throughing the column
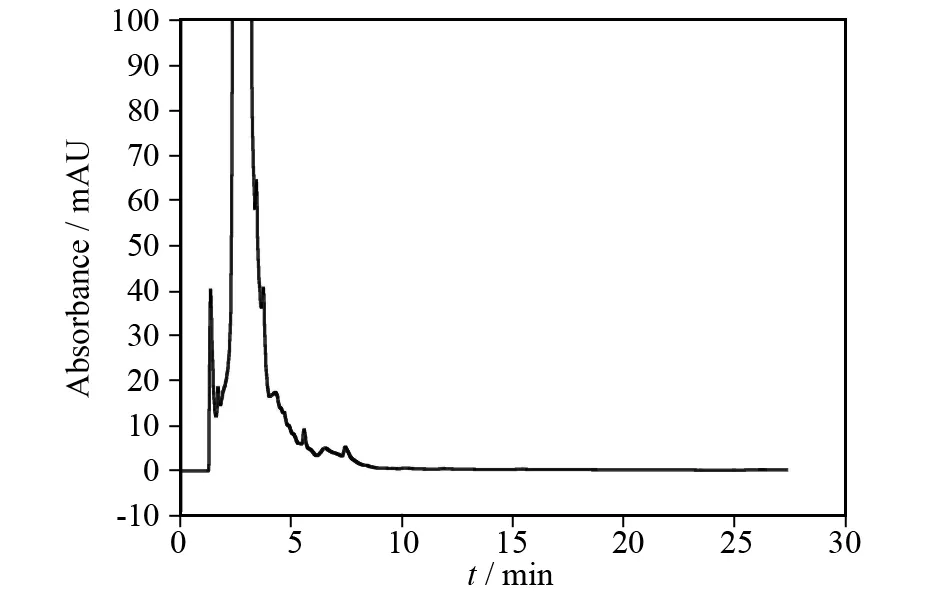
图4 未过柱的怀山药啤酒Fig.4 Yam beer of not throughing the column
从未过柱的小麦啤酒(图3)、怀山药啤酒(图4)色谱图中可以看出,在0~5 min内,有信号较强且较宽的样品峰,除此之外几乎检测不到其他峰. 可能原因是由于在酿造啤酒的过程中使用了麦芽、啤酒花等原料,经啤酒酵母发酵后产生了多糖、脂类等大分子物质,所使用的色谱柱对这些大分子物质保留能力较差,导致无法达到分离而被流动相较快的淋洗出色谱柱,形成较大的宽峰,从而可能会掩盖其他的极性较大的成分[9]. 因此,需要对样品进行进一步处理以消除干扰,分别将样品过Phree Phospholipid Removal小柱,以除去其中的磷脂类成分及其他部分大分子[10]. 所得色谱图如图5、图6所示,分别与图3、图4比较,过柱后的样品在0~5 min的峰明显变窄,且在10~15 min出现一个峰.

图5 过柱小麦啤酒(空白对照)Fig.5 Wheat beer of throughing the column
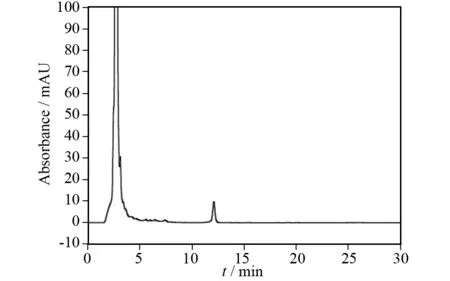
图6 过柱的怀山药啤酒Fig.6 Yam beer of throughing the column
对比图2标准样品出峰时间,查阅相关文献,结合实验室前期工作,推测过柱的怀山药啤酒、小麦啤酒在10~15 min所出的峰可能为山药素Ⅰ衍生物. 本实验所用样品均过小柱处理(下文不再注明).
2.3样品中10~15 min峰的归属
因怀山药啤酒的色谱流出曲线中15 min之后均没有出峰,所以首先可以排除它们含有山药素Ⅰ的可能性. 虽然之前推测样品在10~15 min所出的峰是山药素Ⅰ衍生物,但由于山药素IV和山药素I衍生物均在10~15 min内出峰且出峰时间较为接近,故在相同的色谱条件下对怀山药啤酒样品添加山药素Ⅳ和山药素I衍生物标准溶液进行验证[11].

图7 加标(山药素Ⅳ)的怀山药啤酒Fig.7 Yam beer of adding the batatasin Ⅳ
由图6可知,未加标的怀山药啤酒在10~15 min只出了一个峰,由图7可知,加标山药素Ⅳ后的怀山药啤酒在10~15 min出了两个峰. 由于图2和图7色谱条件相同,而1号峰保留时间与山药素Ⅳ的一致,且加标后峰明显增高,可以推知1号峰是所加标准物山药素Ⅳ. 由于加标山药素Ⅳ后样品中仍存在2号峰,那么2号峰可能是怀山药啤酒本身所含成分所出的峰,而且2号小峰的保留时间与图2中的山药素Ⅰ衍生物保留时间基本一致. 需要进一步验证样品中10~15 min所出峰的归属[12]. 实验在添加山药素IV标准的基础上,又加入了山药素I衍生物标准品,实验结果如图8、图9所示.

图8 稀释2倍的图7溶液Fig.8 Solution of 2-fold dilution for Fig.7

图9 用100 g/L的山药素Ⅰ衍生物稀释2倍的图7溶液Fig.9 Solution of 2-fold dilution with the batatasinⅠderivative of 100 g/L for Fig.7
对于怀山药啤酒,比较图8和图9,可以发现图7的溶液用不同的方式稀释2倍后,1号山药素Ⅳ的峰高由6.6 mV分别降为2.9 mV和3.03 mV,但2号未知峰的峰高在用山药素Ⅰ衍生物稀释时明显增高,故可以确定山药啤酒中2号峰是山药素Ⅰ衍生物,加标实验结果表明,样品中10~15 min所出的峰为山药素Ⅰ衍生物,即怀山药啤酒中含有山药素Ⅰ衍生物. 对比小麦啤酒,在相同实验条件下均检测出山药素Ⅰ衍生物.
2.4线性关系考察
精确配制出一系列浓度的山药素Ⅰ、山药素Ⅰ衍生物、山药素Ⅳ混合标准品溶液,在上述色谱条件下进样,每种浓度的标准品溶液重复进样3次[13].
以峰面积为纵坐标y,标准品溶液的浓度为横坐标x,绘制标准曲线,得表1. 可以看出,在本实验的色谱条件下,3种标准品在测定的范围内线性关系良好.
2.5样品测定
按照上述色谱条件,分别对怀山药啤酒和小麦啤酒中的山药素Ⅰ衍生物的含量进行了测定,分别代入山药素Ⅰ衍生物的回归方程y=2.62×102x-312.86,结合过小柱稀释倍数(5倍),可以得到各样品中山药素I衍生物的含量,结果显示,小麦啤酒和怀山药啤酒两种样品中均含有山药素Ⅰ衍生物,分别为8.33 mg/L与8.77 mg/L,二者山药素Ⅰ衍生物的含量相差不大,作为空白对照的小麦啤酒中山药素Ⅰ衍生物的含量略低于怀山药啤酒[14].
根据本实验的结果,没有添加山药的小麦啤酒也含有山药素Ⅰ衍生物,由此可见,山药素Ⅰ衍生物并非山药中专属化合物,山药素Ⅰ衍生物的化学名称是2,4-二甲氧基-6,7-二羟基菲,推测啤酒在酿造过程中可能会产生山药素Ⅰ衍生物.
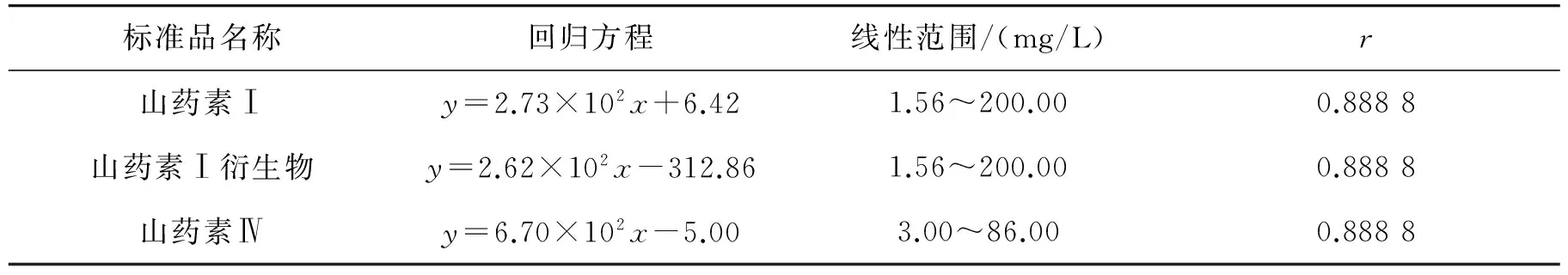
表1 标准品回归方程Table 1 The regression equation of standard sample
2.6回收率实验
对怀山药啤酒进行回收率实验[15]. 因为怀山药啤酒中的山药素Ⅰ衍生物含量为1.75 mg/L(过柱后),分别添加相当于怀山药啤酒自身所含山药素Ⅰ衍生物浓度0.5倍、1倍、2倍的山药素Ⅰ衍生物标准品溶液,结合线性方程,最终求得平均回收率为97.17%.
3 结论
在本论文所采用的色谱条件下,各个实验样品、标准品均能得到稳定性、峰型、分离程度等较好的色谱流出曲线,并且通过保留时间对照法和标准加入法等确定了小麦啤酒和怀山药啤酒中含有山药素Ⅰ衍生物成分. 实验中所用的3种标准品标准曲线在选定的浓度范围内线性关系均良好. 实验待测样品与空白对照品的山药素Ⅰ衍生物的含量无显著性差异,推测可能的原因是山药素Ⅰ衍生物(2,4-二甲氧基-6,7-二羟基菲)的来源并非只有山药,在啤酒酿造过程中也可能会产生山药素Ⅰ衍生物. 最后还对怀山药啤酒中山药素Ⅰ衍生物进行了回收率实验,其平均回收率为97.17%. 本方法简单、快速,且提供了食品中含有复杂样品基质(如含有较多蛋白质、脂类等大分子)的前处理方法,为样品中山药素化合物的测定提供了一定参考.
[1] 高琦, 于唐滢, 贾友峰, 等. 山药发酵制品研究进展[J]. 食品与发酵科技, 2014, 50(1): 5-8.
[2] 王邈, 李德远, 李玮, 等. 山药的药理作用分析及其开发利用[J]. 中国食物与营养, 2010, 16(4): 72-74.
[3] 朱金花, 东莹莹, 胡卫平, 等. 高效液相色谱法同时测定怀山药中4个山药素化合物[J].药物分析杂志, 2015, 35(3): 396-400.
[4] 白冰, 刘绣华, 王勇, 等. 怀山药化学成分研究(Ⅱ)[J]. 化学研究, 2008, 19(3): 67-69.
[5] Yoon K D, Nam S I, Kim Y C. Phenanthrene derivatives,3,5-dimethoxyphenanthrene-2,7-diol and batatasin-1, as non-polar standard marker compounds for Dioscorea Rhizoma [J]. Nat Prod Sci, 2007,13(4): 378-383.
[6] Fu Y C, Ferng L H A, Huang P Y. Quantitative analysis of allantoin and allantoic acid in yam tuber, mucilage, skin and buibil of the Dioscorea species [J]. Food Chem, 2006, 9(4): 541-549.
[7] 薛建平, 祝红蕾, 尧俊英. 铁棍山药及其零余子营养成分的比较研究[J]. 食品工业科技, 2008, 29(8): 268-269.
[8] MARC S, ANNE-CLAIRE M, TOMOFUMI M, et. al. A new phenanthren glacoside and other consitituents from Dioscorea opposite [J]. Chem Pharm Bull, 2004, 52(10): 1235-1237.
[9] HASHIMOTO T, TAJIMA M. Structures and synthesis of the growth inhibitors batatasins Ⅳ andⅤ, and their physiological activities[J]. Phytochemistry, 1978, 17(7): 1179-1184.
[10] HASHIMOTO T, HASEGAWA K, KAWARADA, A. Batatasins: New dormangy-inducing substances of yam bulbis [J]. Planta, 1972, 108(4): 369-374.
[11] MORITOSHI I, TOHRU H, ULRICH H. Inhibition of photosynthesis and respiration by batatasins [J]. Planta, 1978, 138(2): 167-172.
[12] VALLS J, MILLAN S, MARTI M P, et al. Advanced separation methods of food anthocyanins, isoflavones and flavanols [J]. J Chromatog A, 2009, 1216(43): 7143-7172.
[13] KIM S K, LEE S C, PARK T S, et al. Dormancy-related change in endogenous ABA, batatasin, and sugar in stored tuber and bulbil of Chinese Yam [J]. Korean J Crop Sci, 2002, 47(4): 297-300.
[14] KIM S K, LEE S C, KIM H Y, et al. Effects of gibberellic acid and gibberellin biosynthesis retardants on ethylene production, batatasins, and free sugars in dormant tubers of Chinese Yam [J]. Korean J Crop Sci, 2004, 49(4): 300-304.
[15] WANG S J, YU J L, YU J G, et al. Granule structure of C-type Chinese Yam (Dioscorea opposite Thunbvar. Zhongbowen) starch by acid hydrolysis [J]. Food Hydrocolloids, 2008, 22(4): 538-542.
[责任编辑:张普玉]
Detemination on batatasins in Yam beer by HPLC
ZAHNG Pengpai1, WANG Songting1, YANG Shengyu1, ZHU Jinhua2, HOU Yabin3*
(1.CollegeofLifeScience,HenanUniversity,Kaifeng475004,Henan,China; 2.CollegeofChemistryandChemicalEngineering,HenanUniversity,Kaifeng475004,Henan,China; 3.LaboratoryandEquipmentAdministration,HenanUniversity,Kaifeng475004,Henan,China)
Objective: Establish a suitable method to study batatasins in Yam beer by HPLC. Methods: Batatasins in Yam beer was identified by HPLC. The chromatographic column used was Cosmosil 5C18-PAQ (4.6 mm×250 mm, 5 μm). The mobile phase consisted of methanol-water(volumn ratio is 60:40), with a flow rate of 1.0 mL/min. The column temperature was set at 30 ℃ with detection wavelength at 274 nm. Results: The method is simple, reliable and suitable for detemination on batatasins in Yam beer. Batatasin Ⅰ derivative in Yam beer was identified. The average recovery of batatasin Ⅰ derivative was 87.17%.
HPLC; Yam beer; batatasin compounds
2016-01-17.
河南省高等学校重点科研项目资助计划(17A530001).
张彭湃(1978-),男,讲师,研究方向为食品发酵.*
,E-mail: zdsys@henu.edu.cn.
TS262.5
A
1008-1011(2016)05-0603-06
