CD14在强直性脊柱炎患者外周血单个核细胞和血清中的表达研究
2016-10-25陈曦李秋霞魏秋静古洁若
陈曦 李秋霞 魏秋静 古洁若
·基础研究论著·
CD14在强直性脊柱炎患者外周血单个核细胞和血清中的表达研究
陈曦李秋霞魏秋静古洁若
目的研究CD14基因在强直性脊柱炎(AS)患者外周血单个核细胞中RNA,和血清中蛋白的表达情况,并对CD14基因进行相关性分析。方法采集病情活动期AS患者的静脉血,分离外周血单个核细胞(PBMC)后提取RNA,同时从静脉血中离心分离血清于-20℃保存。其中21例AS活动期患者和20名健康志愿者的外周血行Microarray芯片检测。使用ELISA法检测另外40例活动期AS患者和40名健康志愿者血清中CD14的含量。对结果基因进行信号通路分析,探讨其参与AS发病的相关机制。结果Microarray芯片检测CD14在AS患者PBMC中mRNA的表达的荧光强度值为6 824±1 449,健康对照组为4 027±923。ELISA法检测AS患者血清中CD14蛋白含量中位数为2 568 kU/L,健康对照组为 905 kU/L。CD14在AS患者PBMC中mRNA和血清中蛋白的表达水平均高于健康对照组(P均<0.05)。CD14主要参与了Toll样受体(TLR)信号途径和固有免疫信号途径。STRING10在线蛋白质分析提示CD14和MYD88、TLR2、TLR6等基因相关。结论CD14可能通过参与免疫炎症反应相关的通路参与了AS的发病过程。
强直性脊柱炎;CD14;血清;外周血单个核细胞
强直性脊柱炎(AS)是一种常见的全身性慢性炎症性疾病,以骶髂关节炎、肌腱端炎和脊柱炎为特点,病情严重时可导致患者功能丧失和残疾。AS的发病与促炎细胞因子表达的上调有关,其中最重要并为多数学者所公认的细胞因子是TNF-α[1-4]。CD14分子在激活固有免疫系统、细菌吞噬作用和清除凋亡细胞等各种免疫反应中起重要作用。CD14/Toll样受体 4(TLR 4)-核因子-κB(NF-κB)信号通路参与了骨关节炎的发病机制。CD14/TLR 4-NF-κB信号通路过度活化,下游NF-κB p65及基质金属蛋白酶-13(MMP-13)的表达升高可能导致关节软骨破坏、降解加速,是诱发骨关节炎发展的重要因素之一[5]。本课题组在2009年用Microarray芯片对未分化脊柱关节病患者及健康志愿者的外周血单个核细胞(PBMC)进行分析,发现了6个差异基因,经过实时定量PCR(RT-PCR)验证后证实有4个基因与Microarray芯片结果相符[6]。本研究重新对该Microarray芯片进行了分析,使用ELISA法在蛋白质水平进行验证,并结合AS发病机制的相关信号通路进行分析,现报告如下。
对象与方法
一、研究对象
纳入Microarray芯片和ELISA研究的AS患者均来自中山大学附属第三医院门诊或住院患者,健康对照组血液标本均取自中山大学附属第三医院健康体检者,所有受试对象均知情同意并自愿参与本研究。Microarray芯片研究中,AS患者的男女比为13∶8,年龄(35±9)岁;健康对照者的男女比为10∶10,年龄(37±9)岁。ELISA研究中,AS患者的男女比为33∶7,年龄(31±12)岁;健康对照者的男女比为33∶7,年龄(30±9)岁。AS患者均符合1984年修订的AS纽约诊断标准,该组患者均处在疾病活动期,Bath AS病情活动指数(BASDAI)>4分,或ESR升高或CRP升高。纳入Microarray实验组AS患者的BASDAI为4.6(2.6,7.8)分;纳入ELISA实验组的患者BASDAI为5.0(2.9,8.2)分。AS组与健康对照组的性别构成、年龄比较差异均无统计学意义(P均>0.05)。排除合并其他自身免疫性疾病、肝肾疾病、感染、恶性肿瘤及血液系统疾病等。本研究已通过医院伦理委员会审批。
二、主要试剂与仪器
逆转录试剂盒采用PrimeScriptRTMaster Mix (Perfect Real Time)(日本Takara公司)。微阵列芯片(Sentrix Human Ref- 8_v2 Beadchips,美国Illumina公司);Human sCD14 Quantikine ELISA Kit(1 KT) DC140(美国R&D公司)试剂盒。人外周血淋巴细胞分离液(TBD,LTS1077-1,天津市灏洋生物制品科技有限责任公司);Trizol(美国Invitrogen公司);Axon GenePix激光扫描仪(美国Axon公司);KEGG、STRING蛋白分析在线数据库;GenClip 2.0(Human Gene Function And Network Analysis)基因和蛋白在线分析软件。
三、实验方法
使用EDTA抗凝管收集入组者外周静脉血样本,分离PBMC,使用Trizol法提取总RNA。将提取出的总RNA逆转录为模板DNA,并使用包含全基因组20 589个探针的微阵列芯片对21例AS患者和20名健康受试者进行检测。使用ELISA试剂盒对40例AS患者与40名健康体检者CD14分子进行检测,实验按照说明书步骤操作。
四、Microarray芯片的分析
将芯片数据进行标准化处理,使用芯片分析软件Array tool 2.0中的微阵列显著性(SAM)分析法和基因组表达比较法对芯片数据进行分析,随后挑选出SAM分析法中fold值大于1.5(AS患者组中表达下调)和小于0.66(AS患者组中表达上调)的基因,并选择基因组表达比较法中P值小于0.0001的基因。通过文献查阅、京都基因与基因组百科全书(KEGG)数据库的路径分析和使用GenClip 2.0在线蛋白质分析软件的人类基因功能和网络分析功能对CD14相关的信号通路进行分析[7]。利用STRING10在线蛋白质分析软件分析CD14的相关基因,并结合已知的CD14/TLR 4-NF-κB-TNF-α信号通路总结可能的CD14-TLR-NF-κB-TNF-α的信号通路[8-11]。
五、统计学处理
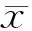
结 果
一、Microarray芯片分析结果
经模板DNA芯片数据比对后,共筛选出63个差异基因(fold<0.66或fold>1.5,P均<0.001)。AS组的荧光强度值为6 824±1 449,是健康对照组(4 027±923)的1.69倍,2组Microarray芯片中CD14荧光强度值比较差异有统计学意义(t=7.330,P<0.001)。
二、ELISA分析结果
AS组和健康对照组PBMC的CD14含量分别为2 568(965,4 490)、905(477,1 269)kU/L,AS组患者PBMC的CD14含量是对照组的2.83倍,2组PBMC的CD14含量比较差异有统计学意义(Z=2.393,P=0.017)。
三、CD14分子参与AS相关信号通路的分析结果
CD14主要参与了Toll样受体信号途径和固有免疫信号途径。STRING10在线蛋白质分析提示CD14和MYD88、TLR2、TLR6等基因相关(图1),可能的CD14-TLR-NF-κB-TNF-α信号通路见图2。
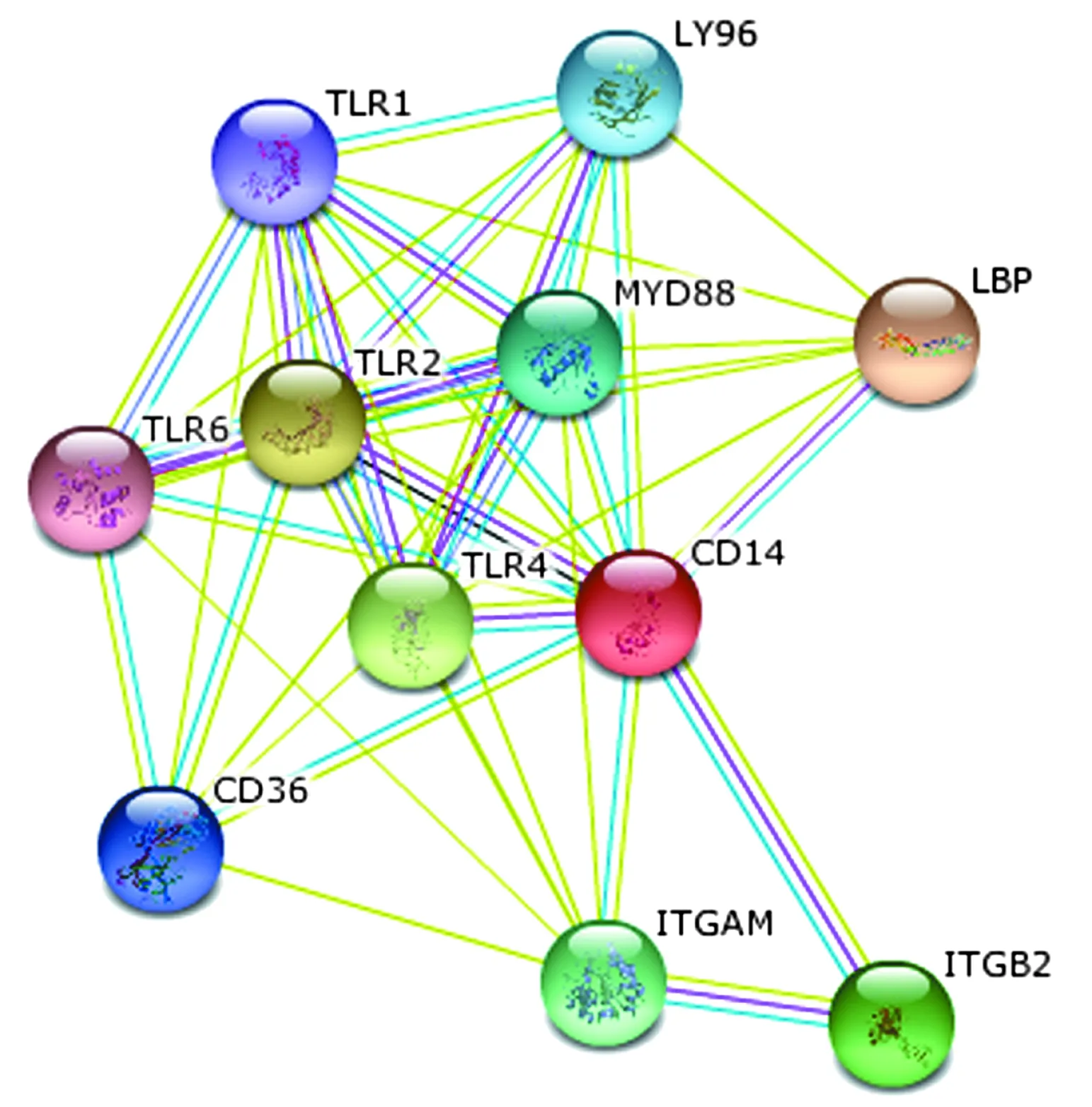
图1 与CD14相关的蛋白分子相互作用示意图
LBP:脂多糖结合蛋白;MYD88:髓系分化因子88;TLR1:Toll样受体1;TLR2:Toll样受体2;TLR4:Toll样受体4;TLR6:Toll样受体6;LY96:淋巴细胞抗原96;ITGAM:整合素αM;ITGB2:整合素β2
讨 论
AS的典型病理变化是从最初的炎症阶段进展到骨化强直阶段,最终发生关节融合,其中最重要的炎症因子是TNF-α。TNF-α作为炎症反应的启动因子,在AS的骨代谢病理过程中起着重要的作用。有研究发现,活动期和非活动期的中国AS患者血清TNF-α水平均明显高于健康人,活动期者较非活动期者升高得更明显[12-13]。目前AS具体的炎症过程仍正在研究中。其中介导固有免疫的TLR家族在AS的发病过程中起着重要作用。本课题组前期研究结果表明,TLR2与TLR4的mRNA和蛋白的表达水平在AS患者中均高于健康人,并且与AS的疾病活动度评分呈线性关系[14]。TLR2、TLR4、TLR6的激活均需要CD14分子的参与, 并继而激活NF-κB,产生TNF-α等炎症因子,导致疾病的发生[8-11]。本研究也发现,无论是在AS患者的PMBC还是在血清中,CD14水平均比健康人升高。
CD14是脂多糖受体,可介导脂多糖对单核细胞的刺激并分泌TNF、IL-1等细胞因子,介导一系列生理(增强免疫反应性)和病理(炎症)反应[15]。

图2 CD14-TLR-NF-κB-TNF-α信号通路示意图
Lipoproteins:脂蛋白类;Mannans:甘露聚糖类;Lipopolysaccharides:脂多糖;MYD88:髓系分化因子88;TRAF6:TNF受体相关因子6;IKKα:IκB激酶α;IKKβ:IκB激酶β;IKKγ:IκB激酶γ
CD14 被证实是脂多糖激活内在免疫信号转导途径进而激活 NF-κB 所必需的细胞因子,而 CD14的活化是炎症反应的共同途径[16]。在风湿性疾病如类风湿关节炎、SLE和干燥综合征的研究中,已证实无论是单核细胞表面的CD14还是可溶性CD14的水平均和疾病的发生、发展有重要关系[17-20]。CD14和AS相关性的研究目前国内较少,以 “ankylosing spondylitis and CD14”为关键词在Pubmed数据库内检索,结果有18篇文献,其中仅3篇文献的研究内容是关于AS和CD14的,而且研究也不够深入,多是关于CD14多态性和其在细胞表面表达情况的观察[21-23]。联系到CD14-TLR-NF-κB-TNF-α信号通路,结合AS的发病特点,笔者推测CD14与炎症和TNF-α的产生相关,参与了AS的发病过程。
Microarray 芯片实验所产生的数据都是高通量的,对高通量数据的分析大多是采用数据的批量导入,很少对单个基因的数据进行分析,因为所使用的分析软件及参数不同,分析结果有可能会有大同小异的结果,也可能会遗漏某些有统计学意义的基因。本研究通过高通量数据的批量分析结合单个基因的数据单独分析,结果发现了CD14在AS患者外周血PBMC的mRNA和血清中蛋白表达水平均有升高,与健康对照者比较差异有统计学意义,弥补了既往数据分析的遗漏,找到了一个有意义的生物标记分子,为日后的进一步研究提供了依据。
[1]Wang NG, Wang DC, Tan BY, Wang F, Yuan ZN. TNF-α and IL10 polymorphisms interaction increases the risk of ankylosing spondylitis in Chinese Hanpopulation.Int J Clin Exp Pathol,2015,8(11):15204-15209.
[2]Dong X, Zheng Y, Shi TY, Liu HY. Effects of tumor necrosis factor-alpha on sexual activity of male patients with ankylosing spondylitis.Clin Rheumatol,2015,34(5):915-920.
[3]Aguillón JC, Cruzat A, Cuenca J, Cuchacovich M. Tumor necrosis factor alpha genetic polymorphism as a risk factor in disease.Rev Med Chil,2002,130(9):1043-1050.
[4]Liu KG, He QH, Tan JW, Liao GJ.Expression of TNF-α, VEGF, and MMP-3 mRNAs in synovial tissues and their roles in fibroblast-mediatedosteogenesis in ankylosing spondylitis.Genet Mol Res,2015,14(2):6852-6858.
[5]王永福, 林剑, 詹宏刚. CD14/TLR-4-NF-κB信号通路参与骨关节炎发病机制的研究. 实用骨科杂志,2013,19(6): 528-530.
[6]Gu J, Wei YL, Wei JC, Huang F, Jan MS, Centola M, Frank MB, Yu D.Identification of RGS1 as a candidate biomarker for undifferentiated spondylarthritis by genome-wideexpression profiling and real-time polymerase chain reaction.Arthritis Rheum,2009,60(11):3269-3279.
[7]李秋霞, 魏秋静, 廖泽涛. 基因挖掘软件GenCLip寻找强直性脊柱炎相关基因的研究. 新医学,2011,42(5): 304-307.
[8]Brenaut P, Lefèvre L, Rau A, Laloё D, Pisoni G, Moroni P, Bevilacqua C, Martin P.Contribution of mammary epithelial cells to the immune response during early stages of a bacterialinfection to Staphylococcus aureus.Vet Res,2014,45:16.
[9]Zoccal KF, Bitencourt Cda S, Paula-Silva FW, Sorgi CA, de Castro Figueiredo Bordon K, Arantes EC, Faccioli LH.TLR2, TLR4 and CD14 recognize venom-associated molecular patterns from Tityus serrulatus to inducemacrophage-derived inflammatory mediators.PLoS One,2014,9(2):e88174.
[10]Park BS, Lee JO.Recognition of lipopolysaccharide pattern by TLR4 complexes.Exp Mol Med,2013,45:e66.
[11]Yew KH, Carpenter C, Duncan RS, Harrison CJ.Human cytomegalovirus induces TLR4 signaling components in monocytes altering TIRAP, TRAM anddownstream interferon-beta and TNF-alpha expression.PLoS One,2012,7(9):e44500.
[12]赵瑞梅, 孙永平. 强直性脊柱炎患者外周血TNF-α、IL-17、IL-23的表达及相关性分析. 实用临床医药杂志,2015, 19(9): 38-40.
[13]张璐, 邹红云, 余伍忠, 王铮, 焦敏. 强直性脊柱炎患者 TNF-α表达水平测定分析. 中国实验诊断学,2014,18(4): 589-592.
[14]毋静, 于清宏, 曲源, 廖泽涛, 魏秋静, 古洁若. TLR-2、TLR-4在强直性脊柱炎患者外周血单个核细胞中的表达及其临床意义. 新医学,2011,42(3): 166-169.
[15]Zanoni I, Granucci F.Role of CD14 in host protection against infections and in metabolism regulation.Front Cell Infect Microbiol,2013,3:32.
[16]Phan HH, Cho K, Sainz-Lyon KS, Shin S, Greenhalgh DG. CD14-dependent modulation of NF-kappaB alternative splicing in the lung after burn injury.Gene,2006,371(1):121-129.
[17]Coulthard LR, Geiler J, Mathews RJ, Church LD, Dickie LJ, Cooper DL, Wong C, Savic S, Bryer D, Buch MH, Emery P, Morgan AW, McDermott MF.Differential effects of infliximab on absolute circulating blood leucocyte counts of innate immune cells inearly and late rheumatoid arthritis patients.Clin Exp Immunol,2012,170(1):36-46.
[18]Korkosz M, Bukowska-Strakova K, Sadis S, Grodzicki T, Siedlar M.Monoclonal antibodies against macrophage colony-stimulating factor diminish the number of circulatingintermediate and nonclassical [CD14(++)CD16(+)/CD14(+)CD16(++)] monocytes in rheumatoid arthritispatient. Blood, 2012, 119(22):5329-5230.
[19]Shin MS, Kang Y, Lee N, Kim SH, Kang KS, Lazova R, Kang I. U1-small nuclear ribonucleoprotein activates the NLRP3 inflammasome in human monocytes. J Immunol, 2012, 188(10): 4769-4775.
[20]尤海燕, 芮金兵, 焦志军, 李晶, 裘影影. 类风湿关节炎患者外周血CD14+CD16+单核细胞亚群测定及意义. 江苏医药,2010,36(13): 1489-1491.
[21]Slobodin G, Kessel A, Kuznets I, Peri R, Haj T, Rosner I, Toubi E, Odeh M. CD14brightLAP+mononuclear cells in peripheral blood positively correlate with BASRI scores in patientswith ankylosing spondylitis: a pilot study.Joint Bone Spine,2012,79(6):633-634.
[22]van der Paardt M, Crusius JB, de Koning MH, Morré SA, van de Stadt RJ, Dijkmans BA, Pea AS, van der Horst-Bruinsma IE.No evidence for involvement of the Toll-like receptor 4 (TLR4) A896G and CD14-C260T polymorphisms insusceptibility to ankylosing spondylitis.Ann Rheum Dis,2005,64(2):235-238.
[23]Pointon JJ, Chapman K, Harvey D, Sims AM, Bradbury L, Laiho K, Kauppi M, Kaarela K, Tuomilehto J, Brown MA, Wordsworth BP.Toll-like receptor 4 and CD14 polymorphisms in ankylosing spondylitis: evidence of a weak association in Finns. J Rheumatol,2008,35(8):1609-1612.
Expression of CD14 in peripheral blood mononuclear cells and serum of patients with ankylosing spondylitis
ChenXi,LiQiuxia,WeiQiujing,GuJieruo.
DepartmentofRheumatism,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
Correspondingauthor,GuJieruo
ObjectiveTo measure the expression level of CD14 mRNA in the peripheral blood mononuclear cells (PBMCs) and CD14 protein in the serum of patients with ankylosing spondylitis (AS) and to perform correlation analysis of CD14 gene. MethodsThe venous blood samples were obtained from patients with active AS, PBMCs were isolated and RNA was extracted subsequently. The serum was isolated from the venous blood samples by centrifuge and restored at -20 ℃. The peripheral blood samples collected from 21 patients with active AS and 20 healthy volunteers were detected by the microarray chip. Using an enzyme-linked immunosorbent assay (ELISA), the expression of CD14 protein in the serum of 40 patients with active AS and 40 healthy volunteers was detected for verification. The signaling pathway of the related genes was analyzed to investigate the mechanism underlying the pathogenesis of AS. ResultsMicroarray chip detected that the fluorescent intensity of CD14 mRNA in the PBMC of AS patients was 6 824±1 449, significantly higher compared with 4 027±923 in the healthy controls (P<0.05). ELISA demonstrated that the median level of CD14 protein in the serum of AS patients was calculated as 2 568 kU/L, significantly higher than 905 kU/L in the healthy controls (P<0.05). CD14 mainly participated in the Toll-like receptor and inherent immune signaling pathways. STRING 10 hinted that CD14 was correlated with MYD88, TLR2 and TLR6, etc. ConclusionCD14 is probably involved with the pathogenesis of AS via participating in the signaling pathways related to immune and inflammatory response.
Ankylosing spondylitis; CD14; Serum; Peripheral blood mononuclear cell
10.3969/j.issn.0253-9802.2016.09.004
510630 广州,中山大学附属第三医院风湿免疫科
,古洁若
2016-06-05)(本文编辑:林燕薇)
