皮质醇和11βHSD mRNA在OSAHS中表达的研究
2016-10-25何丰叶进
何丰 叶进
·临床研究论著·
皮质醇和11βHSD mRNA在OSAHS中表达的研究
何丰叶进
目的探讨OSAHS患者外周血皮质醇和单个核细胞(PBMC)中11β类固醇羟化脱氢酶(11βHSD)mRNA的表达及其意义。方法采用ELISA法和实时荧光定量PCR(RT-PCR)检测30例中重度男性OSAHS患者和27名正常男性外周血中皮质醇浓度和PBMC中11βHSD mRNA的表达,分析它们与OSAHS患者临床参数间的关系。结果OSAHS组和对照组外周血皮质醇浓度无显著差异(t=-0.69,P=0.50)。OSAHS组的PBMC中11βHSD1 mRNA相对表达水平较对照组低(t=2.35,P=0.02);11βHSD2 mRNA在2组人群中均无表达。在OSAHS组中并未发现11βHSD1 mRNA的表达与外周血皮质醇、TNF-α和其他临床参数之间存在相关性。结论中重度男性OSAHS患者PBMC中11βHSD1 mRNA的表达水平较对照组低,这种改变的机制目前尚不清楚;但外周血皮质醇浓度较正常人并无明显改变。
睡眠呼吸暂停,阻塞性;单个核细胞;11β类固醇羟化脱氢酶
11β-hydroxysteroid dehydrogenase
OSAHS是一种最常见的睡眠呼吸障碍疾病,它可能引起体内的炎症状态改变[1]。糖皮质激素(GC)具有抗炎及调节免疫的作用[2]。OSAHS患者体内是否存在下丘脑-垂体-肾上腺(HPA)轴兴奋状态及内源性皮质醇浓度的改变目前仍存在争议[3-5]。组织细胞内活性皮质醇的水平受到11β类固醇羟化脱氢酶(11βHSD)的调节。11βHSD 酶主要有11βHSD1和11βHSD2两种类型,其中11βHSD1可以使无活性的皮质醇转变为有活性的皮质醇,而11βHSD2的作用则相反[6-7]。而炎症因子TNF-α可以调节11βHSD酶的表达和活性[8]。OSAHS患者外周血单个核细胞(PBMC)中是否存在11βHSD酶的改变目前不清楚。为此我们采用实时荧光定量PCR(RT-PCR)检测中重度男性OSAHS患者外周血中皮质醇、TNF-α的水平和PBMC中11βHSD mRNA的表达,并分析它们与OSAHS患者临床参数之间的关系。
对象与方法
一、研究对象
1. OSAHS组
2013年11月至2015年5月在我院睡眠中心,经夜间至少7 h多导睡眠监测确诊为中重度OSAHS的男性患者30例。入选标准参照2011年中华医学会耳鼻咽喉科学会颁布的《阻塞性睡眠呼吸暂停低通气综合征诊疗指南2011修订版》。以呼吸暂停低通气指数(AHI)<5次/小时为正常,5~15次/小时为轻度,15~30次/小时为中度,≥30次/小时为重度。入选患者年龄均大于18岁。排除标准包括:①合并可能影响GC水平的疾病,如库欣综合征、糖尿病、甲状腺功能亢进和甲状腺功能减低等内分泌疾病;②服用影响GC分泌的药物;③严重心脑血管疾病;④其他全身炎症性疾病、感染性疾病、自身免疫性疾病;⑤从事工作为昼夜颠倒性质;⑥正在或已经进行持续正压通气或其他治疗;⑦肿瘤;⑧精神神经性疾病等。OSAHS组包含中度患者12例和重度患者18例,年龄20~63岁。
2.对照组
选取体检合格的正常男性27名作为对照组,并经多导睡眠监测(PSG)检查,AHI<5次/小时,年龄18~62岁。
二、临床资料收集
1.测量空腹时身高、体质量、腰围、和颈围
BMI是由体质量/身高2(kg/m2)计算(BMI≥28 kg/m2即为肥胖患者)。测量时,被测量者立正,腰围在肚脐水平进行的测量,颈围在环甲膜上缘水平进行测量。所有测量均由同一人进行的,数据精确到cm。
2.观察指标
采用Monet32导联多导睡眠呼吸监测系统进行整夜PSG检查。检查前1天内,受试者禁止饮酒、茶和咖啡及服用安眠药等。整晚监测不少于7 h。记录AHI、夜间最低血氧饱和度(LSaO2)、SaO2等指标。血压等均在PSG结束当天清晨的8点(未进食)进行测量。
三、实验方法
1.样本收集
经所有参与者同意后,所有参与者均在行PSG结束后8点左右使用EDTA抗凝管抽取空腹静脉血4 ml,暂存于4℃冰箱中,并于2 h内完成血浆和PBMC的分离,血浆置于1.5 ml EP管中,立即放入-80℃冰箱中保存;每5×106~8×106个细胞加入1 ml Trizol(美国invitrogen公司)裂解细胞,也放入-80℃冰箱中保存。
2.血浆中皮质醇和TNF-α浓度的ELISA测定
皮质醇按照美国Cayman公司的试剂盒说明进行;TNF-α按照美国BD的试剂盒进行。之后均在酶标仪中进行读数。
3.提取总RNA及逆转录合成cDNA
按照Trizol试剂说明书提取PBMC中的总RNA。将已加入Trizol裂解细胞的EP管从-80℃冰箱中取出放置室温,然后以等体积的氯仿萃取总RNA并以异丙醇将总RNA析出后,加入DEPC水溶解。逆转录合成cDNA按照TaKaRa逆转录试剂盒说明书进行。
4. RT-PCR反应
目的基因11βHSD1 mRNA和11βHSD2 mRNA及内参基因β-actin的引物序列分别如下:11βHSD1 mRNA的上游引物序列为5′-GCTCTGTAGGTTCTCTCTGTG-3′,下游引物序列为5′- GTCTGAATTCCTGTTTGCAG-3′;11βHSD2 mRNA的上游引物序列为5′-TCGCGCGGTGCTCATCAC-3′,下游引物序列为5′-GTACGCAGCTCGATGGCACC-3′;β-actin的上游引物序列为5′-GCCGATCCACACGGAGTACTT-3′,下游引物序列为5′-TTGCCGACAGGATGCAGAA-3′。PCR反应体系20 μl,反应条件:预变性95℃ 15 s,变性95℃ 3 s,退火及延伸60℃ 1 min,共45个循环。每个样品均平行做3个复孔。应用ABI 7500 fast RT-PCR仪实时监测整个PCR进程。
5. 结果分析
PCR产物的特异性根据熔解曲线来判定,基因的相对表达量采用2-ΔCt法进行分析。
四、统计学处理
结 果
一、OSAHS组和对照组的临床资料比较
OSAHS组和对照组中AHI、BMI、颈围、腰围、LSaO2、SaO2、收缩压、舒张压比较差异均有统计学意义(P均<0.05),而2组年龄比较差异无统计学意义(P>0.05),见表1。
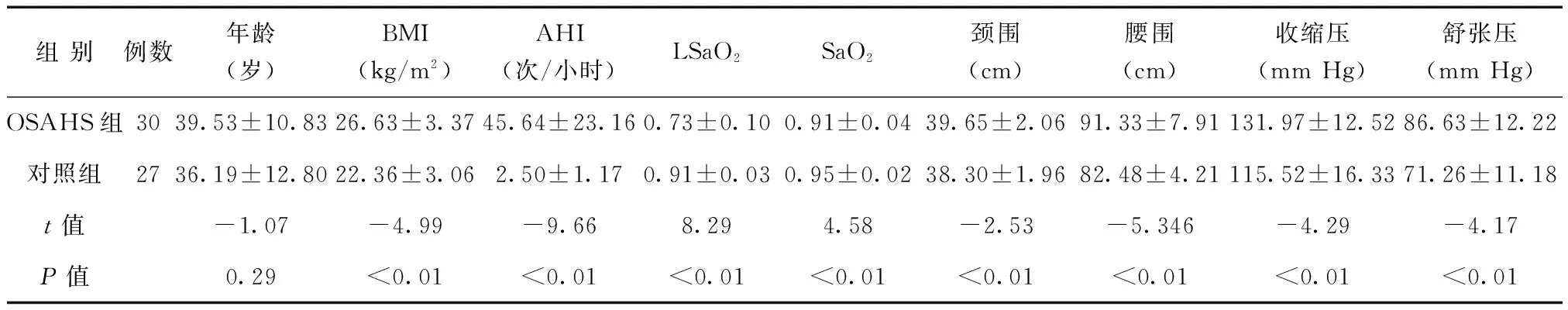
表1 OSAHS组和对照组一般资料的比较
注:1 mm Hg=0.133 kPa
二、OSAHS组和对照组皮质醇、TNF-α和11βHSD1 mRNA的比较
皮质醇在OSAHS组和对照组中分别为(142.94±30.25)ng/ml和(133.80±63.07)ng/ml,2组比较差异无统计学意义(t=-0.69,P=0.50,图1A);TNF-α在OSAHS组和对照组中分别为(4.92±0.92)ng/ml和(4.44±0.52)ng/ml,2组比较差异有统计学意义(t=-2.44,P=0.02,图1B);11βHSD1 mRNA在OSAHS组和对照组中的相对表达量分别为(1.03±0.21)×10-4和(1.33±0.15)×10-4,2组比较差异亦有统计学意义(t=2.35,P=0.02,图1C);11βHSD2 mRNA在2组中均无表达。
三、OSAHS组中11βHSD1 mRNA与皮质醇、TNF-α和临床资料之间的相关性分析结果
11βHSD1 mRNA并未发现与皮质醇和TNF-α之间存在显著相关性;11βHSD1 mRNA也并未发现与AHI、BMI、LSaO2、SaO2、收缩压、舒张压等临床参数间存在显著相关性,见表2。
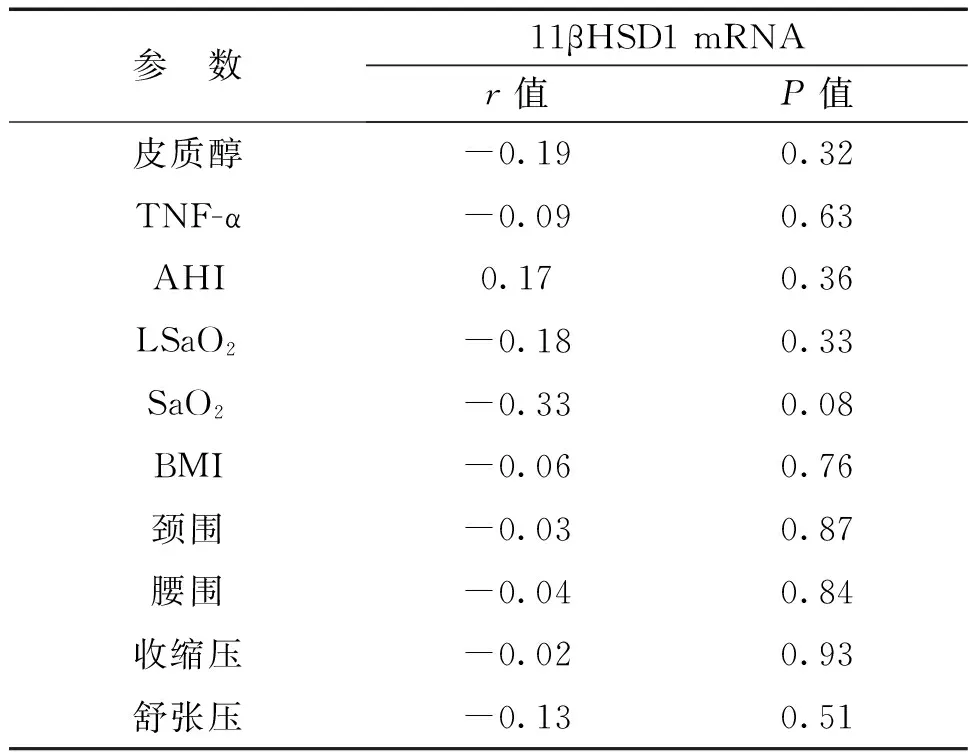
表2 11βHSD1 mRNA与各参数之间
四、OSAHS组中根据BMI分组情况的各参数间的比较
OSAHS组中有20例非肥胖伴OSAHS患者(BMI<28 kg/m2)和10例肥胖OSAHS患者(BMI≥28 kg/m2)。2组的皮质醇、TNF-α和11βHSD1 mRNA等参数比较差异无统计学意义,见表3。
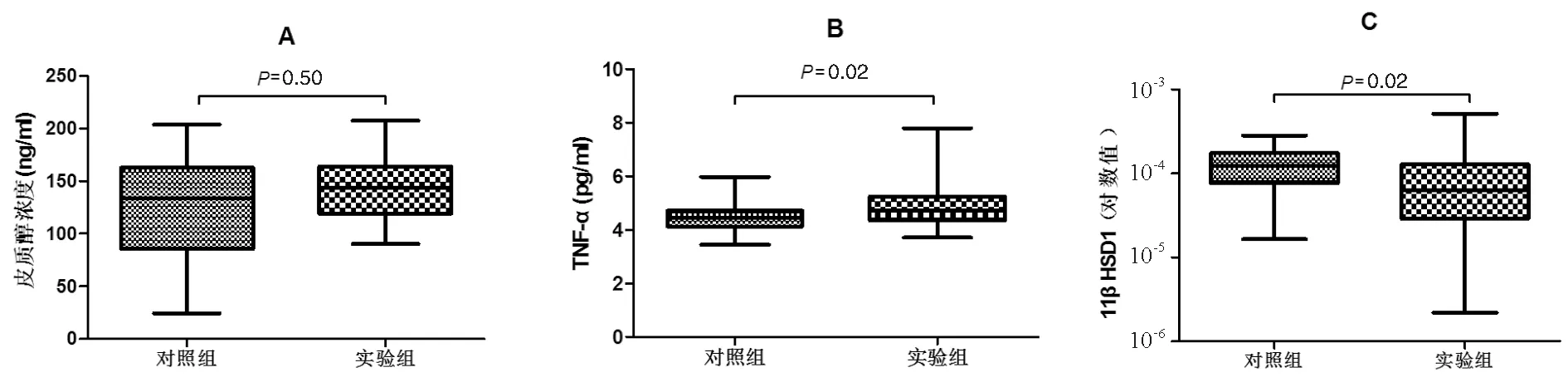
图1 OSAHS组和对照组皮质醇、TNF-α、11βHSD1 mRNA的比较
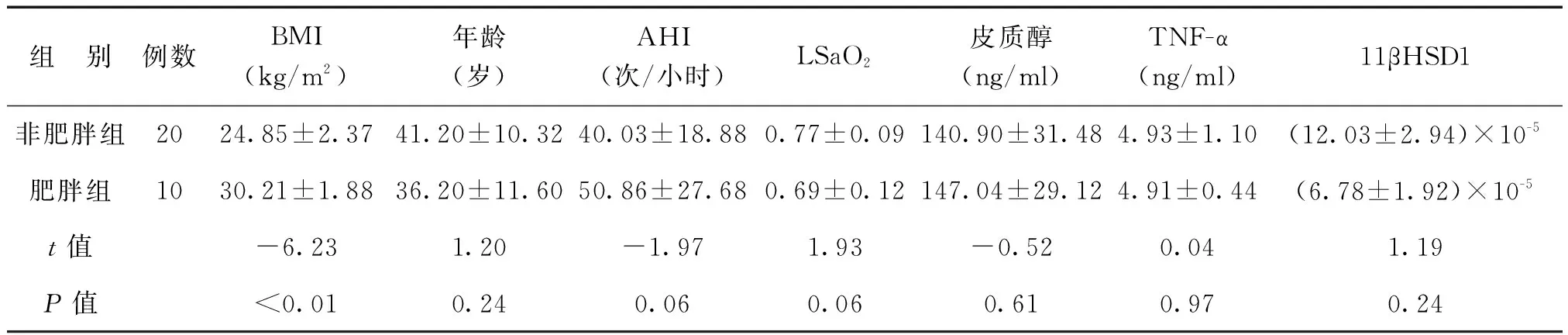
表3 OSAHS组中非肥胖组患者和肥胖患者的各参数比较
讨 论
皮质醇作为HPA轴的终末产物之一,具有昼夜生物节律,表现为在午夜12点左右水平最低、而晨起8点左右水平最高[9-10]。血浆中皮质醇浓度可作为评价HPA轴兴奋性的指标。OSAHS患者夜间睡眠片段化、微觉醒、间歇性缺氧及炎症反应等病理状态可作为应激源,并刺激机体,可能使HPA轴兴奋和外周血皮质醇浓度分泌增加。关于OSAHS患者体内是否有HPA轴兴奋性改变的研究存在争议。Vgontzas等[ 3]和Bratel等[ 11]通过测定OSAHS患者体内皮质醇的水平后认为HPA轴的兴奋性是升高的。但是仍然有一些研究结果与之相悖,如Lanfranco等[ 12]、Panaree等[ 13]和Grunstein等[14]认为OSAHS患者体内不存在皮质醇水平的升高。Karaca等[15]的结果甚至认为OSAHS患者体内的皮质醇水平是降低的。出现这样不一致的研究结果可能与标本采集时间点、方法不同,以及所选取的实验对象纳入标准不一致等因素有关。
我们通过测定外周静脉血中皮质醇的水平后发现OSAHS患者在早上8点左右皮质醇的浓度较正常组并无升高,这与Lanfranco等[12]的结论相同。但是由于人体内的皮质醇分泌是连续的,并不能排除其他时间点或(段)存在皮质醇水平升高的可能。尽管OSAHS组和对照组中BMI并不匹配,但通过BMI将OSAHS组分为OSAHS伴肥胖组和OSAHS伴非肥胖组后,发现2组皮质醇水平并无不同,这可能由于选取的实验对象并非属于变态肥胖患者,因此他们的体质量对体内皮质醇水平并无明显影响。
细胞内11βHSD酶的表达对细胞内活性皮质醇的水平有重要调节作用。免疫细胞也具有调节内源性活性皮质醇水平的能力[6]。已有文献认为在单核细胞、淋巴细胞等免疫细胞中存在11βHSD1酶的表达,但是却并无11βHSD2酶的表达;并且认为可以通过作用11βHSD1酶来影响细胞内活性皮质醇的水平进而调节免疫[6, 16-17]。D′Attilio等[16]对结核性胸膜炎患者PBMC中11βHSD1 mRNA和11βHSD2 mRNA进行检测,发现11βHSD1 mRNA有表达,而11βHSD2 mRNA无表达,认为这是由于11βHSD2主要表达于盐皮质激素靶器官中,而PBMC不属于这类组织细胞[16, 18]。我们发现11βHSD1 mRNA在2组中均有表达,表达率为100%,而11βHSD2 mRNA并没发现表达,与D′Attilio等[16]的研究结果一致。Thieringer等[17]关于单核细胞的研究中也同样发现存在11βHSD 1 mRNA的表达而无11βHSD2 mRNA的表达。另外,Zhang等[6]也在小鼠CD4+、CD8+和B220+等淋巴细胞中发现存在11βHSD1 mRNA的表达,而无11βHSD2的表达。
有研究发现超重或肥胖患者的脂肪组织或者肝脏中11βHSD1含量表达升高;并且认为在成骨细胞中,TNF-α能增强11βHSD1的活性及使其mRNA的表达增加[7-8]。尽管我们的实验对象中重度OSAHS患者较正常对照组有较高的BMI,我们的实验结果发现中重度OSAHS患者体内存在炎症因子TNF-α的升高,但在中重度OSAHS患者PBMC中11βHSD1 mRNA的表达是降低的,并且11βHSD1 mRNA的表达降低与TNF-α之间并不存在显著相关性。这或许是由于我们研究的组织细胞不一样所导致的;脂肪细胞、肝细胞和成骨细胞等都不属于免疫细胞,而PBMC由单核细胞和淋巴细胞组成,它们属于免疫细胞。PBMC中11βHSD1 mRNA表达的降低使细胞内的活性皮质醇水平降低,从而降低皮质醇对免疫细胞的调节及抗炎作用。
OSAHS的病理机制较为复杂,目前还不是非常清楚,可能是由多种机制作用的结果。我们的研究结果发现OSAHS患者PBMC中11βHSD mRNA的表达水平存在着改变,但这种改变的具体机制有待进一步研究。
[1]Steiropoulos P, Papanas N, Nena E, Antoniadou M, Serasli E, Papoti S, Hatzizisi O, Kyriazis G, Tzouvelekis A, Maltezos E, Tsara V, Bouros D. Inflammatory markers in middle-aged obese subjects: does obstructive sleep apnea syndrome play a role? Mediators Inflamm,2010, 2010: 675320.
[2]Baxter JD. Glucocorticoid hormone action. Pharmacol Ther B,1976, 2(3): 605-669.
[3]Vgontzas AN, Pejovic S, Zoumakis E, Lin HM, Bentley CM, Bixler EO, Sarrigiannidis A, Basta M, Chrousos GP. Hypothalamic-pituitary-adrenal axis activity in obese men with and without sleep apnea: effects of continuous positive airway pressure therapy. J Clin Endocrinol Metab,2007, 92(11): 4199-4207.
[4]Edwards KM, Kamat R, Tomfohr LM, Ancoli-Israel S, Dimsdale JE. Obstructive sleep apnea and neurocognitive performance: the role of cortisol. Sleep Med,2014, 15(1): 27-32.
[5]Parlapiano C, Borgia MC, Minni A, Alessandri N, Basal I, Saponara M. Cortisol circadian rhythm and 24-hour Holter arterial pressure in OSAS patients. Endocr Res, 2005, 31(4): 371-374.
[6]Zhang TY, Ding X, Daynes RA. The expression of 11 beta-hydroxysteroid dehydrogenase type I by lymphocytes provides a novel means for intracrine regulation of glucocorticoid activities. J Immunol,2005, 174(2): 879-889.
[7]Asensio C, Muzzin P, Rohner-Jeanrenaud F. Role of glucocorticoids in the physiopathology of excessive fat deposition and insulin resistance. Int J Obes Relat Metab Disord,2004, 28 Suppl 4: S45-S52.
[8]Cooper MS, Bujalska I, Rabbitt E, Walker EA, Bland R, Sheppard MC, Hewison M, Stewart PM. Modulation of 11beta-hydroxysteroid dehydrogenase isozymes by proinflammatory cytokines in osteoblasts: an autocrine switch from glucocorticoid inactivation to activation. J Bone Miner Res,2001, 16(6): 1037-1044.
[9]Chrousos GP. The hypothalamic-pituitary-adrenal axis and immune-mediated inflammation. N Engl J Med,1995, 332(20): 1351-1362.
[10]Kino T, Chrousos GP. Acetylation-mediated epigenetic regulation of glucocorticoid receptor activity: circadian rhythm-associated alterations of glucocorticoid actions in target tissues. Mol Cell Endocrinol,2011, 336(1-2): 23-30.
[11]Bratel T, Wennlund A, Carlström K. Pituitary reactivity, androgens and catecholamines in obstructive sleep apnoea. Effects of continuous positive airway pressure treatment (CPAP). Respir Med,1999, 93(1): 1-7.
[12]Lanfranco F, Gianotti L, Pivetti S, Navone F, Rossetto R, Tassone F, Gai V, Ghigo E, Maccario M. Obese patients with obstructive sleep apnoea syndrome show a peculiar alteration of the corticotroph but not of the thyrotroph and lactotroph function. Clin Endocrinol (Oxf),2004, 60(1): 41-48.
[13]Panaree B, Chantana M, Wasana S, Chairat N. Effects of obstructive sleep apnea on serum brain-derived neurotrophic factor protein, cortisol, and lipid levels. Sleep Breath,2011, 15(4): 649-656.
[14]Grunstein RR, Handelsman DJ, Lawrence SJ, Blackwell C, Caterson ID, Sullivan CE. Neuroendocrine dysfunction in sleep apnea: reversal by continuous positive airways pressure therapy. J Clin Endocrinol Metab,1989, 68(2): 352-358.
[15]Karaca Z, Ismailogullari S, Korkmaz S, Cakir I, Aksu M, Baydemir R, Tanriverdi F, Bayram F. Obstructive sleep apnoea syndrome is associated with relative hypocortisolemia and decreased hypothalamo-pituitary-adrenal axis response to 1 and 250mug ACTH and glucagon stimulation tests. Sleep Med,2013, 14(2): 160-164.
[16]D'Attilio L, Díaz A, Santucci N, Bongiovanni B, Gardeez W, Marchesini M, Bogué C, Dídoli G, Bottasso O, Bay ML. Levels of inflammatory cytokines, adrenal steroids, and mRNA for GRalpha, GRbeta and 11betaHSD1 in TB pleurisy. Tuberculosis (Edinb),2013, 93(6): 635-641.
[17]Thieringer R, Le Grand CB, Carbin L, Cai TQ, Wong B, Wright SD, Hermanowski-Vosatka A. 11 Beta-hydroxysteroid dehydrogenase type 1 is induced in human monocytes upon differentiation to macrophages. J Immunol,2001, 167(1): 30-35.
[18]Draper N, Stewart PM. 11beta-hydroxysteroid dehydrogenase and the pre-receptor regulation of corticosteroid hormone action. J Endocrinol,2005, 186(2): 251-271.
Study of expression levels of cortisol and 11βHSD mRNA in patients with obstructive sleep apnea hypopnea syndrome
HeFeng,YeJin.
DepartmentofOtolaryngology-HeadandNeckSurgery,theThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China
Correspondingauthor,YeJin,E-mail:yejin_sums@aliyun.com
ObjectiveTo investigate the expression and significance of cortisol in the peripheral blood and 11 β-hydroxy steroid dehydrogenase(11βHSD) mRNA in the peripheral blood mononuclear cell(PBMC) in patients with obstructive sleep apnea hypopnea syndrome (OSAHS). MethodsEnzyme-linked immunoadsordent assay (ELISA) and real-time fluorescent quantitative PCR (RT-PCR) were utilized to detect the concentration of cortisol in the peripheral blood and the expression level of 11βHSD mRNA in the PBMC from 30 patients with moderate and severe OSAHS and 27 healthy male individuals. The relationship between the levels of cortisol and 11Βhsd mRNA, and clinical parameters was analyzed. ResultsThe concentration of cortisol in the peripheral blood did not significantly differ between two groups (t=-0.69,P=0.50). Compared with the control group, the expression level of 11βHSD1 mRNA in the OSAHS group was significantly down-regulated (t=2.35,P=0.02). However, 11βHSD2 mRNA was not expressed in either group. In the OSAHS group, no significant correlation was observed between the expression of 11βHSD1 mRNA and clinical parameters such as peripheral blood cortisol, TNF-α, et al. ConclusionsThe expression of 11βHSD1 mRNA in the PBMC from male patients with moderate to severe OSAHS was significantly down-regulated compared with that in their healthy counterparts. The underlying mechanism remains unclear. Nevertheless, the concentration of cortisol in OSAHS patients did not significantly differ from that in the healthy controls.
Sleep apnea,Obstructive; Peripheral blood mononuclear cell;
10.3969/j.issn.0253-9802.2016.09.008
510630 广州,中山大学附属第三医院耳鼻咽喉头颈外科
,叶进,E-mail:yejin_sums@aliyun.com
2016-04-06)(本文编辑:杨江瑜)
