绿原酸对视网膜母细胞瘤细胞株HXO-RB44的生长抑制作用
2016-10-25赵静滨何熹微姚素艳刘建生郑德宇
赵静滨,何熹微,姚素艳,刘建生,郑德宇
(1. 锦州医科大学解剖学教研室,辽宁锦州 121001;2.辽宁抚顺市眼病医院,辽宁抚顺 113008;3. 辽河油田总医院眼科,辽宁盘锦 124010;4. 锦州医科大学病理生理学教研室,辽宁锦州 121001 )
◇中医药研究◇
绿原酸对视网膜母细胞瘤细胞株HXO-RB44的生长抑制作用
赵静滨1,2,何熹微3,姚素艳4,刘建生1,郑德宇1
(1. 锦州医科大学解剖学教研室,辽宁锦州121001;2.辽宁抚顺市眼病医院,辽宁抚顺113008;3. 辽河油田总医院眼科,辽宁盘锦124010;4. 锦州医科大学病理生理学教研室,辽宁锦州121001 )
目的探讨绿原酸(CHA)对体外培养人视网膜母细胞瘤(Rb)细胞株HXO-RB44的作用及机制。方法应用CCK-8体外抑制实验,筛选CHA对体外培养传6代的人Rb细胞株HXO-RB44的最佳抑癌浓度。Westernblot检测人Rb细胞株HXO-RB44中抑癌基因Rb1和P16及细胞周期蛋白(CyclinD2)和细胞周期蛋白依赖激酶(CDK4)的表达变化;ELISA检测培养基中乳酸脱氢酶(LDH)水平。结果CCK-8体外抑制实验结果显示,CHA对人Rb细胞株HXO-RB44的最佳抑癌浓度为80μmol/L。经80μmol/LCHA处理5d的HXO-RB44细胞株中,抑癌基因Rb1和P16均有少量表达,而在阳性对照组(HT1080细胞)和未处理的HXO-RB44细胞几乎没有表达。CHA处理5d的HXO-RB44细胞株的CyclinD2和CDK4的表达明显低于阳性对照组(HT1080细胞)和未处理的HXO-RB44细胞(P<0.01)。CHA处理5d的HXO-RB44的培养基中LDH的含量为(226.75±42.74)U/L,明显低于正常培养的细胞培养基(425.84±31.67)U/L(P<0.01)。结论80μmol/LCHA可能通过增加HXO-RB44抑癌基因的表达,降低细胞周期蛋白的表达及LDH水平,而抑制HXO-RB44细胞株的增殖。
绿原酸;人视网膜母细胞瘤;抑癌基因;细胞周期蛋白2(CyclinD2);细胞周期蛋白依赖激酶4(CDK4)
视网膜母细胞瘤(retinoblastoma,Rb)发生于视网膜的内核层,即双极细胞层,早期就可以发生颅内转移或其他远隔部位转移,常危及患儿生命,是婴幼儿眼病中危害性最大的一种原发性恶性肿瘤,发病率约为1/20 000[1-3]。临床上Rb的主要治疗方法有手术摘除患病眼球[4]、放射治疗[5]、激光光凝治疗[6]及冷冻治疗[7]等。因Rb具有早期转移的特点,化疗药物治疗成为手术治疗的重要补充。目前,长春新碱[8]、卡铂[9]、依托泊苷[10]、环磷酰胺等是治疗Rb的常用药物,而这些化疗药物在抑制或杀灭肿瘤细胞的同时,可诱发脱发、神经毒性、骨髓抑制等,也诱发耐药性并对中晚期患者的疗效不明显。
金银花(honeysuckleflowers)的特征活性成分为绿原酸(chlorogenicacid,CHA),具有抗氧化、抗菌、抗病毒、升高白细胞、免疫调节、抗肿瘤、降血压、降血脂等作用[11]。本课题组以往的研究发现,中药金银花的生物提取物CHA能抑制人鼻咽癌CNE-1细胞株的生长增殖[12]。利用CHA的抗肿瘤作用,如果能够抑制人Rb细胞株HXO-RB44的增殖,促进抑癌基因的表达则能为Rb的治疗提供一种辅助治疗药物。
1 材料与方法
1.1材料CHA(金银花提取物,相对分子质量为354.30,纯度>98%,湖南木兰生物科技有限公司),DMEM、胰蛋白酶(Gibco公司),胎牛血清、HEPES(Hyclone公司),单克隆抗体(P16、Rb、CDK4和cyclinD2,Sigma公司),乳酸脱氢酶(lactatedehydrogenase,LDH)检测试剂盒(武汉博士德),Westernblot检测试剂盒(北京中杉金桥生物公司)。
1.2Rb细胞株的复苏培养根据姚素艳等[12]的方法,将液氮冻存的Rb细胞株HXO-RB44(中科院上海细胞库)常规复苏并培养,细胞生长融合至80%时传代培养,取传6代细胞进行后续实验。
1.3CHA最适浓度的筛选将传代第5天的HXO-RB44细胞接种于96孔板中,每孔约100μL(2 000个/孔),分别向培养基中加入CHA,其终浓度分别为25、50、100、200、400μmol/L,并设正常培养为对照组。继续培养5d后,加入10μLCCK-8试剂,继续培养4h,待完全显色后,应用分光光度计于450nm波长检测每孔的吸光度(A),计算CHA对HXO-RB44的增殖抑制率:抑制率=(对照组A值-CHA组A值)/对照组A值×100%。通过增殖抑制率初步判定CHA对HXO-RB44的具有较好抑制作用时的浓度,再围绕这一浓度进行进一步筛选。
以3×103个细胞/孔将传6代HXO-RB44细胞接种于24孔培养板,按上述实验获得的较佳抑制浓度,向培养基内加入CHA,使其终浓度分别为60、80、100、120、140μmol/L,继续培养,加入CCK8试剂进行检测,连测7d。每组设5个平行孔。细胞增殖率(%)=(实验组平均A值/对照组平均A值)×100%,绘制细胞生长曲线,并确定最佳浓度作为后续实验。
1.4实验分组并测定各组培养基LDH水平CHA组为传6代的HXO-RB44经终浓度为80μmol/LCHA作用,常规培养5d;阳性对照组为人纤维肉瘤HT1080细胞株,阴性对照组为未经处理的HXO-RB44(0μmol/LCHA组),实验对照组为HXO-RB44经雷公藤红素作用5d。收集各处理组培养3d时的培养基,室温下1 000r/min离心10min。各组获得的上清液用酶联免疫吸附法(enzymelinkedimmunosorbentassay,ELISA)检测试剂盒测定LDH水平。
1.5Westernblot检测抑癌基因Rb、P16和细胞周期蛋白(CyclinD2)及细胞周期依赖蛋白(CDK4)的表达80μmol/L的CHA处理HXO-RB44并维持该浓度5d。阳性对照组采用人纤维肉瘤HT1080细胞株,阴性对照组为正常培养的HXO-RB44,实验对照组为雷公藤红素(100μmol/L)处理HXO-RB44细胞株5d。取各种细胞各1×106,提取细胞总蛋白质,按Bradford法测定蛋白含量后于-20 ℃冰箱中保存备用。
常规进行Westernblot检测,其中一抗工作液稀释比分别为Rb(1∶2 000)、p16(1∶1 000) 、CDK4(1∶800)和CyclinD2(1∶1 000)。扫描胶片,运用Quantity-One软件分析条带灰度值,以各样本Rb/β-actin、p16/β-actin、CDK4/β-actin和CyclinD2/β-actin比值表示各组中Rb蛋白、p16蛋白、CDK4蛋白和CyclinD2蛋白的相对表达量。
2 结 果
2.1HXO-RB44细胞的培养情况复苏后进行培养的第一代HXO-RB44生长较为缓慢,约96h左右才能达到80%融合。而在传二代后,细胞生长速度较快,细胞达到80%融合时大约需要72h,每次进行1∶3 传代。细胞呈近似圆球形或多角形(图1)。

图1传3代培养70h的HXO-RB44细胞(倒置显微镜,bar=50μm)
Fig.1The3rd-generationsubculturedHXO-RB44after70hundertheinvertedmicroscope(bar=50μm)
2.2CHA最适浓度的筛选结果CCK-8抑制实验结果显示,各浓度CHA处理组与对照组相比,细胞增殖均被不同程度抑制。随着CHA剂量从25μmol/L依次增大至100μmol/L,细胞增殖率的下降也越来越明显,呈剂量效应关系趋势,并达到最大(P<0.01);从200μmol/L开始对细胞的抑制作用增加不明显,甚至有减弱倾向(图2)。进一步实验并绘制的细胞生长曲线显示,以80μmol/LCHA的抑制作用最强,对HXO-RB44细胞株的生长抑制作用更明显(P<0.05,图3),后续实验选择80μmol/L为实验浓度。
图2CHA对HXO-RB44细胞株增殖的作用
Fig.2ThefunctionofHXO-RB44growthinducedbyCHA
与100μmol/L比较,*P<0.05,**P<0.01。

图3CHA对人Rb细胞株HXO-RB44增殖的抑制作用
Fig.3TheinhibitionofthegrowthofHXO-RB44byCHA
2.3CHA对培养基中LDH含量的影响80μmol/LCHA处理后的HXO-RB44培养基上清的LDH为(226.75±42.74)U/L,正常培养组的LDH为(425.84±31.67)U/L,差异有统计学意义(P<0.01)。与实验对照组的(275.12±38.62)U/L相比,差异无统计学意义(P=0.052)。
2.4各组细胞Rb蛋白、p16、cyclinD2和CDK4蛋白的表达变化体外培养的人Rb细胞株HXO-RB44在CHA(80μmol/L)处理5d后,抑癌基因Rb和p16的表达量与阴性对照组(0μmol/LCHA组)和阳性对照组(正常培养的HT1080)相比,均有明显升高(P<0.01),而与实验对照组(雷公藤红素处理组)相比,无明显变化(图4A、4B)。说明CHA处理后,促进了HXO-RB44中抑癌基因的表达。而实验组CyclinD2和CDK4的表达明显低于阴性对照组和阳性对照组,差异有统计学意义(P<0.01);而与实验对照组相比,无明显变化(图4C、4D)。从CKD4和CyclinD2的检测结果说明,80μmol/L的CHA对于Rb细胞株HXO-RB44的抑制作用是通过延缓G1/S关卡而实现的。
3 讨 论
Rb作为儿童期常见的恶性肿瘤,发生率仅次于葡萄膜黑色素瘤,约为2万分之一[13-14]。在美国每年有300余新增病例,而我国的人口基数庞大,新的病例数会更多。这种发病与种族、性别无关,一般为视网膜母细胞基因的双等位基因突变引起。发达国家诊断病例的早期率为95%左右,而我国仅为85%左右,并且Rb的早期诊断和适宜的治疗是挽救患者生命、甚至是保护眼睛和恢复受损视力的最关键因素[15]。局部治疗辅助以化学治疗对于肿瘤较大且出现眶内转移或远隔部位转移的Rb来说是很好的选择[16]。
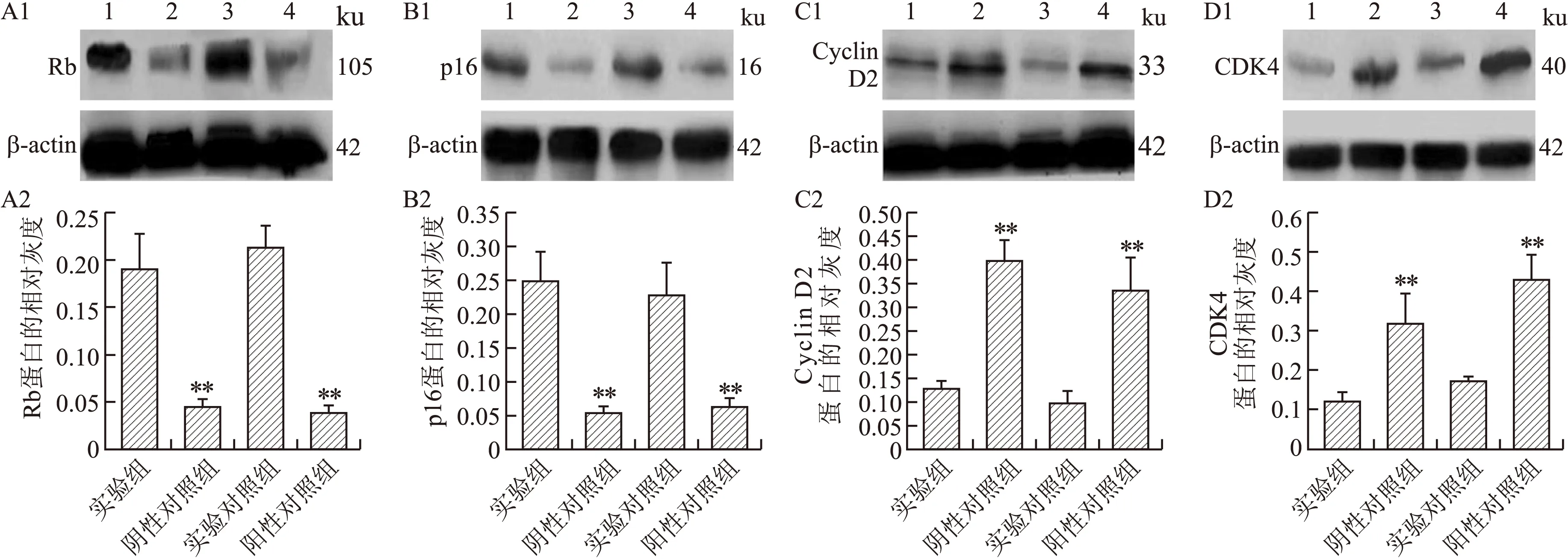
图4CHA对HXO-RB44中Rb、P16、CyclinD2和CDK4表达的影响
Fig.4EffectsofCHAontheexpressionsofRb,P16,CyclinD2andCDK4inHXO-RB44
A1、B1、C1、D1:分别为Westernblot检测结果。泳道1:80μmol/LCHA组(实验组);2:阴性对照组;3:实验对照组;4:阳性对照组。A2、B2、C2、D2:灰度扫描结果的统计学分析。与实验组相比,**P<0.01。
此外,化疗药物能减少放射治疗的放射剂量,减少二次损伤和其他一些继发性疾病。常用的化疗药物包括长春新碱、卡铂、顺铂等,但是化疗药物的副作用却不可忽视。
研究表明,肿瘤组织癌基因和抑癌基因的平衡在某些因素作用下被打破,使癌基因活化,而抑癌基因受抑制,从而引起组织的恶性变。抑癌基因p27[17]、p53[18]、p16[12,19]等在肝癌、前列腺癌、子宫癌等组织中表达较正常组织明显降低。本研究检测了人Rb细胞株HXO-RB44抑癌基因Rb1和p16的表达,结果显示HXO-RB44中抑癌基因Rb1和p16均呈现出下调趋势,说明HXO-RB44中抑癌基因的表达受到抑制,导致其蛋白质对癌基因的抑制作用减弱,部分癌基因活化。在本研究中,HXO-RB44细胞系经80μmol/LCHA作用5d后,抑癌基因Rb1和p16基因的表达较正常培养组均明显升高,提示CHA发挥其抑制人Rb细细胞株增殖的作用可能与抑癌基因表达上调相关。
细胞周期的2个阶段最为重要:G1到S和G2到M,分别称之主G1/S和G2/M关卡;这两个关卡处在复杂活跃的分子水平变化的时期,容易受环境条件的影响。其中CyclinD2、CDK4是重要的细胞周期调控因子,当CDK4与CyclinD2结合后,CDK4被激活而促进细胞周期顺利通过G1/S和G2/M期关卡,缩短细胞周期时间,促进细胞增殖。CyclinD2和CDK4的表达均上调,且其幅度与肿瘤的生长增殖的速度呈正相关[20]。本研究应用Westernblot检测结果显示HXO-RB44细胞CyclinD2和CDK4均呈高表达,说明HXO-RB44具有快速通过细胞周期的关卡的趋势而缩短细胞增殖周期,使细胞呈现出恶性变的倾向;应用80μmol/LCHA处理HXO-RB44细胞5d后,二者均较正常培养的HXO-RB44有明显下降。说明一定浓度的CHA(80μmol/L)能显著下调细胞周期蛋白的表达,从而抑制HXO-RB44细胞快速的通过G1/S期细胞关卡,达到抑制HXO-RB44细胞增殖的作用。
[1]CORSONTW,SAMUELSBC,WENZELAA,etal.Multimodalityimagingmethodsforassessingretinoblastomaorthotopicxenograftgrowthanddevelopment[J].PLoSOne, 2014, 9(6):e99036.
[2]LIUY,WANST,ZHANGP,etal.Expressionlevelsofautophagyrelatedproteinsandtheirprognosticsignificanceinretinocytomaandretinoblastoma[J].IntJOphthalmol, 2014, 7(4):594-601.
[3]YOUSSEFNS,SAIDAM.ImmunohistochemicalexpressionofCD117andvascularendothelialgrowthfactorinretinoblastoma:possibletargetsofnewtherapies[J].IntJClinExpPathol, 2014, 7(9):5725-5737.
[4]ZHAOJ,DIMARASH,MASSEYC,etal.Pre-enucleationchemotherapyforeyesseverelyaffectedbyretinoblastomamasksriskoftumorextensionandincreasesdeathfrommetastasis[J].JClinOncol, 2011, 29:845-851.
[5]BHASKERS,BAJPAIV,TURAKAA.Palliativeradiotherapyinpaediatricmalignancies[J].SingaporeMedJ, 2008, 49:998-1001.
[6]ARCHERDB,AMOAKUWM,KELLYG.Choroidoretinalneovascularisationfollowingradonseedtreatmentofretinoblastomaintwopatients[J].BrJOphthalmol, 1993, 77(2):95-99.
[7]YOOKH,SOHNWY,SUNGKW,etal.Chemoreductionfollowedbylocaltherapyandadjuvantchemotherapyforadvancedintraocularretinoblastoma:apilotstudyinasinglecenter[J].JKoreanMedSci, 2002, 17(6):817-822.
[8]SONGX,WANGH,JIAR,etal.Combinedtreatmentwithanoncolyticadenovirusandantitumoractivityofvincristineagainstretinoblastomacells[J].IntJMolSci, 2012, 13(9):10736-10749.
[9]DUNKELIJ,SHIW,SALVAGGIOK,etal.Riskfactorsforsevereneutropeniafollowingintra-arterialchemotherapyforintra-ocularretinoblastoma[J].PLoSOne, 2014, 9(10):e108692.
[10]STEPHANH,BOELOENIR,EGGERTA,etal.Photodynamictherapyinretinoblastoma:effectsofverteporfinonretinoblastomacelllines[J].InvestOphthalmolVisSci, 2008, 49(7):3158-3163.
[11]LEEWJ,ZHUBT.InhibitionofDNAmethylationbycaffeicacidandchlorogenicacid,twocommoncatechol-containingcoffeepolyphenols[J].Carcinogenesis, 2006, 27(2):269-277.
[12] 姚素艳,李全胜,郑德宇. 绿原酸对体外培养的人鼻咽癌细胞株CNE-1的作用[J]. 西安交通大学学报(医学版), 2014,35(6):837-842.
[13]LANGEM,FUJIKAWAT,KOULOVAA,etal.Arterialterritory-specificphosphorylatedretinoblastomaproteinspeciesandCDK2promotedifferencesinthevascularsmoothmusclecellresponsetomitogens[J].CellCycle, 2014, 13(2):315-323.
[14]BAKTHAVATSALAMD,WHITEMJ,HERLIHYSE,etal.Aretinoblastomaorthologueisrequiredforthesensingofachaloneindictyosteliumdiscoideum[J].EukaryotCell, 2014, 13(3):376-382.
[15]LIUSS,WANGYS,SUNYF,etal.PlasmamicroRNA-320,microRNA-let-7eandmicroRNA-21asnovelpotentialbiomarkersforthedetectionofretinoblastoma[J].BiomedRep, 2014, 2(3):424-428.
[16]MCEVOYJ,NAGAHAWATTEP,FINKELSTEIND,etal.RB1geneinactivationbychromothripsisinhumanretinoblastoma[J].Oncotarget, 2014, 5(2):438-450.
[17]PANMH,CHENWJ,LIN-SHIAUSY,etal.Tangeretininducescell-cycleG1arrestthroughinhibitingcyclin-dependentkinases2and4activitiesaswellaselevatingCdkinhibitorsp21andp27inhumancolorectalcarcinomacells[J].Carcinogenesis, 2002, 23(10):1677-1684.
[18]YULQ,GAOGL,LIUFJ,etal.Dys-psychologicalstresseffectonexpressionsofP53andNFκBp65inhumanovariancarcinomain vivo[J].ChinJCancerRes, 2012, 24(3):245-248.
[19]ANHJ,LEEYH,CHONH,etal.AlterationofPTENexpressioninendometrialcarcinomaisassociatedwithdown-regulationofcyclin-dependentkinaseinhibitor,p27[J].Histopathology, 2002, 41(5):437-445.
[20]SHIBATA-KOBAYASHIS,YAMASHITAH,OKUMAK,etal.Correlationamong16biologicalfactors[p53,p21(waf1),MIB-1 (Ki-67),p16(INK4A),cyclinD1,E-cadherin,Bcl-2,TNF-α,NF-κB,TGF-β,MMP-7,COX-2,EGFR,HER2/neu,ER,andHIF-1α]andclinicaloutcomesfollowingcurativechemoradiationtherapyin10patientswithesophagealsquamouscellcarcinoma[J].OncolLett, 2013, 5(3):903-910.
(编辑国荣)
InhibitoryeffectofchlorogenicacidonthegrowthofretinoblastomacelllineHXO-Rb44
ZHAOJing-bin1,2,HEXi-wei3,YAOSu-yan4,LIUJian-sheng1,ZHENGDe-yu1
(1.DepartmentofAnatomy,JinzhouMedicalUniversity,Jinzhou121001;2.FushunOculopathyHospital,Fushun113008; 3.DepartmentofOphthalmology,LiaoheOilFieldGeneralHospital,Panjin124010; 4.DepartmentofPathophysiology,JinzhouMedicalUniversity,Jinzhou121001,China)
ObjectiveToexplorethefunctionandmechanismofchlorogenicacid(CHA)onhumanretinoblastomacelllineHXO-RB44culturedin vitro.MethodsTheopticconcentrationofCHAwhichinhibitedthe6thgenerationsubculturedHXO-RB44wasdeterminedbyCCK8inhibitionexperimentin vitro.Theexpressionsofanti-oncogeneRb1andP16,CyclinD2andCDK4weredeterminedbyWesternblot.Theconcentrationoflactatedehydrogenase(LDH)wasdetectedbyenzyme-linked-immunosorbentserologicassay(ELISA).ResultsTheoptimalconcentrationofCHAforinhibitingHXO-RB44celllinewas80μmol/LdeterminedbyCCK8inhibitionexperiment.Theanti-oncogenesRb1andP16wereexpressedinalowquantityafterHXO-RB44wastreatedwith80μmol/LofCHAfor5days.However,therewashardlyRb1orP16expressioninthepositivegroup(HT1080)andthenormalculturedHXO-RB44 (chlorogenicacidconcentrationof0μmol/L)determinedbyWesternblotmethods.TheexpressionsofCyclinD2andcyclindependencekinase4 (CDK4)werelowerafterHXO-RB44 < class="emphasis_italic">received
80μmol/LofCHAfor5daysthanthoseintheHT1080celllineandthenormalcultureHXO-RB44 (P<0.01).TheconcentrationofLDHinmediumofHXO-RB44,treatedwith80μmol/LofCHAfor5dayswaslowerthanthatofthenormalculturedHXO-RB44 [(226.75±42.74)U/Lvs. (425.84±31.67)U/L, P<0.01].ConclusionCHAof80μmol/LmayinhibittheproliferationofHXO-RB44celllineviaincreasingtheanti-oncogeneexpressionanddecreasingtheexpressionsofCyclinD2andCDK4aswellastheconcentrationofLDHinmedium.
chlorogenicacid(CHA);humanretinoblastoma;anti-oncogene;CyclinD2;cyclindependencekinase4 (CDK4)
2015-07-18
2016-01-30
辽宁省自然科学基金资助项目(No.2013022066,2013022048),辽宁省教育厅创新团队项目(LT2012016)和一般项目(L2013335).
郑德宇.E-mail:zdy4673349@163.com
R739.7
A
10.7652/jdyxb201605024
SupportedbytheNaturalScienceFoundationofLiaoningProvince(No.2013022066and2013022048)andCreativeTeamFoundationandCommonFoundationoftheDepartmentofEducationofLiaoningProvince(No.LT2012016and2013335)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160805.0953.006.html(2016-08-05)
