ABCB1、CYP3A5和PON1基因多态性对氯吡格雷临床疗效的影响
2016-10-25雷晓辉翟娅婧贺海蓉王学良
雷晓辉,翟娅婧,贺海蓉,王学良,吕 军
(1. 西安交通大学第一附属医院临床研究中心,陕西西安 710061;2.西安交通大学第二附属医院康复医学科,陕西西安 710004;3.西安交通大学医学部公共卫生学院,陕西西安 710061)
◇临床研究◇
ABCB1、CYP3A5和PON1基因多态性对氯吡格雷临床疗效的影响
雷晓辉1,2,翟娅婧1,贺海蓉1,王学良3,吕军1
(1. 西安交通大学第一附属医院临床研究中心,陕西西安710061;2.西安交通大学第二附属医院康复医学科,陕西西安710004;3.西安交通大学医学部公共卫生学院,陕西西安710061)
目的采用Meta分析方法评价冠心病患者肠道多药耐药蛋白1基因ABCB1、细胞色素P450基因CYP3A5、对氧磷酶-1基因PON1多态性与氯吡格雷疗效的关系。方法计算机检索PubMed及中国知网数据库到2015年3月6日为止的中英文相关文献。采用Stata12.0软件进行Meta分析。结果共纳入35项研究,共32 675例患者。分别有19项和8项研究报道了ABCB1C3435T、CYP3A5A6986G与氯吡格雷疗效的关系。Meta分析结果显示,ABCB1C3435T和CYP3A5A6986G多态性对患者主要心血管不良事件(MACE)的发生没有影响(OR=1.099,95% CI 0.913,1.323,P=0.319;OR=0.844,95% CI 0.784,1.220,P=0.844)。有19项关于PON1多态性的研究,发现Q192R突变与MACE的发生风险有关(OR=0.812,95% CI 0.671,0.984,P=0.033),但敏感性分析结果显示缺乏稳定性。结论PON1Q192R突变可作为冠心病患者接受氯吡格雷治疗后不良心血管事件发生的危险因素,但需要更多高质量的研究证实。
氯吡格雷;基因多态性;ABCB1;CYP3A5;PON1;Meta分析
氯吡格雷是不可逆的P2Y12受体拮抗剂,可以减少中风、心梗及外周动脉疾病患者动脉硬化事件的发生。特别对于具有高出血风险的患者,氯吡格雷是抗血小板治疗的首选药物[1]。但是,氯吡格雷疗效存在广泛的个体差异,20%的患者服用常规剂量的氯吡格雷后,其血小板聚集能力没有得到有效抑制,残余的高血小板活性使得这部分患者仍处于支架内血栓、心肌梗死等高风险状态中[2]。
导致氯吡格雷反应差异的具体机制尚未完全明确。目前认为主要与遗传因素有关。研究发现,多种参与氯吡格雷吸收、生物活化以及与受体相互作用等过程的基因多态性对氯吡格雷活性代谢物产生影响,导致了临床疗效的不同[2-4]。
氯吡格雷是噻吩并吡啶类前药,需要通过肠道吸收和肝脏的CYP450酶代谢激活。ABCB1基因编码肠道多药耐药蛋白1参与氯吡格雷的肠道吸收。CYP3A5和对氧磷酶-1(PON1)可分别将氯吡格雷代谢为活性及非活性产物。目前,ABCB1C3435T、CYP3A5A6986G以及PON1Q192R多态性与氯吡格雷疗效的关系存在争议。因此,本研究搜集国内外相关文献进行Meta分析,以期为冠心病患者临床合理应用氯吡格雷提供参考。
1 资料与方法
1.1文献检索计算机检索PubMed和中国知网(CNKI)数据库从建库开始到2015年3月6日为止的文献报道。以“clopidogrel”、“ABCB1”、“CYP3A5”、“PON1”、“polymorphism” “氯吡格雷”、“基因多态性”及其相应的不同表达方式为检索词,运用逻辑符、通配符和范围运算符等制定检索模式。
1.2纳入与排除标准入选标准:研究类型为观察性研究及临床试验;研究对象是以氯吡格雷作为抗血小板治疗药物的冠心病患者,分析了患者ABCB1、CYP3A5及PON1基因多态性;结局指标为主要不良心血管事件(MACE),包括心血管疾病引起的死亡、心肌梗死、脑卒中、急性血管重建、支架血栓等。
排除标准:会议摘要、病例报告、评论和综述类文章;与氯吡格雷无关的研究;非患者研究;未测定ABCB1、CYP3A5及PON1基因多态性的研究;重复报道、数据描述不清的研究。
1.3遗传模型假设由于不能从所有研究中获得各个基因型的数据,因此为了最大限度的提取文献数据,我们采用显性遗传模型进行分析。
1.4文献筛选、资料提取与质量评价由2名评价者按照纳入与排除标准独立筛选文献、提取资料和评价纳入研究的方法学质量,如遇到分歧讨论解决或由第三者判定。
提取资料内容包括:研究特征(第一作者、发表时间、国家)、设计类型、患者特征(疾病类型、数量、年龄)、氯吡格雷剂量、随访时间、基因型等。
根据Cochrane手册干预性系统评价指南,采用Newcastle-OttawaScale(NOS)量表对纳入文献进行质量评价。
1.5统计分析采用Stata12.0进行数据处理。利用Q检验和P值分析各研究之间异质性,并用I2来评价异质性大小,当P≥0.1或I2≤50%时,各研究间无统计学异质性,采用固定效应模型进行合并分析;当P<0.1或I2>50%时,各研究间有统计学异质性,采用随机效应模型进行分析。OR值及95% CI作为合并效应量,检验水准α=0.05。以漏斗图及Egger’s检验分析潜在发表偏倚,必要时进行敏感性分析。
2 结 果
2.1文献筛选情况根据检索策略,共检索到中文文献60篇,英文文献97篇,通过阅读文献题目及摘要,排除综述、会议摘要、健康志愿者研究、动物实验以及与氯吡格雷无关的文献后,初步纳入文献57篇,进一步阅读全文,排除不包含本次结局指标MACE、无法提取完整数据及人群重复的文献后,最终纳入35篇文献[3-37]。
2.2纳入研究的基本特征及质量评价文献纳入的研究经过整合及区分后,共有35项,包括来自12个国家或地区的32 675例患者。主要为前瞻性队列研究,还包括四项RCT亚组研究[9,11,22]。通过NOS量表对研究质量进行评分,结果为5~8分,说明纳入研究整体质量水平较高(表1)。
2.3Meta分析结果
2.3.1ABCB1C3435T多态性与MACE的关系共有19项研究[4,6-7,9-11,16,21,24-25, 27-31,33-34,36-37]报道了ABCB1C3435T基因型分布情况,异质性检验P=0.005,I2=51.9%,采用随机效应模型进行分析,结果显示MACE发生率在CT+TT组和CC组患者间没有统计学差异(OR=1.099,95% CI 0.913,1.323,P=0.319,图1)。
2.3.2CYP3A5A6986G多态性与MACE的关系共有8项研究[4-6,8,14,18,26,36]报道了CYP3A5A6986G基因型分布情况,异质性检验P=0.128,I2=37.7%,采用固定效应模型进行分析,结果显示MACE发生率在GA+AA组和GG组患者间没有统计学差异(OR=0.844,95% CI 0.784,1.220,P=0.844,图2)。
2.3.3PON1Q192R多态性与MACE的关系共有19项研究[3,4,12-13,15,17,19-23, 25,28, 30,32,34-35,37]报道了PON1Q192R基因型分布情况,异质性检验P=0.001,I2=59.1%,采用随机效应模型进行分析,结果显示QQ组患者的MACE发生率显著低于QR+RR组(OR=0.812,95% CI 0.671,0.984,P=0.033,图3)。即PON1Q192R突变是造成服用氯吡格雷的患者发生不良心血管事件的风险因素。
1 纳入文献基本特征及质量评价
Tab.1Thebasiccharacteristicsandepidemiologicalqualityassessmentofeligiblestudies

纳入研究设计类型患者特征氯吡格雷剂量(mg/d)随访时间(月)测定基因型NOS评分SUH2006韩国[5]前瞻性队列研究血管成形术患者,n=348,平均年龄61.6岁300®756CYP3A5A6986G7SIMON2009法国[6]回顾性队列研究急性心梗患者,n=2208,平均年龄66.2岁300®7512ABCB1C3435TCYP3A5A6986G7SPIEWAK2009波兰[7]前瞻性队列研究急性冠脉综合征患者,n=98,平均年龄60.3300或600®7520ABCB1C3435T6洪丹丹2009中国[8]回顾性病例对照研究PCI术治疗患者患者,n=103,平均年龄63.9岁300®757CYP3A5A6986G5MEGA2010美国等多个国家[9]RCT亚组研究急性冠脉综合征患者,n=1471,平均年龄60.2岁300®7515ABCB1C3435T8TIROCH2010德国[10]前瞻性队列研究急性心梗患者,n=928,平均年龄64.8岁600®7512ABCB1C3435T7WALLENTIN2010美国等多个国家[11]RCT亚组研究急性冠脉综合征患者,n=4909,平均年龄62.5岁300或600®759.4ABCB1C3435T7BOUMAN2011荷兰等多个国家[12]前瞻性队列研究急性冠脉综合征患者,n=1982,平均年龄62.2岁600®7512PON1Q192R7CAMPO2011意大利[13]前瞻性队列研究缺血性心脏病,n=300,平均年龄66岁600®7512CYP3A5A6986G7CAMPO2011意大利[14]前瞻性队列研究缺血性心脏病,n=300,平均年龄66岁600®7512PON1Q192R7HULOT2011法国[15]前瞻性队列研究心梗患者,n=371,平均年龄40.3岁756PON1Q192R7JRONG2011韩国[16]前瞻性队列研究急性心梗患者,n=266,平均年龄63.0岁600®7521ABCB1C3435T7LEWIS2011美国[17]前瞻性队列研究PCI术治疗患者,n=227,平均年龄64.3岁300或600®7512PON1Q192R7SAAD2011埃及[18]前瞻性队列研究PCI术治疗患者,n=45,平均年龄52岁300®756CYP3A5A6986G7SIMON2011法国[19]前瞻性队列研究急性冠脉综合征患者,n=2210,平均年龄66岁300®7512PON1Q192R7TRENK2011德国[20]前瞻性队列研究PCI术治疗患者,n=760,平均年龄66.3岁60012PON1Q192R6DELANEY2012美国[21]回顾性病例对照研究心梗患者,n=693,平均年龄68.4岁300®7524ABCB1C3435TPON1Q192R6PARE2012英国[22]RCT亚组研究急性冠脉综合征患者,n=2534,平均年龄63.8759.3PON1Q192R7PARE2012英国[22]RCT亚组研究房颤患者,n=562,平均年龄70.8岁7541.6PON1Q192R7PARK2012韩国[23]前瞻性队列研究PCI术治疗患者,n=1336,平均年龄64岁300或60012PON1Q192R7WU2012中国[24]前瞻性队列研究急性冠脉综合征患者,n=447,平均年龄63岁300®756ABCB1C3435T6丁肖梁2012中国[25]回顾性病例对照研究PCI术治疗患者,n=106,平均年龄64.4岁300或600®7512ABCB1C3435TPON1Q192R6孙彬2012中国[26]回顾性队列研究PCI术治疗患者,n=118,平均年龄58.2岁300®756CYP3A5A6986G5吴鸿谊2012中国[27]前瞻性队列研究急性冠脉综合征患者,n=447,平均年龄63岁300®756ABCB1C3435T7PARK2013韩国[3]前瞻性队列研究PCI术治疗患者,n=1264,平均年龄64岁300或600®75—ABCB1C3435T7TANG2013中国[28]前瞻性队列研究PCI术治疗患者,n=670,平均年龄58.9岁300®7512ABCB1C3435TPON1Q192R7VERCHUREN2013新西兰[29]前瞻性队列研究PCI术治疗患者,n=1327,平均年龄60.8岁600®7512ABCB1C3435TPON1Q192R7VIVIANI2013意大利[4]前瞻性队列研究PCI术治疗患者,n=1432,平均年龄64.9岁600®7512ABCB1C3435TCYP3A5A6986GPON1Q192R7陈涛2013中国[30]回顾性队列研究急性冠脉综合征患者,n=2569,平均年龄58岁300®75—ABCB1C3435TPON1Q192R5周超飞2013中国[31]回顾性队列研究冠心病并择期行PCI治疗的患者,n=300,平均年龄59.8岁600®7512ABCB1C3435T6MARTINEZ2014西班牙[32]前瞻性队列研究冠心病患者,n=263,平均年龄59.7岁30012PON1Q192R7ZHANG2014中国[33]前瞻性队列研究PCI术治疗患者,n=452,平均年龄59岁300®7512ABCB1C3435T6白莹2014中国[34]前瞻性队列研究急性冠脉综合征患者,n=299,平均年龄59.1岁300®751ABCB1C3435TPON1Q192R6陈艳2014中国[35]前瞻性队列研究PCI术治疗患者,n=115,平均年龄60.6岁300®757PON1Q192R5唐晓芳2014中国[36]前瞻性队列研究冠心病患者,n=1408,平均年龄58岁300®7512ABCB1C3435TCYP3A5A6986G6王辰2014中国[37]前瞻性队列研究急性冠脉综合征患者,n=107,平均年龄63岁300®753ABCB1C3435TPON1Q192R5
PCI:经皮冠状动脉介入治疗;RCT:随机对照试验;“—”为文献中无详细资料。
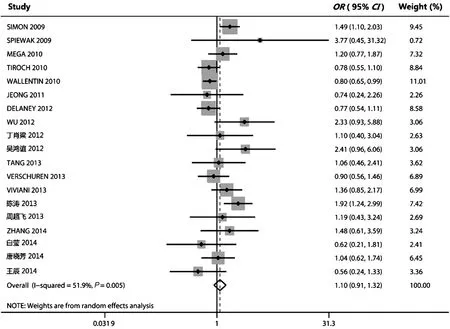
图1ABCB1C3435T基因突变与主要不良心血管事件的森林图
Fig.1ForestplotoftheassociationbetweenABCB1C3435Tmutationandmajoradversecardiovascularevents

图2CYP3A5A6986G基因突变与主要不良心血管事件的森林图
Fig.2ForestplotoftheassociationbetweenCYP3A5A6986Gmutationandmajoradversecardiovascularevents
2.4发表偏倚分析结果发表偏倚的漏斗图显示存在一定程度的不对称性,但是Egger’s检验提示不存在发表偏倚(图4)。
2.5敏感性分析结果ABCB1C3435T研究的敏感性分析图表明陈涛[30]的研究相对于其他研究敏感性较大,将其剔除后结果依然不存在显著性差异,说明本次分析结果稳定(图5)。CYP3A5A6986G研究的敏感性分析图表明SIMON等[6]、VIVIANI等[4]和唐晓芳等[36]的研究敏感性较大,将其依次剔除后结果依然不存在显著性差异,说明分析结果稳定(图6)。PON1Q192R研究的敏感性分析图表明BOUMAN等[12]和PARE等[22]的研究敏感性较大。将BOUMAN[12]剔除后,差异不存在显著性意义,说明本次分析结果缺乏稳定性(图7)。因此,PON1Q192R与氯吡格雷服用者MACE发生率的关系还需要更多的研究来验证。

图3PON1Q192R基因突变与主要不良心血管事件的森林图
Fig.3ForestplotoftheassociationbetweenPON1Q192Rmutationandmajoradversecardiovascularevents

图4各基因多态性对主要心血管不良事件发生率影响的漏斗图Fig.4Funnelplotoftheinfluenceofdifferentgenepolymorphismsontheriskofmajoradversecardiovascularevents
A:ABCB1C3435T组;B:CYP3A5A6986G;C:PON1Q192R。
3 讨 论
本次Meta分析发现,PON1基因多态性Q192R可影响氯吡格雷的临床疗效,QR+RR组患者与QQ携带者相比,发生不良心血管事件的风险更大。ABCB1C3435T和CYP3A5A6986G多态性则与氯吡格雷疗效无关。
氯吡格雷是临床上常用的抗血小板药物,但是氯吡格雷反应存在广泛的个体差异。目前,有多项研究证实氯吡格雷反应差异与CYP2C19多态性有关。对此2010年FDA发布了黑框警告,认为对于CYP2C19慢代谢者应当调整氯吡格雷剂量或采用其他药物治疗。但是,CYP2C19基因多态性只能解释氯吡格雷反应差异的一部分,还应考虑其他遗传因素[38]。2006年TAUBERT等[39]首次描述了ABCB1基因(C3435T)中单核苷酸多态性对氯吡格雷疗效的影响。但之后的研究结果存在争议[6-7,9]。PON1可将氯吡格雷代谢为没有活性的产物。BHATTACHARYYA等[40]认为Q192R突变可引起MACE的增加,但是之后的研究均没有发现这一结果[15,17]。此外,还有许多其他基因多态性对氯吡格雷疗效影响的研究[4,29]。因此,很有必要在这些临床研究的基础上对相关基因多态性与氯吡格雷疗效的关系做进一步的分析。

图5ABCB1C3435T对主要心血管不良事件发生率影响的敏感性分析
Fig.5SensitivityanalysischartoftheassociationbetweenABCB1C3435Tandmajoradversecardiovascularevents

图6CYP3A5A6986G对主要心血管不良事件发生率影响的敏感性分析Fig.6SensitivityanalysischartoftheassociationbetweenCYP3A5A6986Gandmajoradversecardiovascularevents

图7PON1Q192R对主要心血管不良事件发生率影响的敏感性分析
Fig.7SensitivityanalysischartoftheassociationbetweenPON1Q192Randmajoradversecardiovascularevents
本研究首次针对CYP3A5A6986G多态性与氯吡格雷疗效的联系进行了Meta分析,没有发现其相关性。ABCB1C3435T与氯吡格雷疗效的结果与之前Meta分析[41-43]一致,也没有发现它与MACE的发生有关,但是本次Meta分析新纳入了2012年以后的研究以及中文相关研究,并且对文献质量进行了评分。PON1Q192R的研究结果与已发表的Meta分析[44-45]不同,MACE发生率在QQ组和QR+RR组之间有显著性差异,QR或RR基因型患者发生MACE的风险较大,这可能是研究人群的差异导致的。
综上所述,本研究提示对于接受氯吡格雷治疗的冠心病患者而言,PON1Q192R多态性可预测主要不良心血管事件的发生,但这一结果缺乏稳定性,需要更多高质量的研究来进一步证实。
[1]SNOEPJD,HOVENSMM,EIKENBOOMJC,etal.Clopidogrelnonresponsivenessinpatientsundergoingpercutaneouscoronaryinterventionwithstenting:asystematicreviewandmeta-analysis[J].AmHeartJ, 2007, 154(2):221-231.
[2]SIMONT,VERSTUYFTC,MARY-KRAUSEM,etal.Geneticdeterminantsofresponsetoclopidogrelandcardiovascularevents[J].NEnglJMed, 2009, 360(4):363-375.
[3]PARKJJ,PARKKW,KANGJ,etal.GeneticdeterminantsofclopidogrelresponsivenessinKoreanstreatedwithdrug-elutingstents[J].IntJCardiol, 2013, 163(1):79-86.
[4]VIVIANIANSELMIC,BRIGUORIC,RONCARATIR,etal.Routineassessmentofon-clopidogrelplateletreactivityandgenepolymorphismsinpredictingclinicaloutcomefollowingdrug-elutingstentimplantationinpatientswithstablecoronaryarterydisease[J].JACCCardiovascInterv, 2013, 6(11):1166-1175.
[5]SUHJW,KOOBK,ZHANGSY,etal.IncreasedriskofatherothromboticeventsassociatedwithcytochromeP450 3A5polymorphisminpatientstakingclopidogrel[J].CMAJ, 2006, 174(12):1715-1722.
[6]SIMONT,VERSTUYFTC,MARY-KRAUSEM,etal.Geneticdeterminantsofresponsetoclopidogrelandcardiovascularevents[J].NEnglJMed, 2009, 360(4):363-375.
[7]SPIEWAKM,MALEKLA,KOSTRZEWAG,etal.InfluenceofC3435Tmultidrugresistancegene-1 (MDR-1)polymorphismonplateletreactivityandprognosisinpatientswithacutecoronarysyndromes[J].KardiolPol, 2009, 67(8):827-834.
[8] 洪丹丹. 细胞色素P450酶(CYP2C19与CYP3A5)基因多态性对氯吡格雷治疗冠状动脉粥样硬化性心脏病患者疗效的影响[D]. 福建医科大学硕士学位论文, 2009.
[9]MEGAJL,CLOSESL,WIVIOTTSD,etal.GeneticvariantsinABCB1andCYP2C19andcardiovascularoutcomesaftertreatmentwithclopidogrelandprasugrelintheTRITON-TIMI38trial:Apharmacogeneticanalysis[J].Lancet, 2010, 376(9749):1312-1319.
[10]TIROCHKA,SIBBINGD,KOCHW,etal.ProtectiveeffectoftheCYP2C19*17polymorphismwithincreasedactivationofclopidogreloncardiovascularevents[J].AmHeartJ, 2010, 160(3):506-512.
[11]WALLENTINL,JAMESS,STOREYRF,etal.EffectofCYP2C19andABCB1singlenucleotidepolymorphismsonoutcomesoftreatmentwithticagrelorversusclopidogrelforacutecoronarysyndromes:AgeneticsubstudyofthePLATOtrial[J].Lancet, 2010, 376(9749):1320-1328.
[12]BOUMANHJ,SCHOMIGE,VANWERKUMJW,etal.Paraoxonase-1isamajordeterminantofclopidogrelefficacy[J].NatMed, 2011, 17(1):110-116.
[13]CAMPOG,FERRARESIP,MARCHESINIJ,etal.RelationshipbetweenparaoxonaseQ192Rgenepolymorphismandon-clopidogrelplateletreactivityovertimeinpatientstreatedwithpercutaneouscoronaryintervention[J].JThrombHaemost, 2011, 9(10):2106-2108.
[14]CAMPOG,PARRINELLOG,FERRARESIP,etal.Prospectiveevaluationofon-clopidogrelplateletreactivityovertimeinpatientstreatedwithpercutaneouscoronaryintervention:Relationshipwithgenepolymorphismsandclinicaloutcome[J].JACC, 2011, 57(25):2474-2483.
[15]HULOTJS,COLLETJP,CAYLAG,etal.CYP2C19butnotPON1geneticvariantsinfluenceclopidogrelpharmacokinetics,pharmacodynamics,andclinicalefficacyinpost-myocardialinfarctionpatients[J].CircCardiovascInterv, 2011, 4(5):422-428.
[16]JEONGYH,TANTRYUS,KIMIS,etal.EffectofCYP2C19*2and*23loss-of-functionallelesonplateletreactivityandadverseclinicaleventsinEastAsianacutemyocardialinfarctionsurvivorstreatedwithclopidogrelandaspirin[J].Circ-CardiovascInterv, 2011, 4(6):585-594.
[17]LEWISJP,FISCHAS,RYANK,etal.Paraoxonase1 (PON1)genevariantsarenotassociatedwithclopidogrelresponse[J].ClinPharmacolTher, 2011, 90(4):568-574.
[18]SAADAA,ABDELSALAMAM,KAMALGM,etal.EffectofcytochromeP450 3A5polymorphismonplateletreactivityaftertreatmentwithclopidogrelinpatientsscheduledforpercutaneouscoronaryintervention[J].EgyptHeartJ, 2011, 63(1):23-31.
[19]SIMONT,STEGPG,BECQUEMONTL,etal.Effectofparaoxonase-1polymorphismonclinicaloutcomesinpatientstreatedwithclopidogrelafteranacutemyocardialinfarction[J].ClinPharmacolTher, 2011, 90(4):561-567.
[20]TRENKD,HOCHHOLZERW,FROMMMF,etal.Paraoxonase-1Q192Rpolymorphismandantiplateleteffectsofclopidogrelinpatientsundergoingelectivecoronarystentplacement[J].CircCardiovascGenet, 2011, 4(4):429-436.
[21]DELANEYJT,RAMIREZAH,BOWTONE,etal.PredictingclopidogrelresponseusingDNAsampleslinkedtoanelectronichealthrecord[J].ClinPharmacolTher, 2012, 91(2):257-263.
[22]PAREG,ROSSS,MEHTASR,etal.EffectofPON1Q192Rgeneticpolymorphismonclopidogrelefficacyandcardiovasculareventsintheclopidogrelintheunstableanginatopreventrecurrenteventstrialandtheatrialfibrillationclopidogreltrialwithirbesartanforpreventionofvascularevents[J].CircCardiovascGenet, 2012, 5(2):250-256.
[23]PARKJJ,PARKKW,KANGJ,etal.Paraoxonase1genepolymorphismdoesnotaffectclopidogrelresponsevariabilitybutisassociatedwithclinicaloutcomeafterpercutaneouscoronaryintervention[J].JACC, 2012, 60B213.
[24]WUH,QIANJ,XUJ,etal.EffectsofCYP2C19variantallelesonpostclopidogrelplateletreactivityandclinicaloutcomesinanactualclinicalsettinginChina[J].PharmacogenetGenom, 2012, 22(12):887-890.
[25] 丁肖梁. 冠心病患者氯吡格雷抗血小板活性个体差异影响因素的研究[D]. 苏州大学硕士论文, 2012.
[26] 孙彬. 氯吡格雷治疗患者的血小板功能差异与遗传多态性研究[D]. 中国人民解放军医学院硕士论文, 2012.
[27] 吴鸿谊. 急性冠脉综合征患者的血小板功能评价及氯吡格雷疗效的基因学研究[D]. 复旦大学博士论文, 2012.
[28]TANGXF,WANGJ,ZHANGJH,etal.EffectoftheCYP2C19 2and3genotypes,ABCB1C3435TandPON1Q192RallelesonthepharmacodynamicsandadverseclinicaleventsofclopidogrelinChinesepeopleafterpercutaneouscoronaryintervention[J].EurJClinPharmacol, 2013, 69(5):1103-1112.
[29]VERSCHURENJJ,BODENH,WESSELSJA,etal.ValueofplateletpharmacogeneticsincommonclinicalpracticeofpatientswithST-segmentelevationmyocardialinfarction[J].IntJCardiol, 2013, 167(6):2882-2888.
[30] 陈涛. 中国ACS患者氯吡格雷代谢相关基因多态性分布及其与近期临床终点的关联[D]. 北京协和医学院博士学位论文, 2013.
[31] 周超飞. 基因多态性和氯吡格雷血药浓度对个体反应性差异和临床事件的影响研究[D]. 中国人民解放军医学院硕士学位论文, 2013.
[32]MARTINEZ-QUINTANAE,MEDINA-GILJM,RODRIGUEZ-GONZALEZF,etal.Positiveclinicalresponsetoclopidogrelisindependentofparaoxonase1Q192RandCYP2C19geneticvariants[J].JClinPharmacol, 2014, 54(8):843-849.
[33]ZHANGJH,TANGXF,ZHANGY,etal.RelationshipbetweenABCB1polymorphisms,thromboelastographyandriskofbleedingeventsinclopidogrel-treatedpatientswithST-elevationmyocardialinfarction[J].ThrombRes, 2014, 134(5):970-975.
[34] 白莹. 急性冠脉综合征患者氯吡格雷代谢基因多态性与抗血小板功能的注册研究[D]. 北京协和医学院博士学位论文, 2014.
[35] 陈艳. 湘南地区汉族人群中PON1Q192R基因多态性与氯吡格雷抵抗的相关性[D]. 南华大学硕士学位论文, 2014.
[36] 唐晓芳. 冠心病患者氯吡格雷低反应性药物基因组学及药物效应动力学的研究[D]. 北京协和医学院博士学位论文, 2014.
[37] 王辰.ACS患者氯吡格雷治疗敏感性评价及与基因多态性研究[D]. 皖南医学院硕士学位论文, 2014.
[38]DALYPL,BECKERRC.Pharmacogeneticsofantiplatelettherapy[J].CurrAtherosclerRep, 2014, 16(5):411.
[39]TAUBERTD,VONBECKERATHN,GRIMBERGG,etal.ImpactofP-glycoproteinonclopidogrelabsorption[J].ClinPharmacolTher, 2006, 80(5):486-501.
[40]BHATTACHARYYAT,NICHOLLSSJ,TOPOLEJ,etal.Relationshipofparaoxonase1 (PON1)genepolymorphismsandfunctionalactivitywithsystemicoxidativestressandcardiovascularrisk[J].JAMA, 2008, 299(11):1265-1276.
[41]LUOM,LIJ,XUX,etal.ABCB1C3435Tpolymorphismandriskofadverseclinicaleventsinclopidogreltreatedpatients:ameta-analysis[J].ThrombRes, 2012, 129(6):754-759.
[42]SINGHM,SHAHT,ADIGOPULAS,etal.CYP2C19*2/ABCB1-C3435Tpolymorphismandriskofcardiovasculareventsincoronaryarterydiseasepatientsonclopidogrel:isclinicaltestinghelpful?[J].IndianHeartJ, 2012, 64(4):341-352.
[43]SUJ,XUJ,LIX,etal.ABCB1C3435Tpolymorphismandresponsetoclopidogreltreatmentincoronaryarterydisease(CAD)patients:ameta-analysis[J].PLoSOne, 2012, 7(10):e46366.
[44]RENYJL,COMBESCUREC,DAALIY,etal.Influenceoftheparaoxonase-1Q192Rgeneticvariantonclopidogrelresponsivenessandrecurrentcardiovascularevents:asystematicreviewandmeta-analysis[J].JThrombHaemost, 2012, 10(7):1242-1251.
[45]LIP,BUSH,LUXT,etal.RelationshipsbetweenPON1Q192Rpolymorphismandclinicaloutcomeofantiplatelettreatmentafterpercutaneouscoronaryintervention:ameta-analysis[J].MolBiolRep, 2014, 41(9):6263-6273.
(编辑韩维栋)
EffectofthepolymorphismsofABCB1,CYP3A5andPON1genesontheclinicalefficacyofclopidogrel
LEIXiao-hui1,2,ZHAIYa-jing1,HEHai-rong1,WANGXue-liang3,LÜJun1
(1.ClinicalResearchCenter,theFirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061; 2.DepartmentofRehabilitation,theSecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004; 3.SchoolofPublicHealth,Xi’anJiaotongUniversityHealthScienceCenter,Xi’an710061,China)
ObjectiveToinvestigatetherelationshipofthepolymorphismsofABCB1,CYP3A5andPON1withclopidogrelresponseinpatientswithcoronaryheartdisease.MethodsWesearchedthePubMedandCNKIdatabasesforrelatedstudiespublisheduptoMarch6, 2015.Stata12.0softwarewasemployedtoperformtheMeta-analysis.ResultsAtotalof35studiesinvolving32 675patientswereanalyzed.NineteenandeightresearchesreportedthecorrelationofABCB1C3435TandCYP3A5A6986Gwithclopidogrelresponse,respectively,butnocorrelationwasfound(OR=1.099, 95% CI 0.913, 1.323, P=0.319; OR=0.844, 95% CI 0.784, 1.220, P=0.844).NineteenstudiesexaminedPON1polymorphisms,andQ192Rmutationwasfoundtoberelatedtotheriskofmajoradversecardiovascularevents(OR=0.812, 95% CI 0.671, 0.984, P=0.033).However,theresultofsensitivityanalysisshowedlackofrobustness.ConclusionPON1Q192RmutationisariskfactorforMACEinpatientstreatedwithclopidogrel.Futurelarge-scalestudiesthatincludelong-termfollow-upsarestillneeded.
clopidogrel;genepolymorphism;ABCB1;CYP3A5;PON1; Meta-analysis
2015-12-28
2016-03-07
吕军.E-mail:lujun2006@mail.xjtu.edu.cn
R574.62
A
10.7652/jdyxb201605023
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160805.0957.008.html(2016-08-05)
