宫颈上皮内瘤变及微浸润癌患者人乳头瘤病毒基因亚型分析
2016-10-25张忠明崔绪琴张冠军赵延红刘润润高宝霞
张忠明,崔绪琴,李 娜,张冠军,赵延红,刘润润,谢 琪,高宝霞
(西安交通大学第一附属医院:1.妇产科;2.病理科;3.网络信息部,陕西西安 710061)
◇临床研究◇
宫颈上皮内瘤变及微浸润癌患者人乳头瘤病毒基因亚型分析
张忠明1,崔绪琴1,李娜1,张冠军2,赵延红3,刘润润1,谢琪1,高宝霞1
(西安交通大学第一附属医院:1.妇产科;2.病理科;3.网络信息部,陕西西安710061)
目的明确陕西省宫颈上皮内瘤变(CIN)及微浸润癌(MICC)病例宫颈人乳头瘤病毒(HPV)感染的基因亚型分布特征。方法选取2009年10月至2015年10月在西安交通大学第一附属医院病理确诊的1 571例陕西地区宫颈病变患者,其中CIN1、CIN2、CIN3、原位癌(CIS)、MICC分别为252、505、539、143、132例,采用凯普医用核酸分子快速导流杂交基因芯片技术检测宫颈样本中高危型HPV(HR-HPV)15种和低危型HPV(LR-HPV)6种(共21种)HPV基因亚型,分析HPV基因分型检测结果。结果总体HPV感染率为90.64%。HR-HPV感染率89.37%,占HPV阳性标本的98.60%;总体HPV感染率和HR-HPV感染率在CIN1、CIN2、CIN3、CIS、MICC中分别为76.98%和73.02%、89.70%和88.51%、95.73%和94.99%、95.80%和95.80%、93.94%和93.94%,各组间差异除CIN3+(即CIN3和CIS)与MICC组外均有统计学意义(χ2=18.11~136.96,P<0.001)。感染率最高者为HPV16(55.63%),其他常见亚型为HPV58(16.74%)、52(11.01%)、33 (7.00%)、31(6.62%)、18(5.86%)。LR-HPV感染率6.68%。LR-HPV感染率在前述各组中分别为10.32%、8.32%、4.64%、3.50%、5.30%。常见LR-HPV为HPV81(2.93%)、11(1.78%)、6(1.21%)。高危/低危HPV混合感染率5.41%。CIN1组HPV基因亚型分布特征明显不同于其他病变组。结论陕西地区宫颈病变中HPV感染水平符合疾病本质规律且随着病变加重显著增加,其基因型分布基本符合亚洲人群分布规律并具一定区域性差异。HPV基因亚型分布特征在不同病变中的差异反映了不同亚型在宫颈病变发生中作用的不同。本结果对理解宫颈病变的发生机制、宫颈癌防治和疫苗研制具有指导意义。
人乳头瘤病毒亚型;分布特征;宫颈上皮内瘤变;宫颈癌
宫颈癌是最常见的妇科恶性肿瘤,中国每年有近10万宫颈癌新发病例,并出现年轻化和发病增加趋势[1]。宫颈癌是由宫颈上皮的不典型增生(宫颈上皮内瘤变,即CIN,包括CIN1、CIN2、CIN3及原位癌CIS)经微浸润癌(microinvasivecancer,MICC)最终发展至临床浸润癌的连续病理过程。具有嗜上皮特性的人乳头瘤病毒(humanpapillomavirus,HPV)感染是宫颈癌前病变和宫颈癌发生的核心病因[2]。早期发现和处理宫颈癌前和早期病变是消除临床宫颈癌的关键[3]。在已发现的200余种HPV基因亚型中,20余种属于宫颈癌密切相关亚型,即高危型HPV(HR-HPV),其致癌能力和人群分布存在显著的病毒谱特征和地域差异。进一步确切分析区域病变人群中HPV基因亚型的分布特征,对于理解宫颈病变发生机制和制定地域宫颈癌防治策略至关重要[2-4]。本研究以6年间1个大样本的HPV分型检测结果为对象,分析陕西省区域女性宫颈癌前和早期病变人群中HPV感染基因亚型的分布特征。
1 资料与方法
1.1研究对象2009年10月至2015年10月在西安交通大学第一附属医院行高频电刀宫颈锥切术(LEEP)的患者1 571例(CIN1、CIN2、CIN3、CIS、MICC分别为252、505、539、143、132例),年龄20~72岁,平均年龄(40.82±8.81)岁。各组详细年龄构成见表1。
表1各宫颈病变组诊断年龄统计结果
Tab.1Theagesofthepatientsinthecervicallesiongroups

年龄(岁)CIN1(n=252)CIN2(n=505)CIN3(n=539)CIS(n=143)MICC(n=132)总计(n=1571)诊断年龄范围22~6420~7220~7422~6726~6620~74平均年龄±标准差41.39±9.0140.13±9.1840.98±8.7440.36±7.7042.22±8.2140.82±8.81
研究对象选取自1 669例LEEP术病例、术前6月以内有宫颈刷取样本HPV基因分型检测结果的1 571例患者。排除现时妊娠、3d内有阴道用药或冲洗史,48h内有性行为及月经期患者。受检者均来自陕西地区。
病理诊断以本院高年资病理专家诊断为准,采用Bethesda2001标准[3]。同一病例术前与术后病理诊断不一致时,以病变级别较重结果作为最终诊断。
1.2标本采集和HPV分型检测方法DNA提取、PCR扩增、导流杂交和结果判定等分型检测参照文献[5]和检测操作说明进行,采用凯普医用核酸分子快速导流杂交基因芯片技术检测21种HPV亚型,包括15种HR-HPV(16、18、31、33、35、39、45、51、52、53、56、58、59、66、68)和6种低危亚型HPV(LR-HPV)[6、11、42、43、44、81(CP8304)]。少部分病例检测结果来自前期其他可信医疗机构,其检测方法和上述方法相同,其在检测上述21种HPV亚型的同时,还检测另外3种HR-HPV(26、73、82)和4种低危HPV(LR-HPV40、54、55、67),共计28种亚型。
1.3统计学处理应用SPSS18.0统计学软件,差异比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1HPV总体感染状况在1 571例受检病例中,1 424例HPV检测阳性,总阳性率为90.64%;其中HR-HPV感染率为89.37%(1 404/1 571),LR-HPV感染率为6.68%(105/1 571),高危和低危混合感染率为5.41%(85/1 571)。CIN3+(CIN3及CIS)与MICC组总体HPV感染率差异无统计学意义(χ2=0.83,P>0.10);而CIN1、CIN2组间差异有统计学意义(χ2=16.68~76.70,P<0.001);总体CIN组与MICC组差异无统计学意义(χ2=1.85,P>0.10,表2)。
表2HPV亚型在各类宫颈病变组的检测阳性率及分布状况
Tab.2TheoverallprevalenceofHPVgenotypesamongthecervicallesiongroups

[n (%)]
HPV(+):总体HPV(+);HR-HPV(+):高危型HPV(+);LR-HPV(+):低危HPV(+);Co-HPV(+):高危和低危HPV复合(+)。
2.2HR-HPV各亚型感染的检测结果89.37%的病例(1 404/1 571例)HR-HPV检测结果为阳性,占HPV阳性病例的98.60%。CIN3+与MICC组HR-HPV总体阳性率比较,差异无统计学意义(χ2=0.35,P>0.10),其余各CIN组间差异有统计学意义(χ2=18.11~93.57,P<0.001)。总体CIN组与MICC组差异无统计学意义(χ2=3.62,P>0.05,表3)。
在HR-HPV各亚型中,HPV16 的阳性率(874/1 571,55.63%)最高,占HPV阳性标本的61.38%(874/1 424)和高危阳性标本的62.25%(874/1 404);在CIN1、CIN2、CIN3+和MICC组分别为26.59%、47.52%、69.21%(472/682)和71.97%。CIN3+与MICC组HPV16阳性率差异无统计学意义(χ2=0.40,P>0.10),各余各CIN组间差异有统计学意义(χ2=30.57~136.96,P<0.001);总体CIN组与MICC组差异也有统计学意义(χ2=15.58,P<0.001,表3)。
阳性率第2位的HR-HPV亚型为HPV58(263/1 571,16.74%),占HPV阳性标本的18.47%(263/1 424)和高危阳性标本的18.73%(263/1 404),各CIN组间阳性率比较差异无统计学意义(χ2=0.04~2.93,P>0.05);处于第3位的HR-HPV亚型为HPV52(173/1571,11.01%),占HPV阳性标本的12.15%(173/1 424)和高危阳性标本的12.32%(173/1 404),CIN1和CIN2组阳性率高于CIN3+和MICC组,差异有统计学意义(P<0.05);其余3种HR-HPV亚型阳性率依次为HPV33、31、18,阳性率分别为7.00%、6.62%、5.86%(表3)。以上6种HR-HPV亚型(HPV16、58、52、33、31、18)总体感染1 325例(84.36%),占全部HPV阳性标本的94.37%(1 325/1 404)和HR-HPV阳性标本的93.05%(1 325/1 424);最少见HR-HPV亚型为HPV35(0.89%)和HPV45(0.76%)。
表3HR-HPV在各类宫颈病变组分布状况的检测结果
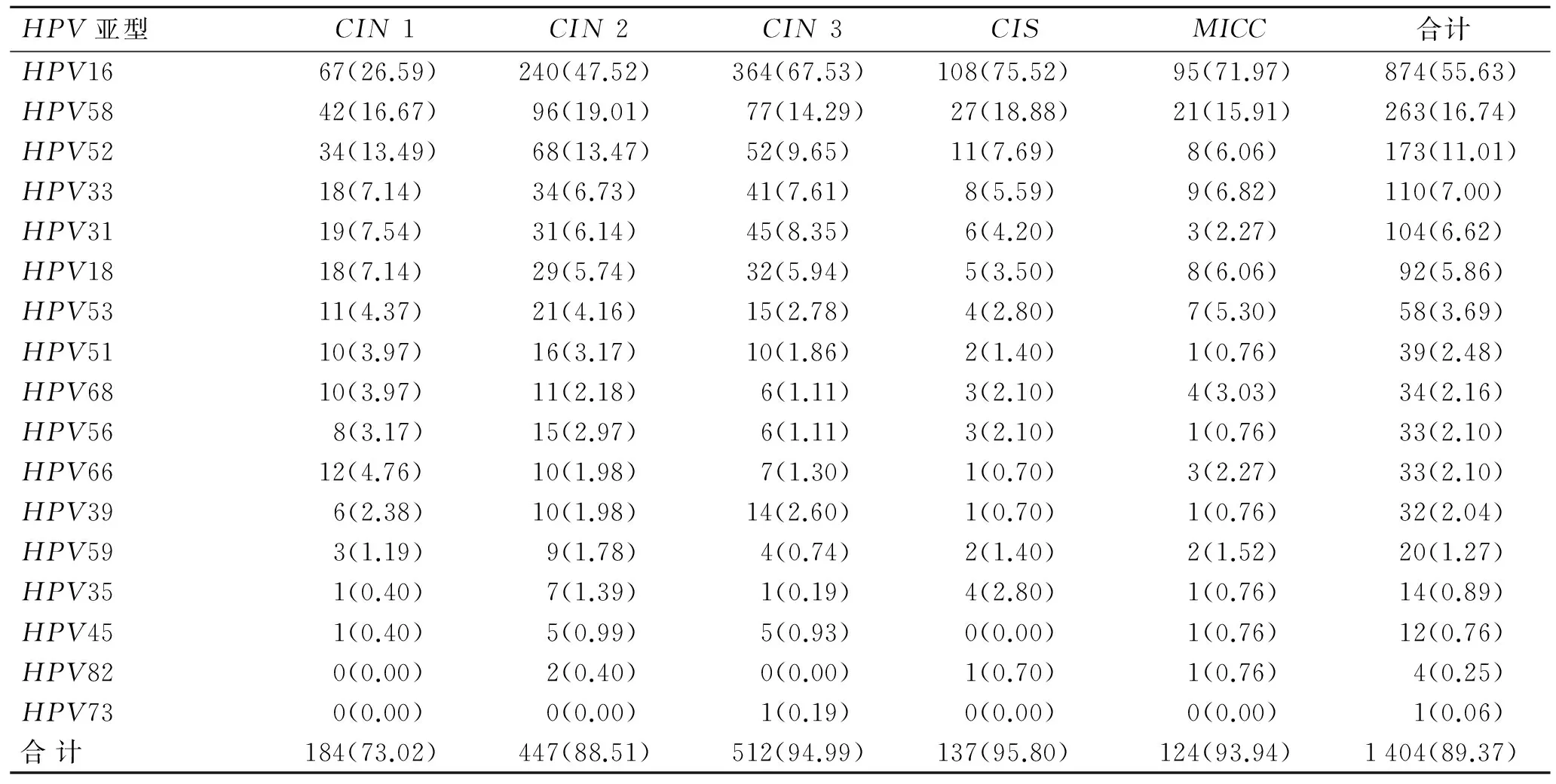
Tab.3 The genotypes of high-risk HPV distribution among the cervical lesion groups[n (%)]
2.3LR-HPV各亚型感染的检测结果6.68%(105/1 571例)LR-HPV检测结果为阳性,占HPV阳性病例的7.37%;CIN1与CIN3+(χ2=11.44,P<0.001)和CIN2与CIN3+(χ2=7.82,P<0.05)LR-HPV总体阳性率比较,差异有统计学意义;总体CIN组与MICC组差异无统计学意义(χ2=0.44,P>0.10,表4)。
在LR-HPV亚型中,HPV81阳性率(46/1 571,2.93%)最高,占HPV阳性标本的3.23%(46/1 424)和LR-HPV阳性标本的43.81%(46/105),HPV81阳性率随病变加重而降低,CIN1组与其他各组比较,差异有统计学意义(χ2=4.03~8.34,P<0.05);其他常见LR-HPV亚型依次为HPV11(1.78%)和HPV6(1.21%,表4)。HPV81、11、6这3种常见LR-HPV亚型感染总例数为90例(5.73%),占全部HPV阳性标本的6.32%(90/1 424)和LR-HPV阳性标本的85.71%(90/105)。少见LR-HPV亚型为HPV40、44、54、67,各型的阳性率均为0.06%(表4)。
表4各类宫颈病变组LR-HPV的阳性感染率和分布状况
Tab.4Thegenotypesoflow-riskHPVdistributionamongthecervicallesiongroups

[n (%)]
2.4HPV混合感染和感染种类例数状况5.41%(85/1 571例)患者同时检测到HR-HPV和LR-HPV阳性(即混合型感染),分别占HPV阳性病例、HR-HPV阳性病例、LR-HPV阳性病例的5.97%、6.05%、80.95%(表2),HR-HPV和LR-HPV间差异有统计学意义(P<0.001);在1 424例HPV阳性病例中,1 005例[70.58%,年龄(40.82±8.52)岁]为单种HPV感染,419例[29.42%,年龄(40.02±9.14)岁]为两种及以上HPV感染,其中有3例[年龄(40.00±14.45)岁]同时检测到6种HPV感染;HR-HPV和LR-HPV间单种感染差异无统计学意义(χ2=0.01,P>0.10,表5)。另外,在全部105例LR-HPV阳性病例中,单一种类LR-HPV为98例,占LR-HPV阳性病例的93.33%;HR-HPV和LR-HPV间多重感染差异无统计学意义(χ2=0.01,P>0.10)。
表5各类宫颈病变组的HR-HPV感染种类的检测结果
Tab.5Thegenotypenumbersofhigh-riskHPVinthecervicallesionpatients

[n (%)]
高危占比:该种类数阳性的病例数占高危HPV阳性例数的百分比;阳性占比:该种类数阳性病例数占总体HPV阳性例数的百分比。
3 讨 论
本研究通过一个区域医疗中心6年间的大样本病例分析,首先明确了宫颈病变总体HPV、HR-HPV、LR-HPV感染率分别为90.64%、89.37%、6.68%(表2)。进一步分析显示,CIN1、CIN2、CIN3+、MICC组的总体HPV感染率分别为76.98%、89.70%、95.75%、93.94%,HR-HPV感染率分别为73.02%、88.51%、95.16%、93.94%,而LR-HPV感染率分别为10.32%、8.32%、4.40%、5.30%(表2)。可见随病变加重,主要是HR-HPV感染率显著增加,这提示HR-HPV感染是宫颈病变逐级加重的主要病因因素。进一步分层分析显示,在所有HPV感染中,HPV16阳性率最高(55.63%),且占高危阳性标本的62.25%(表3)。HPV16阳性率在CIN1、CIN2、CIN3+、MICC组分别为26.59%、47.52%、69.21%、71.97%,呈现更突出的逐级加重特征。6种最常见高危亚型(HPV16、58、52、33、31、18)总体感染率84.36%,占全部HPV阳性标本的94.37%和HR-HPV阳性标本的93.05%(表3)。这表明在目前发现的20余种高危HPV亚型中,病因来源集中于上述6种最常见的高危亚型,其中HPV16比例最大。与以往相关领域其他作者的研究结果比较,本研究HR-HPV阳性率明显较高,而基因亚型谱基本一致[6-8]。
本研究致病性HPV亚型的分布谱中,6种最常见高危亚型的阳性频度按降序依次为HPV16、58、52、33、31、18(表3),不同于作者之前报道的22 306例同一地域基本人群(主要为非患病人群)HPV16、52、58、18、31、39的顺序[5],这说明各个HR-HPV基因型致病力的差异。进一步分析还显示,在高危型感染中,单种类型HPV感染率在各类宫颈病变中总体阳性率为73.93%,组间差异无统计学意义(表5),表明病变的性质(严重程度)主要只与有无高危型HPV亚型感染密切相关,而与感染亚型种类数的多少无关。大量基础研究表明,宫颈癌和癌前病变的发生基于HPV与宿主DNA的整合导致致癌基因E6、E7异常表达引起宿主细胞的非限制增生[2]。这提示,基于HPV亚型致病力的差异,对于具体病例宫颈病变的发生应该是由单个致瘤力较强的HPV亚型负责,而与其他复合感染亚型关系不大。此外,本研究显示的3种最常见低危亚型的阳性频度按降序依次为HPV81、11、6(表4),不同于作者近前报道的基本人群HPV6、11、81的顺序[5],这种差异同样反映了各个LR-HPV基因型致病力(主要是引起低级别宫颈病变)的差异,即与通常引起下生殖道疣状增生的HPV6、11相比,HPV81在宫颈上皮内瘤变(特别是CIN1)中作用更大。
本研究显示,CIN1的HPV基因亚型分布(包括高危亚型感染率、低危亚型感染率、HPV亚型分布谱等)明显不同于其他各组宫颈病变,主要表现为相对较低的HR-HPV和较高的LR-HPV感染率以及明显不同的HPV分布谱(表2~表5),说明CIN1从病因到病变性质均明显有别于其他高级别宫颈病变,即在CIN1病变形成中虽然仍以高危HPV为主要病因,但参与度明显小于其在高级别宫颈病变中的作用,而且致瘤力较弱的HR-HPV致病率较高,同时LR-HPV也发挥了一定作用,提示在临床上应区别对待。
鉴于宫颈CIS在病理学上异型细胞全层累及的特点和临床认知上的争议,本研究将CIS作为一组独立病变进行分析。结果显示,HPV基因亚型分布基本符合CIN3的规律(表2~表5),提示新近国际临床指南对该种病变的临床病理定位更新,具有很好的合理性[2-4]。MICC属于最早期别的宫颈癌,目前缺乏相关HPV感染的单独研究报道。本研究显示,MICC的总体HPV、HR-HPV、LR-HPV感染率分别为93.94%、93.94%、5.30%,与CIN3+组者基本一致(表2~表4)。唯其6种最常见高危亚型的阳性频度按降序依次为HPV16、58、33、18、52、53,其中HPV33、18、53位次较其他癌前病变组前移(表3)。此外,MICC组HPV阳性病例具有100%的HR-HPV亚型占比(表2~表4),明显有别于癌前病变各组,更明确了高危HPV亚型是MICC的重要病因,且其病变形成与低危复合感染基本无关。同时,MICC组的上述现象与其他作者揭示的典型的临床浸润癌病例分析结果也具有一定差异,表现为与后者比较相对稍低的HR-HPV感染率和病毒谱的细微差异,提示了MICC这一介于CIN和典型临床宫颈癌之间的宫颈病变发病和临床行为的特殊性[2,8-11]。
大量研究显示,HPV感染的亚型分布具有明显地域性差异。HPV16和HPV18是熟知和公认的致癌型高危HPV亚型,其基因组件E6、E7是明确定义的致癌基因且被深入研究[2-4]。但病毒流行病学研究显示,除欧美地区宫颈癌(及癌前病变)以HPV16、18亚型为主导基因亚型外[2,9],世界其他地区的HPV感染谱却明显不同[6-8,10-13]。本结果显示,本地区宫颈病变中常见高危亚型的阳性频度按降序依次为HPV16、58、52、33、31、18、53、51、68等(表3),其中除HPV16仍居绝对优势(阳性率55.63%,高危占比62.25%)外,HPV58(阳性率16.74%,高危占比18.73%)和HPV52(阳性率11.01%,高危占比12.32%)有突出优势地位,而欧美地区的次要优势亚型的HPV18仅居本研究优势亚型的第6位(阳性率5.86%,高危占比6.55%)。这与欧美地区的HPV感染谱显著不同[2,9],但与亚洲大区域内的综合基本特征相似[6-8,11-13]。与国内区域比较,本结果更接近于周边地区山西、新疆、河南、四川等省份和浙江省的结果,但和北京、湖南、云南、港澳台地区普遍表现为超过HPV16的HPV52和HPV58基因型的高频度阳性率有明显差异[6-8,12,13]。这尚需更进一步从更大区域和更深入的人群背景因素分析寻找线索和答案。基于大量病毒流行病学的多年调查结果,宫颈癌这一性传播性肿瘤预防的抗HPV16/18型双价疫苗已经在西方不少国家得以试用并显示出令人鼓舞的效果[14],中国普适性HPV疫苗探索和定型也成为业界关注的热点[15]。由于HPV亚型分布的明显地域差异,这一双价疫苗对于中国人群显然防癌覆盖率十分有限,依据本研究的数据,双价疫苗对陕西地区人群而言仅有60%的预防覆盖效率,而更适合陕西地区人群宫颈癌预防的推荐疫苗应该是至少涵盖最常见6种高危亚型(HPV16、58、33、18、52、53)的多价疫苗,其预防效率将涵盖94%以上病例人群。
综上,本研究通过一个宫颈病变的临床大样本精确HPV分型分析,首次明确了陕西地区宫颈癌前病变和微浸润癌中HPV的分布特征,对于进一步了解宫颈病变发生机制、指导宫颈癌临床诊治和预防性HPV疫苗研制提供了重要依据。
[1]CHENW,ZHENGR,BAADEPD,etal.CancerstatisticsinChina, 2015[J].CACancerJClin, 2016, 66(2):115-132.
[2]SNIJDERSPJ,STEENBERGENRD,HEIDEMANDA,etal.HPV-mediatedcervicalcarcinogenesis:conceptsandclinicalimplications[J].JPathol, 2006, 208(2):152-164.
[3]SANTESSON,MUSTAFARA,SCHÜNEMANNHJ,etal.WorldHealthOrganizationGuidelinesfortreatmentofcervicalintraepithelialneoplasia2-3andscreen-and-treatstrategiestopreventcervicalcancer[J].IntJGynaecolObstet, 2016, 132(3):252-258.
[4]ACOG.PracticeBulletinNo. 157Summary:Cervicalcancerscreeningandprevention[J].ObstetGynecol, 2016, 127(1):185-187.
[5] 樊静,李娜,张忠明,等. 陕西省宫颈人乳头瘤病毒感染亚型分布特征分析[J]. 中国妇幼健康研究, 2015, 26(5):958-960.
[6]ZHAOFH,ADAMK,LEWKOWITZ,etal.PrevalenceofhumanpapillomavirusandcervicalintraepithelialneoplasiainChina:apooledanalysisof17population-basedstudies[J].IntJCancer, 2012, 131(12):2929-2938.
[7]WANGR,GUOXL,WISMANGB,etal.Nationwideprevalenceofhumanpapillomavirusinfectionandviralgenotypedistributionin37citiesinChina[J].BMCInfectDis, 2015, 15:257.
[8]GUANP,HOWELL-JONESR,LIN,etal.Humanpapillomavirustypesin115,789HPV-positivewomen:ameta-analysisfromcervicalinfectiontocancer[J].IntJCancer, 2012, 131(10):2349-2359.
[9]ANDERSONLA,O’RORKEMA,NORTHERNIRELANDHPVWORKINGGROUP.etal.HPVprevalenceandtype-distributionincervicalcancerandpremalignantlesionsofthecervix:Apopulation-basedstudyfromNorthernIreland[J].JMedVirol, 2016, 88(7):1262-1270.
[10]OGEMBORK,GONAPN,SEYMOURAJ,etal.PrevalenceofhumanpapillomavirusgenotypesamongAfricanwomenwithnormalcervicalcytologyandneoplasia:asystematicreviewandmeta-analysis[J].PLoSOne, 2015, 10(4):e0122488.
[11]SASAGAWAT,MAEHAMAT,IDETAK,etal.Population-basedstudyforhumanpapillomavirus(HPV)infectioninyoungwomeninJapan:AmulticenterstudybytheJapanesehumanpapillomavirusdiseaseeducationresearchsurveygroup(J-HERS)[J].JMedVirol, 2016, 88(2):324-335.
[12]ZHANGC,PARKJS,GRCEM,etal.Geographicaldistributionandriskassociationofhumanpapillomavirusgenotype52-variantlineages[J].JInfectDis, 2014, 210(10):1600-1604.
[13]CHANPK,HOWC,CHANMC,etal.Meta-analysisonprevalenceandattributionofhumanpapillomavirustypes52and58incervicalneoplasiaworldwide[J].PLoSOne, 2014, 9(9):e107573.
[14]MARKOWITZLE,HARIRIS,LINC,etal.Reductioninhumanpapillomavirus(HPV)prevalenceamongyoungwomenfollowingHPVvaccineintroductionintheUnitedStates,NationalHealthandNutritionExaminationSurveys, 2003-2010[J].JInfectDis, 2013, 208(3):385-393.
[15]XUQX,ZHANGZY.High-riskhumanpapillomavirusgenotypesincervicallesionsandvaccinationchallengesinChina[J].AsianPacJCancerPrev, 2015, 16(6):2193-2197.
(编辑国荣)
Humanpapillomavirusgenotypesdistributioninpatientswithcervicalintraepithelialneoplasiaandmicroinvasivecancer
ZHANGZhong-ming1,CUIXu-qin1,LINa1,ZHANGGuan-jun2,ZHAOYan-hong3,LIURun-run1,XIEQi1,GAOBao-xia1
(1.DepartmentofGynecologyandObstetrics; 2.DepartmentofPathology; 3.DepartmentofNetworkInformation,theFirstAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710061,China)
ObjectiveToanalyzetheHPVgenotypedistributionamongwomenwithcervicalintraepithelialneoplasia(CINsandCIS)andmicroinvasivecancer(MICC)inShaanxiProvince.MethodsThestudyrecruited1 571patientswithpathologicallydiagnosedcervicallesions,including252CIN1, 505CIN2, 539CIN3, 143CIS,and132MICCcases.AllthepatientswerediagnosedintheFirstAffiliatedHospitalofXi’anJiaotongUniversitybetweenOctober2009andOctober2015. 21HPVgenotypeswereexaminedbyaPCR-basedhybridizationgenechipassay.ResultsTheoverallHPVprevalencewas90.64%. 89.37%ofthewomenhadahighriskofHPVs(HR-HPV),whichaccountedfor98.60%inallHPVpositivesamples.TheoverallinfectionrateofHPVandinfectionrateofHR-HPVwere76.98%and73.02%, 89.70%and88.51%, 95.73%and94.99%, 95.80%and95.80%, 93.94%and93.94%inCIN1,CIN2,CIN3,CIS,andMICCpatients,respectively,whichweresignificantlydifferentamongthegroups(χ2=18.11-136.96, P<0.001),exceptthatbetweenCIN3+(CIN3andCIS)andMICC.TheinfectionwasmostprevalentinHPV16 (55.63%),followedbyHPV58 (16.74%),HPV52 (11.01%),HPV33 (7.00%),HPV31 (6.62%)andHPV18 (5.86%). 6.68%ofthewomenwerepositiveforlow-riskHPVs(LR-HPV).TheLR-HPVinfectionratewas10.32%, 8.32%, 4.64%, 3.50%and5.30%intheabovegroups,respectively.ItwasmostprevalentinHPV81 (2.93%),followedbyHPV11 (1.78%)andHPV6 (1.21%).TherateofmixedinfectionofbothHR-HPVandLR-HPVwas5.41%.ThespectraofHPVgenotypesweredifferentbetweenCIN1andtheothergroups.ConclusionTheHR-HPVinfectionratesincreasewithincreasedlesionseverityandthegenotypedistributionofHPVinShaanxiareahasasimilarspectrumtothoseinthewholeAsianregionswithsomedifference.ThedifferentdistributionofHPVgenotypesinvariouscervicalconditionsindicatesdifferentpathogeneticroleofdifferentHPVgenotypesincervicallesions.Thisstudyprovidessomeguidanceforunderstandingthepathogenesisandpreventionofcervicalcanceraswellasvaccinationdevelopment.
humanpapillomavirusgenotype;distribution;cervicalintraepithelialneoplasia(CIN);cervicalcancer
2016-04-15
2016-05-17
国家自然科学基金资助项目(No.30872741);陕西省自然基金资助项目(No.2016JM8106)
张忠明.E-mail:xianzzm@aliyun.com
R737
A
10.7652/jdyxb201605017
SupportedbytheNationalNaturalSciencesFoundationofChina(No.30872741)andtheNaturalScienceFoundationofShaanxiProvince(No.2016JM8106)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160803.1418.030.html(2016-08-03)
