肾母细胞瘤中ERCC1、TUBB3、TOP2AmRNA的表达及临床意义
2016-10-25潘伟康王怀杰郑百俊郭青青郭正团
潘伟康,余 辉,王怀杰,郑百俊,郭青青,郭正团,高 亚,李 鹏
(1. 西安交通大学第二附属医院小儿外科,陕西西安 710004;2. 西安交通大学医学部,陕西西安 710061)
◇临床研究◇
肾母细胞瘤中ERCC1、TUBB3、TOP2AmRNA的表达及临床意义
潘伟康1,余辉1,王怀杰1,郑百俊1,郭青青2,郭正团1,高亚1,李鹏1
(1. 西安交通大学第二附属医院小儿外科,陕西西安710004;2. 西安交通大学医学部,陕西西安710061)
目的探讨核苷酸切除修复交叉互补基因(excisionrepaircrosscomplementation1,ERCC1)、3型β微管蛋白编码基因(ClassⅢβ-tubulin,TUBB3)和DNA拓扑异构酶Ⅱα(TopoisomeraseⅡA,TOP2A)mRNA在小儿肾母细胞瘤组织中的表达及临床意义。方法收集18例肾母细胞瘤组织标本及14例癌旁组织标本,通过分支-DNA液相芯片法检测标本中ERCC1、TUBB3、TOP2AmRNA的表达水平,并分析上述基因表达与肾母细胞瘤临床病理的关系。结果肾母细胞瘤组织中ERCC1、TUBB3和TOP2A高表达率分别为44.4%、50.0%和66.7%,均显著高于癌旁组织的7.1%、7.1%和14.3%,差异有统计学意义(P<0.05)。ERCC1高表达率与肾母细胞瘤临床分期和病理类型有关(P<0.05),TOP2A高表达率与肾母细胞瘤临床分期相关(P<0.05)。结论小儿肾母细胞瘤组织中ERCC1、TUBB3和TOP2AmRNA表达高于癌旁组织,可能参与肾母细胞瘤的发生发展过程。
肾母细胞瘤;ERCC1;TUBB3;TOP2A
肾母细胞瘤也称为Wilms瘤,是最常见的小儿实体肿瘤之一,其发病率约为儿童全部肿瘤的6%[1]。通过手术切除联合术后化疗和放疗等综合治疗途径,可使肾母细胞瘤患儿的5年生存率达到87%[2]。但目前肾母细胞瘤的治疗仍面临诸多问题,如肿瘤的发生发展机制的阐明、多药耐药现象的克服、化疗毒副作用的降低和治疗有效率的提高等。随着分子生物学的发展,在肺癌、结直肠癌、乳腺癌等多种成人实体肿瘤中发现,核苷酸切除修复交叉互补基因(excisionrepaircross-complementinggroup,ERCC1)、3型β微管蛋白编码基因(ClassⅢβ-tubulin,TUBB3)和DNA拓扑异构酶Ⅱα(topoisomeraseⅡA,TOP2A)mRNA的异常表达与肿瘤的发生发展、化疗药物的疗效密切相关[3-6]。但有关ERCC1、TUBB3、TOP2A基因在正常肾脏及小儿肾母细胞瘤中的表达鲜见报道。为此本研究拟通过分支DNA液相芯片技术,测定肿瘤组织和癌旁组织中ERCC1、TUBB3和TOP2AmRNA的表达,并分析ERCC1、TUBB3和TOP2AmRNA表达水平与肾母细胞瘤病理学参数的关系,为探索小儿肾母细胞瘤的发生发展机制及个体化综合治疗方案的选择和精准药物疗效预测提供参考依据。
1 材料与方法
1.1临床资料收集西安交通大学第二附属医院小儿外科2014年1月~2015年11月经影像学检查、实验室检查及手术后病理证实的肾母细胞瘤组织标本18例。男性13例,女性5例;年龄0.5~8岁,中位年龄2.3岁。所有病例均为初治病例,均未接受放化疗。同期取距离肿瘤组织2cm处癌旁组织18例(4例样本不合格,未入组)作为对照组。
1.2方法1.2.1样本制备肿瘤组织及癌旁组织用100mL/L甲醛溶液固定16~24h,乙醇洗涤。
1.2.2检测方法采用分支DNA液相芯片技术,同时检测样本中ERCC1、TUBB3、TOP2AmRNA表达,由广州益善医学检验所检测。与PCR方法相比,该技术不需要进行RNA抽提及逆转录。具体操作步骤为:①56 ℃用裂解液裂解样本2h;②加入缓冲液、探针-微球和支持延伸探针,55 ℃震荡孵育过夜;③次日将孵育板置于磁力架静置1min,去上清液;④洗涤液震荡洗涤1min,于磁力架上静置1min,去上清液,重复3次;⑤加入扩增延伸探针和标记探针,50 ℃下震荡反应1h;⑥磁力架上静置1min,去上清液,洗涤2次;⑦加入链霉亲和素-藻红蛋白,50 ℃震荡30min;⑧静置于磁力架上1min,去上清液,重复洗涤2次。⑨加洗涤液震荡洗涤5min,Luminex阅读仪读取中位荧光值(MFI),经广州益善医学检验所相关数据分析软件分析,得到最终结果。
1.3结果判定ERCC1、TUBB3、TOP2AmRNA表达水平以百分率表示。≥75%为高表达,60%~75%为中偏高表达,40%~60%为中表达,40%~25%为中偏低表达,小于25%为低表达。mRNA表达水平可以反映药物疗效。将ERCC1和TUBB3高表达、中偏高表达记为高表达组,中表达、中偏低表达和低表达记为中低表达组。将TOP2A高表达、中偏高表达和中表达记为高表达组,将中偏低表达和低表达记为中低表达组。
1.4统计学分析所有数据分析均使用SPSS19.0统计软件完成,采用Fisher确切概率法检验进行统计分析,P<0.05为差异有统计学意义。
2 结 果
2.1一般结果分析18例入组患儿中,8例患儿术前出现肉眼血尿,4例患儿术中发现肾静脉或下腔静脉中有瘤栓,肿瘤质量约220~870g。无合并其他系统畸形及综合征。左侧8例,右侧10例,均为单侧肾母细胞瘤。病理类型包括预后良好(FH)型10例(图1A),预后不良(UH)型8例(图1B)。按照SIOP分期系统,Ⅰ~Ⅱ期11例,Ⅲ~Ⅳ期7例,Ⅴ期0例。
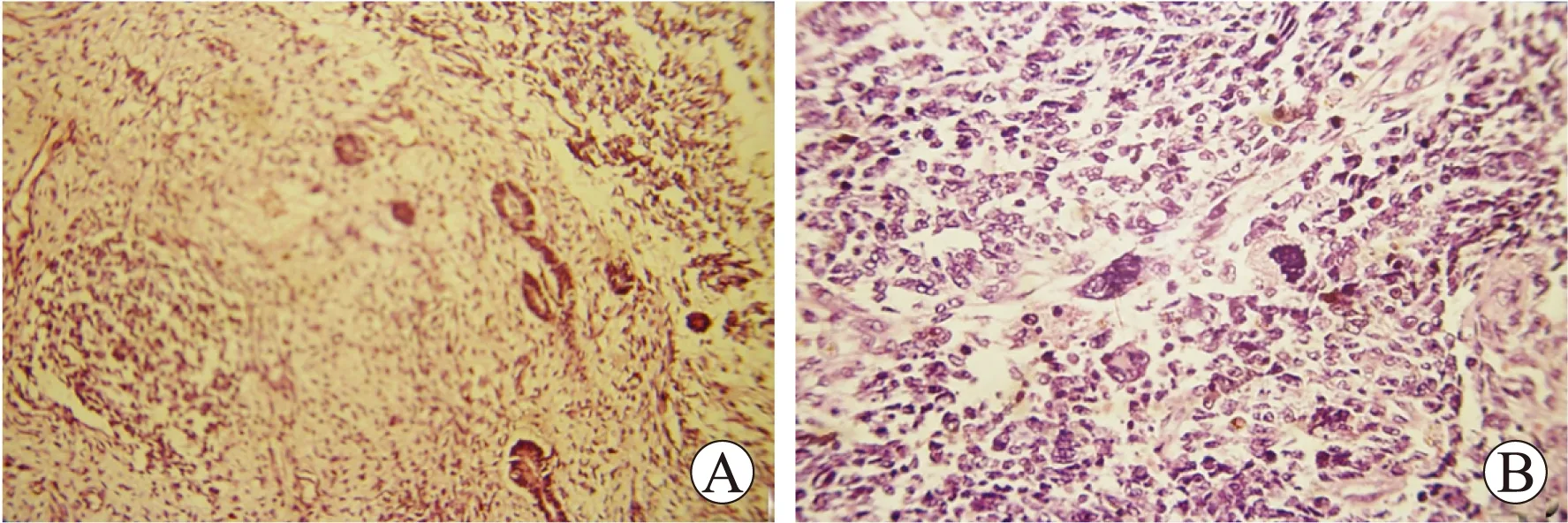
图1预后良好型(A)及预后不良型(B)肾母细胞瘤HE染色
Fig.1HEstainingofnephroblastomawithFH(A)andnephroblastomawithUH(B) (×200)
2.2ERCC1、TUBB3、TOP2AmRNA在肿瘤组织和癌旁组织中的表达在肿瘤组织及癌旁组织中,ERCC1、TUBB3、TOP2AmRNA表达结果见表1。结果显示:肾母细胞瘤组织中ERCC1高表达率为44.4%,明显高于癌旁组织7.1%(P<0.05)。TUBB3在肿瘤组织中高表达率为50%,在癌旁组织中高表达率为7.1%,两者差异有统计学意义(P<0.05)。TOP2A在肿瘤组织中高表达率(66.7%)明显高于癌旁组织(14.3%),差异有统计学意义(P<0.05)。
2.3ERCC1、TUBB3、TOP2AmRNA表达与肾母细胞瘤临床病理的关系在Ⅲ/Ⅳ期患儿中,ERCC1mRNA高表达率为85.7%,显著高于Ⅰ/Ⅱ期的18.2%(P<0.05)。UH型高表达率为87.5%,高于FH型的10%(P<0.05)。表明ERCC1mRNA高表达率与临床分期和组织类型有关,但是与性别、年龄无关(P>0.05,表2)。
TUBB3mRNA高表达率与性别、年龄、临床分期和组织类型均无关(P>0.05,表2)。
晚期(Ⅲ/Ⅳ)患儿TOP2AmRNA高表达率为100%,明显高于早期(Ⅰ/Ⅱ)患儿的45.5%(P<0.05),表明TOP2AmRNA高表达率与临床分期相关,但与性别、年龄、组织类型无关(P>0.05,表2)。
表1ERCC1、TUBB3、TOP2AmRNA在肿瘤组织和癌旁组织的表达
Tab.1TheexpressionsofERCC1,TUBB3andTOP2AmRNAinnephroblastomaandperitumoraltissues

[n (%)]
表2ERCC1、TUBB3、TOP2AmRNA表达与肾母细胞瘤临床病理的关系
Tab.2RelationshipofERCC1,TUBB3,andTOP2AmRNAexpressionswithclinicopathologicparametersofnephroblastoma
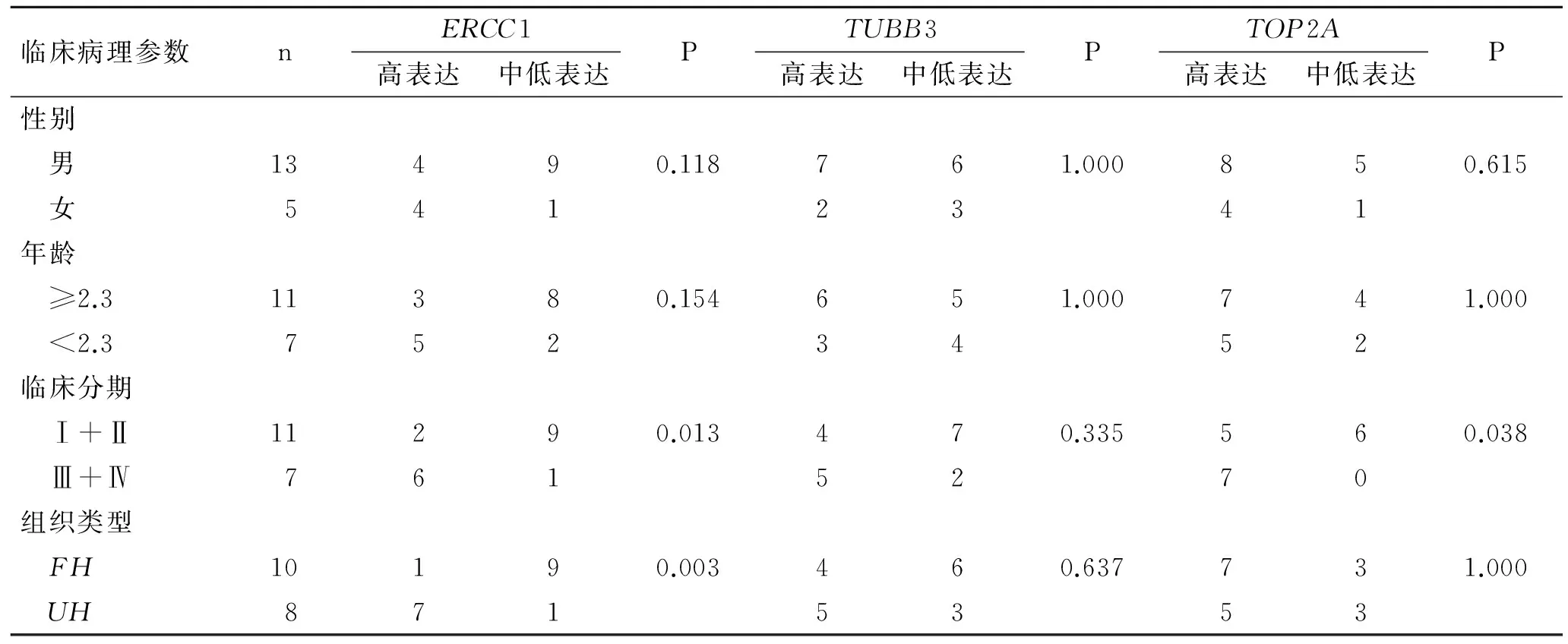
临床病理参数nERCC1高表达中低表达PTUBB3高表达中低表达PTOP2A高表达中低表达P性别 男13490.118761.000850.615 女5412341年龄 ≥2.311380.154651.000741.000 <2.37523452临床分期 Ⅰ+Ⅱ11290.013470.335560.038 Ⅲ+Ⅳ7615270组织类型 FH10190.003460.637731.000 UH8715353
3 讨 论
随着手术、化疗、放疗等综合治疗手段的应用,小儿肾母细胞瘤的生存率得到了显著改善。目前,国际上倾向在保证疗效的情况下,降低治疗强度,减少毒副作用,改善患儿的生存质量[7]。因此,需要深入评估患儿的个体差异,选择合适的个体化治疗方案和剂量,克服多药耐药现象,提高治疗有效率并降低毒性反应,实现精准治疗的目标。肾母细胞瘤的发生发展和多药耐药是多种基因在多个不同阶段共同作用的结果。因此,对肿瘤组织进行多种基因并行检测,不仅有助于阐明肿瘤的发生发展机制,还可以预测化疗药物的疗效,从而针对性地选择治疗方案。
ERCC1属于核苷酸外切修复家族成员,其表达量直接影响DNA的修复[8]。ERCC1的异常表达与结直肠癌、肝癌、肺癌等多种肿瘤的发生密切相关[3,9-10]。另外,由于铂类药物主要是通过引起肿瘤细胞内DNA的交联,阻碍DNA的合成与复制,从而抑制肿瘤细胞的生长。因此,ERCC1表达与铂类药物的疗效密切相关,美国国立综合癌症网络(NationalComprehensiveCancerNetwork,NCCN)临床实践指南建议患者在接受铂类药物化疗前进行ERCC1基因表达检测[11]。在多种肿瘤中,ERCC1低表达的患者与高表达患者相比,更能够从含铂类药物的治疗方案中获益[4,12]。TUBB3基因编码的β-tubulin-Ⅲ蛋白是微管蛋白的重要组成部分。微管蛋白在维持细胞形态、调控细胞有丝分裂中起重要作用。有研究表明,TUBB3基因异常表达与肿瘤发生发展和抗微管类药物密切相关[5]。KOH等[13]用免疫组化方法检测发现,在肺鳞癌中TUBB3阳性率高于其他病理类型,且TUBB3阳性表达与5年无病生存率和总生存时间有关。TUBB3低表达的患者对长春碱类药物的敏感性更好[14]。TOP2A基因通过编码DNA拓扑异构酶Ⅱ参与DNA复制、转录和翻译等过程,增强肿瘤细胞的增殖能力。研究发现,TOP2A高表达的患者对依托伯苷和蒽环类药物较敏感,而低表达患者对上述两类药物表现出耐药性[6,15]。
目前,基因表达检测通常使用定量PCR法。定量PCR法是敏感度高的mRNA检测方法,但该方法需要进行RNA抽提、纯化、逆转录和目标片段扩增等多个步骤,易产生积累误差,且定量PCR方法每次检测的基因数目有限,无法实现多基因的并行检测。为此本研究采用分支-DNA液相芯片法,在样本裂解后直接进行检测,省略了RNA抽提、逆转录及目标片段扩增等步骤,大大降低多步骤操作的积累误差,同时能最大程度保证检测结果的准确性和可重复性。并且可同步实现多个基因的mRNA水平检测,尤其适用于甲醛固定石蜡包埋(FFPE)样本的多基因并行检测[16-17]。
本研究结果显示,肾母细胞瘤组织中ERCC1高表达率明显高于癌旁组织,ERCC1高表达率与肾母细胞瘤临床分期和病理组织类型有关,较晚临床分期和预后不良的患儿ERCC1更趋向于高表达。表明肾母细胞瘤组织中存在大量的DNA损伤,引起DNA修复基因的表达增加。提示肿瘤恶性程度越高,其DNA损伤积累越多,基因组越不稳定。TUBB3mRNA在癌旁组织中存在表达,提示TUBB3表达对维持正常细胞生理活动起着重要作用。但TUBB3mRNA的高表达率在肿瘤组织和癌旁组织中存在显著差异,表明其异常表达可能在肾母细胞瘤的发生中起到了促进作用。TOP2A在肿瘤组织中的高表达率明显高于癌旁组织,在临床分期较晚的患儿中,TOP2A的高表达率为100%。表明TOP2A在肿瘤组织中表达增高,并随着临床分期的加大,其表达呈现上升的趋势,提示晚期肾母细胞瘤患儿可能对依托伯苷和蒽环类药物更敏感。
综上所述,ERCC1、TUBB3和TOP2AmRNA的异常表达可能参与肾母细胞瘤的发生发展过程,检测ERCC1、TUBB3和TOP2AmRNA的表达水平可能为肾母细胞瘤的临床分期、恶性程度判断及化疗方案的选择提供依据。但因本研究病例偏少及肿瘤发生发展的复杂性,ERCC1、TUBB3和TOP2A在肾母细胞瘤中的作用有待进一步研究与论证。
[1]DAVIDOFFAM.Wilms’tumor[J].CurrOpinPediatr, 2009, 21(3):357-364.
[2]PASTOREG,ZNAORA,SPREAFICOF,etal.MalignantrenaltumoursincidenceandsurvivalinEuropeanchildren(1978-1997):reportfromtheAutomatedChildhoodCancerInformationSystemproject[J].EurJCancer, 2006, 42(13):2103-2114.
[3]SAEBOM,SKJELBREDCF,NEXOBA,etal.IncreasedmRNAexpressionlevelsofERCC1,OGG1andRAIincolorectaladenomasandcarcinomas[J].BMCCancer, 2006, 16(6):208-215.
[4]OLAUSSENKA,DUNANTA,FOURETP,etal.DNArepairbyERCC1innon-small-celllungcancerandcisplatin-basedadjuvantchemotherapy[J].NEnglJMed, 2006, 355(10):983-991.
[5]VILMARA,GARCIA-FONCILLASJ,HUARRIZM,etal.RT-PCRversusimmunohistochemistryforcorrelationandquantificationofERCC1,BRCA1,TUBB3andRRM1inNSCLC[J].LungCancer, 2012, 75(3):306-312.
[6]PRESSMF,SAUTERG,BUYSEM,etal.AlterationoftopoisomeraseII-alphageneinhumanbreastcancer:associationwithresponsivenesstoanthracycline-basedchemotherapy[J].JClinOncol, 2011, 29(7):859-867.
[7]NAKAMURAL,RITCHEYM.CurrentmanagementofWilms’tumor[J].CurrUrolRep, 2010, 11(1):58-65.
[8]TSODIKOVOV,JVANOVD,ORELLIB,etal.StructuralbasisfortherecruitmentofERCCl-XPFtonucleotideexcisionrepaircomplexesbyXPA[J].EMBO, 2007, 26(22):4768-4776.
[9]FAUTRELA,ANDRIEUXL,MUSSOO,etal.OverexpressionofthetwonucleotideexcisionrepairgenesERCC1andXPCinhumanhepatocellularcarcinoma[J].JHepatol, 2005, 43(2):288-293.
[10]ZHOUW,LIUG,PARKS,etal.Gene-smokinginteractionassociationsfortheERCC1polymorphismsintheriskoflungcancer[J].CancerEpidemiolBiomarkersPrev, 2005, 14(2):491-496.
[11]ETTINGERDS,AKERLEYW,BORGHAEIH,etal.Non-smallcelllungcancer,version2.2013[J].JNatlComprCancNetw, 2013, 11(6):645-653.
[12]O’GRADYS,FINNSP,CUFFES,etal.TheroleofDNArepairpathwaysincisplatinresistantlungcancer[J].CancerTreatRev, 2014, 40(10):1161-1170.
[13]KOHY,JANGB,HANSW,etal.ExpressionofclassⅢbeta-tubulincorrelateswithunfavorablesurvivaloutcomeinpatientswithresectednon-smallcelllungcancer[J].JThoracOncol, 2010, 5(3):320-325.
[14]ZHANGHL,RUANL,ZHENGLM,etal.AssociationbetweenclassⅢβ-tubulinexpressionandresponsetopaclitaxel/vinorebine-basedchemotherapyfornon-smallcelllungcancer:ameta-analysis[J].LungCancer, 2012, 77(1):9-15.
[15]BRASEJC,SCHMIDTM,FISCHBACHT,etal.ERBB2andTOP2Ainbreastcancer:acomprehensiveanalysisofgeneamplification,RNAlevels,andproteinexpressionandtheirinfluenceonprognosisandprediction[J].ClinCancerRes, 2010, 16(8):2391-2401.
[16]CANALESRD,LUOY,WILLEYJC,etal.EvaluationofDNAmicroarrayresultswithquantitativegeneexpressionplatforms[J].NatBiotechnol, 2006, 24(9):1115-1122.
[17]KNUDSENBS,ALLENAN,MCLERRANDF,etal.Evaluationofthebranched-chainDNAassayformeasurementofRNAinformalin-fixedtissues[J].JMolDiagn, 2008, 10(2):169-176.
(编辑邱芬)
ExpressionandclinicalsignificanceofERCC1,TUBB3andTOP2AmRNAinnephroblastoma
PANWei-kang1,YUHui1,WANGHuai-jie1,ZHENGBai-jun1,GUOQing-qing2,GUOZheng-tuan1,GAOYa1,LIPeng1
(1.DepartmentofPediatricSurgery,theSecondAffiliatedHospitalofXi’anJiaotongUniversity,Xi’an710004; 2.HealthScienceCenter,Xi’anJiaotongUniversity,Xi’an710061,China)
ObjectiveToinvestigatetheexpressionandclinicalsignificanceofexcisionrepaircrosscomplementation1(ERCC1),ClassⅢβ-tubulin(TUBB3)andtopoisomeraseⅡA(TOP2A)innephroblastoma.MethodsTheexpressionlevelsofERCC1,TUBB3andTOP2Ain18casesofnephroblastomatissueand14casesofperitumoraltissueweredetectedbybranch-DNAliquidchiptechnology.Therelationshipoftheexpressionsoftheabovegeneswiththeclinicopathologiccharacteristicsofnephroblastomawasanalyzed.ResultsThehighexpressionratesofERCC1,TUBB3andTOP2Ainnephroblastomatissues(44.4%,50.0%, 66.7%)weresignificantlyhigherthanthoseinperitumoraltissues(7.1%, 7.1%and14.3%) (P<0.05).ThehighexpressionofERCC1wascorrelatedwiththeclinicalstageandhistopathologictype(P<0.05).TOP2Awascorrelatedwiththeclinicalstage(P<0.05).ConclusionTheexpressionsofERCC1,TUBB3andTOP2Awerehigherinnephroblastomathaninnormalrenaltissue.HighexpressionsofERCC1,TUBB3andTOP2Amayplayanimportantroleincarcinogenesisandprogressionofnephroblastoma.
nephroblastoma;ERCC1;TUBB3;TOP2A
2016-01-28
2016-05-25
国家自然科学基金资助项目(No.81172589)
李鹏.E-mail:sienafiat@hotmail.com
R737.11
A
10.7652/jdyxb201605015
SupportedbytheNationalNaturalScienceFoundationofChina(No.81172589)
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160803.1405.020.html(2016-08-03)
