慢病毒介导的骨形态发生蛋白-2治疗骨质疏松骨折的效果
2016-10-25张君
张 君
(新乡医学院第一附属医院骨外科,河南新乡 453000)
◇基础研究◇
慢病毒介导的骨形态发生蛋白-2治疗骨质疏松骨折的效果
张君
(新乡医学院第一附属医院骨外科,河南新乡453000)
目的探讨慢病毒介导的骨形态发生蛋白-2(BMP-2)治疗骨质疏松骨折的效果。方法建立30只大鼠骨质疏松模型并进行分组。模型组和BMP-2治疗组(即BMP-2组)进一步制作左胫骨中段横行骨折模型,并于骨折当天在骨折局部分别皮下注射对照病毒和BMP-2质粒的慢病毒,而对照组不作骨折处理,只在相应部位皮下注射等体积的PBS。4d后分别处死各组3只大鼠,用Westernblot检测骨折局部皮下BMP-2的表达情况;治疗8周后处死其余大鼠,取左胫骨进行X线检查并评分,测定骨密度及骨的生物力学指标,观察骨痂组织学变化。结果BMP-2组大鼠骨折处皮下组织BMP-2蛋白表达水平明显高于对照组和模型组(P<0.05)。模型组和BMP-2组大鼠胫骨X线评分与对照组比较,明显降低(P<0.05),但是BMP-2组明显高于模型组(P<0.05)。模型组和BMP-2组大鼠骨密度明显低于对照组,而BMP-2组明显高于模型组(P<0.05)。模型组和BMP-2组大鼠胫骨3点弯曲参数(最大载荷、最大应力、破坏载荷和破坏应力)与对照组大鼠比较,均明显下降,而BMP-2组各参数较模型组明显升高(P<0.05)。骨痂组织HE染色显示,模型组大鼠软骨性骨痂较多,骨小梁较细,排列稀疏紊乱,而BMP-2组大鼠可见大量软骨性骨痂向骨性骨痂转变,新生形成大量编织骨小梁。结论慢病毒介导的BMP-2能促进骨形成,促进骨折部位愈合,对骨质疏松性骨折具有很好的治疗效果。
慢病毒;骨形态发生蛋白(BMP-2);骨质疏松性骨折;骨密度;弯曲参数;基因治疗;骨生物力学
骨质疏松是一种因骨强度降低、骨微结构破坏,导致骨脆性增加,容易出现骨折的全身性骨骼系统疾病[1-2]。骨强度主要表现为骨密度和骨质量,而老年人患上骨质疏松之后,骨密度和骨质量均显著下降,导致骨强度下降,很容易出现骨折[3]。骨质疏松常见的骨折部位主要以脊柱、髋部、桡骨远端和肱骨近端。老年患者一旦发生骨质疏松性骨折,极大影响了其身心健康和生活质量。骨形态发生蛋白(bonemorphogeneticprotein,BMP)是一种多功能的生长因子,对胚胎骨形成及出生后成骨有重要作用,其中BMP-2是最主要的骨形成调控因子[4-5]。BMP-2是主要调节骨形成的信号蛋白,具有强大的成骨作用,同时可促进骨骼愈合和修复,是治疗骨质疏松性骨折的药物[6-8]。由于蛋白类药物在体内的半衰期短,药物生物利用率低,作用于骨折部位的药物浓度低。因此,寻求一种持久的、能在局部部位高表达BMP-2的方法是治疗骨折的关键[9]。本研究采用慢病毒介导BMP-2,观察其在因骨质疏松发生骨折部位的表达变化及其对骨折治疗效果的影响。
1 资料与方法
1.1材料SD大鼠(180~200g)购自上海斯莱克动物中心;BMP-2抗体购自美国Abcam公司;GAPDH单克隆抗体购自南京诺唯赞生物有限公司;IVISLuminaⅡ活体动物成像仪购自美国冷泉港生物科技股份有限公司;LUNAR骨密度仪购自美国通用电气有限公司;CSS-44100微机控制电子万能试验机购自美国通用电气有限公司;切片机购自德国徕卡公司。
1.2骨质疏松模型的构建及分组30只SD大鼠构建骨质疏松模型,即建模前12h,大鼠禁食,采用100g/L氯胺酮腹腔注射麻醉。仰卧位固定后,腹部消毒处理,沿着腹部中线切开3cm切口,暴露子宫并结扎子宫角,切除卵巢后直接缝合。另外15只大鼠仅剥离卵巢周围脂肪组织,不切除卵巢,为对照组。术后均肌肉注射青链霉素,40 000U/只,连续注射3d。
30只骨质疏松大鼠模型建立8周后,进一步建立大鼠左侧胫骨骨折模型,并随机分为模型组和治疗组(即BMP-2组),每组大鼠15只。模型组和BMP-2组大鼠分别于胫骨骨折处注射溶解于PBS溶液中的包装空载体和BMP-2基因的慢病毒1×108(体积100μL);对照组于模型组和BMP-2组相同部位注射等体积(100μL)的PBS溶液。注射8周后对大鼠胫骨的生物学指标进行测定。
1.3Westernblot检测BMP-2表达各组大鼠在治疗4d后处死3只,取注射部位皮下组织并匀浆提取蛋白,进行SDS-PAGE电泳并将蛋白转移至PVDF膜上,50g/L脱脂奶粉封闭30min,然后用BMP-2兔多克隆抗体(稀释比为1∶1 000)以及GAPDH鼠单克隆抗体(稀释比为1∶5 000)4 ℃包被过夜,次日用PBS洗涤3次,每次5min;然后用羊抗兔和羊抗鼠HRP标记的二抗室温包被1h后,用PBS洗涤3次,每次5min后,加发光液后进行拍照扫描。
1.4X线平片检查及评定在治疗后8周,取各组大鼠左胫骨,采用小动物活体成像仪进行X线扫描,并按照下述标准进行评定:骨折线清晰,无骨膜反应为0分;骨折边缘部分趋于模糊,骨膜出现轻度反应为1分;骨折边缘模糊,骨膜反应浅淡,出现少量骨痂,边缘不整齐为2分;骨折线边缘仍然可以看到,但是边缘接近消失,骨痂量增多,且密度较深为3分;骨折线完全消失,骨痂填满缺损,并与骨皮质密度相同为4分。
1.5骨痂密度及骨生物力学指标测定处死治疗8周后的各组大鼠,无菌条件下剥离胫骨,取胫骨骨痂组织,采用LUNAR骨密度仪测定左侧胫骨骨痂骨密度,并进行分析。
采用CSS-44100微机控制电子万能试验机测试左侧胫骨的3点弯曲试验。将胫骨置于测试仪上,以胫骨中心为加力点,支座跨距20mm,最大荷载200N,加力至骨折,计算胫骨内径和外径,分析最大载荷、最大应力、破坏载荷和破坏应力。
1.6骨枷组织学变化取胫骨骨痂组织,PBS洗涤后采用40g/L多聚甲醛固定24h,EDTA脱钙5周,常规制作5μm厚石蜡包埋切片,HE染色,并在显微镜下观察骨痂组织学变化。
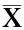
2 结 果
2.1大鼠注射部位皮下组织BMP-2蛋白的表达变化BMP-2组大鼠注射病毒部位的组织中BMP-2蛋白的表达较高。而模型组和对照组表达水平相当(图1)。

图1各组大鼠骨折处皮下组织BMP-2的表达
Fig.1BMP-2expressioninfracturesubcutaneoustissueofthethreegroups
2.2大鼠X线平片结果分析X线显示对照组大鼠胫骨未见骨折线。而模型组大鼠骨折线较为清晰,骨折部位仅有部分骨痂形成;BMP-2组大鼠胫骨骨折线基本消失,骨痂形成明显,且骨髓腔逐渐形成。对照组大鼠X线评分高于模型组和BMP-2组,而模型组评分明显低于BMP-2组,差异均有统计学意义(P<0.05,图2)。

图2各组大鼠X线片评分的比较
Fig.2ComparisonofXrayscoreinratsofthethreegroups
2.3三组大鼠骨密度分析与对照组骨密度(0.154±0.021)比较,模型组大鼠(0.137 ±0.013)显著下降,差异有统计学意义(P<0.05)。与对照组和模型组比较,BMP-2组(0.183±0.027)大鼠的骨密度显著性升高,差异有统计学意义 (P<0.05,图3)。

图3三组大鼠骨密度的比较
Fig.3Comparisonofbonedensityinratsofthethreegroups
2.4各组大鼠胫骨生物力学分析与对照组大鼠比较,模型组和BMP-2组大鼠胫骨3点弯曲参数(最大载荷、最大应力、破坏载荷和破坏应力)明显下降,差异有统计学意义(P<0.05)。与模型组比较,BMP-2组大鼠胫骨3点弯曲参数较模型组明显升高,差异有统计学意义(P<0.05,表1)。
2.5模型组和BMP-2组大鼠骨折处骨痂组织组织学变化模型组大鼠可见软骨性骨痂较多,骨小梁较细,排列稀疏紊乱;BMP-2组大鼠可见大量软骨性骨痂向骨性骨痂转变,新生形成大量编织骨小梁(图4)。
表1三组大鼠胫骨3点弯曲实验参数的比较
Tab.1Comparisonof3pointbendingexperimentparametersinratsofthethreegroups

组别最大载荷(N)最大应力(N/mm2)破坏载荷(N)破坏应力(N/mm2)对照组0.10±0.03157.25±20.340.09±0.01129.48±15.54模型组0.04±0.01*110.32±15.32*0.04±0.01*89.33±10.52*治疗组0.07±0.02*#135.44±18.22*#0.07±0.01*#110.25±13.69*#
与对照组比较,*P<0.05;与模型组比较,#P<0.05。

图4模型组和BMP-2组大鼠骨痂组织学的变化
Fig.4Thehistologicalchangesofcallusinthemodelgroupandthetreatmentgroup(×200)
3 讨 论
骨质疏松是以骨量减少、骨组织微结构破坏、骨脆性增加而容易骨折为特征的代谢性骨病[10]。全球每年骨质疏松发生骨折的数量呈现明显的增加趋势。由于骨质疏松骨脆性增加,采用内固定治疗的临床难度较大,因此,骨质疏松性骨折的治疗目前已成为临床研究的焦点和热点[11]。近年来,发现了许多能诱导成骨作用的蛋白如BMP对骨质疏松性骨折的治疗可能有一定的治疗作用。BMP蛋白是转化生长因子家族成员之一,目前大量研究结果显示BMP蛋白能诱导原始间质细胞向成骨和软骨趋化、增殖和分化,并且能诱导成骨形成[12-13]。但是,这些蛋白通过口服或者注射会被体内的蛋白酶迅速水解,不能长时间发挥其生物学作用,因此生物利用率太低。BMP-2是目前研究较多的骨形成蛋白之一。
由于传统给药治疗药物的生物利用率比较低,研究者普遍将目光转移至BMP-2的基因治疗。所谓基因治疗是指通过载体使目的基因在病变部位过表达,进而治疗疾病的技术。要实施基因治疗,选择合适的基因传输载体至关重要。病毒类载体是目前常用的介导外源基因表达的载体,其主要分为慢病毒、腺病毒、腺相关病毒、逆转录病毒和单纯性疱疹病毒[14-15]。慢病毒是目前应用较广的病毒类型之一,其具有可感染非分裂期细胞,容纳外源性基因片段大,可持续性表达等优点[16]。本研究采用慢病毒介导BMP-2基因表达治疗骨质疏松性骨折,并探讨了其治疗效果。
本研究结果显示,采用慢病毒介导的BMP-2基因在大鼠骨折部位组织注射后4d即观察到BMP-2显著表达,说明慢病毒介导的BMP-2能够在组织中表达,且能够在骨折组织局部形成高表达区域,有助于药物发挥生物学功能。对其治疗效果进行分析显示,经慢病毒介导的BMP-2治疗后能够促进骨折部位的愈合,可能是由于BMP-2蛋白的高表达促进了骨形成,进而有助于骨折部位的愈合。此外,与模型组大鼠比较,慢病毒介导的BMP-2治疗组的骨痂部位的骨密度水平明显增加,也反映了BMP-2的过表达可以促进骨形成。对大鼠骨折的胫骨进行生物力学分析,结果显示经慢病毒介导的BMP-2治疗后大鼠胫骨的最大载荷、最大应力、破坏载荷和破坏应力等生物力学参数较模型组明显增加,说明BMP-2过表达促进了骨形成和骨愈合,使骨骼承载压力的能力增加。并通过骨痂的HE染色得到了进一步证实,模型组大鼠可见软骨性骨痂较多,骨小梁较细,排列稀疏紊乱。而经慢病毒介导的BMP-2治疗组大鼠可见大量软骨性骨痂向骨性骨痂转变,新生形成大量编织骨小梁。这都说明慢病毒介导的BMP-2的过表达能够促进骨质疏松骨折部位骨形成,进而促进大鼠的骨折部位的愈合。
综上所述,慢病毒介导的BMP-2蛋白对骨质疏松性骨折具有很好的治疗效果。但是,本研究采用的慢病毒载体仅适合于进行动物基础研究,对于临床治疗仍然需要寻求更好的蛋白传输载体,以避免病毒潜在的危险。
[1]KAGEYAMAG.Thefiagnosisandtreatmentofosteoporosis[J].RinshoByori, 2015, 63(5):570-579.
[2]AGUILAREA,BARRYSD,CEFALUCA,etal.Osteoporosisdiagnosisandmanagementinlong-termcarefacility[J].AmJMedSci, 2015, 350(5):357-363.
[3]SATTUISE,SAAGKG.Fracturemortality:associationswithepidemiologyandosteoporosistreatment[J].NatRevEndocrinol, 2014, 10(10):592-602.
[4]MURPHYMK,HUEYDJ,HUJC,etal.TGF-β1,GDF-5,andBMP-2stimulationinduceschondrogenesisinexpandedhumanarticularchondrocytesandmarrow-derivedstromalcells[J].StemCells, 2015, 33(3):762-773.
[5]YUT,JIANGT,WEIQM,etal.Woundhealingeffectsofsilkfibroin-bonemorphogeneticprotein-2scaffoldsoninflammatorypulpinrats[J].JPekingUniversity, 2015, 47(5):814-819.
[6]CHENGH,JIANGW,PHILLIPSFM,etal.Osteogenicactivityofthefourteentypesofhumanbonemorphogeneticproteins(BMPs)[J].JBoneJointSurgAm, 2003, 85-A(8):1544-1552.
[7]HUZ,PEELSA,LINDHOLMTC,etal.Osteoinductivityofpartiallypurifiedbovine,ostrichandemubonemorphogeneticproteinsin vitro[J].JBiomedMaterResA, 2011, 98(3):473-477.
[8]RAHMANMS,AKHTARN,JAMILHM,etal.TGF-β/BMPsignalingandothermolecularevents:regulationofosteoblastogenesisandboneformation[J].BoneRes, 2015, 3:15005.
[9]TANNOURYCA,ANHS.Complicationswiththeuseofbonemorphogeneticprotein2 (BMP-2)inspinesurgery[J].SpineJ, 2014, 14(3):552-559.
[10]WIDLERL.Calcilytics:antagonistsofthecalcium-sensingreceptorforthetreatmentofosteoporosis[J].FutureMedChem, 2011, 3(5):535-547.
[11]BERNABEIR,MARTONEAM,ORTOLANIE,etal.Screening,diagnosisandtreatmentofosteoporosis:abriefreview[J].ClinCasesMinerBoneMetab, 2014,11(3):201-207.
[12]ZHANGX,GUOJ,WUG,etal.Effectsofheterodimericbonemorphogeneticprotein-2/7onosteogenesisofhumanadipose-derivedstemcells[J].CellProlif, 2015, 48(6):650-660.
[13]CHENC,ULUDAGH,WANGZ,etal.NogginsuppressiondecreasesBMP-2-inducedosteogenesisofhumanbonemarrow-derivedmesenchymalstemcellsin vitro[J].JCellBiochem, 2012, 113(12):3672-3680.
[14]ULRICH-VINTHERM.Genetherapymethodsinboneandjointdisorders.Evaluationoftheadeno-associatedvirusvectorinexperimentalmodelsofarticularcartilagedisorders,periprostheticosteolysisandbonehealing[J].ActaOrthopSuppl, 2007, 78(325):1-64.
[15]FRANCESCHIRT.Biologicalapproachestoboneregenerationbygenetherapy[J].JDentRes, 2005, 84(12):1093-1103.
[16]PALFIS,GURRUCHAGAJM,RALPHGS,etal.Long-termsafetyandtolerabilityofProSavin,alentiviralvector-basedgenetherapyforParkinson’sdisease:adoseescalation,open-label,phase1/2trial[J].Lancet, 2014, 383(9923):1138-1146.
(编辑国荣)
Theeffectoflentivirus-mediatedBMP-2onthetreatmentofosteoporoticfracturesZHANGJun
(DepartmentofBoneSurgery,theFirstAffiliatedHospitalof
XinxiangMedicalCollege,Xinxiang453000,China)
ObjectiveToinvestigatetheeffectoflentivirus-mediatedbonemorphogeneticprotein(BMP-2)onthetreatmentofosteoporoticfractures.MethodsWedivided30osteoporoticmodelratsintocontrolgroup,modelgroupandtherapygroup.Themodelgroupandtherapygroupwereusedtomakethelefttibialtransversefracturemodel.Inthemodelgroupandthetherapygroup,ratsweretreatedbylocalfracturesubcutaneousinjectionoflentiviruswhichwaspackedwithemptyplasmidandBMP-2plasmid.TheratsinthecontrolgroupwereinjectedwithPBSonly.Thethreegroupsofratsweresacrificedat8weeksafteroperation,theexpressionofBMP-2wasusedtoanalyzebyWesternblot.X-rayscore,bonedensity,bonebiomechanicalindexandbonestructureweremeasured.ResultsLentivirus-mediatedBMP-2genewasexpressedin vivo.Comparedwiththatinthecontrolgroup,theX-rayscoreinthemodelgroupandthetherapygroupwaslower(P<0.05).TheX-rayscorewassignificantlyhigherinthetherapygroupthaninmodelgroup(P<0.05).Thebonemineraldensityinthemodelgroupandthetherapygroupwassignificantlyreducedcomparedwiththatinthecontrolgroup,whilebonemineraldensityinthetherapygroupsignificantlyincreasedcomparedwiththatinthemodelgroup(P<0.05).Comparedwiththecontrolgroup,the3pointbendingparameters(maximumload,maximumstress,failureloadandfailurestress)inthemodelgroupandthetherapygroupsignificantlydecreased,whilethe3pointbendingparametersinthetherapygroupweresignificantlyhigherthanthoseinthemodelgroup(P<0.05).HEstainingshowedthattherewascartilagecallusandthetrabecularbonewasthinandsparseinthemodelgroup,whilealargeamountofcartilagecalluschangedintothebonycallusinthetherapygroup.ConclusionLentivirus-mediatedBMP-2canpromoteboneformationandpromotethehealingoffracturesite,whichhasagoodtherapeuticeffectonosteoporoticfracture.
lentivirus;BMP-2;osteoporosisfracture;bonemineraldensity;genetherapy;bonebiomechanical
2015-12-13
2016-04-25
张君.E-mail:zhangjunwait@sina.com
R318
A
10.7652/jdyxb201605011
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20160803.1131.010.html(2016-08-03)
