石羊河下游退耕地土壤微生物变化及土壤酶活性
2016-10-24王理德王方琳魏林源郭春秀吴春荣李发明
王理德,姚 拓,王方琳,魏林源,郭春秀,吴春荣,李发明
1 甘肃农业大学, 草业学院, 兰州 730070 2 甘肃省荒漠化与风沙灾害防治国家重点实验室培育基地, 武威 733000 3 甘肃河西走廊森林生态系统国家定位观测研究站, 武威 733000 4 草业生态系统教育部重点实验室, 兰州 730070
石羊河下游退耕地土壤微生物变化及土壤酶活性
王理德1,2,3,姚拓1,4, *,王方琳2,3,魏林源2,3,郭春秀2,3,吴春荣2,3,李发明2,3
1 甘肃农业大学, 草业学院, 兰州730070 2 甘肃省荒漠化与风沙灾害防治国家重点实验室培育基地, 武威733000 3 甘肃河西走廊森林生态系统国家定位观测研究站, 武威733000 4 草业生态系统教育部重点实验室, 兰州730070
采用时空替代法,对石羊河下游不同年限(1,2,3,4,5,8,15,24、31 a)退耕地土壤微生物(细菌、真菌和放线菌)数量、生物量(碳、氮和磷)及土壤酶(过氧化氢酶、蔗糖酶、脲酶和磷酸酶)活性变化及三者的相关性进行了测定和分析。结果表明,在退耕1—31 a的9个样地样方中土壤三大类微生物数量以细菌最高,放线菌次之,真菌最低。总体来看,三大土壤微生物数量的加权平均值最大值均在退耕后的前8 a。土壤微生物生物量碳在退耕初期随着退耕年限的增加而减小,退耕4 a后逐渐增大,退耕24 a期间达到了加权平均值的最大,最后趋于稳定;土壤微生物生物量氮在退耕初期随着退耕年限的增加而增加,退耕4 a加权平均值的最大值出现,随后逐渐减小的趋势,并且不同退耕年限土壤微生物生物量氮差异显著;土壤微生物生物量磷在退耕初期随着退耕年限的增加而增加,退耕8 a前后加权平均值达到最大值,随后逐渐减小,最终趋于稳定。土壤酶活性总趋势随着退耕地自然演替时间的增加呈波动式下降。不同土壤层次(0—10 cm,10—20 cm,20—30 cm及30—40 cm),土壤微生物数量、生物量及土壤酶活性随土层深度显著降低, 并且表层土壤微生物生物量及土壤酶活性占有较大比例。土壤微生物及土壤酶活性的变化是一个极其缓慢的互动过程,存在着互相回馈的响应,特别是真菌与放线菌、微生物量氮及蔗糖酶,放线菌与过氧化氢酶、蔗糖酶,微生物量碳与磷酸酶,微生物量氮与脲酶,微生物量磷与蔗糖酶均存在极显著的相关性。总体来看在退耕年限4—5 a前,有利于土壤发育,退耕后期土壤肥力呈下降的趋势。
石羊河下游;退耕地;土壤微生物;土壤酶活性
石羊河流域中下游地区曾经是植被茂密、物种丰富、水草特别丰美的大片绿洲[1]。但是,由于石羊河上游农业生产规模不断扩大,对水资源的需求逐年增加,流入石羊河中下游绿洲区内的水量急剧减少[2],下游地区不得不过量开采地下水来满足灌溉需水[3]。造成土地大面积弃耕而撂荒,这部分土地如果不及时保护,就会风蚀沙化,成为新的沙尘源,形成恶性循环,使土壤系统遭到破环,其结果加剧和导致石羊河中下游成为全国沙尘源区和生态危机区,不利于《甘肃石羊河流域重点治理规划》国家生态建设项目工程的实施。因此,加强对石羊河下游土壤系统的研究,不仅对该区域的生物多样性保护具有积极作用,而且对我国干旱沙区生态系统研究具有重大指导意义。
土壤微生物是生态系统的重要组成部分,虽然只占土壤营养库的小部分,但它既是养分的“库”,又是养分的“源”,是土壤生态系统的核心,直接或间接参与调节土壤养分循环[4]、能量流动[5]、有机质转换[6]、土壤肥力形成[7]、污染物的降解及环境净化[8]等,特别在生态系统物质转化和能量流动过程中起主导作用,具有巨大的生物化学活性[9]。在一定程度上能反映土壤环境状况,能较早地指示生态系统功能的变化,是评价土壤环境质量的重要参数[10]。土壤酶是土壤系统的生物催化剂,参与许多重要的生物化学过程,在土壤物质循环和能量转化过程中起着重要作用,是土壤功能的直接体现。与土壤理化性质、土壤类型、施肥、耕作以及其它农业措施等密切相关[11- 12]。土壤酶活性在一定程度上反映了土壤所处的状况,且对环境等外界因素引起的变化较敏感,成为土壤系统变化的预警和敏感指标[13],作为农业土壤质量和生态系统功能的生物活性指标已被广泛研究[14- 15]。土壤微生物与土壤酶活性一起推动着土壤生物化学过程,同时对土壤的演化具有重要影响。以前,对土壤演变的研究主要以土壤理化性质为目标[16],近年来,土壤微生物特性与土壤酶活性对土壤生态系统演变所起的作用也受到广泛的关注[14,17- 21],但在西北干旱沙区,退耕地自然恢复过程中土壤微生物与土壤酶活性相关性研究报道较少。
本研究以石羊河下游不同年限(1—31 a)退耕地为研究对象,旨在探讨其土壤微生物区系组成、土壤微生物生物量、土壤酶活性的变化特征以及它们之间的相互关系,为揭示石羊河下游退耕区土壤系统的结构和功能提供基础数据,同时为该地区的可持续发展提供理论依据。
1 材料与方法
1.1研究区概况
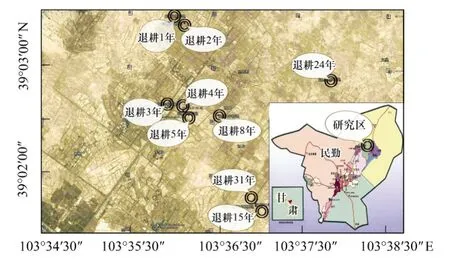
图1 研究区位置示意图Fig.1 Location of study area schematic plot
研究区位于石羊河下游的甘肃省民勤县西渠镇(图1),海拔1297—1306 m,地理坐标为39°01′44″—39°03′28″ N、103°35′58″—103°37′54″ E,研究区均为退耕地,附近居民已经搬迁或者移民。年日照时数2832.1 h,年均温度7.4℃,极端最高气温38.1℃,极端最低气温-28.8℃,昼夜温差大;年均降水量110 mm,年内分布不均匀,73%的降雨量集中在7—9月;年均蒸发量2644 mm;年平均风速2.3 m/s;土壤类型为灰棕漠土。灌木种主要有盐爪爪(Kalidiumfoliatum),苏枸杞(Lyciumruthenicum),红砂(Reamuriasoongoria)等;草本植物有藜(Chenopodiumalbum),骆驼蒿(Peganumnigellastrum),盐生草(Halogetonarachnoideus),骆驼蓬(Peganumharmala),田旋花(Convolvulusarvensis)等。
1.2样地布设
2011年11月,走访调查当地农户和查阅西渠镇煌辉村与志云村退耕土地使用记录。在此基础上采用空间替代时间的方法,在集中连片的退耕地上,选择植物生长均匀、微地形差异较小。并且土壤没有因自然因素而导致地形的变迁或因人为因素而引起的土壤物质再分配的地段,在保证样地沙土母质基本相同的情况下,分别选择退耕年限为1,2,3,4,5,8,15,24、31 a的9个样地(表1),用GPS定位,样地面积为1 hm2。在每个样地中以S形方法布设5个土样采集点,做好标记。试验区各样地之间相对高差约9 m(表1)。
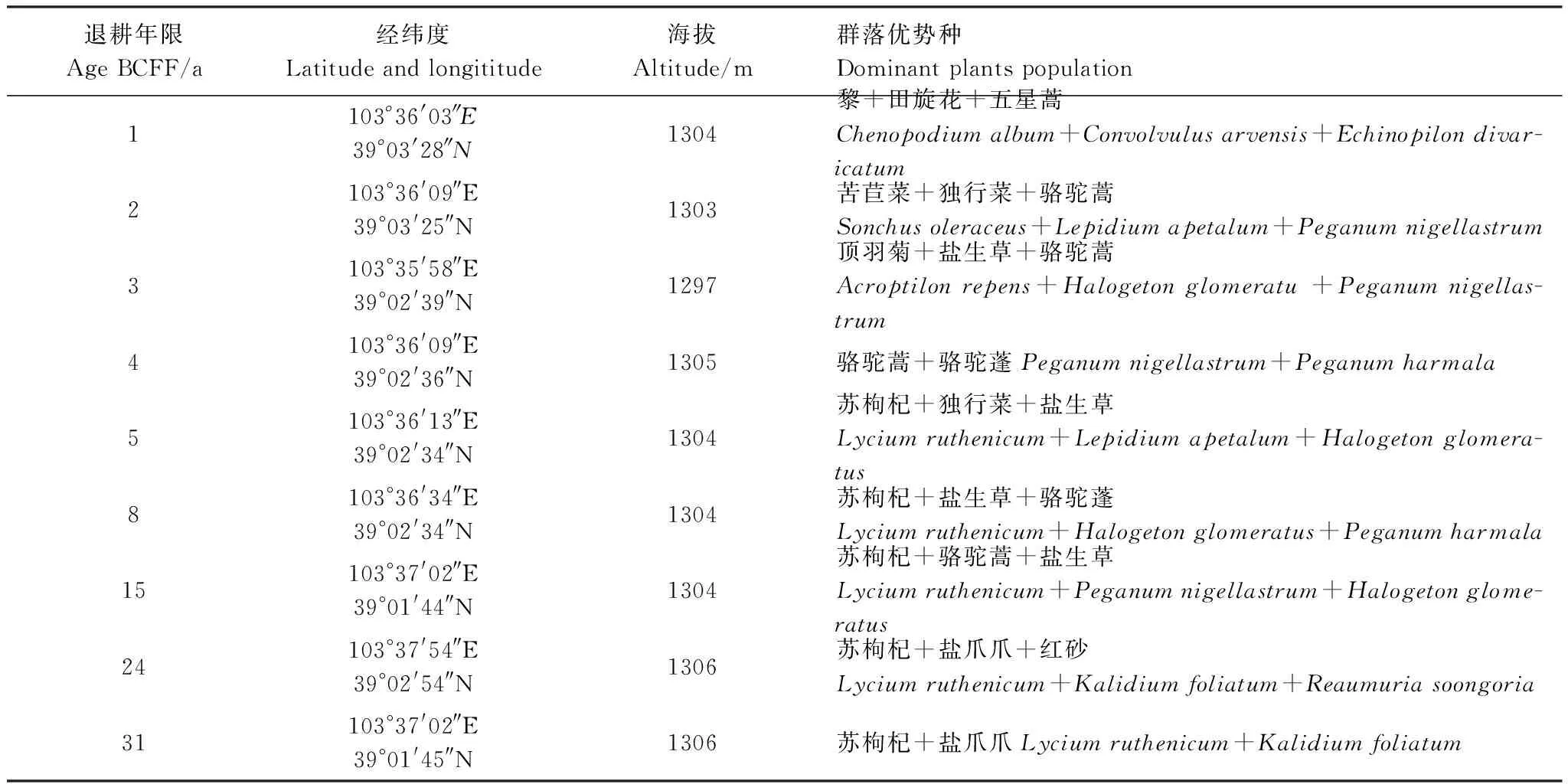
表1 不同退耕年限样地状况
1.3土壤样品采集及预处理
2012年9月22—23日,在每个样地内布设的5个土样采集点,每样点3个重复,分别采集0—10 cm、10—20 cm、20—30 cm 、30—40 cm深度的土壤样品,共108个。每个样品取重1 kg左右,装入无菌袋放于带冰块的泡沫箱内,带回实验室,贮存于4℃冰箱,用于土壤微生物数量、土壤微生物生物量及土壤酶活性的测定。
1.4土壤分析测定1.4.1土壤微生物数量测定
细菌数量测定:采用牛肉膏蛋白胨琼脂培养基,以平板表面涂抹法计数[9]。
真菌数量测定:采用马丁-孟加拉红培养基,以平板表面涂抹法计数[9]。
放线菌数量测定:采用改良高氏一号培养基[22],以平板表面涂抹法计数[9]。
1.4.2土壤微生物生物量测定
以氯仿熏蒸法[9]测定。土壤微生物生物量碳(SMBC)测定[23]。土样经氯仿熏蒸后用0.5 mol/L K2SO4溶液提取,浸提液中碳测定采用重铬酸钾硫酸外加热法。
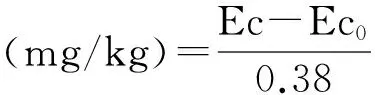
土壤微生物生物量氮(SMBN)测定[23]。土样经氯仿熏蒸后用0.5 mol/L K2SO4溶液提取,浸提液中氮测定采用凯氏定氮法。
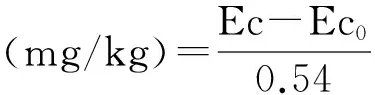
土壤微生物生物量磷(SMBP)测定[23]。土样经氯仿熏蒸后用0.5 mol/L NaHCO3溶液提取,提取液中磷测定采用钼蓝比色法。
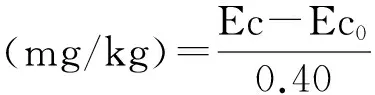
式中,Ec为熏蒸土壤浸提液中有机碳(氮、磷)量;Ec0为不熏蒸土壤浸提液中有机碳(氮、磷)量;0.38(0.54、0.40)-校正系数。
1.4.3土壤酶活性测定
过氧化氢酶活性的测定采用容量法[15],用于滴定土壤滤液所消耗的高锰酸钾量(毫升数)为B,用于滴定25 mL原始的过氧化氢混合液所消耗的高锰酸钾量(毫升数)为A。(A-B)×T即为过氧化氢酶活性。
脲酶活性的测定采用靛酚蓝比色法[24],以24 h后1 g土壤中NH3-N的毫克数表示。
蔗糖酶活性采用3,5-二硝基水杨酸比色法[24],以24 h后1 g土壤葡萄糖的毫克数表示。
磷酸酶活性用磷酸苯二钠比色法[24],以24 h后1 g土壤中释出的酚的毫克数表示。
1.4.4土壤微生物数量、微生物生物量和土壤酶活性加权平均值计算
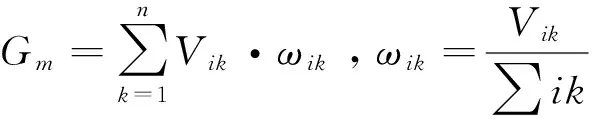
1.5数据处理
试验数据先使用 Excel软件进行统计整理,然后将整理好的数据用SPSS 18.0软件进行分析处理。不同年代退耕地土壤微生物数量、微生物量及土壤酶活性差异显著性采用单因素方差分析(one-way ANOVA)检验。上述三者之间的相关性分析采用Pearson相关。
2 结果与分析
2.1土壤微生物数量的变化
土壤三大类微生物数量反映了土壤中微生物的功能与活性。石羊河中下游不同年限退耕地土壤三大类微生物数量均表现为:细菌最高,放线菌次之,真菌最低。经方差分析,退耕年限对微生物数量无显著影响。而土层深度的变化对细菌、真菌及放线菌有极显著的差异(P<0.01),同一退耕年限,土壤三大类微生物数量均为表层大于深层,如退耕1a表层细菌、真菌及放线菌的数量分别为30—40 cm土层中的51、5.6及8.1倍。
不同退耕年限土壤微生物数量的变化,从图2和表2中可以看出,不同年限退耕地相同土层间细菌成阶梯式变化,加权平均值的最大值11.49×105cfu/g出现在第1年,加权平均值的最小值0.75×105cfu/g出现在第15年前后,从第2年到第4年、第5年到第8年以及第15年到第24年这几个时段都成阶梯式逐渐增大。真菌总体表现出随着退耕年限的增加波动式增大、再波动式减小的趋势。当退耕4 a时,达到加权平均值的最大值2.33×103cfu/g,然后随着退耕年限的增大,逐渐减小,最后趋于稳定。放线菌呈现出随着退耕年限的增加而波动式增大,最后波动式减小的趋势。在退耕1—4 a间逐渐增大,第5年时有所下降,到退耕8 a前后达到了加权平均值的最大值5.81×105cfu/g,退耕15 a期间,下降到加权平均值的最小值0.71×105cfu/g,而后逐渐趋于平稳。退耕1—31 a间,土壤微生物数量均表现出随土壤深度的增加而逐渐降低,不同层次间三大土壤微生物数量存在极显著差异(P<0.01)。
表 2 不同退耕年限土壤微生物数量
表中数据均为不同土壤层次(0—10 cm,10—20 cm,20—30 cm及30—40 cm)各指标的加权平均值
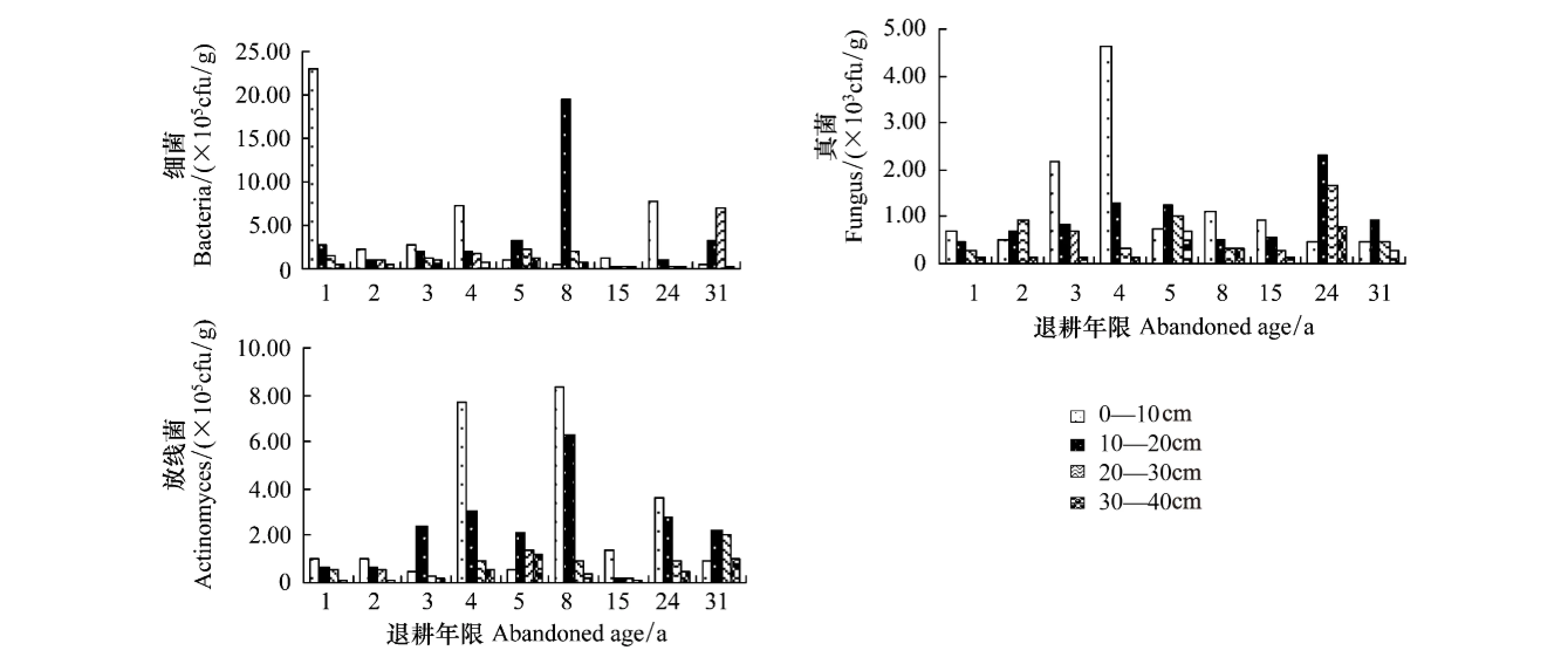
图2 不同土层不同退耕年限土壤微生物数量分布Fig.2 The quantitative distribution of soil microorganism in various soil layers at different ages since restoration
2.2土壤微生物生物量的变化
土壤微生物生物量碳、氮、磷是土壤活性养分的储存库,能灵敏的反映环境因子的变化[25]。土壤微生物生物量随着土层深度的增加,呈显出减少的变化趋势,经方差分析,各土层之间微生物生物量碳、氮、磷有极显著的差异(P<0.01)。不同退耕年限土壤微生物生物量氮差异显著(P<0.05),即退耕年限不同,微生物生物量氮亦不同。但对微生物生物量碳和微生物生物量磷差异不显著。即随着退耕年限的变化,微生物生物量碳和磷无明显变化。
不同退耕年限土壤微生物数量的变化,从图3和表3中可以看出,不同年限退耕地相同土层间土壤微生物生物量碳成阶梯式变化,加权平均值的最大值629.88mg/kg出现在第24年期间,加权平均值的最小值177.79mg/kg出现在第3年,从第1年到第3年逐渐减小,然后成逐渐增大趋势,到24 a前后趋于平稳。土壤微生物生物量氮呈现出随着退耕年限的增加而波动式减小,再波动式增大,最后波动式减小的趋势,到24 a前后趋于平稳。在退耕1—2 a逐渐减小,而后显著增大,到退耕4 a时达到了加权平均值的最大值183.73 mg/kg,然后相对趋于平稳而下降,退耕15 a前后下降到加权平均值的最小值79.92 mg/kg。微生物量磷总体表现出随着退耕年限的增加波动式增大、再波动式减小的趋势。当退耕5—8 a时,达到加权平均值的最大值121.12mg/kg左右,然后随着退耕年限的增大,逐渐减小,最后趋于稳定。退耕1—31 a间,土壤微生物生物量均表现出随土壤深度的增加而逐渐降低,不同层次间土壤微生物生物量存在极显著差异(P<0.01)。
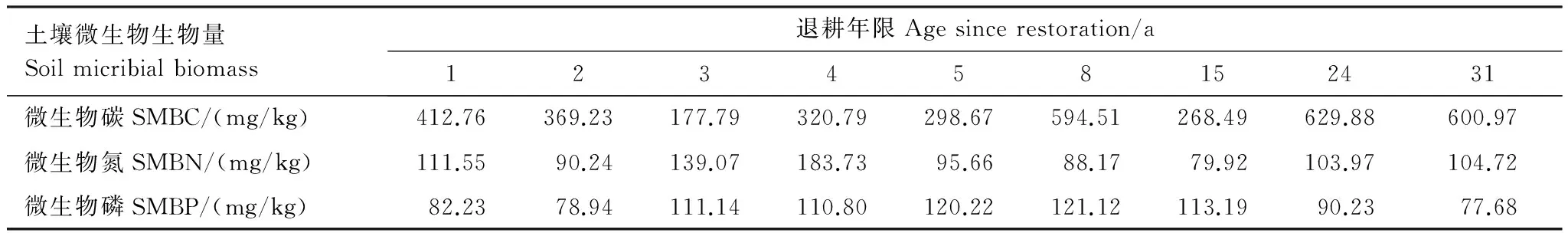
表3 不同退耕年限土壤微生物生物量
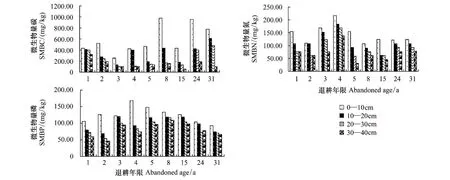
图3 不同土层不同退耕年限土壤微生物量分布Fig.3 The soil microbial biomass distribution in different soil layers at different ages since restoration
2.3土壤酶活性的变化
从图4可以看出,各层次土壤酶活性变化的总趋势为,随着土壤深度的增加而降低,即:0—10 cm>10—20 cm>20—30 cm>30—40 cm。经方差分析,退耕年限与土层深度的变化,对过氧化氢酶的活性无显著影响;而对蔗糖酶与脲酶活性有极显著的差异(P<0.01);磷酸酶的活性随着退耕年限的变化不大,但随着土壤深度的增加显著减小(P<0.01)。
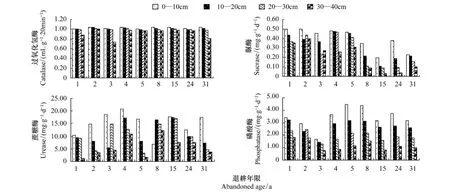
图4 不同土层不同退耕年限土壤酶分布Fig.4 The soil enzyme distribution in different soil layers at different ages since restoration
针对不同退耕年限土壤酶活性变化,从图4和表4中可以看出,不同年限退耕地相同土层间过氧化氢酶活性成波动式变化,加权平均值的最大值1.03 mL g-120min-1)出现在第2年,加权平均值的最小值0.94 mL g-120min-1出现在第3年,总体来看,不同年限退耕地其活性变化不大,相对稳定,加权平均值都在1 mL g-120min-1左右。脲酶活性呈现出随着退耕年限的增加而波动式减小趋势,最后趋于稳定。退耕5年后,波动幅度较大,明显减小,退耕15 a前后,达到加权平均值的最小值0.12 mg g-1d-1,最后趋于相对平稳。蔗糖酶活性总体表现出随着退耕年限的增加波动式增大、再波动式减小的趋势。当退耕4 a时,蔗糖酶活性达到加权平均值的最大值16.51 mg g-1d-1,当退耕时间达到15 a期间其活性逐渐减小,最后趋于稳定。磷酸酶活性呈现出随着退耕年限的增加而波动式减小,再波动式增大,最后相对的趋势。在退耕1 a到3 a间逐渐减小,而后显著增大,到退耕5—8 a时达到了加权平均值的最大值3.17 mg g-1d-1左右,退耕15 a前后,磷酸酶活性相对平稳。
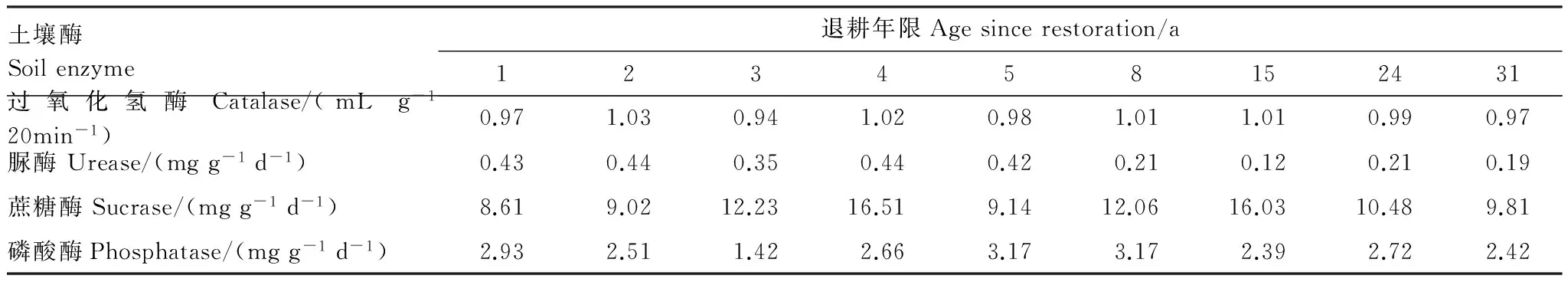
表4 不同退耕年限土壤酶活性数值
3 讨论与结论
3.1土壤微生物数量的变化规律
土壤微生物数量与其所处土壤各相关因子的变化密不可分。本研究中,土壤三大类微生物数量基本都是细菌最高,放线菌次之,真菌最低,这说明细菌是优势菌,这个结论印证了谭宏伟[18]、马文文[20]、王少昆[21]、逄蕾[26]等的观点。石羊河下游流域土壤中性偏碱性,同时生长的植被分泌物,适宜细菌的生长繁殖,而不利于真菌的生存,因此细菌数量远大于真菌数量。不同退耕年限9个样地相比较,退耕1 a的土地中细菌数量最多,而真菌数量最少,放线菌数量居中,这与总的微生物数量的变化趋势相一致;退耕4 a的土地中真菌数量最大,细菌与放线菌数量居中;退耕8 a期间土地中放线菌数量最大,细菌与真菌数量居中。总体来看,三大土壤微生物的加权平均值的最大值均在退耕后的前8 a,这是由于,退耕1—8 a耕作施肥等农业管理措施刚停止或者停止时间不长,土壤有机质含量和其他相关因子较高[27],1 a生草本植物迅速生长,占据优势[28],土壤微生物生长旺盛;随着退耕年限的增加,特别是退耕4—5 a后,土壤湿度减小,土壤全氮、铵态氮和有机质等其它因子含量下降[27,29- 30],限制了土壤微生物的活动。
在土壤层次上,除退耕2 a土壤中真菌的加权平均值的最大值出现在20—30 cm土层外,其余各退耕年限三大土壤微生物的加权平均值的最大值均出现在0—10 cm及10—20 cm土壤层,总的变化趋势是随土壤深度的增加三大土壤微生物数量逐渐减小。该结果与谭宏伟[18]、马文文[20]、文都日乐等[31]研究得出的土壤微生物空间变化规律相似。其原因与各土层中有机质含量以及土壤的水分含量直接相关[32]。
3.2土壤微生物微生物量的变化规律
土壤微生物生物量反映了土壤中微生物的功能与活性,同时,微生物量与其所处土壤各相关因子的变化密不可分。对研究区9个样地相比较,土壤微生物生物量碳的加权平均值的最大值629.88 mg/kg出现在退耕后24 a期间,而此时土壤微生物生物量氮与土壤微生物生物量磷居中;退耕4 a的土地中微生物量氮值(183.73 mg/kg)最大,微生物量碳与微生物量磷居中;退耕8 a左右土地中微生物量磷值(121.12 mg/kg)最大,微生物量碳与微生物量居中。土壤微生物生物量是土壤中活的有机质,是土壤养分重要来源。土壤微生物生物量碳加权平均值的最大值出现在退耕后的24 a期间,说明土壤微生物生物量碳的聚集是一个漫长的过程,到24 a前后才能达到加权平均值的最大值;土壤微生物生物量氮的加权平均值的最大值出现在退耕后的4 a,说明退耕4 a时,土壤肥力水平达到了最好状态,到退耕5 a时,又恢复到退耕3 a时的状况,可能与退耕最后一年种植的不同农作物有关,退耕4 a的土地,最后一年种植豆科的紫花苜蓿(MedicagosativaL.),其余土地种植的农作物是西瓜(Citrulluslanatus)、茴香(Foeniculumvulgare)、棉花(Gossypiumspp)等,这一现象的出现,正好与种植豆科植物可以改良土壤相吻合,说明退耕地土壤肥力的状况与退耕最后一年种植的农作物有密切的关系;土壤微生物生物量磷加权平均值的最大值虽然出现在退耕后的5—8 a,但变化不在,退耕3 a到15 a期间都在加权平均值110 mg/kg与120 mg/kg上下波动,说明土壤微生物生物量磷受退耕年限的影响不明显,可能原因是磷在土壤中的形态较为复杂,并且土壤磷素分布受到成土母质中矿物成分、地貌、土地利用方式等多种因素的影响,几乎不受自然环境和植被的影响[20,33]。其具体原因有待进一步的研究。
在土壤层次上,微生物量磷呈现出随着土层深度增加而土壤微生物生物量减小的趋势。同时也发现,0—10 cm土层的微生物量在4层总的微生物量中占有较大的比例。谭宏伟[18]、马文文[20]、文都日乐等[31]研究也发现了相似的规律。主要是由于土壤表层有少量的枯枝落叶和腐殖质,有机质含量高,再加上表层温度条件和通气状况良好,微生物旺盛生长,代谢活跃,使表层的土壤微生物生物量增加[19- 20]。
3.3土壤酶活性的变化规律
对9个样地相比较,退耕2 a的土壤中过氧化氢酶与脲酶的活性最强,而蔗糖酶与磷酸酶活性居中;退耕4 a的土壤中蔗糖酶与脲酶活性最强,过氧化氢酶与磷酸酶活性居中;退耕5 a的土壤中磷酸酶活性最强,蔗糖酶活性较弱,过氧化氢酶与脲酶活性居中。因此,根据各种酶的功能特征,退耕2 a的土壤对防止H2O2的毒害最为有效,最有利于土壤含氮化合物的水解与转化;退耕4 a的土壤熟化程度最高;退耕5 a的土壤有利于加快有机磷的脱磷速度。总体来看,四种土壤酶的加权平均值的最大值均在退耕后的前5 a,这是由于,退耕1—5 a耕作施肥刚刚停止,土壤有机质含量和其他相关因子较高[27,29],土壤酶的活性较强;退耕4—5 a后,全氮、铵态氮、土壤有机质、全磷等其他因子含量下降[29],脲酶、磷酸酶的活性功能也随之减小。根据退耕年限与四种酶活性的相关性分析,蔗糖酶与退耕年限表现出极显著的正相关,相关系数为53.4%;脲酶与退耕年限表现出极显著的负相关,相关系数达到86.2%。这说明土壤酶活性用来表征干旱区土壤肥力状况是可行的,同时说明,退耕4—5 a后虽然土壤的熟化程度越大,但土壤的肥力呈下降的趋势[30],这一现象的出现与草原撂荒地土壤理化特性随着撂荒时间延长而增加的现象相反[34]。石羊河下游地区,土层浅薄,退耕4年后,土壤团聚性降低,土壤质地变粗[30],就会风蚀沙化,生态环境一旦遭到破坏,则难以恢复。因此,退耕4—5 a撂荒地合理利用与修复值得高度重视。
在土壤层次上,随土壤深度的增加四种土壤酶活性逐渐减小。同时也发现,0—10 cm土层的酶活性在4层总酶活性中占有较大的比例。该结果与文都日乐等[31]、符裕红[35]、秦燕等[36]、王理德[37]研究得出的土壤酶活性垂直变化的特点相一致。其原因,由于石羊河下游土壤肥力较差,只有表层有少量的枯枝落叶和腐殖质,可以支持微生物的生长,表层温度条件和通气状况良好,一旦遇到降雨,微生物旺盛生长,代谢活跃,使表层的土壤酶活性提高。研究区干旱少雨,自然降雨只能贮藏于土壤表层,随着土壤剖面的加深,土壤水分显著减少,土壤温度降低,土壤密度增加,有机质和腐殖质数量减少,限制了土壤微生物的正常活动及代谢产酶能力[38]。由于这些因素的综合作用,使得土壤酶活性随着土层的加深而逐渐降低,而且,表层土壤酶活性所占比例较大。
也有学者研究认为土壤脲酶活性[39]与土壤氧化氢酶活性[40]随土层的增加而逐渐升高,还有学者认为它们的变化不明显,没有表现出规律性[41]。研究结果相异,主要是因为研究区土壤、气象及环境不同而不同。
3.4土壤微生物数量、微生物量及酶活性的相关性
对石羊河流域下游退耕地土壤微生物数量、微生物量和土壤酶活性进行相关性分析结果如表5所示。土壤微生物数量与土壤微生物生物量之间的相关性结果显示,土壤微生物生物量碳与放线菌呈显著正相关(P<0.05);土壤微生物生物量氮与三大土壤微生物数量均呈显正相关,并与真菌呈现出极显著正相关(P<0.01),相关系数达到了90%以上;土壤微生物生物量磷与细菌呈显著负相关、与放线菌呈显著正相关(P<0.05),而与真菌无显著相关性。
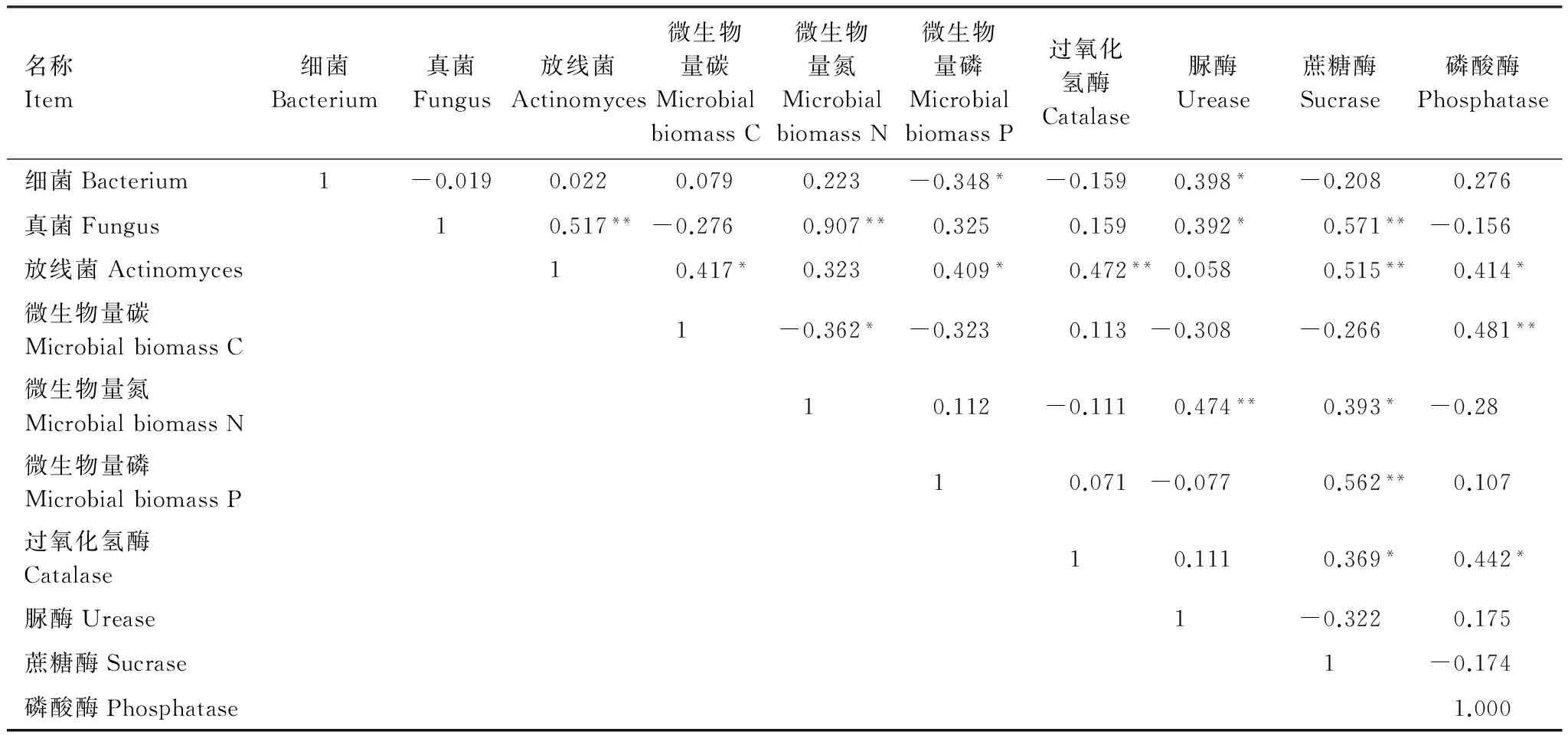
表5 各指标之间的相关性
* 表示显著相关(P<0.05),** 表示极显著相关(P<0.01)
土壤微生物数量与土壤酶之间的相关性结果表明,土壤细菌与脲酶呈显著正相关(P<0.05),而与其它3种土壤酶无显著的相关性;真菌与蔗糖酶呈极显著正相关(P<0.01),与脲酶呈显著正相关(P<0.05),而与过氧化氢酶和磷酸酶无显著相关性;放线菌与过氧化氢酶和蔗糖酶呈极显著正相关(P<0.01),与磷酸酶呈显著正相关(P<0.05)。
土壤微生物生物量与土壤酶之间的相关性结果表明,土壤微生物碳只与磷酸酶呈现出极显著正相关(P<0.01),而与其余3种酶无显著的相关性;土壤微生物氮与脲酶呈极显著正相关(P<0.01),与蔗糖酶呈显著正相关(P<0.05),而与过氧化氢酶和磷酸酶呈负相关;微生物磷只与蔗糖酶呈现出极显著正相关(P<0.01),而与其余3种酶无显著相关性。
三大类微生物之间只有真菌与放线菌呈极显著正相关(P<0.01),其它之间都没有显著相关性;微生物量碳、氮、磷之间也只有微生物量碳与微生物量氮呈显著负相关(P<0.05),其余之间也无显著相关性;四种酶彼此之间只有过氧化氢酶与蔗糖酶和磷酸酶呈现出显著的正相关(P<0.05),其余各土壤酶之间也无显著相关性。
土壤微生物数量、土壤微生物生物量和土壤酶活性反映了土壤的营养状况,三者在一定程度上可以反映土壤肥力状况及其生产力水平[42]。石羊河下游退耕地土壤微生物数量、微生物量和酶活性之间有不同程度的相关性。特别是真菌与放线菌、微生物量氮、蔗糖酶,放线菌与过氧化氢酶、蔗糖酶,微生物量碳与磷酸酶,微生物量氮与脲酶,微生物量磷与蔗糖酶均存在极显著的相关性。微生物数量、微生物量和酶活性对土壤养分的转化和供应起重要作用[43],且三者之间密切联系、彼此影响。放线菌与土壤磷酸酶存在显著的正相关(P<0.05),表明微生物促进胞外磷酸酶的分泌[44]。土壤微生物生物量氮与脲酶活性呈极显著正相关(P<0.01),这表明土壤中存在着一些固氮微生物,其数量的增加将促进对土壤氮的固定,从而为脲酶提供了底物,提高了脲酶活性,使其矿化成无机氮,土壤微生物吸收后转化成土壤微生物生物量氮,微生物量氮是土壤有机—无机态氮转化的一个关键环节[44]。
土壤演变是极其复杂而又缓慢的过程,石羊河流域下游退耕地在31 a的自然恢复过程中,土壤微生物数量表现为细菌数量最多,是该地区的优势菌,放线菌数量次之,真菌数量最少。退耕4 a时,土壤的熟化程度和土壤肥力水平达到了最好状态。土壤微生物数量、土壤微生物生物量碳、氮、磷含量及土壤酶活性随土层的加深而降低,两两之间都存在不同程度的相关性。退耕4—5 a年后,土壤的肥力呈下降的趋势。因此,退耕4—5 a后,土地修复、利用及荒漠化治理是关键时候。
致谢:北京林业大学吴江梅教授对写作给予帮助,特此致谢。
[1]冯绳武. 民勤绿洲的水系演变. 地理学报, 1963, 29(3): 241- 249.
[2]苏志珠, 卢琦, 吴波, 靳鹤龄, 董光荣. 气候变化和人类活动对我国荒漠化的可能影响. 中国沙漠, 2006, 26(3): 329- 335.
[3]李丁, 马金珠, 南忠仁. 民勤盆地地下水水位下降特征与可持续利用评价. 中国沙漠, 2004, 24(6): 734- 739.
[4]Petersen D G, Blazewicz S J, Firestone M, Herman D J, Turetsky M, Waldrop M. Abundance of microbial genes associated with nitrogen cycling as indices of biogeochemical process rates across a vegetation gradient in Alaska. Environmental Microbiology, 2012, 14(4): 993- 1008.
[5]Pratscher J, Dumont M G, Conrad R. Ammonia oxidation coupled to CO2fixation by archaea and bacteria in an agricultural soil. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(10): 4170- 4175.
[6]Jackson L E, Bowles T M, Hodson A K, Lazcano C. Soil microbial-root and microbial-rhizosphere processes to increase nitrogen availability and retention in agroecosystems. Current Opinion in Environmental Sustainability, 2012, 4(5): 517- 522.
[7]Hadar Y, Papadopoulou K K. Suppressive composts: microbial ecology links between abiotic environments and health y plants. Annual Review of Phytopathology, 2012, 50: 133- 153.
[8]Kuzyakov Y, Xu X. Competition between roots and microorganisms for nitrogen: mechanisms and ecological relevance. New Phytologist, 2013, 198(3): 656- 669.
[9]许光辉, 郑洪元. 土壤微生物分析方法手册. 北京: 农业出版社, 1986.
[10]付勇, 庄丽, 王仲科, 刘鸯, 李勇冠. 新疆野生多伞阿魏生境土壤理化性质和土壤微生物. 生态学报, 2012, 32(10): 3279- 3287.
[11]周礼恺. 土壤酶学. 北京: 科学出版社, 1987.
[12]Paul E A, Clack F E. Soil Microbiology and Biochemistry. New York: Academic Press, 1998: 104- 109.
[13]Badiane N N Y, Chotte J L, Pate E, Masse D, Rouland C. Use of soil enzyme activities to monitor soil quality in natural and improved fallows in semiarid tropical regions. Applied Soil Ecology, 2001, 18(3): 229- 238.
[14]邱东, 程争鸣, 张元明, 吴楠, 牟书勇, 齐晓玲, 潘惠霞. 寡营养细菌对古尔班通古特沙漠土壤环境的影响. 干旱区研究, 2012, 29(1): 148- 154.
[15]关松荫. 土壤酶及其研究法. 北京: 农业出版社, 1986.
[16]赵哈林, 周瑞莲, 赵学勇, 张铜会, 王进. 呼伦贝尔沙质草地土壤理化特性的沙漠化演变规律及机制. 草业学报, 2012, 21(2): 1- 7.
[17]杨成德, 龙瑞军, 陈秀蓉, 徐长林, 薛莉. 东祁连山高寒灌丛草地土壤微生物量及土壤酶季节性动态特征. 草业学报, 2011, 20(6): 135- 142.
[18]谭宏伟, 杨尚东, 吴俊, 刘永贤, 熊柳梅, 周柳强, 谢如林, 黄国勤, 赵其国. 红壤区桉树人工林与不同林分土壤微生物活性及细菌多样性的比较. 土壤学报, 2014, 51(3): 575- 584.
[19]刘艳梅, 杨航宇, 李新荣. 生物土壤结皮对荒漠区土壤微生物生物量的影响. 土壤学报, 2014, 51(2): 394- 401.
[20]马文文, 姚拓, 靳鹏, 王国基, 张玉霞. 荒漠草原2种植物群落土壤微生物及土壤酶特征. 中国沙漠, 2014, 34(1): 176- 183.
[21]王少昆, 赵学勇, 张铜会, 李玉强, 连杰, 黄文达, 云建英. 造林对沙地土壤微生物的数量、生物量碳及酶活性的影响. 中国沙漠, 2013, 33(2): 529- 535.
[22]中国科学院南京土壤研究所微生物室. 土壤微生物研究法. 北京: 科学出版社, 1985.
[23]杨成德. 祁连山不同高寒草地型土壤微生物生物量及土壤理化性质分异特征研究[D]. 兰州: 甘肃农业大学, 2007.
[24]姚槐应, 黄昌勇. 土壤微生物生态学及其实验技术. 北京: 科学出版社, 2007.
[25]王学娟, 周玉梅, 王秀秀, 江肖洁, 韩士杰. 长白山苔原生态系统土壤酶活性及微生物生物量对增温的响应. 土壤学报, 2014, 51(1): 166- 175.
[26]逄蕾, 肖洪浪, 谢忠奎, 柴守玺, 路建龙, 周茅先, 常磊, 王亚军. 砂田不同覆盖方式对土壤微生物组成的影响. 中国沙漠, 2012, 32(2): 351- 358.
[27]王俊年, 郭树江, 李得禄, 王理德. 石羊河流域下游不同年代退耕地土壤养分和盐分变异特征研究. 中国农学通报, 2012, 28(26): 211- 216.
[28]何芳兰, 李治元, 赵明, 尉秋实, 郭树江, 王多泽. 民勤绿洲盐碱化退耕地植被自然演替及土壤水分垂直变化研究. 中国沙漠, 2010, 30(6): 1374- 1380.
[29]韩福贵, 王理德, 王芳琳, 张莹花, 何芳兰, 郭春秀, 魏林源. 石羊河流域下游退耕地土壤酶活性及土壤肥力因子的相关性. 土壤通报, 2014, 45(6): 1025- 1030.
[30]郭春秀, 王理德, 韩福贵, 马剑平, 何芳兰, 刘淑娟, 王方琳, 张莹花, 魏林源. 石羊河下游民勤绿洲不同年限退耕地土壤物理性质变化研究. 中国农学通报, 2014, 30(27): 72- 76.
[31]文都日乐, 李刚, 张静妮, 赖欣, 易津, 范国艳, 杨殿林. 呼伦贝尔不同草地类型土壤微生物生物量及土壤酶活性研究. 草业学报, 2010, 19(5): 94- 102.
[32]陈祝春, 李定淑. 固沙植物根际微生物对于沙土发育和流沙固定的影响. 生态学杂志, 1987, 6(2): 6- 12.
[33]王丰. 武夷山不同海拔植被带土壤微生物生物量碳、氮、磷研究[D]. 南京: 南京林业大学, 2008: 2- 5.
[34]李永强, 赵萌莉, 韩国栋, 焦树英. 不同年限草原撂荒地土壤理化特性研究. 中国草地学报, 2012, 34(3): 61- 64, 69- 69.
[35]符裕红, 黄宗胜, 喻理飞. 岩溶区典型根系地下生境类型中土壤酶活性研究. 土壤学报, 2012, 49(6): 1202- 1209.
[36]秦燕, 牛得草, 康健, 曹格图, 张斯莲, 傅华. 贺兰山西坡不同类型草地土壤酶活性特征. 干旱区研究, 2012, 29(5): 870- 877.
[37]王理德, 姚拓, 何芳兰, 韩福贵, 郭春秀, 王方琳, 魏林源. 石羊河下游退耕区次生草地自然恢复过程及土壤酶活性的变化. 草业学报, 2014, 23(4): 253- 261.
[38]秦纪洪, 张文宣, 孙辉, 王琴. 亚高山森林土壤酶活性的温度敏感性特征. 土壤学报, 2013, 50(6): 1241- 1245.
[39]郭明英, 朝克图, 尤金成, 徐丽君, 王丽娟, 贾淑杰, 辛晓平. 不同利用方式下草地土壤微生物及土壤呼吸特性. 草地学报, 2012, 20(1): 42- 48.
[40]李林海, 邱莉萍, 梦梦. 黄土高原沟壑区土壤酶活性对植被恢复的响应. 应用生态学报, 2012, 23(12): 3355- 3360.
[41]杨梅焕, 曹明明, 朱志梅. 毛乌素沙地东南缘沙漠化过程中土壤酶活性的演变研究. 生态环境学报, 2012, 21(1): 69- 73.
[42]Pajares S, Gallardo J F, Masciandaro G, Ceccanti B, Etchevers J D. Enzyme activity as an indicator of soil quality changes in degraded cultivated Acrisols in the Mexican trans-volcanic belt. Land Degradation & Development, 2010, 22(3): 373- 381.
[43]Moscatelli M C, Fonck M, De Angelis P, Larbi H, Macuz A, Rambelli A, Grego S. Mediterranean natural forest living at elevated carbon dioxide: Soil biological properties and plant biomass growth. Soil Use and Management, 2001, 17(3): 195- 202.
[44]玛伊努尔·依克木, 张丙昌, 买买提明·苏来曼. 古尔班通古特沙漠生物结皮中微生物量与土壤酶活性的季节变化. 中国沙漠, 2013, 33(4): 1091- 1097.
Soil microbial and soil enzyme activity in a discontinued farmland by the Lower Shiyang River
WANG Lide1,2,3, YAO Tuo1,4,*, WANG Fanglin2,3, WEI Linyuan2,3, GUO Chunxiu2,3, WU Chunrong2,3, LI Faming2,3
1PrataculturalCollegeofGansuAgriculturalUniversity,Lanzhou730070,China2StateKeyLaboratoryBreedingBaseofDesertificationandAeolianSandDisasterCombating,Wuwei733000,China3GansuHexiCorridorForestEcosystemNationalResearchStation,Wuwei733000,China4KeylaboratoryofGrasslandEcosystem,MinistryofEducation,Lanzhou730070,China
To better understand the changes in soil conditions after agriculture use ceases, we measured and analyzed the changes in three components—soil microbial quantity, soil microbial biomass, and soil enzyme activity—in sample sites where farming had been discontinued for different periods (1, 2, 3, 4, 5, 8, 15, 24 and 31 years), in the lower Shiyang River area. By using the data, the correlations between the three components were also studied in 2012. The three components, respectively, contained 1) bacteria, fungi, and actinomycetes; 2) microbial biomass carbon, microbial biomass nitrogen, and microbial biomass phosphorus; and 3) catalase, sucrase, urease, and phosphatase. Synchronic space investigation was adopted instead of diachronic temporal investigation. Results showed that bacteria were the most abundant of the three soil microorganisms in the nine soil samples taken 31 years after farming ceased, followed by actinomycetes and fungi. Overall, the maximum weighted average of the three soil microbial quantities all occurred in the first 8 years after farming ceased. The quantity of soil microbial biomass carbon initially decreased with increasing time since farming ceased. It gradually increased starting in the 4thyear and reached the peak in the 24thyear, after which it became stable. The soil microbial biomass nitrogen appeared to increase with time. After the maximum weighted average in the 4thyear, there was a steady reduction with large significant differences in soil microbial biomass nitrogen among soil sites of various ages. The weighted average soil microbial biomass phosphorus increased at the same pace as nitrogen at the beginning of the soil restoration period. The biomass phosphorus level climaxed at the 8thyear, after which it tended to decline gradually before finally stabilizing. The general trend of soil enzyme activity decreased, but with fluctuations, with increasing soil succession age. Moreover, soil microbial quantity, soil microbial biomass, and soil enzyme activity declined dramatically in all restoration ages with soil depth from 0 to 10 cm, 10 to 20 cm, and 20—30 to 30—40 cm. In addition, the surface soil microbial biomass and soil enzyme activity were the largest among the four soil levels. The changes in soil microbial quantity, soil microbial biomass, and soil enzyme activity were extremely slow. In addition, an interactive process and a feedback response between the three components was observed. Highly significant correlations were found, especially between fungi and actinomycetes, microbial biomass nitrogen and sucrase, actinomycetes and catalase and sucrase, microbial biomass carbon and phosphatase, microbial biomass nitrogen and urease, and microbial biomass phosphorus and sucrose. To summarize, we noted an improvement in the soil conditions in the initial 4-5 years after ceasing agricultural practice, followed by a declining trend in soil fertility.
lower Shiyang River; former agricultural land; soil microbes; soil enzyme activity
国家自然科学基金项目(41161049, 31360584, 31160264)
2014- 12- 28; 网络出版日期:2015- 11- 16
Corresponding author.E-mail: yaotuo@gsau.edu.cn
10.5846/stxb201412282593
王理德,姚拓,王方琳,魏林源,郭春秀,吴春荣,李发明.石羊河下游退耕地土壤微生物变化及土壤酶活性.生态学报,2016,36(15):4769- 4779.
Wang L D, Yao T, Wang F L, Wei L Y, Guo C X, Wu C R, Li F M.Soil microbial and soil enzyme activity in a discontinued farmland by the Lower Shiyang River.Acta Ecologica Sinica,2016,36(15):4769- 4779.
