培美曲塞或多西他赛联合顺铂治疗晚期肺腺癌的疗效和不良反应
2016-10-24孙国平
王 慧,孙国平
培美曲塞或多西他赛联合顺铂治疗晚期肺腺癌的疗效和不良反应
王慧1,2,孙国平1
目的比较培美曲塞或多西他赛联合顺铂一线治疗突变状态未知的晚期肺腺癌的临床疗效、反应及生存期。方法70例晚期肺腺癌患者,分别应用PP组(培美曲塞+顺铂)及DP组(多西他赛+顺铂)治疗。PP组35例,第1天静脉注射培美曲塞500 mg/m2;DP组35例,第1天静脉注射多西他赛75 mg/m2。第2~4天两组均联合顺铂25 mg/m2静脉滴注。21 d为1个周期,每例至少完成2周期后评价疗效及不良反应。结果PP组中位无进展生存期8个月,中位生存时间14.3个月,1年生存率62.8%。DP组中位无进展生存期7个月,中位生存时间13.3个月,1年生存率65.7%。两组比较差异均无统计学意义。PP组血液学、消化道和肾功能毒性发生率明显低于DP组(P<0.05)。结论PP或DP一线治疗晚期肺腺癌疗效相当,PP组不良反应较低,适合对于化疗耐受性不佳的患者。
培美曲塞; 多西他赛; 肺腺癌;疗效; 不良反应
肺癌是最常见的恶性肿瘤之一,发生和死亡率居肿瘤第1位。非小细胞肺癌一般早期无特异症状,常常被忽视,且发现时多为晚期,并伴有远处转移,多失去手术机会;化疗是主要治疗手段。目前,针对晚期肺腺癌一般都取病灶标本行表皮生长因子受体(epidermal growth factor receptor,EGFR)和间变性淋巴瘤激酶(anaplasticlymphomakinase, ALK)基因检测。如有EGFR基因突变和ALK基因突变可首选EGFR酪氨酸激酶抑制药(EGFR-TKI)和ALK抑制药口服治疗。对于首诊时突变状态未知或野生情况下的晚期肺腺癌则首选化疗。以铂类为基础的双药联合化疗方案,为公认的化疗一线方案。临床上多采用第3代化疗药物培美曲塞或多西他赛联合铂类。晚期肺腺癌患者体力状况较差,对化疗耐受性较差。本研究对晚期肺腺癌治疗的两种方案进行了对比研究,旨在为寻找既有较好的疗效,不良反应又小,更适合这些患者的化疗方案。
1 对象与方法
1.1对象选择2011-01至2014-12安徽省马鞍山市人民医院资料完整的晚期肺腺癌患者,共70例。纳入标准:(1)经病理学确诊的、初治的晚期(Ⅲ或Ⅳ期)不能手术或不愿意手术的肺腺癌患者;(2)至少有一个客观可测量的肿瘤病灶;(3)ECOG评分≤1分,预期生存时间≥3个月;(4)治疗前血常规、肝肾功能、电解质、心电图基本正常。采用PP方案(PP组,n=35)及DP方案(DP组,n=35)化疗。两组一般资料比较,差异无统计学意义(表1)。

表1 培美曲塞(PP组)或多西他赛(DP组)联合顺铂一线治疗晚期肺腺癌的一般资料比较 ;(n;%)]
1.2治疗方法PP组:生理盐水100 ml+培美曲塞500 mg/m2,第1天静脉滴注,顺铂25 mg/m2,第2~4天静脉滴注。自化疗前1周开始口服叶酸片400 μg/d,并肌注维生素B121000 μg/次,每9周1次,为预防皮疹,在培美曲塞使用前1 d、当天、第2天服用地塞米松4 mg, 2次/d。DP组:生理盐水250 ml+多西他赛75 mg/m2,第1天静脉滴注,顺铂25 mg/m2,第2~4天静脉滴注。为预防液体储留综合征,在多西他赛使用前1d,当天,第2天服用地塞米松8 mg,2次/d。两组用药前常规给予阿扎司琼10 mg静脉滴注止吐治疗,均为每21 d为一疗程,至少治疗2个疗程后评价近期疗效和不良反应。
1.3疗效评价标准两组患者化疗2个疗程后,评价疗效。根据RESIST(1.1)实体瘤疗效评价标准[1]:分为完全缓解(CR)、部分缓解(PR)、病情稳定(SD)和疾病进展(PD)。总有效率(RR)=CR+PR。根据WHO对于抗癌药物急性与亚急性毒性反应分度标准评价不良反应,共分为0-Ⅳ度。
1.4统计学处理应用SPSS 21统计软件进行统计学分析,计量资料采用t检验或Wilcoxon秩和检验,计数资料采用χ2检验比较两组差异;Kaplan-Meier法进行生存分析。以P<0.05为差异有统计学意义。
2 结 果
2.1疗效比较两组最多均完成6个周期化疗,均无CR病例。PP组治疗总周期为164个,平均(4.7±1.6)个周期。DP组治疗总周期147个,平均(4.2±1.5)个周期,两组比较,无统计学差异(t=1.328,P=0.559)。 疗效方面:PP组PR16例(45.7%),SD12例(34.3%),PD 7例(20.0%)。DP组PR14例(40.0%),SD11例(31.4%),PD10例(28.6%)。疾病控制率分别为80.0%和71.4%,两组比较差异无统计学意义(χ2=0.699,P=0.403)。
2.2进展时间和生存时间比较截止时间为2015-07。PP组患者中位无进展生存时间为8个月,DP组中位无进展生存时间为7个月,差异无统计学意义(P=0.523,图1)。PP组中位生存时间为14.3个月,DP组中位生存时间为13.3个月,差异无统计学意义(P=0.469,图2)。两组的1年生存率分别为62.9%和65.7%,无统计学差异(P=0.803)。

图1 研究组(PP组)和对照组(DP组)患者的无进展生存率比较
2.3不良反应两组主要不良反应为血液学毒性和非血液性毒性。PP组中性粒细胞、血红蛋白下降发生率均低于DP组,血小板下降无差异。PP组恶心呕吐的胃肠道反应发生率低于DP组,肾功能异常、脱发发生率低于DP组,PP组疲乏感明显低DP组。PP组腹泻、肝功能异常、皮疹发生率较DP组无差异(表2)。
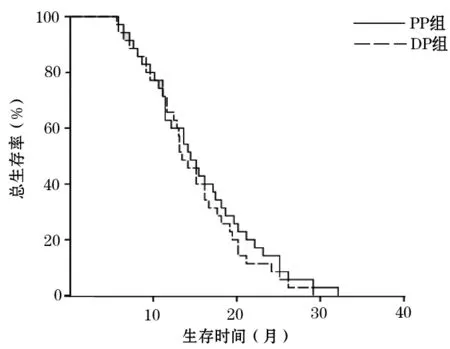
图2 研究组(PP组)和对照组(DP组)患者的总生存率比较

表2 培美曲塞(PP组)或多西他赛(DP组)联合顺铂一线治疗晚期肺腺癌的不良反应比较 (n;%)
3 讨 论
肺癌是一种严重威胁人类健康的疾病,发病率和死亡率均为癌症之首,其中80%~85%为非小细胞肺癌[2]。这些患者中,超过60%初始发现时肿瘤已失去手术治疗或根治性放射治疗的机会[3]。化疗成为主要治疗手段,且效果肯定。1995年的一项覆盖了52个随机对照试验的Meta分析,结果显示含铂双药联合的化疗对比最佳支持治疗,延长了晚期非小细胞肺癌的生存期,改善了生活质量[4]。20世纪90年代开发的第3代化疗药物,如紫杉醇、多西他赛、吉西他滨、长春瑞滨,一项覆盖45个随机对照试验的Meta分析比较了这4种药物疗效,4种药的客观反应率相似,均降低了疾病立即进展风险[5]。因此,铂类联合第3代化疗药物是晚期非小细胞肺癌的基础用药。而寻找适合晚期患者的化疗方案一直为临床工作中探索的方向。
培美曲塞是一种新型的多靶点抗肿瘤药物,其作用机制为阻断嘌呤和嘧啶合成所需的胸苷酸合成酶、二氢叶酸还原酶和甘氨酰胺核苷酸甲酰转移酶的活性,使细胞分裂停止在S期,从而抑制肿瘤细胞生长[6]。文献[7]报道,培美曲塞+顺铂组与吉西他滨+顺铂组的中位生存时间相似,均为10.3个月;而培美曲塞+顺铂组中位无进展生存时间为4.8个月,吉西他滨+顺铂组中位无进展生存时间为5.1个月,亦无统计学差别。而在腺癌和大细胞癌亚组患者的生存期上培美曲塞+顺铂组中位生存时间为11.8个月,吉西他滨+顺铂组中位生存时间为10.4个月,培美曲塞组明显优于吉西他滨组。3/4级血液学毒性发生率上培美曲塞组明显低于吉西他滨组。基于该研究结果,2008年9月FDA批准培美曲塞与顺铂联用,为复发和转移并伴有非鳞状组织学特征的非小细胞癌的一线治疗方案。
多西他赛是以微管为靶点的抗肿瘤药物,能促进微管异常聚合并保持稳定,因具有较高的抗肿瘤活性、抗肿瘤血管形成和诱导凋亡作用而备受关注[8]。2003年ASCO报道的TAX326研究比较了多西他赛+顺铂、多西他赛+卡铂、长春瑞滨+顺铂,多西他赛+顺铂组有明显更高的有效率和1、2年生存率[9],FDA已批准多西他赛用于晚期非小细胞肺癌一线治疗。
培美曲塞与多西他赛联合铂类均可用于晚期肺腺癌的一线治疗。2011年全球23个中心参与的S380 Ⅲ期研究,结果表明,260例肺腺癌者,培美曲塞+卡铂组中位无进展生存时间5.8个月,多西他赛+卡铂组中位无进展生存时间 6.0个月;培美曲塞组中位生存时间 14.9个月,多西他赛组中位生存时间14.7个月,两组比较无统计学差别[10]。培美曲塞组中性粒细胞减少和贫血的血液学毒性反应明显低于多西他赛组,有统计学差异(分别是P<0.001和P=0.009)。脱发的非血液学毒性反应明显低于多西他赛组,有统计学差异(P<0.001)。腹泻、皮疹的不良反应在培美曲塞组和多西他赛两组无差异。本研究发现,PP组患者有效16例(45.7%),DP组患者有效14例(40.0%),两组有效率和疾病控制率比较,差异均无统计学意义。PP组在中性粒细胞减少,血红蛋白减少,恶心呕吐、肌酐升高、疲乏、脱发方面均低于DP组,而在血小板下降,腹泻、肝功能异常、皮疹发生率方面两组差异无统计学意义。与上述研究结果部分相同。PP组不良反应小,为良好的选择。以上临床疗效分析:PP组与DP组疗效相当,PP组与DP组中位无进展生存时间和生存时间均无统计学差异。
本研究样本量较小,生存时间不能完全反映化疗的作用。总之,培美曲塞联合顺铂与第3代化疗药物多西他赛联合顺铂疗效相当,不良反应更小,特别适合机体状况略差,对化疗耐受性差的人群,可以作为晚期肺腺癌的一线治疗方案的选择。
[1]Eisenhauer A, Therasse P, Bogaerts J,etal. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009,45(2):228-247.
[2]Navada S, Lai P, Schwartz AG,etal. Temporal trends in small cell lung cancer:analysis of the national surveillance,epidemiology,and end-results(SEER)database [J]. J Clin Oncol, 2006, 24 (18Suppl): 7082.
[3]Ginsberg R J, Goldberg M, Waters P E. Surgery in non-small lung cancer//Roth J A, Ruckdeschel J C, Weisenburger T H. Thoracic Oncology [M]. 2nd ed. Philadelphia: W.B. Saunders Company, 1995:124-146.
[4]Alberti W,Anderson G, Bartolucci A.Chemotherapy in non-small cell lung cancer: a meta-analysis using updated data on individual patients from 52 randomised clinical trials [J]. BMJ, 1995, 311(7010): 899-909.
[5]Grossi F, Aita M, Defferrari C,etal. Impact of third-genenration drugs on the activity of first-line chemotherapy in advanced non-small cell lung cancer: a meta-analytical approach [J]. Oncologist, 2009,14(5):497-510.
[6]Adjei A A. Pemetrexed(ALJMTA):a novel multitargeted antineoplastic agent [J]. Clin Cancer Res, 2004,10(2):4276-4280.
[7]Scagliotti G V, Parikh P, Joachim V P,etal. Phase III study comparing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer [J]. J Clin Oncol, 2008, 26(21): 3543-3551.
[8]Le Chevalier T, Berille Z, Zaleberg J R,etal. Overview of docetaxel(Taxotere)/cisplain combination in non small cell lung cancer [J]. Semin Oncol, 1999, 26(3 Suppl 11): 13-18.
[9]Fossella F, Pereira J R, Von Pawel J,etal. Randomized, multinational, phase III study of docetaxel plus platinum combinationgs versus vinorelbine plus cisplatin for advanced non-small-cell lung cancer: the TAX 326 study group [J]. J Clin Oncol, 2003, 21(16): 3016-3024.
[10]Pereira J R, Cheng R, Orlando M,etal. Elderly subset analysis of randomized phase III study comparing pemetrexed plus carboplatin with docetaxel plus carboplatin as first-line treatment for patients with locally advanced or metastatic non-small cell lung cancer [J]. Drugs R D, 2013, 13(4):289-296.
(2015-06-10收稿2015-09-18修回)
(责任编辑武建虎)
Efficacy and toxicity of pemetrexed or docetaxel combined with cisplatin in the first-line treatment of advanced lung adenocarcinoma
WANG Hui1,2and SUN Guoping1.
1.Department of Oncology, The First Affiliated Hospital of Medical University of Anhui,Hefei 230022,China;2. Department of Oncology, Ma’anshan People’s Hospital of Anhui Province,Ma’anshan 243000,China
ObjectiveTo compare toxicity and survival of the clinical curative effect of pemetrexed combined with cisplatin and docetaxel combined with cisplatin in the first-line treatment of advanced lung adenocarcinoma with unknown mutations. Methods70 patients with advanced lung adenocarcinoma, using PP regimen group (pemetrexed + cisplatin) and DP regimen group(docetaxel + cisplatin) treatment respectively. To PP group of 35 cases, intravenous injection of pemetrexed 500 mg/m2was given on the first day to DP group of 35 cases, on the first day intravenous docetaxel 75 mg/m2was given. On 2-4 days, the two groups were given combination of cisplatin intravenous infusion of 25 mg/m2. The curative effects and adverse reactions were evaluated 21 days for a cycle, each patient completed at least 2 cycles. ResultsThe median progression free survival was 8 months, and the median survival time was 14.3 months, and the 1 year survival rate was 62.8% in the PP group. The median progression free survival was 7 months, and the median survival time was 13.3 months, and the 1 year survival rate was 65.7% in the DP group. There was no significant difference between the two groups. The incidence of toxicity of hematology, digestive tract and renal function was significantly lower in PP group than in DP group (P<0.05). ConclusionsThe effect of PP or DP in the treatment of advanced lung adenocarcinoma is similar and the side effect of PP is lower, which is suitable for patients with poor tolerance to chemotherapy.
pemetrexed; docetaxel; lung adenocarcinoma; effect; toxicity
王慧,本科学历,主治医师。
1.230022合肥,安徽医科大学第一附属医院肿瘤科;2.243000,安徽省马鞍山市人民医院肿瘤科
孙国平,E-mail:sungp@ahmu.edu.cn
R734.2
