绿色荧光蛋白滑膜间充质干细胞抑制大鼠骨关节炎的实验研究
2016-10-24张继虹孙先润李亚国李连娥李晓云
唐 涛,张继虹,孙先润,李 治,王 波,刘 颖,李亚国,肖 壮,李连娥,李晓云
(1.昆明理工大学医学院康复医学教研室,昆明650050;2.云南省第一人民医院康复医学科,昆明650032)
绿色荧光蛋白滑膜间充质干细胞抑制大鼠骨关节炎的实验研究
唐涛1,2,张继虹1,孙先润2,李治2,王波2,刘颖1,李亚国1,肖壮1,李连娥1,李晓云1
(1.昆明理工大学医学院康复医学教研室,昆明650050;2.云南省第一人民医院康复医学科,昆明650032)
目的探讨关节腔内注射绿色荧光蛋白(GFP)滑膜间充质干细胞防治骨关节炎的有效性。方法增殖培养GFP滑膜间充质干细胞至第3代,收集并调整细胞浓度至1.0×108/mL后行关节腔内细胞移植。15只SD大鼠经改良Hulth手术造骨关节炎模型,同一大鼠左腿为对照组,右腿为治疗组。于1周、2周时麻醉状态下CT扫描后处死大鼠,取全膝关节置于4%多聚甲醛液固定、制片,番红-O染色后进行病理图像系统分析,经Mankin′s评分,分析评价骨关节炎中2组关节软骨破坏进展。结果CT显示治疗组较对照组骨赘和软骨下硬化减少,关节软骨破坏轻。第2周时胫骨关节软骨Mankin′s评分对照组为10.07±0.63,治疗组为3.56±0.21,2组比较差异有统计学意义(P<0.01)。结论关节腔内注射GFP滑膜间充质干细胞能有效抑制关节软骨的破坏进展。
骨关节炎;关节软骨;绿色荧光蛋白滑膜间充质干细胞移植
骨关节炎是严重危害人类健康的慢性进行性骨关节病之一,其主要特点是侵害关节软骨和滑膜组织,导致关节疼痛、畸形和功能障碍。骨关节炎的预防及治疗一直是研究的热点。目前临床治疗包括手术(人工关节置换术)、微创(关节腔冲洗、注射)、非手术(口服药物、外敷药物、现代康复、传统中医药)等方法,其中见效快、创伤小的关节腔内注射最受患者欢迎(如关节腔内注射透明质酸钠等)[1-2]。近年研究[2-3]发现,间充质干细胞移植可促进软骨损伤修复。为探讨关节腔内移植干细胞后其在关节腔内的分布、转化情况以及对关节软骨形态学改变的影响,为临床干细胞治疗骨关节炎提供理论依据,本研究通过关节腔内注射荧光滑膜间充质干细胞治疗骨关节炎,从组织形态学、影像学的角度观察大鼠骨关节炎软骨下骨密度、关节软骨破坏进展、干细胞软骨样转化的改变情况,初步探讨干细胞移植治疗骨关节炎的治疗机制。
1 材料与方法
1.1材料
1.1.1实验动物:12周龄、体质量250~300 g的清洁级健康成年雄性SD/SPF大鼠15只(昆明理工大学动物实验室提供)。
1.1.2主要试剂及仪器:绿色荧光蛋白(green fluorescent protein,GFP)滑膜间充质干细胞、番红-O、甲苯胺蓝染色剂、OCT冰冻切片包埋剂(昆明泽浩科技有限公司);生物组织包埋机、冰冻切滑行式组织切片机(日本Funakoshi公司);光学显微镜(日本OLYMPUS公司);低温恒温切片机(KD-2850,北京佳源兴业科技有限公司);德国西门子Definition双源CT机(德国西门子公司)。
1.2方法
1.2.1SD大鼠GFP滑膜间充质干细胞培养:将GFP滑膜间充质干细胞解冻复苏。用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的L-DMEM培养液培养,3 d后调整细胞浓度为1.0×108/mL,接种于100 mL培养皿中,置于37℃、5%CO2饱和湿度培养箱中培养。72 h后弃去悬浮细胞,加入新鲜培养液,根据细胞生长情况,2~3 d换液,倒置显微镜下观察,呈纤维、纺锤样漩涡状排列,健康生长;在荧光镜见清晰GFP荧光干细胞,当细胞达80%融合时进行传代(图1)。
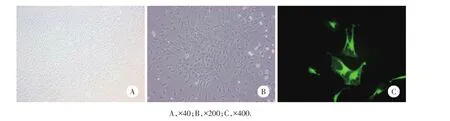
图1 GFP滑膜干细胞在培养皿中的生长状况Fig.1 The grow th sta tus of GFP synovial cells in the culture dish
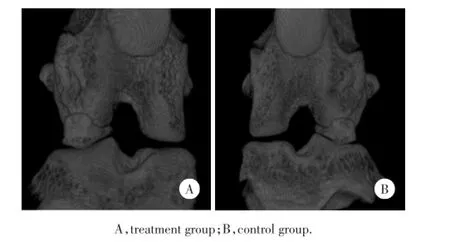
图2 改良Hulth手术后全膝关节CT三维重建影像图Fig.2 3D-reconstruction CT im ages of total knee after operation by the im proved Hulth surgical method
1.2.2大鼠骨关节炎模型的制备:采用改良Hulth手术方法[4]制造骨关节炎动物模型。大鼠左、右膝关节经剃毛、严格消毒后,铺上无菌铺巾;切断内侧副韧带、前交叉韧带,切除内侧半月板,行抽屉试验确认(图2);最后用无菌生理盐水冲洗关节腔,缝合手术切口并消毒。自然喂养,分别于第1、2周采集全膝关节。
1.2.3干细胞移植方法:培养的第3代GFP滑膜间充质干细胞,以0.25%胰蛋白酶消化后,PBS洗涤2次,计数细胞,收集并调整细胞浓度为1.0×108/mL,收集备用。Hulth手术后左侧膝关节(对照组)腔内注射10%PBS 1 mL,同时右侧膝关节(治疗组)腔内注射GFP滑膜间充质干细胞(1.0×108/mL)悬浮液1 mL(图2)。
1.2.43D-CT检查方法:利用德国西门子Definition双源CT机对膝关节进行全面扫描,管电压120 kV,管电流120 mA,行螺旋扫描,重建图像0.6 mm层厚,并行三维重建、三维成像观察,矩阵为512×512,骨窗窗位400~600 Hu,窗宽1 500~2 000 Hu,软组织窗位40 Hu,窗宽为350~400 Hu。大鼠全膝关节固定平放,相同方法尽量与对照组放置在同一水平位置,扫描范围由股骨内外髁至胫骨平台,包括整个膝关节。均由放射科专业医生操作并进行CT影像学重建分析。
1.2.5标本收集及检测方法:乙醚吸入麻醉后,采用瞬间颈椎脱位法处死大鼠,取全膝关节,去皮后快速置入4℃4%多聚甲醛固定。经20%EDTA脱钙液脱钙后,全膝关节沿髌尖韧带正中线行矢状面切开一分为二,经常规系列脱脂,脱水,石蜡包埋,切片5 μm厚,于4℃冷藏备用[4]。冰冻切片方法同上,经OCT冰冻切片包埋剂包埋,低温恒温切片机(-15℃)切片,10 μm厚,-20℃冰箱保存备用[5]。
1.3统计学分析
采用StatView 5.0统计软件处理数据,计量资料均采用表示,组间比较用单因素方差分析,对照组和治疗组之间的比较采用Mann-Whitney U检验,P<0.05为差异有统计学意义。
2 结果
2.1CT影像学检查结果
CT影像学观察显示:对照组较治疗组关节间隙变窄,关节表面骨质欠光滑,密度增高,并伴骨质增生,骨赘形成;而治疗组较对照组改善明显,骨赘和软骨下硬化减少,关节软骨退变减缓。见图3。
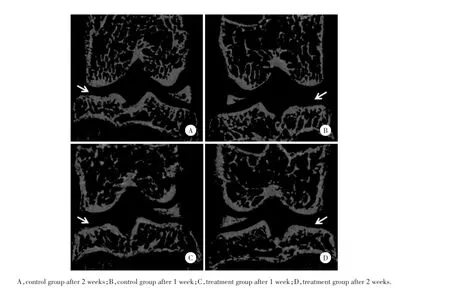
图3 GFP滑膜间充质干细胞移植后对照组和治疗组的CT平扫Fig.3 CT scan after GFP synovia l mesenchymal stem cell transplantation in both control and treatment groups
2.2干细胞移植后在膝关节腔内分布情况
经关节腔内注射GFP滑膜干细胞后,通过全膝关节冰冻切片荧光镜观察清晰可见:GFP滑膜干细胞吸附在滑膜组织表层内,少量GFP干细胞游离吸附在受损软骨表面(图4,箭头所示)。
2.3甲苯胺蓝和番红-O快绿染色
甲苯胺蓝和番红-O快绿染色后的组织形态学观察显示:对照组染色明显减退,软骨表面出现溃烂缺损,软骨细胞明显减少,潮线紊乱,软骨层厚度减少;治疗组可见染色稍减退、偶见部分新的软骨细胞生长,其周围甲苯胺蓝和番红-O快绿染色明显高于周边,且软骨厚度修复较好。见图5。GFP滑膜间充质干细胞植后,第1周时胫骨关节软骨Mankin's评分对照组为6.23±0.72,治疗组为5.43± 0.51,第2周时胫骨关节软骨Mankin's评分对照组为10.07±0.63,治疗组为3.56±0.21。Mann-Whitney U检验结果显示,第2周时治疗组与对照组比较Mankin's评分的差异有统计学意义(P<0.01),说明GFP滑膜间充质干细胞移植2周后,治疗组关节软骨修复或抑制软骨破坏程度明显优于对照组。

图4 GFP滑膜间充质干细胞移植后在关节腔内的分布情况Fig.4 The distribution o f GFP m esenchym al synovial stem cells in joint cavity afte r transp lanta tion
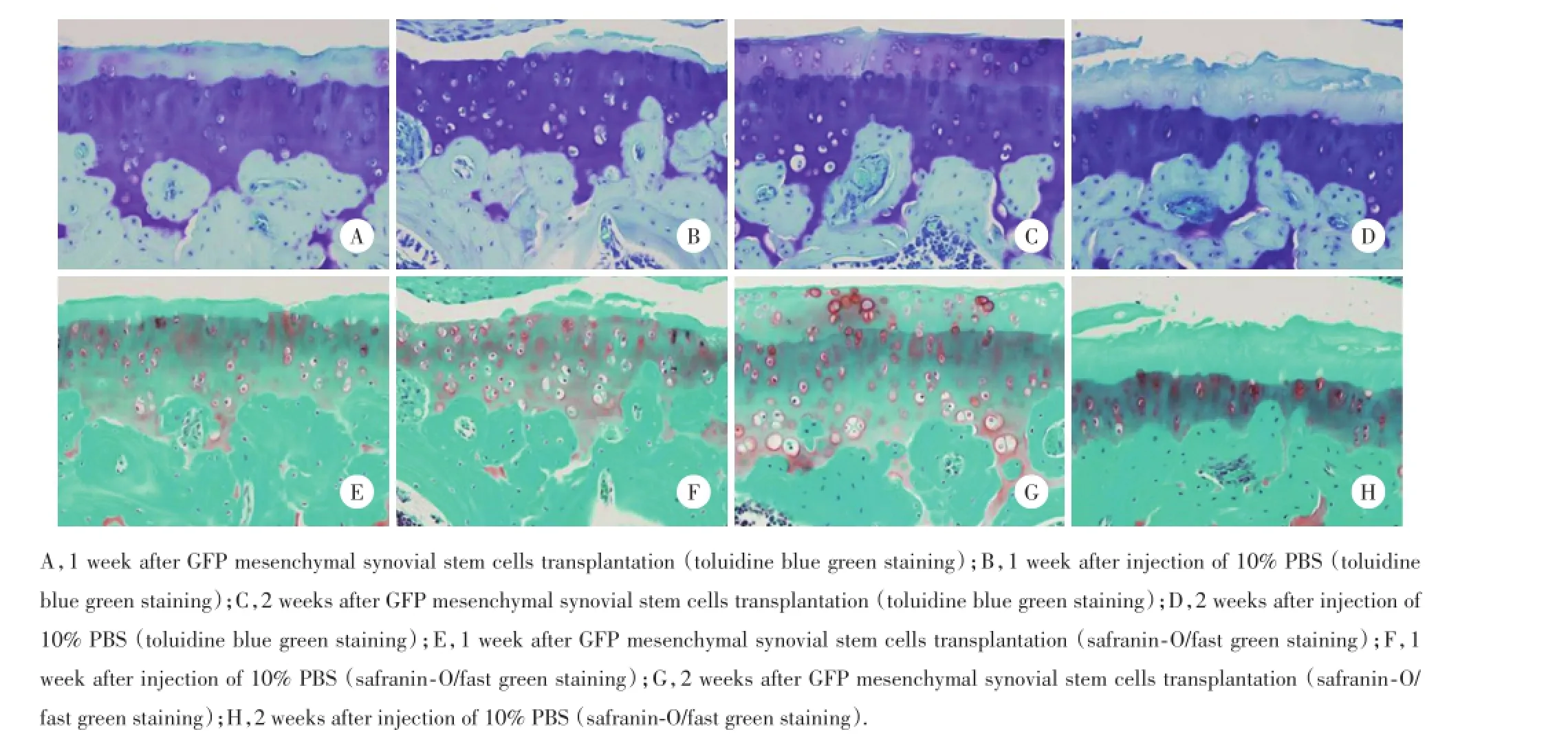
图5 软骨甲苯胺蓝和番红-O快绿染色结果×200Fig.5 Toluidine blue green and safran in-O/fast green stain ing o f the a rticula r cartilage×200
3 讨论
滑膜间充质干细胞具有强大的增殖能力和多分化潜能,免疫原性弱,可增殖分化为多种中胚层组织,如成骨细胞、软骨细胞、神经元细胞和典型的外胚层细胞[5-6]。采集简单、增殖能力强的滑膜间充质干细胞在软骨损伤修复中具有重要价值。KOGA等[7-8]的研究表明,滑膜间充质干细胞移植入缺损软骨损伤模型大白兔后,在体内同样具有良好软骨分化能力,因此关节腔注射滑膜干细胞治疗骨关节炎是可行的方法之一。
以往的关节腔内注射干细胞治疗,大多数集中在通过微创介入将干细胞直接注射在软骨受损、缺损部位[7-11]。据我们所知,目前尚无相关研究对关节腔内注射后移植干细胞的动向进行跟踪观察。基于此,本研究先体外成功培养并增殖大鼠荧光蛋白滑膜间充质干细胞,传代并进行了荧光电镜确认;之后收集调整细胞浓度,采用操作简便的关节腔内注射将GFP滑膜间充质干细胞移植入活体大鼠骨关节炎损伤模型;并充分利用GFP滑膜间充质干细胞良好的发光特点,使移植的干细胞处于良好的自然状态生存;避免了细胞标志物等对移植干细胞的人为毒性损伤,充分保障移植后干细胞的自然活性。我们首次对其在移植关节腔内后的分布状况进行了全面观察,从冰冻切片荧光电镜观察清晰可见:移植后的GFP滑膜间充质干细胞主要附着聚落在滑膜组织的内层,以及部分黏附在损伤的关节软骨表面。这与其他细胞移植研究[10-11]的结果一致。
1周、2周的甲苯胺蓝和番红-O染色显示,移植的GFP滑膜间充质干细胞聚集在滑膜组织及软骨损伤部位,关节腔内存活良好,并向软骨细胞转化。它为干细胞移植治疗骨关节炎提供了可行的实验依据。本研究仅限于早期骨关节炎的防治观察,转化的软骨细胞是否具有真正关节软骨细胞的功能、移植细胞长期能否吸附在受损软骨部位生长等还有待进一步研究。
细胞移植修复软骨损伤的作用机制目前尚不清楚,一般认为移植细胞受损后,炎性反应释放的趋化因子作用并迁移,积聚迁移于损伤部位,填补原有软骨细胞的缺损,并可能向软骨方向分化形成新的软骨细胞;另外,细胞移植可能改变局部微循环,也可能促进分泌软骨生长的相关因子,从而刺激软骨细胞增殖,促进软骨修复。本研究是大鼠活体行关节腔注射干细胞对大鼠骨关节炎模型进行抑制性治疗的初步研究,主要从组织形态学及CT影像学角度来观察关节腔内注射GFP滑膜间充质干细胞抑制骨关节炎软骨破坏进度及软骨下骨的变化,结果初步证实关节腔内注射滑膜间充质干细胞能抑制关节软骨破坏进展,但其详细治疗作用机制仍不清楚,需要后期继续进一步研究。本研究证实膝关节内注射滑膜间充质干细胞能有效抑制早期骨关节炎恶化,为预防和治疗创伤性骨关节炎提供了新的思维和治疗方向。
[1]CUCCHIARINI M,de GIROLAMO L,FILARDO G,et al.Basic science of osteoarthritis[J].J Exp Orthop,2016,3(1):22.DOI:10.1186/s40634-016-0060-6.
[2]TANG T,MUNETA T,SEKIYA I,et al.Serum keratan sulfate transiently increases in the early stage of osteoarthritis during strenuous running of rats:protective effect of intraarticular hyaluronan injection[J].Arthritis Res Ther,2008,10(1):R13.DOI:10.1186/ ar2363.
[3]TANG T,MUNETA T,SEKIYA I.Fibrous change of the infrapatellar fat pad due to strenuous running exercise and its treatment with intraarticular hyaluronan injection in rat model[J].J Med Dent Sci,2008,55(1):163-173.
[4]ROGART JN,BARRACH HJ,CHICHESTER CO.Articular collagen degradation in the Hulth-Telhag model of osteoarthritis[J].Osteoarthritis Cartilage,1999,7(6):539-547.
[5]YOSHIMURA H,MUNETA T,NIMURA A,et al.Comparison of rat mesenchymal stem cells derived from bone marrow,synovium,periosteum,adipose tissue,and muscle[J].Cell Tissue Res,2007,327(3):449-462.
[6]SAKAGUCHI Y,SEKIYA I,MUNETA T,et al.Comparison of human stem cells derived from various mesenchymal tissues:superiority of synovium as a cell source[J].Arthritis Rheum,2005,52(8):2521-2529.
[7]KOGA H,MUNETA T,NAGASE T,et al.Comparison of mesenchymal tissue-derived stem cells for in vivo chondrogenesis:suitable conditions for cell therapy of cartilage defects in rabbit[J].Cell Tissue Res,2008,333(2):207-215.DOI:10.1007/s00441-008-0633-5.
[8]NIMURA A,MUNETA T,KOGA H,et al.Increased proliferation of human synovial mesenchymal stem cells with autologous human serum:comparisons with bone marrow mesenchymal stem cells and with fetal bovine serum[J].Arthritis Rheum,2008,58(2):501-510.DOI:10.1002/art.23219.
[9]MORITO T,MUNETA T,SEKIYA I,et al.Synovial fluid-derived mesenchymal stem cells increase after intra-articular ligament injury in humans[J].Rheumatology(Oxford),2008,47(8):1137-1143.DOI:10.1093/rheumatology/ken114.
[10]NAKAMURA T,SEKIYA I,MUNETA T,et al.Arthroscopic,histological and MRI analyses of cartilage repair after a minimally invasive method of transplantation of allogeneic synovial mesenchymal stromal cells into cartilage defects in pigs[J].Cytotherapy,2012,14(3):327-338.DOI:10.3109/14653249.2011.638912.
[11]NAM HY,KARUNANITHI P,LOO WC,et al.The effects of staged intra-articular injection of cultured autologous mesenchymal stromal cells on the repair of damaged cartilage:a pilot study in caprine model[J].Arthritis Res Ther,2013,15(5):R129. DOI:10.1186/ar4309.
(编辑陈姜)
Experimental Study on GFP-expressing Synovial Stem Cells for Their Potential Therapeutic Effect on Osteoarthritis in Rats
TANG Tao1,2,ZHANG Jihong1,SUN Xianrun2,LI Zhi2,WANG bo2,LIU Ying1,LI Yaguo1,XIAO Zhuang1,LI Lian'e1,LI Xiaoyun1
(1.Section of Rehabilitation Medicine,Medical Faculty of Kunming University of Science and Technology,Kunming 650500,China;2.Section of Rehabilitation Medicine,First People's Hospital of Yunnan Province,Kunming 650032,China)
Objective To explore the preventive and therapeutic effects of intra-articular injection of synovial mesenchymal stem cells for osteoarthritis.Methods Synovial mesenchymal stem cells expressing green fluorescent protein(GFP)were thawed and allowed to proliferate to the third generation.Then,the cells were collected and adjusted to the concentration of 1.0×108/mL for final intra-articular injection.Osteoarthritis models were established by using an improved Hulth method on 15 healthy adult male SD rats.Treatments were preformed on the right legs,while the left legs were used as controls for each of animals.Rats were sacrificed after CT screening after the first and second week.Total knee tissues were fixed in 4%paraformaldehyde,sliced and stained by safranin-O/fast green,and then examined using a pathological image analysis system.Articular cartilage damage was evaluated by using the Mankin′s score.Results CT results showed that the treatment group had less osteophytes and subchondral sclerosis and reduced cartilage damage compared with the control group.At the second week,the Mankin′s score on tibial articular cartilage was 10.07±0.63 for the control group and 3.56±0.21 for the treatment group,and the difference between the two groups was statistically significant(P<0.01).Conclusion Intra-articular injection of GFP synovial mesenchymal stem cells can effectively alleviate the damage of articular cartilage.
osteoarthritis;articular cartilage;green fluorescent protein synovial mesenchymal stem cell transplantation
R684.3
A
0258-4646(2016)10-0913-05
10.12007/j.issn.0258-4646.2016.10.012
昆明理工大学引进人才基金(KKZ3201460023);2013年云南省应用基础研究计划项目(2013FZ182)
唐涛(1970-),男,讲师,博士.
E-mail:taoer2324@sina.com
2016-03-24
网络出版时间:
网络出版地址
