抗病毒治疗对HBV DNA阴性的乙肝相关肝癌行TACE术后HBV再激活的预防及对预后影响
2016-10-22蒋雪花陈志勇
杨 阳,杨 龙,魏 燕,蒋雪花,陈志勇,陈 坚
论著
抗病毒治疗对HBV DNA阴性的乙肝相关肝癌行TACE术后HBV再激活的预防及对预后影响
杨阳1,杨龙1,魏燕2,蒋雪花1,陈志勇1,陈坚2
目的观察抗病毒治疗对乙肝病毒(hepatitis B virus,HBV)DNA阴性的乙肝相关肝细胞癌(hepatitis B virus related hepatocellular carcinoma,HBVR-HCC)行TACE术后HBV再激活的预防及预后影响。方法选取2012-05-01至2014-05-01在武警上海总队医院行肝动脉化疗栓塞术(transarterial chemoembolization,TACE)HBVR-HCC患者60例(血清HBV DNA<500 U/ml),随机分为治疗组(TACE前行抗病毒治疗)30例和对照组(仅行TACE治疗,HBV再激活后行抗病毒治疗)30例。比较两组患者治疗前后血清HBV DNA、肝功能、凝血功能、甲胎蛋白(α-fetoprotein,AFP)及Child-pugh评分变化情况及生存状况。结果两组患者基线特征差异无统计学意义,治疗组中未出现患者血清HBV DNA转为阳性,对照组中有6例患者血清HBV DNA转为阳性,两组比较差异有统计学意义(χ2=6.486,P=0.011);术后随访期间,肝功能指标与Child-pugh评分在治疗组与对照组之间差异无统计学意义;术后24周及48周,凝血酶原时间(prothrombin time,PT)与AFP在治疗组与对照组之间差异无统计学意义;术后72周及96周,治疗组明显低于对照组,两组比较差异有统计学意义(P<0.05)。治疗组和对照组客观缓解率(objective response rate, ORR)分别为56.7%和50.0%,两组比较差异无统计学意义(χ2=0.268,P=0.605);治疗组和对照组患者疾病控制率(disease control rate,DCR)分别为86.7%和83.3%,两组比较差异无统计学意义(χ2=0.131,P=0.718)。治疗组与对照组1年生存率分别为76.7%和70.0%,两组比较差异无统计学意义(χ2=0.341,P=0.559);2年生存率分别为70.0%和43.3%,两组比较差异有统计学意义(χ2=4.344,P=0.037)。治疗组与对照组中位生存期(median overall survival,mOS)分别为26.1[95%可信区间(confidence interval,CI):23.9~28.1]个月与22.7(95%CI:6.2~39.6)个月,两组比较差异有统计学意义(χ2=4.857,P=0.021);中位疾病无进展生存期(median progression-free survival,mPFS)分别为16.4(95%CI:14.8~17.6)个月与15.1(95%CI:4.6~26.0)个月,两组比较差异有统计学意义(χ2=4.561,P=0.027)。结论血清HBV DNA阴性的HBVR-HCC患者TACE术前行抗病毒治疗可以防止乙肝病毒再激活,延长患者生存时间,改善预后。
乙型肝炎;再激活;肝细胞癌;抗病毒;动脉化疗栓塞
肝动脉化疗栓塞(transarterial chemoembolization,TACE)可以提高中晚期肝细胞癌(hepatocellular carcinoma,HCC)患者的生存率[1],然而局部肿瘤复发和肝衰竭仍是导致患者死亡的主要原因。研究证明,约90%的HCC患者合并乙肝病毒(hepatitis B virus,HBV)感染[2,3],10%~30%乙肝相关肝细胞癌(hepatitis B virus related hepatocellular carcinoma,HBVR-HCC)患者行TACE术后出现HBV再激活[4,5],HBV感染及其再激活在HCC患者TACE术后肿瘤复发和肝衰竭的过程中起到重要作用。因此,近年来国内外已有大量研究表明,对于血清HBV DNA阳性的HCC患者积极行抗乙肝病毒治疗,可以改善患者预后[6-16];而血清HBV DNA阴性的HBVR-HCC患者在抗病毒适应证方面是应该密切监测血清HBV DNA水平,待其被再激活后实施抗病毒治疗,还是应在行TACE术前即抗病毒治疗,目前仍存在许多争议[17],目前对于血清HBV DNA阴性的HBVR-HCC癌患者抗病毒治疗国内外临床资料极少。本研究旨在探讨抗病毒治疗对血清HBV DNA阴性的HBVR-HCC患者行TACE术后HBV再激活的预防及预后影响。
1 对象与方法
1.1对象选择2012-05-01至2014-05-01在我院感染科、肿瘤内科门诊就诊及住院的患者作为研究对象。纳入标准:(1)HCC的诊断符合我国2011年版肝癌诊疗规范[18],无手术指证,无TACE禁忌证;(2)血清HBsAg阳性,血清HBV DNA<500 U/ml;(3)临床相关资料完整;(4)肝功能分级(Child-Pugh)A或B级;(5)按照新修订的实体瘤疗效评价标准[19](modified responsed evaluation criteria in solid tumors, mRECIST)至少有一个能被测量的未处理靶病灶。排除标准:(1)既往曾行抗病毒、化疗或放射治疗;(2)合并慢性肝病包括丙型肝炎、丁型肝炎、自身免疫性肝病、胆汁淤积性肝硬化、乙醇性肝病及人类免疫缺陷病毒(human immuno deficiency virus,HIV)感染。
根据纳入标准和排除标准选择60例HBVR-HCC患者,其中男43例,女17例;年龄38~62岁,中位年龄45.9岁。采用数字法将60例分为治疗组和对照组,每组30例。两组患者基线资料差异无统计学意义(P<0.05,表1)。所有病例均经肝穿刺活检或根据实验室检查结果结合影像学确定诊断,其中临床诊断41例,病理诊断19例。
表1 乙肝相关肝细胞癌60例患者基线一般资料 (n=30;±s)
1.2方法治疗组行TACE前1周给予恩替卡韦(中美上海施贵宝制药有限公司,批号:H20052237,0.5 mg/次,1 次/d,TACE术后长期用药)口服治疗,对照组仅予行TACE治疗,检测到血清HBV DNA转阳后再行恩替卡韦口服抗病毒治疗。TACE的具体操作流程为采用Seldinger技术行股动脉穿刺插管至肝固有动脉或其分支,造影明确肿瘤供血动脉后选择插管至肿瘤供血动脉,尽可能接近瘤灶,用碘油(上海旭东海普药业有限公司,批号:H31021603)与丝裂霉素(日本协和发酵工业株式会社,批号:425ACI)或表柔比星(浙江海正股份药业有限公司,批号:1131007A)混合乳化剂在X线监视下注入肿瘤供血动脉内,注药至载瘤动脉血流停滞时结束。栓塞结束后再次肝总动脉行动脉造影,评估栓塞程度以及肝动脉其他分支的血流情况。术后给予保肝对症治疗,TACE治疗时间间隔一般为4~6周,治疗组和对照组分别行介入治疗(3.9±0.74)和(4.2±0.79)次,两组治疗次数差异无统计学意义(P=0.391)。所有患者术前术后均常规行保肝、退黄疸、利尿、纠正低蛋白血症等非手术治疗,定期复查发现问题及时对症处理。TACE停止标准[15]:肿瘤影像学可见肿瘤全部坏死或消失,同时连续2次AFP检测水平均处于正常范围内;肝功能出现严重障碍;认为患者已不宜继续接受治疗或患者本人不愿继续接受治疗。
1.3疗效评价根据mRECIST评价标准评价治疗效果,分为完全缓解(complete response,CR),部分缓解(partial response,PR)、疾病稳定(stable disease,SD)、疾病进展(progressive disease,PD)。以CR+PR计算客观缓解率(objective response rate, ORR),以CR+PR+SD计算疾病控制率(disease control rate,DCR)。
1.4随访随访至2015-10,随访时间5~35个月,中位随访时间17.7个月。随访内容包括患者神志、腹水量、肝功能、凝血功能、血清HBV DNA、AFP及影像学资料,制定随访表。随访方式为门诊、住院及电话等,对患者随访的终点为患者死亡。总生存期(overall survival,OS)定义为首次介入术至患者死亡的时间,如患者未死亡即为初诊至随访时间;疾病无进展生存期(progression-free survival,PFS)定义为首次介入术至患者肿瘤出现复发或新的转移的时间,如患者未出现上述情况,即为介入术至随访的时间。
2 结 果
2.1HBV再激活情况比较首次行TACE术至随访结束,治疗组中未出现患者血清HBV DNA转为阳性,对照组中有6例血清血清HBV DNA转为阳性,两组比较差异有统计学意义(χ2=6.486,P=0.011)。
2.2术后肝功能、凝血功能、AFP及Child-pugh评分比较术后24、48、72周及96周肝功能相关指标与Child-pugh评分在治疗组与对照组之间差异均无统计学意义;术后24周及48周, PT与AFP在治疗组与对照组之间差异无统计学意义,而在术后72周及96周,差异有统计学意义(P<0.05,表2)。
2.3近期疗效治疗组CR 2例,PR 15例,SD 9例,PD 4例;对照组CR 2例,PR 13例,SD 10例,PD 5例。治疗组ORR为56.7%,对照组为50.0%,两组比较差异无统计学意义(χ2=0.268,P=0.605);治疗组DCR为86.7%,对照组为83.3%,两组比较差异无统计学意义(χ2=0.131,P=0.718)。
表2 两组乙肝相关肝细胞癌患者TACE治疗后各项指标变化比较 ±s)
注:与对照组比较,①P<0.05;②P<0.01
2.4预后分析治疗组与对照组患者1年生存率分别为76.7%和70.0%,两组比较差异无统计学意义(χ2=0.341,P=0.559);治疗组与对照组患者2年生存率分别为70.0%和43.3%,两组比较差异有统计学意义,χ2=4.344,P=0.037。治疗组中位生存期(median overall survival,mOS)为26.1个月,95%可信区间(confidence interval,CI):23.9~28.1;对照组mOS为22.7个月,95%CI:6.2~39.6,两组比较差异有统计学意义(χ2=4.857,P=0.021,图1)。治疗组中位疾病无进展生存期(median progression-free survival,mPFS)为16.4个月,95%CI:14.6~17.8;对照组mPFS为15.1个月,95%CI:4.6~26.2,两组比较差异有统计学意义(χ2=4.561,P=0.027,图2)。
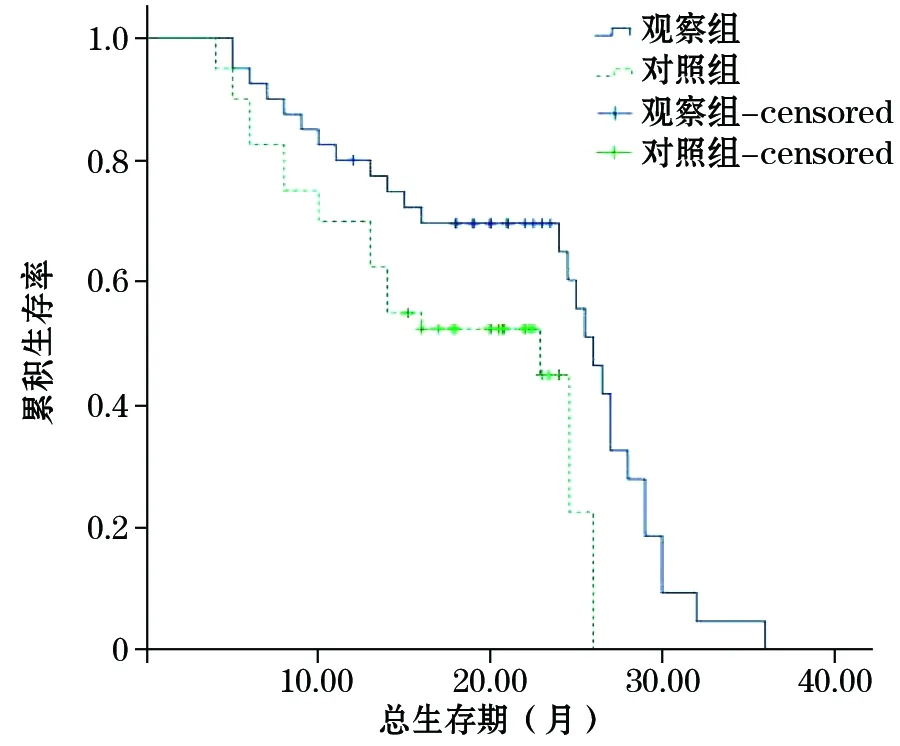
图1 两组HBVR-HCC患者总生存期的比较

图2 两组HBVR-HCC患者疾病无进展生存期的比较
3 讨 论
本研究中对照组出现6例血清HBV DNA转为阳性,后经抗病毒治疗血清HBV DNA转阴,因此两组患者术后近期疗效(ORR、DCR)及1年生存率无显著差异,可能与患者血清HBV DNA水平较低,对患者近期的影响较小以及血清HBV DNA转阳患者采用恩替卡韦抗病毒治疗后病毒迅速转阴有关。但治疗组的2年生存率较对照组有显著的提高,其mOS与mPFS也较对照组有显著的延长,治疗组患者血清AFP与PT在48周及96周较对照组显著降低也反映出患者获益于抗病毒治疗。随访期间两组患者肝功能等生化指标差异无统计学意义可能与患者长期积极采取保肝、利尿及纠正低蛋白血症等内科治疗有关,掩盖了患者生化指标的真实变化情况。
本研究中入组患者的基线血清HBV DNA均为阴性(HBV DNA<500 U/ml),对照组较治疗组的不良预后除了与治疗组中部分患者出现HBV再激活,HBV对肿瘤复发产生的不利影响以外,笔者认为可能与对照组中未行抗病毒患者肝细胞内低浓度的HBV DNA持续存在有关,因为患者血清HBV DNA水平低于检测值下限不等于患者体液和肝细胞内无HBV存在,这部分患者体内病毒水平较低,但HBV的持续感染仍是导致患者肿瘤复发和肝功能异常的重要因素。
通过此项研究,笔者认为对于血清HBV DNA阴性的HBVR-HCC患者行TACE术前也应行抗病毒治疗,除预防HBV的再激活以外,进一步降低患者体内HBV DNA水平对改善患者预后也能起到积极的作用,得出了与国内外学者相似的研究结论[20-22]。
此外,本研究也存在一些不足之处,除纳入的样本量不大,可能导致检验效能偏低外,主要是未对患者血清HBV DNA行高灵敏度检测,目前,国内商业实验室可行高灵敏度血清HBV DNA检测,检测下限一般为15 ~20 U/ml,但此类检测的费用一般为医院常规检测的十倍左右,因此,针对HBVR-HCC患者广泛采用该项检查存在较大难度,如能对患者行此项检查并根据病毒水平再细化分组进行比较,可能得出更有说服力的循证医学证据,为临床治疗提供更多科学依据。
[1]Lao X M, Luo G, Ye L T,etal. Effects of antiviral therapy on hepatitis B virus reactivation and liver function after resection or chemoembolization for hepatocellular carcinoma[J]. Liver Int, 2013, 33(4): 595-604.
[2]Forner A, Llovet J M, Bruix J. Hepatocellular carcinoma[J]. Lancet, 2012, 379(9822): 1245-1255.
[3]Hai H, Tamori A, Kawada N,etal. Role of hepatitis B virus DNA integration in human hepatocarcinogenesis [J]. World J Gastroenterol, 2014, 20(20): 6236-6243.
[4]Peng J W, Lin G N, Xiao J J,etal. Hepatitis B virus reactivation in hepatocellular carcinoma patients undergoing transcatheter arterial chemoembolization therapy[J]. Asia Pac J Clin Oncol, 2012, 8(4): 356-361.
[5]Jang J W, Choi J Y, Bae S H,etal. Transarterial chemo-lipiodolization can reactivation hepatitis B virus replication in patients with hepatocellular carcinoma[J]. J Hepatol, 2004, 41(3): 427-435.
[6]Zhang Z Y, Zhou Z Q, Zhou G W. Higher efficacy of antiviral therapy after major hepatectomy in patients with hepatitis B virus-related hepatocellular carcinoma of less than 3 cm[J]. Eur J Gastroenterol Hepatol, 2014, 26(10):1116-1124.
[7]Colombo M, Iavarone M. Role of antiviral treatment for HCC prevention[J]. Best Pract Res Clin Gastroenterol, 2014, 28(5):771-781.
[8]Yin J, Li N, Han Y,etal. Effect of antiviral treatment with nucleotide/nucleoside analogs on postoperative prognosis of hepatitis B virus-related hepatocellular carcinoma: a two-stage longitudinal clinical study[J]. J Clin Oncol, 2013, 31(29):3647-3655.
[9]Chang C H, Lin J W, Wu L C,etal. National antiviral treatment program and the incidence of hepatocellular carcinoma and associated mortality in Taiwan: a preliminary report[J]. Med Care, 2013, 51(10):908-913.
[10]Chen L P, Zhao J, Du Y,etal. Antiviral treatment to prevent chronic hepatitis B or C-related hepatocellular carcinoma[J]. World J Virol, 2012, 1(6):174-183.
[11]Toyoda H, Kumada T, Tada T,etal. Transarterial chemoembolization for hepatitis B virus-associated hepatocellular carcinoma: improved survival after concomitant treatment with nucleoside analogues[J]. J Vasc Interv Radiol, 2012, 23(3):317-322.
[12]Rapti I, Hadziyannis S. Risk for hepatocellular carcinoma in the course of chronic hepatitis B virus infection and the protective effect of therapy with nucleos(t)ide analogues[J]. World J Hepatol, 2015, 7(8):1064-7103.
[13]王丽君,卜文哲,陈华,等. TACE联合恩替卡韦治疗乙肝相关原发性肝癌回顾性分析[J]. 中华肿瘤防治杂志,2014,21(20):1617-1622.
[14]蒋进发,陈国勇,张明海,等. 恩替卡韦抗病毒治疗对肝癌HBV感染患者术后预后的影响[J]. 中国现代医学杂志,2014,24(33):90-93.
[15]郭锰. 恩替卡韦联合介入治疗乙型肝炎相关原发性肝癌的临床研究[J]. 中国普通外科杂志杂志,2014,23(7):898-903.
[16]王伯庆,薛峰,佟庆,等. 抗病毒治疗对乙型肝炎相关肝癌根治术后复发和生存的影响[J]. 实用肝脏病杂志,2015,18(2):132-135.
[17]周伟平,尹磊,吴孟超. 抗病毒治疗在HBV相关肝癌综合治疗中的作用[J]. 实用肝脏病杂志,2015,18(2):115-117.
[18]中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J].临床肿瘤学杂志,2011,16(10):929-946.
[19]Lencioni R, Llovet J M. Modified RECIST (mRE-CIST) assessment for hepatocellular carcinoma[J]. Semin Liver Dis,2010,30(1):52-60.
[20]李太平.行肝动脉化疗栓塞术后HBV DNA阴性乙肝相关性肝癌患者抗病毒治疗的临床意义[J].肝脏,2015,20(1):57-59.
[21]周佳美,向慧玲,吕洪敏,等. 预防性抗病毒对TACE治疗的HBV DNA阴性乙肝相关性肝癌的效果[J].天津医药,2013,41(9):875-877.
[22]Vizzini G B, Luca A, Marino I R. Hepatitis B virus reactivation after a single session of transarterial chemoembolization in patients with hepatocellular carcinoma[J]. Ann Intern Med, 2003, 138(8): 691-692.
(2015-11-24收稿2016-01-15修回)
(责任编辑岳建华)
Effect of antiviral therapy on prevention ofHBV reactivation after transarterial chemoembolization and prognosis in patients with of HBV DNA negative HBV related hepatocellular carcinoma
YANG Yang1, YANG Long1, WEI Yan2, JIANG Xuehua1, CHEN Zhiyong1, and CHEN Jian2.
1.Department of Infectious Diseases,2.Department of Oncology, Shanghai Municipal Corps Hospital of Chinese Pepole’s Armed Police Force, Shanghai 201103, China
ObjectiveTo study plan to observe the effect of antiviral therapy on hepatitis B virus (HBV) DNA negative HBV related hepatocellular carcinoma(HBVR-HCC), prevention of HBV reactivation and prognosis after transarterial chemoembolisation.MethodsSixty patients with HBVR-HCC (serum HBV DNA<500 IU/ml) were recruited during the period of 2012-05-01~2014-05-01 from Shanghai Corps Hospital of Chinese Pepole’s Armed Police Force, randomly assigned into study group (n=30, antiviral before TACE) and control group (n=30, TACE alone, antiviral unless HBV reactivation). The serum HBV DNA, liver function, coagulation function, α-fetoprotein (APF), and Child-Pugh score of the two groups before and after treatment were analyzed, and survival status between the two groups were compared.ResultsThe characteristics of the two groups had no statistically significant differentce in the baseline. No HBV reactivation was found in the study group, while six were found in control group, there was statistically significant difference between the two group(χ2=6.486,P=0.011).During the follow-up for two years, the liver function and Child-Pugh score had no statistical significant difference between the two groups. Prothrombin time (PT) and AFP had no statistically significant difference between the two groups at 24 and 48 weeks after TACE(P>0.05), while in the study group were significantly lower than in the control group at 72 and 96 weeks(P<0.05). The objective response rate (ORR) and disease control rate (DCR) had no statistically significant difference between the study group and the control group, there were 56.7%vs50.0% (χ2=0.268,P=0.605) and 86.7%vs83.3% (χ2=0.131,P=0.718), respectively. The survival rate of in the study group and the control group had no statistically significant difference at 1 year after TACE (76.7%vs70.0%,χ2=0.341,P=0.559), while had statistically significant difference at 2 years (70.0%vs43.3%,χ2=4.344,P=0.037). The median overall survival (mos) and median progression-free survival (mpfs) in the study group and the control group had statistically significant difference, there were 26.1 (95%CI: 23.9-28.1 ) months vs 22.7 (95%CI: 6.2-39.6) months (χ2=4.857,P=0.021) and 16.4 (95%CI:14.8-17.6) months vs 15.1 (95%CI:4.6-26.0)months (χ2=4.651,P=0.027), respectively.ConclusionsAntiviral therapy of HBV DNA negative HBVR-HCC before TACE can prevent HBV reactivation, prolong survival and improve prognosis.
hepatitis B; reactivation; hepatocellular carcinoma; antiviral; transarterial chemoembolization
杨阳,硕士研究生,主治医师。
201103,武警上海总队医院:1.感染科,2.肿瘤内科
杨龙,E-mail:yyandcg@sina.com
R735.7
