硫酸亚铁的重结晶对其水热法制备α-Fe2O3粒子的影响
2016-10-22余旺郑雅杰
余旺,郑雅杰
硫酸亚铁的重结晶对其水热法制备α-Fe2O3粒子的影响
余旺,郑雅杰
(中南大学冶金与环境学院,湖南长沙,410083)
以钛白副产物硫酸亚铁为原料,采用重结晶法对其除杂后,得到精制硫酸亚铁与氨水反应制备Fe(OH)3胶体为前驱体,经水热反应合成α-Fe2O3粒子。考察重结晶对硫酸亚铁的杂质去除及其水热法制备α-Fe2O3粒子的影响。采用电感耦合等离子体光谱仪分析硫酸亚铁和水热产物中的杂质元素含量,通过X线衍射仪、扫描电镜和激光粒度仪分析水热产物物相、形貌和粒径。研究结果表明:当结晶温度在0~30 ℃时,随着温度的升高,硫酸亚铁中杂质Ti,Zn和Al的去除率变化不大,杂质Mg和Mn的去除率略有增大,经过2次重结晶,Mg,Ti,Mn,Zn和Al的最大去除率分别可达到60.15%,94.87%,70.44%,50.90%和71.36%;随着结晶数的增加,所得水热法α-Fe2O3产品纯度更高、杂质含量更低,颗粒结晶更完整、粒径越小、粒径分布范围越窄,结晶数为0,1和2时所得球形α-Fe2O3粒子的纯度分别为96.32%,98.40%和98.80%,它们的中位粒径分别为0.66,0.62和0.58mm。
钛白;硫酸亚铁;重结晶;水热法;α-Fe2O3
二氧化钛(俗称钛白)是目前世界上最重要的一种白色颜料,其生产工艺主要有硫酸法和氯化法。中国2014年钛白粉产量达到246.6万t,钛白生产绝大多数采用硫酸法[1]。采用硫酸法生产钛白,每生产1 t钛白粉要排出硫酸亚铁3.5~4.0 t,中国2014年排出的硫酸亚铁大约有900万t,如此大量的硫酸亚铁(FeSO4∙7H2O)如不加以综合利用,既污染了环境又浪费了宝贵的资源[2]。目前,硫酸亚铁可以用来制备净水剂、饲料添加剂、氧化铁红、氧化铁黄、氧化铁黑、铁催化剂、试剂级硫酸亚铁、化肥等[3]。氧化铁红(α-Fe2O3)作为一种重要的无机颜料,由于其优越的性能,如无毒性、化学稳定性、耐用性及低成本等,得到了广泛应用,如建筑行业用颜料、无机染料、陶瓷、造纸行业用颜料和吸附剂、油漆、塑料等[4]。近年来,利用钛白副产物硫酸亚铁合成氧化铁红的研究比较活跃[5−6]。氧化铁红的生产方法分为干法和湿法2种,干法工艺有绿矾煅烧法、铁黄煅烧法、铁黑煅烧法等;湿法工艺有硫酸盐法、硝酸盐法、水热法、催化法 等[7]。其中水热法生产的特点是粒子纯度高、分散性好、晶形好且可控制,生产成本低,水热法成为目前研究最广泛的方法之一,LIU等[8−10]近年来研究了硫铁矿烧渣水热法制备氧化铁。但是,钛白副产物硫酸亚铁中含有Mg,Ti,Mn,Si,Al,Zn,Ca等多种杂质[11]。这些杂质混杂在颜料成品中会影响颜料的色光与性能。目前,关于硫酸亚铁中杂质对其水热法制备α-Fe2O3粒子的影响的研究鲜见报道。在此,本文作者以钛白副产物硫酸亚铁为原料,采用重结晶法对其除杂后,得到精制硫酸亚铁与氨水反应制备Fe(OH)3胶体为前驱体,经水热反应合成α-Fe2O3粒子。考察结晶温度和结晶数对硫酸亚铁中杂质去除的影响,同时通过考察结晶数对水热法α-Fe2O3产品物相、化学成分、形貌和粒径的影响来反映硫酸亚铁中杂质对其水热法合成α-Fe2O3粒子的影响。
1 实验
1.1 实验原料与试剂
试剂为还原铁粉、七水合硫酸亚铁及氨水(广东西陇化工股份有限公司),均为分析纯。水热反应晶种超微细氧化铁红(湖南三环颜料有限公司)粒子形貌为圆球形,颗粒均匀,粒径为0.3~0.7mm。本实验所用硫酸亚铁原料为烘干硫酸亚铁。采用X线荧光光谱仪(XRF)分析其化学成分,如表1所示。烘干硫酸亚铁主要由O,Fe和S 3种元素组成,并含有Mg,Ti和Mn等微量杂质。采用X线衍射仪(XRD)分析其晶相,如图1所示。烘干硫酸亚铁的主要晶相为四水硫酸亚铁(FeSO4∙4H2O)。
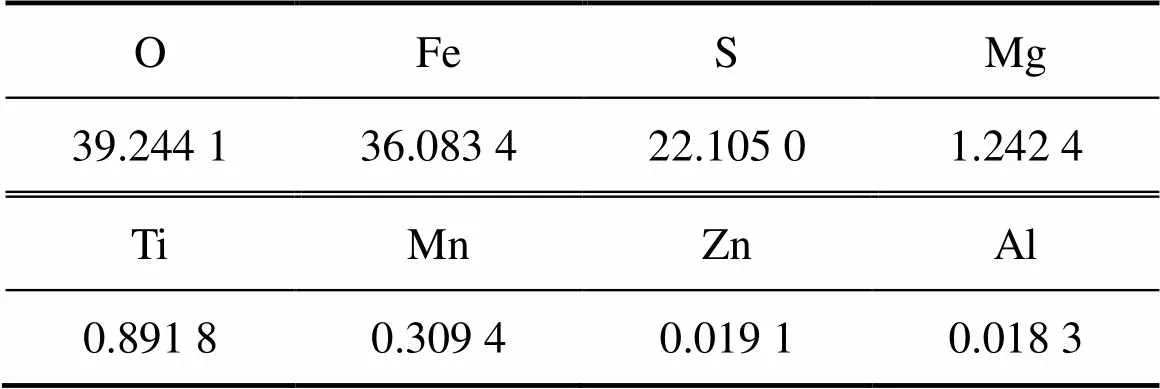
表1 烘干硫酸亚铁的化学成分(质量分数)
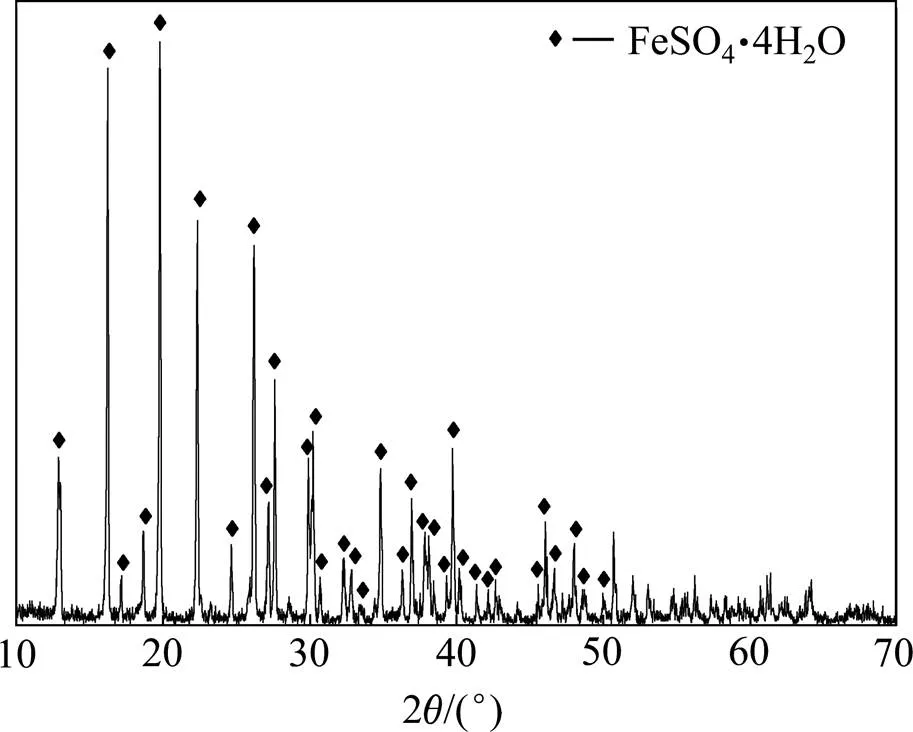
图1 烘干硫酸亚铁X线衍射图
1.2 实验过程
本实验可以分为硫酸亚铁重结晶、Fe(OH)3胶体制备和水热反应3个主要过程。
首先,采用重结晶法对硫酸亚铁进行除杂,取340 mL去离子水加热至64℃,按FeSO4的饱和度[12]加入烘干硫酸亚铁500 g,并加入2 g还原铁粉,保持溶液温度为64℃直至硫酸亚铁完全溶解,将溶解后的溶液缓慢冷却至0,10,20和30℃恒定结晶1 h,离心分离后得到1次精制硫酸亚铁和结晶母液;不同结晶温度下所得1次精制硫酸亚铁进行第2次重结晶,取一定量去离子水加热至64℃,按FeSO4的饱和度加入1次精制硫酸亚铁,保持溶液温度为64 ℃直至硫酸亚铁完全溶解,将溶解后的溶液缓慢冷却至与第1次重结晶相同的结晶温度恒定结晶1 h,离心分离后得到2次精制硫酸亚铁和结晶母液。
然后,以硫酸亚铁和氨水为原料,采用氧气氧化法制备Fe(OH)3胶体,称取一定量的烘干硫酸亚铁配制不同浓度的Fe2+溶液300 mL,在一定搅拌速率下缓慢滴加氨水调节反应溶液pH,室温下通入氧气反应一定时间,反应后,洗涤、过滤得到Fe(OH)3胶体,依次考察pH、氧气流量、搅拌速率、Fe2+浓度和反应时间对Fe(OH)3胶体制备的影响,确定Fe(OH)3胶体制备的最佳工艺条件。
最后,采用重结晶法对硫酸亚铁进行除杂,结晶温度选定为10℃,得到1次和2次精制硫酸亚铁;分别以烘干硫酸亚铁,1次精制硫酸亚铁和2次精制硫酸亚铁为原料,在最佳工艺条件下制备Fe(OH)3胶体;按总铁浓度1.25 mol/L和Fe2+与Fe3+物质的量比(Fe2+)/(Fe3+)=0.08称取一定量Fe(OH)3胶体和七水合硫酸亚铁加入烧杯中,按质量浓度5 g/L加入晶种,再加入去离子水配制胶体溶液300 mL,将制备好的胶体溶液转移到高压釜(FYXD0.5 20/350,大连通产高压釜容器制造有限公司)进行水热反应,设置搅拌速度为300 r/min,在230℃下,反应30 min后,采用内管冷却水快速冷却反应器,将所得水热产物从反应釜中取出,过滤、洗涤,并于105℃干燥12 h得到α-Fe2O3产品。
本实验整个工艺流程如图2所示。
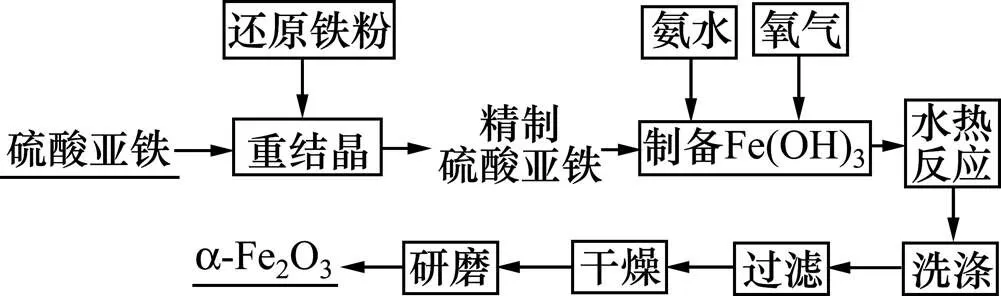
图2 实验工艺流程图
1.3 分析与检测
根据GB/T 1863—2008采用化学滴定法分析溶液中Fe2+和 Fe3+浓度,固体样品经盐酸溶解后再滴定铁含量;采用电感耦合等离子体光谱仪(ICP−OES,IRIS Intrepid Ⅱ,Thermo Eleetron Corporation)分析溶液中的杂质元素含量,固体样品经盐酸溶解后采用ICP−OES测定;采用 X 线荧光光谱仪(XRF,S4PI0NEER)分析原料中元素成分;采用X线衍射仪(XRD,Rigaku D/max−TTR III)分析样品物相(发光源为Cu K靶,管压为40 kV,管流为250 mA,= 0.154 056×10−10 m,2为10.0°~70.0°);在扫描电镜(SEM,FEI Quanta 200)下观察水热产物表面形貌;采用激光粒度分析仪(LS−POP(6),珠海欧美克仪器有限公司)分析水热产物粒子粒径。
对硫酸亚铁进行重结晶后,根据式(1)和(2)分别计算结晶产率和杂质去除率:
式中:为硫酸亚铁的结晶产率;1为结晶后精制硫酸亚铁中FeSO4的质量;2为结晶前硫酸亚铁原料中FeSO4的质量;为硫酸亚铁中杂质的去除率,1为结晶后精制硫酸亚铁中杂质的质量;2为结晶前硫酸亚铁原料中杂质的质量分数。
2 结果与讨论
2.1 硫酸亚铁重结晶
2.1.1 结晶温度和结晶数对硫酸亚铁结晶产率的影响
固体物质在溶剂中的溶解度与温度有密切关系。一般是温度升高,溶解度增大。在重结晶过程中,若把固体溶解在热的溶剂中达到饱和,冷却时由于溶解度降低,溶液变成过饱和会析出晶体。实验中固定饱和溶解温度为64℃,控制结晶温度分别为0,10,20和30℃,所得精制硫酸亚铁结晶产率如图3所示。
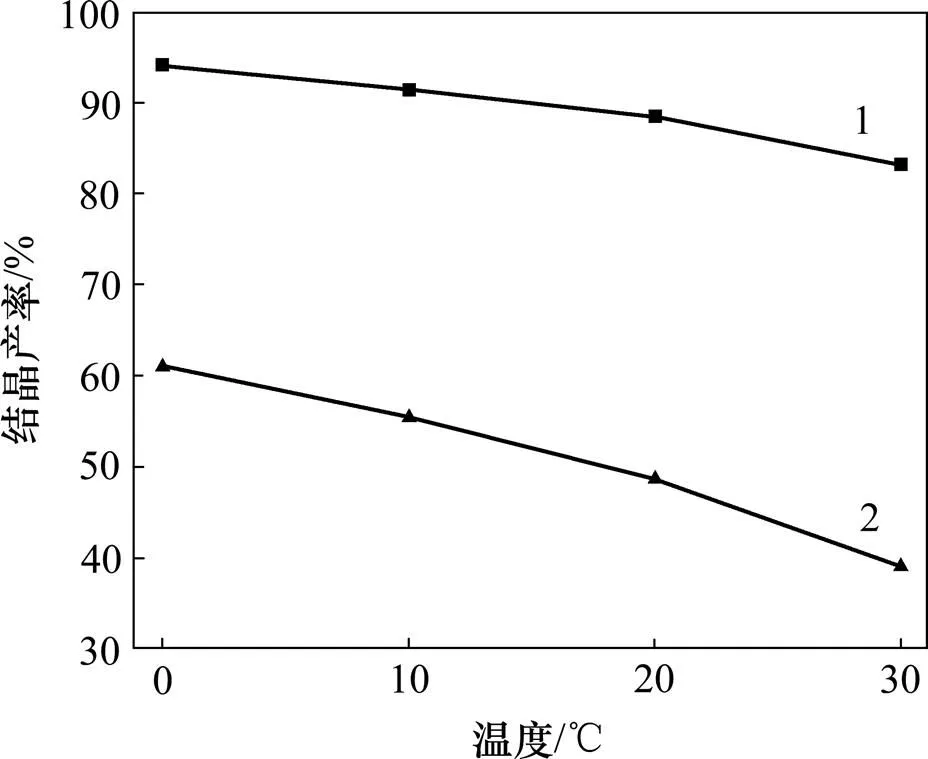
结晶数/次:1—1;2—2。
从图3可见:随着结晶温度的升高,硫酸亚铁的溶解度增大,结晶母液中残留的硫酸亚铁含量增多,从而硫酸亚铁的结晶产率降低。当结晶温度从0℃升至30℃时,硫酸亚铁1次重结晶产率从94.18%降至83.19%;其2次重结晶产率从61.06%降至39.06%。此外,在不同结晶温度下,2次重结晶后的结晶产率比1次重结晶后的低,这是因为2次重结晶产生2次结晶母液,损失更多的硫酸亚铁。
2.1.2 结晶温度和结晶数对硫酸亚铁中杂质去除的影响
重结晶是纯化、精制固体物质的有效手段,其过程为:首先,使重结晶物质在较高的温度下溶解在适合的溶剂中;然后,降低温度使待重结晶的物质结晶析出,而使杂质残留在溶液中[13]。本实验所用硫酸亚铁原料中主要杂质为Mg,Ti,Mn,Zn和Al,杂质含量依次下降,它们在不同结晶温度下的去除情况如图4所示。由图4(a)可以看出:在1次重结晶中,结晶温度对硫酸亚铁中杂质Ti,Zn和Al的去除影响不大,三者的最大去除率分别可达到84.16%,32.78%和64.70%;然而,杂质Mg和Mn的去除率随结晶温度的升高而略有增大,两者的最大去除率分别可达到36.72%和46.71%。由图4(b)可以看出:经过2次重结晶,结晶温度对硫酸亚铁中杂质Ti,Zn和Al的去除影响也不大,三者的最大去除率分别可增大到94.87%,50.90%和71.36%;杂质Mg和Mn的去除率随结晶温度的升高也略有增大,两者的最大去除率分别可增大到60.15%和70.44%。

结晶数/次:(a) 1;(b) 2 1—Ti;2—Al;3—Mn;4—Mg;5—Zn。
2.2 Fe(OH)3胶体制备
实验中,以硫酸亚铁和氨水为原料,采用氧气氧化法制备Fe(OH)3胶体,化学反应方程式如下:
FeSO4+2NH3∙H2O=(NH4)2SO4+Fe(OH)2(3)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(4)
以反应后的亚铁氧化率、反应溶液中的铁残留率和产物颜色为评价指标,依次考察了pH、氧气流量、搅拌速率、Fe2+浓度和反应时间对Fe(OH)3胶体制备的影响。
取Fe2+浓度为0.5 mol/L的硫酸亚铁溶液300 mL,在充分搅拌条件下缓慢滴加氨水调节反应溶液pH,氧气流量为0.5 L/min,搅拌速率为400 r/min,反应时间设为3 h,考察pH 8.0,8.5,9.0,9.5和10.0对Fe(OH)3胶体制备的影响。不同pH下的Fe(OH)3胶体制备实验结果如表2所示。
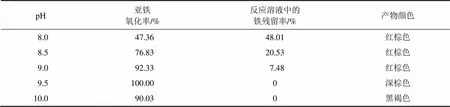
表2 不同pH下的Fe(OH)3胶体制备实验结果
由表2可知:随着pH的增加,亚铁氧化率先增大后减小,反应溶液中的铁残留率逐渐减小。当pH达到9.5时,反应溶液中的铁残留率为0,此时溶液中铁完全沉淀下来,亚铁氧化率为100%。当pH继续增大到10时,亚铁氧化率降低,生成黑褐色沉淀,这可能是由于pH过高,生成四氧化三铁[14]。综上所述,选择反应最佳pH为9.5。
继续考察氧气流量、搅拌速率、Fe2+浓度和反应时间对Fe(OH)3胶体制备的影响,分别选择氧气流量(0.1,0.2,0.3,0.4和0.5 L/min)、搅拌速率(300,350,400和450 r/min)、Fe2+浓度(0.5,0.6,0.7和0.8 mol/L)、反应时间(1.0,1.5,2.0和3.0 h)为考察因素。经过实验,最后得到Fe(OH)3胶体制备的最优工艺条件为pH 9.5,氧气流量0.2 L/min,搅拌速率450 r/min,Fe2+浓度0.6 mol/L,反应时间1.5 h。在此条件下,反应后亚铁氧化率100%。
2.3 硫酸亚铁的重结晶对其水热法合成α-Fe2O3粒子的影响
硫酸亚铁经重结晶法除杂后,进行水热反应制备α-Fe2O3粒子,考察结晶数0,1和2对α-Fe2O3产品的物相、化学成分、形貌和粒径的影响。图5所示为不同结晶数时水热反应所得α-Fe2O3产品XRD图谱。由图5可知:水热产物均为斜方六面体晶系α-Fe2O3晶相,其晶胞参数=0.503 6 nm,=0.503 6 nm,= 1.374 9 nm(JCPDS卡片,No.33-0664),无其他杂相;随着结晶数的增多,水热产物各衍射峰逐渐增强。衍射峰的峰强越大,颗粒的结晶越好[15]。由此可知,随着结晶数的增加,水热法所得α-Fe2O3颗粒物相更纯,结晶更完整。
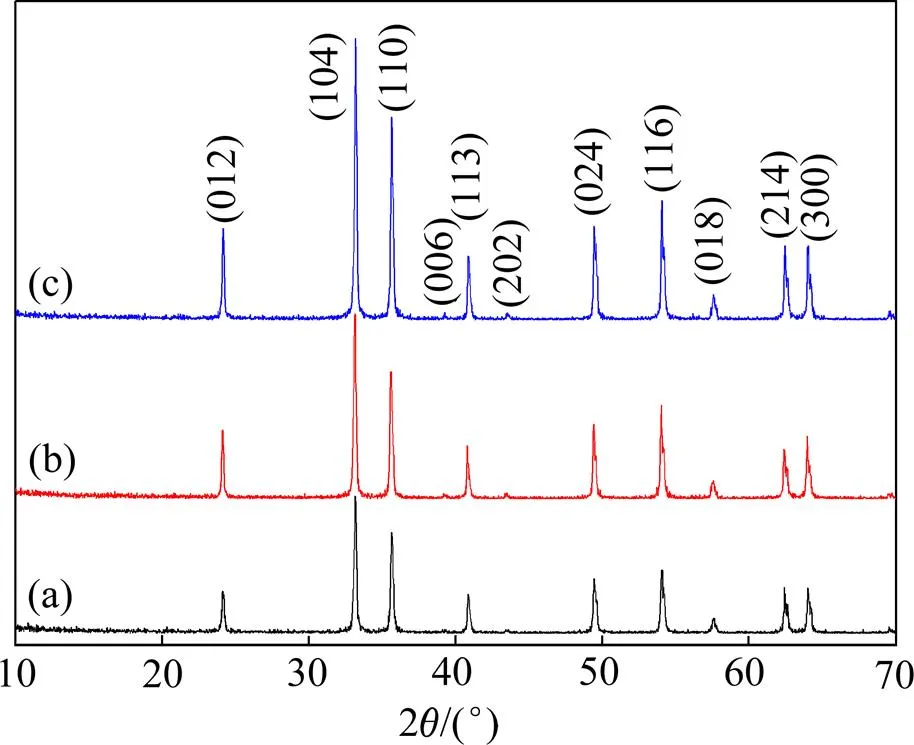
结晶数/次:(a) 0;(b) 1;(c) 2
表3列出了不同结晶数下所得水热法α-Fe2O3产品的化学成分。由表3可知:无结晶时,以硫酸亚铁为原料直接经水热反应制备α-Fe2O3,所得α-Fe2O3产品Fe2O3纯度为96.32%,达到国家标准A类品95%的要求(GB/T 1863—2008),产品中主要杂质为Ti和Mn,杂质Mg含量并不高,这可能是由于Mg2+的沉淀pH较高[16],在制备Fe(OH)3胶体时,反应溶液中的大部分Mg2+并未随Fe(OH)3胶体沉淀下来;随着结晶数的增加,α-Fe2O3产品Fe2O3纯度更高,杂质含量更低,这和XRD物相的检测结果是一致的;结晶数为2时,硫酸亚铁经过2次重结晶后,经水热反应制备α-Fe2O3,所得α-Fe2O3产品纯度达到98.8%,产品中所有杂质质量分数均低于0.1%。
表3 不同结晶数下水热法所得α-Fe2O3产品的化学成分(质量分数)
Table 3 Chemical composition of α-Fe2O3products hydrothermally prepared at different crystallization times %

结晶数/次Fe2O3MgTiMnZnAl 096.320.0131.7300.1880.0120.057 198.400.0070.2990.1290.0090.029 298.800.0050.0630.0800.0040.025
图6所示是结晶数为0,1和2时所得水热产物的SEM照片。由图6可知:不同结晶数下所得α-Fe2O3粒子均为球形,且都存在粒子间团聚现象,这是因为所形成的α-Fe2O3粒子细小,比表面积大,表面能高而产生团聚体[17],同时α-Fe2O3粒子也会因剩磁而产生磁团聚;随着结晶数的增加,α-Fe2O3粒子的粒径越均一,这可能是由于α-Fe2O3产品中的杂质含量随着结晶数的增加而减少,杂质含量越少,氧化铁晶粒生长过程中晶核附着生长点越均一,最后生成的氧化铁粒子粒径也越均一。

结晶数/次:(a) 0;(b) 1;(c) 2
对α-Fe2O3产品进行超声分散前处理后,采用激光粒度仪检测其粒径分布,不同结晶数下所得α-Fe2O3粒子的粒径分布特征如图7所示。由图7可见:随着结晶数的增加,α-Fe2O3粒子的粒径分布范围越窄,粒径越均一;随着结晶数的增加,α-Fe2O3粒子的粒径越小,结晶数为0,1和2时所得α-Fe2O3粒子的中位粒径(50)分别为0.66,0.62和0.58mm。在溶液体系中氧化铁的形成是氧化铁晶体一系列生长过程的结果,包括成核和晶体生长2部分,而成核速率和晶体生长速率决定了形成的氧化铁颗粒粒径[18]。随着结晶数的增加,溶液中杂质含量减少,氧化铁晶体成核更快更均一,当成核速率远大于晶体长大速率时,体系内很快生成大量的晶核,最终颗粒粒径越小,粒径分析和SEM分析结果相吻合。
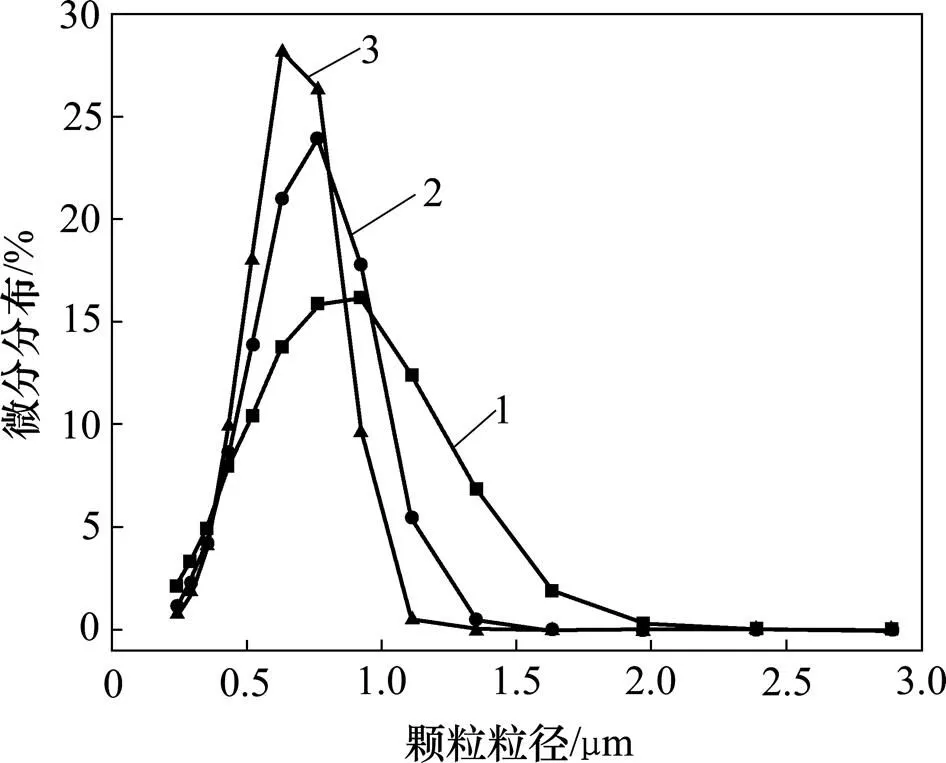
结晶数/次:1—0;2—1;3—2。
3 结论
1) 采用重结晶法对硫酸亚铁进行除杂,恒定结晶的温度选定为0,10,20和30℃,结晶温度对硫酸亚铁中杂质Ti,Zn和Al的去除影响不大,杂质Mg和Mn的去除率随结晶温度的升高而略有增大,经过2次重结晶,Mg,Ti,Mn,Zn和Al的最大去除率分别可达到60.15%,94.87%,70.44%,50.90%和71.36%。
2) 通过单因素实验对工艺条件进行了优化,Fe(OH)3胶体制备的最优条件为pH 9.5,氧气流量0.2 L/min,搅拌速率450 r/min,Fe2+浓度0.6 mol/L,反应时间1.5 h。在此条件下,反应后亚铁氧化率100%。
3) 随着结晶数的增加,所得水热法α-Fe2O3产品物相更纯,结晶更完整,Fe2O3纯度更高,杂质含量更低,结晶数为0,1和2时所得产品纯度分别为96.32%,98.40%和98.80%,结晶数为2时所得产品中所有杂质的质量分数均低于0.1%。
4) 不同结晶数下所得水热法α-Fe2O3粒子均为球形,且都存在粒子间团聚现象,随着结晶数的增加,α-Fe2O3颗粒粒径越小,粒径分布范围越窄,结晶数为0,1和2时所得α-Fe2O3粒子的中位粒径(50)分别为0.66,0.62和0.58mm。
[1] 邓捷, 张义杰. 2014年中国钛白粉行业运营情况及发展预测[J]. 中国涂料, 2015, 30(4): 1−6. DENG Jie, ZHANG Yijie. China Titanium Dioxide Operation in 2014 and Future Forecast[J]. China Coatings, 2015, 30(4): 1−6.
[2] 华彬, 施利毅, 施卫, 等. 生产钛白的副产物硫酸亚铁的精制研究[J]. 上海大学学报(自然科学版), 1999, 5(1): 61−63. HUA Bin, SHI Liyi, SHI Wei, et al. Study on the refining process of ferrous sulfate originated from the by-product of titanium dioxide production[J]. Journal of Shanghai University (Natural Science Edition), 1999, 5(1): 61−63.
[3] 陈朝华, 刘长河. 钛白粉生产及应用技术[M]. 北京: 化学工业出版社, 2005: 523−524. CHEN Chaohua, LIU Changhe. Technology of titanium dioxide production and application[M]. Beijing: Chemical Industry Press, 2005: 523−524.
[4] LI Dengxin, GAO Guolong, MENG Fanling, et al. Preparation of nano-iron oxide red pigment powders by use of cyanided tailings[J]. Journal of Hazardous Materials, 2008, 155(1/2): 369−377.
[5] GUSKOS N, PAPADOPOULOS G J, LIKODIMOS V, et al. Photoacoustic, EPR and electrical conductivity investigations of three synthetic mineral pigments: hematite, goethite and magnetite[J]. Materials Research Bulletin, 2002, 37(6): 1051−1061.
[6] 曹人玻. 以钛白副产物绿矾为原料低温制备纳米三氧化二铁的研究[D]. 广州: 华南理工大学轻工与食品学院, 2011: 15−48. CAO Renbo. Research on the synthesis of nanosized hematite with copperas at low temperature[D]. Guangzhou: South China University of Technology. School of Light Industry and Food Science, 2011: 15−48.
本文以成都大学软件工程专业建设为背景,以保持专业建设的优势为目的,从专业建设目标、课题体系建设、实践教学机制构建、教学方法与手段改革、师资队伍建设、实践教学条件建设等多个方面进行了探索研究,提出了成都大学软件工程品牌专业建设实施方案,并通过全国专业排名变化数据验证了方案的可行性和有效性,为其他高校软件工程品牌专业建设提供了参考。
[7] 郑雅杰, 符丽纯. 硫铁矿烧渣水热法制备氧化铁[J]. 中南大学学报(自然科学版), 2007, 38(4): 674−680.ZHENG Yajie, FU Lichun. Preparation of ferric oxide from pyrite cinders by hydrothermal method[J]. Journal of Central South University (Science and Technology), 2007, 38(4): 674−680.
[8] LIU Zhaocheng, ZHENG Yajie. Micaceous iron oxide prepared from pyrite cinders by hydrothermal method[J]. Journal of Central South University of Technology, 2011, 18(1): 89−95.
[9] ZHENG Yajie, LIU Zhaocheng. Preparation of monodispersed micaceous iron oxide pigment from pyrite cinders[J]. Powder Technology, 2011, 207(1/2/3): 335−342.
[10] LIU Zhaocheng, ZHENG Yajie. Hexagonal hematite platelets synthesized from pyrite cinders by hydrothermal process[J]. Journal of Central South University of Technology, 2011, 18(5): 1377−1382.
[11] GÁZQUEZ M J, BOLÍVAR J P, GARCÍA-TENORIO R, et al. Physicochemical characterization of raw materials and co-products from the titanium dioxide industry[J]. Journal of Hazardous Materials, 2009, 166(2/3): 1429−1440.
[13] 龚殿婷. 高纯硼酸的制备及制备过程中影响因素研究[D]. 沈阳: 东北大学材料与冶金学院, 2009: 54.GONG Dianting. Preparation of high purity boric acid and the study of influencing factors in the process[D]. Shenyang: Northeastern University. School of Materials and Metallurgy, 2009: 54.
[14] 朱骥良, 吴申年. 颜料工艺学[M]. 2版. 北京: 化学工业出版社, 2002: 244.ZHU Jiliang, WU Shennian. Pigment technology[M]. 2nd ed. Beijing: Chemical Industry Press, 2002: 244.
[15] SHEN Lazhen, QIAO Yongsheng, GUO Yong, et al. Preparation and formation mechanism of nano-iron oxide black pigment from blast furnace flue dust[J]. Ceramics International, 2013, 39(1): 737−744.
[16] 张希衡. 水污染控制工程[M]. 2版. 北京: 冶金工业出版社, 1993: 170−172. ZHANG Xiheng. Water pollution control engineering[M]. 2nd ed. Beijing: Metallurgical Industry Press, 1993: 170−172.
[17] 刘昭成, 郑雅杰. 硫铁矿烧渣水热法合成形貌可控的氧化铁[J]. 中南大学学报(自然科学版), 2011, 42(9): 2563−2570. LIU Zhaocheng, ZHENG Yajie. Morphology controllable iron oxide synthesized from pyrite cinders by hydrothermal method[J]. Journal of Central South University (Science and Technology), 2011, 42(9): 2563−2570.
[18] LIU Zhaocheng, ZHENG Yajie. Effect of Fe(Ⅱ) on the formation of iron oxide synthesized from pyrite cinders by hydrothermal process[J]. Powder Technology, 2011, 209(1/2/3): 119−123.
Effect of recrystallization on formation of α-Fe2O3particles prepared from ferrous sulphate by hydrothermal process
YU Wang, ZHENG Yajie
(School of Metallurgy and Environment, Central South University, Changsha 410083, China)
Iron oxide particles were synthesized by hydrothermal process, using ferric hydroxide gel as precursor. The precursor was prepared by the reaction of ammonia and refined ferrous sulfate which was obtained by recrystallization from a byproduct of TiO2industry. The effects of recrystallization on impurities removal of ferrous sulphate and formation of α-Fe2O3particles synthesized from ferrous sulphate by hydrothermal process were studied. The impurity elements of ferrous sulphate and iron oxide samples were analyzed by inductively coupled plasma optical emission spectrometer (ICP-OES), and the phase, shape and particle size of the synthesized iron oxide were characterized by X-ray diffraction (XRD), scanning electron microscope (SEM) and laser particle size analyzer (LPSA) respectively. The results show that ferrous sulphate is purified by recrystallization method. With the increase of crystallization temperature, when it is in the range of 0−30 ℃, the removal rates of impurity Ti, Zn and Al change little and those of impurity Mg and Mn increase slightly. After double recrystallization, the maximum removal rates of impurity Mg, Ti, Mn, Zn and Al reach 60.15%, 94.87%, 70.44%, 50.90% and 71.36%, respectively. With the increase of crystallization times, α-Fe2O3particles with higher purity, lower impurity content, better crystallization, smaller particle size and narrower particle size distribution are obtained. The Fe2O3purity of spherical iron oxide particles prepared at 0, 1 and 2 times crystallization are 96.32%, 98.40% and 98.80%, respectively, and the median particle sizes are 0.66, 0.62 and 0.58mm, respectively.
titanium dioxide; ferrous sulfate; recrystallization; hydrothermal process; α-Fe2O3
10.11817/j.issn.1672-7207.2016.09.007
TQ138.1
A
1672−7207(2016)09−2951−07
2015−08−31;
2015−10−18
广东省教育部产学研重大项目(2013A090100013);新疆维吾尔自治区高技术研究发展计划项目(201407300993)(Project (2013A090100013) supported by the Special Project on the Integration of Industry, Education and Research of Guangdong Province; Project (201407300993) supported by the High Technology Research and Development Program of Xinjiang Uygur Autonomous Region)
郑雅杰,博士,教授,博士生导师,从事有色金属冶金、功能材料及污染控制研究;E-mail: zyj@csu.edu.cn
(编辑 赵俊)
