快速基质分散净化—超快速液相色谱—串联质谱法同时测定玉米中22种三嗪类除草剂残留
2016-10-21吴岩赵伟刘永姜冰魏冬旭勾越李丽丽韩峰祖元刚
吴岩 赵伟 刘永 姜冰 魏冬旭 勾越 李丽丽 韩峰 祖元刚

摘要 建立了玉米中扑灭津、莠去津、敌草净、特丁通等22种三嗪类除草剂多残留的分析方法。样品以乙腈为提取剂,经高速匀浆方法提取并浓缩后,以增强型脂质去除净化剂(EMRLipid)净化,除去了样品中的脂质,有效地降低了样品中的复杂基质所带来的背景干扰,净化液再经增强型脂质去除萃取剂(EMRPolish)盐析萃取,以Kinetex XBC18柱为分离柱,用乙腈和0.1%甲酸溶液进行梯度洗脱,电喷雾正离子(ESI+)多反应模式监测,超快度液相色谱串联质谱(UFLCMS/MS)测定,基质匹配标准曲线法定量。加标水平为5, 10和20 μg/kg时,22种农药的回收率为72%~105%,相对标准偏差小于15%。22种农药的检出限为0.16~1.8 μg/kg, 在1.0~50 μg/L范围内线性关系良好(r>0.993)。本方法具有快速、准确、灵敏度高等优点,能够准确测定玉米中22种三嗪类除草剂的残留量。
关键词 脂质去除; 快速基质分散净化; 超快速液相色谱串联质谱法; 三嗪类除草剂; 玉米
1引言
三嗪类除草剂(Triazine herbicides),又被称为均三氮苯类除草剂,是目前作为预防农田杂草生长的在世界范围内应用广泛的高效除草剂之一。由于该类除草剂的使用量较大,并且具有水溶性强、化学性质稳定残留时间较长的特点,在使用后容易对农作物、土壤及地表水产生污染,从而进入人类的食物链,对人类健康和环境造成严重的危害。另外,研究表明,阿特拉津等三嗪类除草剂能够干扰人体荷尔蒙的正常功能,世界多国已将其列入内分泌干扰物名单 [1 ]。
玉米是我国重要粮食作物之一,种植面积大约3亿亩,年产量超亿吨,约占世界产量的20%。莠去津等三嗪类除草剂主要用于防治玉米田中一年生杂草,如果在施药过程中存在滥用、乱用的行为,将对玉米产业造成经济损失,并且危害食用者的健康。世界各国都对玉米中三嗪类除草剂的残留量制定了严格的限量标准,如美国对玉米中西玛津、莠去津、扑灭津等除草剂的最大残留限量为0.25 mg/kg,对特丁净、环丙津等除草剂最大残留限量为0.1 mg/kg,对西草净的限量为0.05 mg/kg [2 ]。我国国家标准GB 27632014中对玉米中莠去津、嗪草酮的限量为0.05 mg/kg,对西玛津的限量为0.1 mg/kg [3 ]。在我国,三嗪类除草剂是一个大型品种系列,每年产量和使用量都很大,可能对生态环境和食品安全造成极大的危害。
已报道的三嗪类除草剂的分析方法主要有毛细管电泳法(CE) [4 ]、气相色谱法(GC) [5~7 ]、高效液相色谱法(HPLC) [8~10 ]、气相色谱质谱法(GCMS) [11~14 ]以及液相色谱串联质谱法(LCMS/MS) [15~18 ]等,这些方法各有优缺点,CE法对于水样分析虽具有一定的优势,但存在检测器单一,方法适用范围窄等不足;GC以及HPLC分析三嗪类除草剂主要使用电子捕获检测器(ECD)、氮磷检测器(NPD)和紫外检测器(UVD),以上检测器只能以保留时间定性,检测结果存在假阳性的可能性较大,其在灵敏度及选择性上存在的不足,导致其所测定的三嗪类农药种类有限;GCMS与LCMS/MS相比GC和HPLC在灵敏度及选择性上有一定的优势,但是由于三嗪类除草剂的水溶性大多较强,农药的极性也相对较强,GCMS能够分析的三嗪类除草剂也有限,方法的检出限也不能完全到达残留限量的要求。LCMS/MS检测技术近年来不断发展,相比于GCMS具有高选择性、高灵敏度、高通量等优势,尤其对于水溶性较强的三嗪类除草剂而言,其母体结构含有的N原子在ESI+模式下极易电离,并且能够获得较低的检测限,采用多反应离子监测模式(MRM)定性更加准确。
为了配合高灵敏度的LCMS/MS,降低复杂样品所帶来的基质干扰对检测结果的影响,现有的样品净化技术也得到了快速发展, 如固相萃取(SPE) [10,12,16 ]、凝胶色谱(GPC) [13 ]、QuEChERS和分子印迹(MIT) [18 ]技术。QuEChERS(Quick,easy,cheap,effective,rugged and safe)技术,是一种分散固相萃取净化技术,具有提取净化效率高、环境污染小、操作简单快速等优点,在三嗪类农药多残留检测中已有应用 [15,20 ]。增强型脂质去除净化剂(Enhanced matrix removallipid,EMRLipid)是一种新型的高聚物吸附剂,可以有效地吸附脂质中C5及以上碳链,尤其对脂质为主要干扰物质的玉米样品来说,将EMRLipid吸附剂引入QuEChERS净化步骤中,有效地降低了基质干扰。目前还未见EMRLipid净化剂用于三嗪类除草剂残留检测的报道。
本研究采用EMR QuEChERS与UFLCMS/MS检测技术相结合的方式,建立了玉米中扑灭津、莠去津、敌草净、特丁通等22种三嗪类除草剂多残留的超快速液相色谱串联质谱(UFLCMS/MS)分析方法,考察了不同提取方式对提取效果的影响及EMRLipid净化剂的净化效果。结果表明,本方法操作简单、快速、选择性好、准确度高,具有一定的实用意义,为粮谷中三嗪类农药残留监控提供了必要的技术支持。
2实验部分
2.1仪器与试剂
UFLCMS/MS液相色谱串联质谱仪(Nexera XR液相色谱仪由日本岛津公司生产,AB6500+质谱仪由美国ABI公司生产),配有ESI源;T25高速均质器(德国IKA公司);NEVAP氮吹仪(美国Organomation公司);RV10旋转蒸发器(德国IKA公司);X22R高速离心机(美国贝克曼公司);MS3旋混仪(德国IKA公司)。
乙腈、甲醇(农残级, Sigma公司);甲酸(LCMS级, Sigma公司);NaCl(分析纯,北京益利公司);无水MgSO4、无水乙酸钠(分析纯,Sigma公司)。
莠去通、莠去津、叠氮津、草净津、环丙津、脱乙基另丁津、敌草净、异戊乙净、异丙净、环嗪酮、嗪草酮、扑灭通、扑草净、扑灭津、另丁津、密草通、西玛津、西玛通、西草净、特丁通、特丁津、草达津等农药标准品购于SigmaAldrich公司和德国DR公司。
EMRLipid净化管(含1 g EMR聚合物,使用前需加入与净化液体积相同的水后混合均匀)、EMRPolish反萃管(含2 g无水MgSO4)、dSPE净化管(含PSA 150 mg、C18 150 mg和无水MgSO4 900 mg)(美国Agilent公司)。
2.2液相色谱条件
Kinetex XBC18色谱柱(50 mm×2.0 mm,2.6 μm,美国菲罗门公司);流动相: 由0.1%甲酸溶液(A)与0.1%甲酸乙腈溶液(B)组成,梯度洗脱程序: 0~0.5 min, 10% B;0.5~2.0 min, 10%~50% B; 2.0~4.0 min, 50%~90% B;4.0~6.0 min, 90% B;6.0~6.1 min, 90%~10% B;6.1~8.0 min, 10% B。流速: 0.3 mL/min;进样量: 5 μL;柱温箱: 40℃;分析时间: 8 min。
2.3质谱条件
离子源为电喷雾(ESI+),采用正离子MRM模式采集数据。以全扫描、子离子扫描等方式优化每种农药的母离子和子离子的强度。优化后的质谱分析条件: 喷雾电压(IS)5500 V;离子源温度(TEM)600℃;气帘气压力(Curtain gas)35 psi;雾化气压力(Gas 1): 55 psi;辅助加热气(Gas 2):60 psi;碰撞气(CAD):9。离子对(MRM)、去簇电压(DP)、碰撞能量(CE)等参数见表1。
2.4标准溶液的配制
准确称取适量的农药标准品(纯度≥98.0%), 用乙腈分别配制成100.0 mg/L的标准储备液;混合标准溶液:根据需要再用乙腈逐级稀释成浓度为1.0, 2.0, 5.0, 10和50 μg/L的系列混合标准工作溶液。
2.5样品提取
2.5.1均质提取称取约10 g试样(精确至0.01 g)于200 mL三角瓶中,加入20 mL水溶胀30 min,加50 mL乙腈,用均质器于15000 r/min均质提取2 min,提取液经减压抽滤后,再用20 mL乙腈重复提取残渣一次,合并2次提取液,用乙腈定容至100 mL。分取50 mL上述提取液于100 mL具塞量筒中,加入10 g NaCl,剧烈振荡10 min,静置分层,直至上层乙腈相与水相界面清晰后方可进行下步操作。准确移取乙腈层25 mL于100 mL鸡心瓶中,在45℃下旋转浓缩至近干,用乙腈溶解残渣,将溶液转移并定容至5 mL刻度离心管中,待净化。
2.5.2振荡提取称取约5 g试样(精确至0.01 g),置于50 mL塑料离心管中,加入去离子水10 mL,静置20 min,向其中加入10 mL 1 %乙酸乙腈溶液,再向其中加入6 g无水MgSO4和1.5 g无水乙酸钠,盖上离心管盖,立刻剧烈振荡数次,防止结块,再以1000 r/min旋混2 min(或以手剧烈振荡提取1 min),提取液于4000 r/min离心3 min,待净化。
2.6样品净化
2.6.1EMR QuEChERS净化移取2.5节中待净化溶液5 mL,置于已经加入5 mL水混合均匀的EMRLipid净化管中,再以1000 r/min旋混2 min(或以手剧烈振荡提取1 min),再以10000 r/min高速离心5 min,转移5 mL上清液于EMRPolish反萃管中,剧烈振荡萃取1 min, 再以4000 r/min离心3 min,取上清液1 mL用0.22 μm有机滤膜过滤,注入UFLCMS/MS 分析。
2.6.2dSPE QuEChERS净化步骤移取2.5节中待净化溶液3 mL,置于装有含PSA 150 mg、C18 150 mg、无水MgSO4 900 mg的净化离心管中,再以1000 r/min旋混2 min(或以手劇烈震荡提取1 min),再以10000 r/min高速离心5 min,取上清液1 mL,用氮气吹至近干,残留物用乙腈1 mL溶解,再加入含5%甲酸乙腈溶液10 μL,混合均匀,用0.22 μm有机滤膜过滤,注入UFLCMS/MS 分析。
3结果与讨论
3.1色谱条件的选择和优化
本研究考察了流动相分别为乙腈0.1%甲酸和甲醇5 mmol/L乙酸铵两种不同体系的分离效果,实验表明,采用甲醇5 mmol/L乙酸铵体系时多数化合物出现峰形拖尾的现象,尤其西玛津、嗪草酮、叠氮津的拖尾严重,严重影响其灵敏度。采用乙腈0.1%甲酸体系时,由于流动相水相中有少量酸的加入,明显改善了碱性化合物的峰型,因此,确定以乙腈0.1%甲酸体系作为流动相。
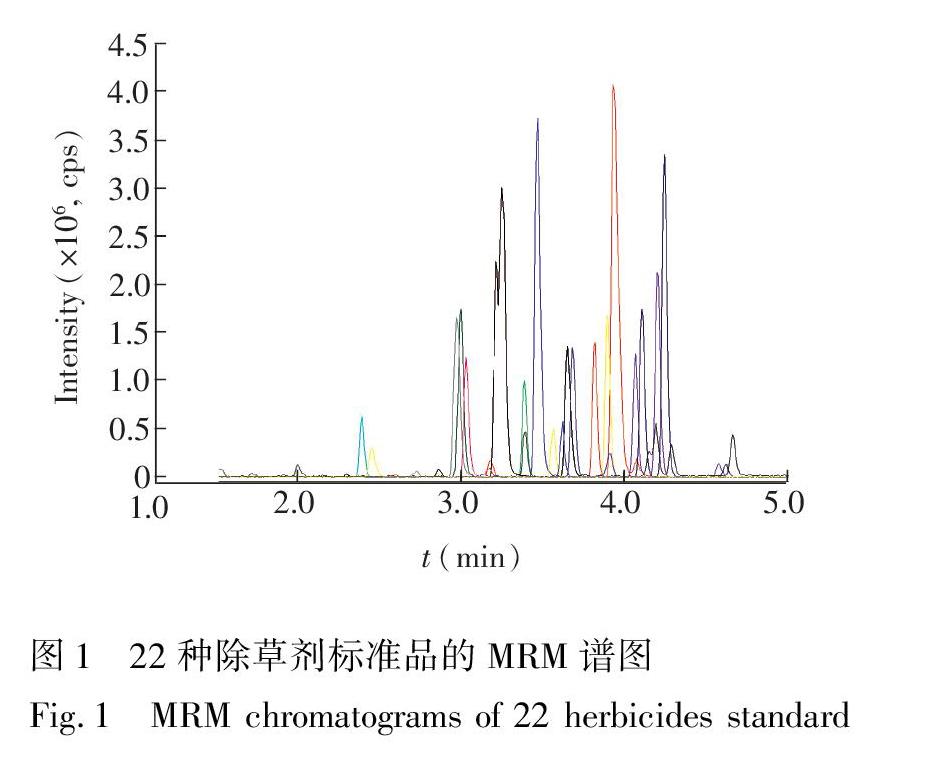
比较了Kinetex XBC18 (50 mm×2.0 mm, 2.6 μm,简称XBC18柱)和Synergi FusionRP(50 mm×2.0 mm, 2.5 μm,简称FusionRP柱)两种不同色谱柱的灵敏度和分离效率。结果表明,绝大多数除草剂在XBC18柱上的灵敏度比FusionRP柱高1~3倍,并且在XBC18的峰型好于FusionRP柱,相同的梯度洗脱条件下XBC18柱的分析时间可控制在6 min以内,相比于FusionRP柱要节省约一半的时间,因此本研究确定使用XBC18柱。22种除草剂的MRM谱图见图1。
3.2提取条件的确定
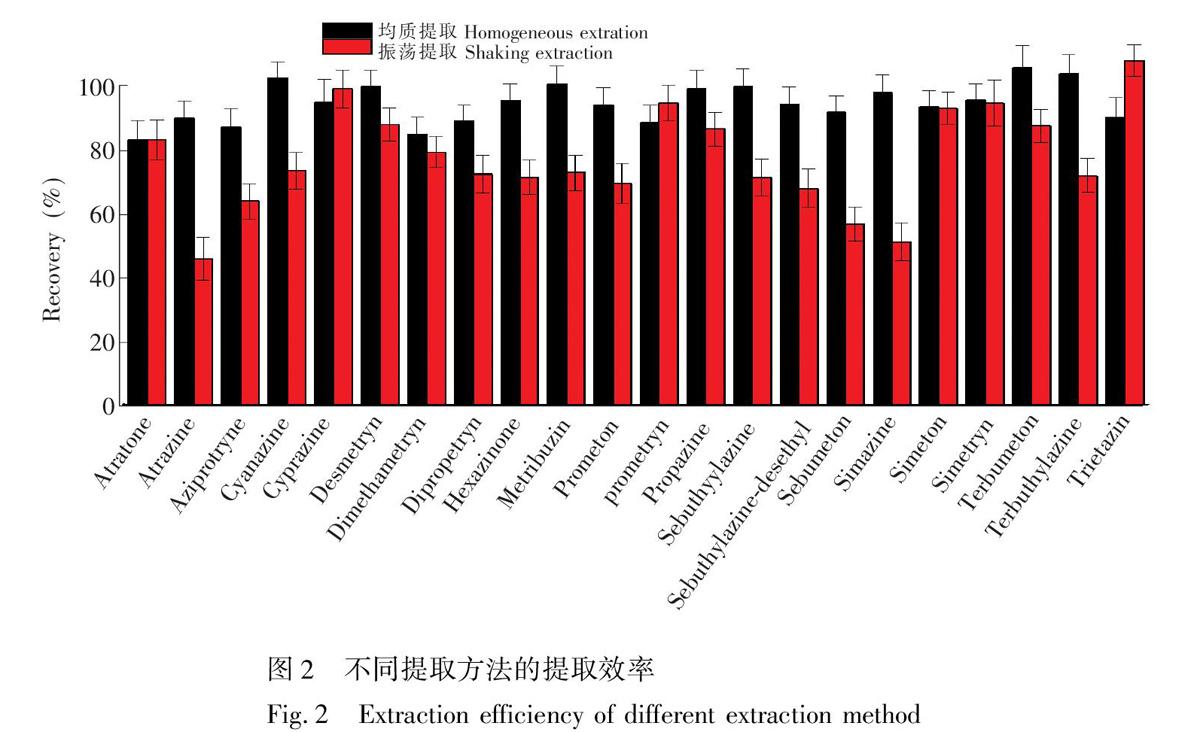
本研究考察了均质提取与振荡提取两种方式的提取效率,对22种除草剂在5 μg/kg的浓度水平下进行添加回收实验,按照2.5节操作,样品净化按照2.6.1节操作。结果表明,采用均质提取方式时,22种除草剂的提取效率均在80.7%~104.0%之间,而采用振荡提取方式时,大多数除草剂的提取效率均在60.7%~88.4%之间,水溶性较强的西玛津、莠去津、嘧草通的提取效率较差,仅在43.1%~58.6%之间,这可能由于玉米样品加水后溶胀,加入酸性乙腈等提取试剂后,采用振荡提取的方式,不能使提取溶剂与样品基质完全接触,从而降低了提取效率,而采用均质提取的方式则可以避免以上情况,并且二次提取能够从根本上保证提取效率。因此,本研究确定采用均质提取方式进行实验。均质提取与振荡提取效率的比较见图2。
3.3净化效果的比较由于玉米样品基质中含有较多脂质,这些物质在提取过程中会随被测农药同时被提取出来,如果不进一步的净化,基质效应带来的干扰会影响检测结果的准确性。本研究根据被测农药的性质,结合目前现有的农药多残留常用的QuEChERS净化方法,将EMRLipid高聚物分散剂用于除去样品中的脂质类干扰物质,简化了传统的dSPE QuEChERS净化过程。考察了EMR QuEChERS与dSPE QuEChERS净化方式的净化效果,发现EMR QuEChERS能够有效的降低基质效应,相比以硅胶基质为主键合C18、PSA等固定相的分散剂除去脂质效果更好,使检测结果的准确度和重现性更好,并且经过EMRLipid净化后,净化液由EMRPolish反萃管盐析后,上清液可经过滤后供UFLCMS/MS直接分析,无需经过氮吹、复溶等步骤,缩短了分析时间。使用不同净化方式的净化效果比较见图3。
从图3可见,使用EMRLipid净化剂净化后的玉米空白样品总离子流图背景干扰明显降低,因此,对于含有脂质类干扰物质的玉米样品而言,EMR QuEChERS净化方法为其样品前处理提供了一种新的选择,本研究确定使用EMR QuEChERS净化步骤进行净化。
3.4方法线性范围和检出限
在优化的色谱质谱条件下,进行方法学考察。配制22种除草剂质量浓度分别为1.0, 2.0, 5.0, 10.0和50.0 μg/L的系列混合标准溶液,每种浓度进样5 μL,以MRM定量离子色谱峰面积(A)对浓度(C, μg/L)建立标准曲线,以3倍信噪比(S/N)计算检出限(LOD),结果见表2。各组分在线性范围内,峰面积与浓度成良好的线性关系,相关系数大于0.993。22种除草剂的线性范围、检测限及相关系数见表2。
3.5方法的回收率及精密度
本方法采用标准加入法,取已制备均匀的空白样品,准确加入22种除草剂的混合标准溶液,分别添加浓度为5、10和20 μg/kg的样品各5份,按上述优化后的方法提取净化样品,并进行UFLCMS/MS分析。采用玉米空白基质溶液配制系列标准溶液,外标法进行定量分析,计算平均回收率和精密度(表3),结果表明,所有农药的回收率均在72%~105%之间,精密度也均小于15%,符合我国国家标准GB/T 274042008中规定的要求 [21 ]。
4结 论
本研究采用EMRLipid净化技术与超快速液相色谱串联质谱法(UFLCMS/MS)相结合,建立了一种简便、快捷的测定玉米中22种三嗪类除草剂多残留的分析方法,为高脂质样品的净化提供了一种新的手段,使快速净化与确证检测技术的更好地有机融合,显著缩短了检测时间,保证了检测结果的准确性和再现性。
References
1Baranowska I, Barchanska H, Pacak E. Procedures of Trophic Chain Samples Preparation for Determination of Triazines by HPLC and Metals by ICPAES Methods. Environ Pollut, 2006, 143: 206-211
2LIN WeiXuan. The Compilation of Residue Limits Standards for Pesticides and Veterinary Drugs in Foodstuffs in the Word. Dalian: Dalian Maritime University Press, 2002: 1057
林维宣. 各国食品中农药兽药残留限量规定. 大连: 大连海事大学出版社, 2002: 1057
3GB 27602014, National Food Safety StandardMaximum Residue Limits for Pesticides in Food. National Standards of the People′s Republic of China
食品安全國家标准 食品中农药残留最大限量. 中华人民共和国国家标准. GB 2760-2014
4LI YaZhen, LI ZhaoQian, ZHU HuaLing, WANG WeiPing. Chinese J. Anal. Chem., 2015, 43(12): 1882-1887
李亚珍, 李兆乾, 朱华玲, 王卫平. 分析化学, 2015, 43(12): 1882-1887
5LI WeiJian, NIE ZhiQiang, CAI YanMing, LIU XiaoWei, WANG Lu, LI Hong. Journal of AgroEnvironment Science, 2009, 1: 211-215
李卫建, 聂志强, 蔡彦明, 刘潇威, 王 璐, 李 红. 农业环境科学学报, 2009, 1: 211-215
6ZHANG JingBo, JIANG WenFeng, DONG Zhen Lin, ZHAO ShouCheng, WEI Feng. Chinese Journal of Chromatography, 2006, 24(6): 648-651
张敬波, 姜文凤, 董振霖, 赵守成, 卫 锋. 色谱, 2006, 24(6): 648-651
7PENG JinYun, WEI LiangXing, NONG KeLiang, LIN RunGuo. Chinese Journal of Analysis Laboratory, 2010, 29(6): 49-52
彭金云, 韦良兴, 农克良, 林润国. 分析试验室, 2010, 29(6): 49-52
8QI Yan, ZHAN ChunRui, ZHANG XinZhong, YANG Qiang. Chinese J. Anal. Chem., 2006, 34(6): 787-790
祁 彦, 占春瑞, 张新忠, 杨 强. 分析化学, 2006, 34(6): 787-790
9LI AiQiang, CHEN Jun, ZHANG ZongXiang. The Administration and Technique of Environmental Monitoring, 2008, 20(3): 44-46
李爱强, 陈 军, 张宗祥. 环境监测管理与技术, 2008, 20(3): 44-46
10YANG WenWu, MA YongGang, ZHANG ZongXiang. The Administration and Technique of Environmental Monitoring, 2010, 22(6): 55-57
杨文武, 马永刚, 张宗祥. 环境监测管理与技术, 2010, 22(6): 55-57
11ZHANG XinZhong, MA XiaoDong, ZHANG WeiGuo, LIN Jian, LI ChongJiu. Chinese J. Anal. Chem., 2008, 36(6): 781-787
张新忠, 马晓东, 张伟国, 林 健, 李重九. 分析化学, 2008, 36(6): 781-787
12ZHANG HuaWei, LIU HuiHui, TIAN XIUHui, DENG XuXiu, HUANG Hui, HAN DianFeng, XU YingJiang, GONG XiangHong. Journal of Chinese Mass Spectrometry Society, 2015, 36(2): 177-184
张华威, 刘慧慧, 田秀慧, 邓旭修, 黄 会, 韩典峰, 徐英江, 宫向红. 质谱学报, 2015, 36(2): 177-184
13LIU YunFei, ZHANG XinZhang, ZHANG LuShan, GENG Yue, MA XiaoDong, LI ChongJiu. Journal of Instrumental Analysis, 2009, 28(1): 96-100
刘云飞, 张新忠, 张璐珊, 耿 岳, 马晓东, 李重九. 分析测试学报, 2009, 28(1): 96-100
14WANG WanHong, WANG YanHong, WANG ShiCheng, ZHANG Hong, WANG Ying, ZENG Qing. Environmental Chemistry, 2009, 28(6): 899-903
王万红, 王颜红, 王世成, 张 红, 王 莹, 曾 青. 环境化学, 2009, 28(6): 899-903
15WANG YuJian, HUANG HuiLing, LI HuaPing, LIANG ZhenGang. Physical Testing and Chemical Analysis(Part B:Chemical Analysis), 2009, 49(2): 181-185
王玉健, 黄惠玲, 李华平, 梁振纲. 理化检验(化学分册), 2009, 49(2): 181-185
16WANG XiaoChun, LIU QingLong, YANG YongLiang. Chinese J. Anal. Chem., 2014, 42(3): 390-396
王晓春, 刘庆龙, 杨永亮. 分析化学, 2014, 42(3): 390-396
17LI YuZuo, ZHANG Rui, WANG HaiTao, DUAN HongAn, WANG Mo, LI Tuo, YAO YanPing, ZHANG ChunWei. Journal of Instrumental Analysis, 2009, 28(3): 315-318, 325
李育左, 张 睿, 王海涛, 段宏安, 王 沫, 李 拓, 姚燕林, 张春伟. 分析测试学报, 2009, 28(3): 315-318, 325
18WANG XiaoChun, LIU QingLong, YANG YongLiang. Chinese J. Anal. Chem., 2014, 42(3): 390-396
王晓春, 刘庆龙, 杨永亮. 分析化学, 2014, 42(3): 390-396
19HAN Fang, HU YanYun, ZHANG Lei, SHENG Xuan, SUN Hao, SONG Wei, L YaNing, ZHENG Ping. Chinese J. Anal. Chem., 2012, 40(11): 1648-1653
韓 芳, 胡艳云, 张 蕾, 盛 旋, 孙 昊, 宋 伟, 吕亚宁, 郑 平. 分析化学, 2012, 40(11): 1648-1653
20WANG TianShun, FAN YeGeng, YANG YuXia, LIANG Jun, MO LeiXing, LIAO Jie, YA Yu, FANG XueFeng. Journal of Instrumental Analysis, 2011, 30(10): 1153-1156
王天顺, 范业赓, 杨玉霞, 梁 俊, 莫磊兴, 廖 洁, 牙 禹, 方锋学. 分析测试学报, 2011, 30(10): 1153-1156
21GB/T 274042008, Criterion on Quality Control of LaboratoriesChemical Testing of Food. National Standards of the People′s Republic of China
实验室质量控制规范 食品理化检测. 中华人民共和国国家标准. GB/T 274042008
