五大连池新生代火山泥有机成分检测及其指标相关性分析
2016-10-21潘虹杨臣方振兴等
潘虹 杨臣 方振兴等
摘要[目的]探索五大连池火山泥生态,并为其演变规律提供数据支撑。[方法]以五大连池新生代火山泥为研究对象,利用改良熏蒸浸提法测定火山泥微生物碳、氮;利用化学滴定和比色法测定火山泥酶活性各指标,利用国标规定的土壤指标检测方法测定火山泥养分各指标。[结果]微生物量碳、氮分别以药泉山、火烧山火山泥带最高,5条泥带碳氮比均在10.00~13.00。过氧化氢酶、转化酶、脲酶、蛋白酶、纤维素酶含量分别以莫拉布山、火烧山、龙门山、火烧山、药泉山火山泥带最高,在研究区内,纤维素酶所占比重最大,脲酶最小,总酶含量以药泉山泥带最高。5条泥带全氮、全磷及全钾含量相对较均衡,分别在1.00~2.50、0.20~0.70、19.20~23.50 mg/g,分别以火烧山、龙门山、火烧山最高,有机质以火烧山含量最高。各有机成分间均呈现不同程度的相关性。[结论]药泉山和火烧山火山泥带各有机成分积累能力较强,矿化度较高。相关性分析表明,转化酶对环境变化的响应更为敏感。
关键词五大连池;火山泥;有机成分;相关性
中图分类号S153.6;Q938.1+3;X132文献标识码A文章编号0517-6611(2016)04-193-04
Organic Composition Detection and Correlation Analysis of Cenozoic Volcanic Mud at Wudalianchi World Geopark
PAN Hong, YANG Chen, FANG Zhenxing et al (Institute of Volcano and Spring, Heilongjiang Academy of Science, Harbin, Heilongjiang 150090)
Abstract[Objective] To provide data support for the ecology and evolution rule of cenozoic volcanic mud in Wudalianchi World Geopark. [Method] With cenozoic volcanic mud in Wudalianchi World Geopark as the research object, microbial biomass carbon and nitrogen in volcanic mud were detected by improved redistilled extraction method; indexes of enzymatic activity were detected by chemical titration and colorimetric method; indexes of nutrient in volcanic mud were detected by soil index detection method. [Result] The microbiomass carbon and nitrogen were the highest at Yaoquanshan, Huoshaoshan volcanic mud areas. The ratio between carbon and nitrogen was from 10.00 to 13.00 in the five areas. Hydrogen peroxidase, invertase, urease, protease and cellulase contents were the highest at Molabushan, Huoshaoshan, Longmenshan, Huoshaoshan, Yaoquanshan volcanic mud areas, respectively. In the research areas, cellulase had the greatest proportion, but urease showed the least. Total enzyme content was the highest at Yaoquanshan. In the five mud areas, total N, total P and total K were relatively balanced, which were within 1.0-2.5, 0.2-0.7 and 19.2-23.5 mg/g, respectively. They were the highest at Huoshaoshan, Longmenshan and Huoshaoshan volcanic mud areas. All the organic compositions showed different degrees of correlation. [Conclusion] Yaoquanshan and Huoshaoshan volcanic mud areas have relatively strong accumulation ability of organic composition, and high degree of mineralization. Correlation analysis shows that invertase is more sensitive to environmental changes.
Key wordsWudalianchi; Volcanic mud; Organic compositions; Correlation
五大連池世界生物圈保护区,暨五大连池世界地质公园,地处小兴安岭山地向松嫩平原的转换地带,位于126°07′17.81″~126°31′38.27″ E,48°38′21.25″~48°48′01.03″ N,属于寒温带季风气候,海拔250~300 m,年平均气温为0 ℃左右,年日照时数在2 100~2 850 h,年均降水量500 mm。主要植物种有小叶章Cinnamomum angustifolia、大叶章Deyeuxia langsdorffii、羊草Leymus chinensis、赖草Leymus secalinus、野笠苔草Carex drymophila、乌拉草Carex meyeriana等,伴生种有沼柳Salix rosmarinifolia 、草玉梅Anemone rivularia、小白花地榆Sanguisorba.tenuifolia等。五大连池火山泥因其蕴含多种矿物元素和具生物活性效应的稀土元素而广泛应用于各领域。近年来,火山泥的研究在我国是一个较特殊的研究方向,各种版本的教材、专著、科研文献对火山泥的生态研究匮乏。目前,人们对五大连池火山泥的研究仍处于初步阶段,如田杰[1]利用原子吸收分光光度法对五大连池矿泉泥中无机微量元素进行了测定;1996年吕育齐等[2]利用平皿法从测定矿泥杂菌总数、大肠杆菌、金黄葡萄球菌等指标,进行了五大连池矿泥卫生学研究;2000年吕育齐等[3]系统地对五大连池火山泥水分、粒径、密度、黏度、灰分、流变学、外观等物理性质进行了测定;尤传誉等[4]结合研究区钻孔资料对五大连池地区矿泥的分布特征、分布范围及储量进行了分析和评价。可见,学者对五大连池火山泥的研究仅限于物理成分鉴定、储量探究、特征性指标表述等方面。然而,对五大连池新生代火山泥有机成分的研究鲜见报道。五大连池世界生物圈保护区内火山众多,均为第四纪火山群,笔者选取其中极具代表性的5条火山附属泥带作为研究区域,检测微生物量碳氮、酶活性、养分等指标,并分析其指标间相关性,旨在为探索五大连池火山泥生态及其演变规律提供数据支撑。
1材料与方法
1.1试验区设置及样品采集5条火山附属泥带分别为药泉山火山泥带、火烧山火山泥带、莫拉布山火山泥带、龙门山火山泥带、焦得布山火山泥带(图1),将每条泥带均匀地划分为5个试验区,每个试验区面积约2 hm2,均匀选取3个样点,每点去除0~0.5 m表层土壤,钻取深度为20~130 cm泥层样品,从剖面层选取一段火山泥样,去除少量植物根系和石块,分别封装2个样袋,标记后带回实验室。一部分经室内风干、研磨、过筛、混匀后,用于养分和酶活性的测定,另一部分置于4 ℃冰箱保存,供微生物及其他指标的测定[5]。注:U为5座火山分布;V为药泉山火山泥带试验区;W为火烧山火山泥带试验区;X为莫拉布山火山泥带试验区;Y为龙门山火山泥带试验区;Z为焦得布山火山泥带试验区。
1.2.1土壤处理。将供试样品置于有适量的水和NaOH溶液的恒溫培养箱内,于25 ℃培养7 d,消除水分、温度的差异及新鲜有机物质的干扰,使各样品具有可比性[6]。称取火山泥样品(相当于干土15 g)置于真空干燥器中,同时放置盛有无乙醇氯仿及0.1 mol/L NaOH溶液(约2/3)的25 mL烧杯各1只,密封干燥器抽真空至氯仿沸腾并持续5 min后关闭阀门,于25 ℃黑暗条件下培养24 h。培养结束后,反复抽真空15 min除尽样品吸附的氯仿,另称取等量样品做不熏蒸处理,在所有样品中加入0.5 mol/L K2SO4溶液60 mL,于300 r/min振荡30 min,过滤。每样品及空白均设3次平行[7-8]。
1.2.2微生物量碳的测定。吸取提取液2 mL于150 mL消化管中,加入0.8 mol/L 1/6 K2Cr2O7溶液2 mL,12 mol/L浓H2SO4溶液2 mL,混匀后置于190 ℃油浴锅中煮沸5 min,冷却后转移到150 mL三角瓶中,加2滴邻啡啰啉指示剂,用0.2 mol/L FeSO4标准溶液滴定,溶液颜色由橙黄至蓝绿,再至棕红色即为滴定终点,记录FeSO4标准溶液用量。
1.2.3微生物量氮的测定。吸取提取液10 mL于消化管中,加入混合催化剂(K2SO4∶CuSO4∶Se=100∶10∶1) 2 g、 12 mol/L浓H2SO4溶液5 mL,混匀后置于340 ℃远红外消煮炉中持续消煮90 min,冷却后置于凯氏定氮仪中蒸馏,完毕后用0.01 mol/L HCl标准溶液滴定,溶液颜色呈紫红色即为滴定终点,记录HCl标准溶液用量。
1.3酶活性的测定过氧化氢酶检测采用高锰酸钾滴定法;转化酶检测采用水杨酸比色法;脲酶检测采用苯酚次氯酸钠比色法;蛋白酶检测采用FolinCiocalteu比色法;纤维素酶检测采用水杨酸比色法[9-10]。
1.4养分的测定全氮量检测采用重铬酸钾-硫酸消化法[11];全磷量检测采用NaOH熔融-钼锑抗比色法[12];全钾量检测采用NaOH熔融-火焰光度法[13];有机质检测采用重铬酸钾容量法-外加热法[14]。
1.5数据统计采用Excel软件统计数据,相关性分析采用Spss 19.0软件。
2结果与分析
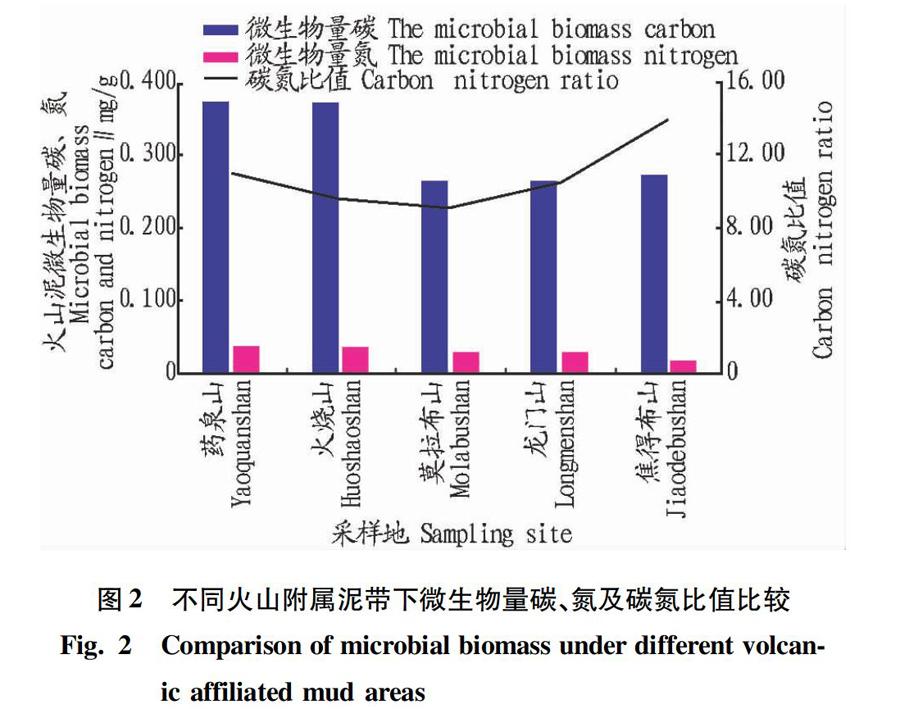
2.1不同火山附属泥带下微生物量碳、氮比较从图2可以看出,不同火山附属泥带下微生物量碳有所差别,除药泉山、火烧山附属泥带下微生物量碳大于0.350 mg/g处,其余泥带下微生物量碳均在0.280以下,且无显著差异。较碳而言,微生物量氮的总体变化趋势类似,火烧山泥带微生物量氮相较药泉山略高,但二者均在0.035 mg/g以上,其余泥带均在0.020 mg/g左右,且无显著差异。从微生物量碳氮比来看,所有泥带均在10.00~13.00,与耕作土壤相比数值较小,由于微生物量碳氮是基质养分的储存库,这一数值与火山泥贫养状态直接相关[15-18]。
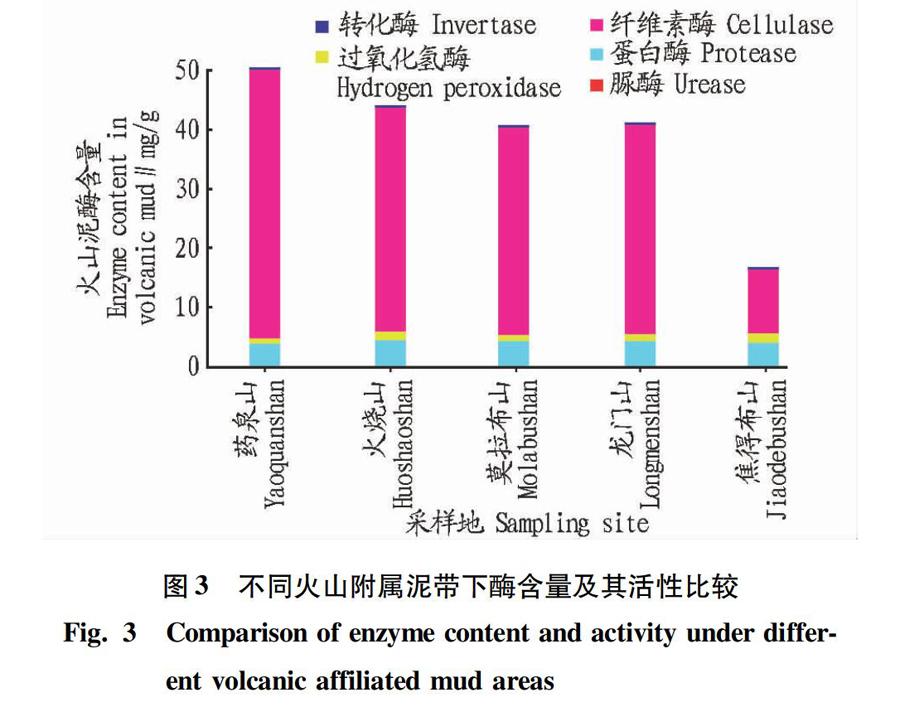
2.2不同火山附属泥带下酶活性比较从图3可以看出,从单种类酶来看,纤维素酶以药泉山含量较高,为50.00 mg/g左右,而火烧山、龙门山、莫拉布山次之,焦得布山最低,仅10.00 mg/g左右。在5种酶中,纤维素酶所占比重最大,这与表层丰满的苔草类植被生长及其根系分泌物直接相关,与耕作土壤一致。转化酶含量以火烧山最高,达到1.10 mg/g以上,其余含量相对较低。各附属泥带中,过氧化氢酶、蛋白酶含量相差不大,分别在4.00、0.40 mg/g左右。与其他种类酶相比,脲酶整体含量过低,各泥带无显著差异,均在0.02 mg/g左右,导致该现象的原因一方面是火山衍生环境中尿素含量极少,另一方面,表层植被及微生物代谢物中存在少量尿素,而脲酶将其水解为CO和NH3,NH3反过来对脲酶的活性又有抑制作用[19]。
从5条附属泥带来看,药泉山总酶含量相对较高,原因可能是其内部流经矿泉水带,致使泥层表面植被生长丰茂,泥层中微生物数量较多所致,另外,矿泉水中丰富的矿物元素(如Mg2+、Zn+、Mn2+、Sr2+等)与酶活性呈正相关;火烧山、龙门山、莫拉布山总酶含量次之;焦得布山总酶含量最低,这可能与其疑似常年冻土层相关。
2.3不同火山附属泥带下养分含量比较从图4可以看出,5条附属泥带下全氮、全磷及全钾的含量主要受泥质类型的影响,含量相对均衡,分别在1.00~2.50、0.20~0.70、19.20~23.50 mg/g,并以药泉山、龙门山、火烧山最高。有机质含量略有差别,以火烧山最高,达54.72 mg/g,以莫拉布山最低,为25.06 mg/g。相较前3项指标,有机质来源广泛,主要为土壤微生物的活动、植物根系分泌物和动植物残体腐解过程[20],因此含量相对较高。总体来说,由于火山泥来源特殊性,其养分含量较耕作土壤略低,这与其基质贫养状况相关。
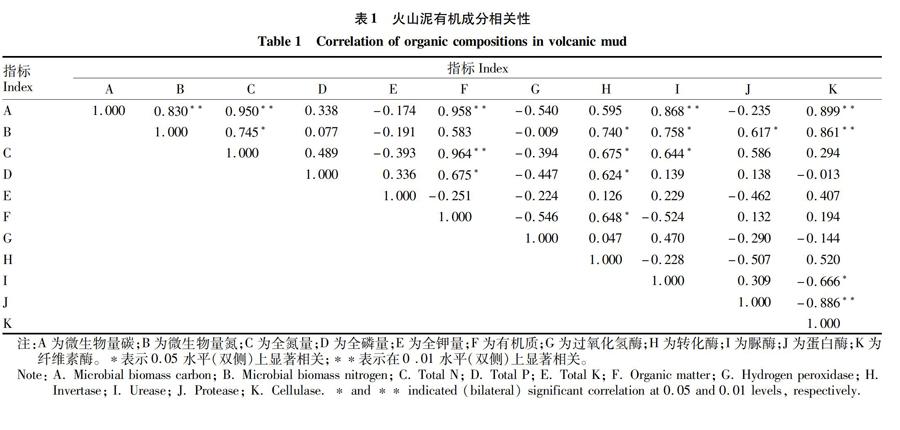
2.4有机成分相关性分析由表1可知,微生物量碳、氮间存在极显著相关性,微生物量碳含量与有机质、脲酶、纤维素酶含量呈极显著相关,微生物量氮含量与全氮量、转化酶、脲酶、蛋白酶和纤维素酶含量呈显著或极显著相关,转化酶含量与全氮量、全磷量、有机质含量显著相关,脲酶与全氮量显著相关,纤维素酶与蛋白酶显著相关,与脲酶含量极显著相关。可见,微生物量碳氮与酶之间,酶与养分之间,多种酶之间均呈现不同程度的正相关性。究其原因,酶类是由火山泥微生物代谢和植物的根部分泌所得,直接参与物质和能量转化,其活性一定程度上反映火山泥微生物活动的强度。
的转化一方面依赖于泥质中微生物的活动以及酶对底物的转化和生成,另一方面可促进微生物生长繁殖,增加酶活性[21-28]。
另外,火山泥过氧化氢酶与各因子之间均呈现不同程度的负相关,可能与火山泥高黏性高密度有关[28],因为酶类主要以酶–矿物粘粒复合体形式存在于泥质中,且处于被保护的物理状态[29],与其他酶类相比,过氧化氢酶的这种被保护状态可能更强。
3结论与讨论
目前,有关五大连池火山泥的研究仅局限于物理成分鉴定、储量探究等方面,笔者从有机成分的角度探索并解析五大连池火山泥尚属首次。由于微生物直接参与火山泥腐殖质的形成以及无机元素的转化循环过程,故今后笔者将从微生物角度,系统、全面地研究火山泥成分的微变化和营养形成过程,为后续发现火山极端微生物和有利用价值的菌种资源奠定基础。
该研究通过对五大连池新生代火山泥附属泥带微生物量碳氮、酶活性、养分等指标的检测及相关性分析,得出以下结论:
(1)微生物量碳、氮分别以药泉山、火烧山火山泥带最高,碳氮比符合微生物基质碳氮营养需求率;过氧化氢酶、转化酶、脲酶、蛋白酶、纤维素酶含量分别以莫拉布山、火烧山、龙门山、火烧山、药泉山火山泥带最高,总酶含量以药泉山泥带最高;5条泥带全氮、全钾及有机质含量均以火烧山最高,全磷以龙门山最高。总体来看,药泉山与火烧山火山泥带各有机成分积累能力较强,矿化度高。
(2)从检测数据来看,与壤土相比,火山泥微生物量、酶活性、养分含量普遍偏低,可见,研究区内泥质各有机成分与火山贫养环境密切相关。相关性分析表明, 与其他有机成分相比,转化酶活性表现为显著或极显著的正相关,说明转化酶对环境变化的响应更为敏感。
参考文献
[1] 田杰.五大连池矿泉泥中无机微量元素的测定[J].化学与粘合,1996(1):30-32.
[2] 吕育齐,倪小虎,杨东诚,等.五大连池矿泥卫生学研究[J].黑龙江医药, 1999(6): 334-335.
[3] 吕育齐,李文宇,阚美娟, 等.五大连池矿泥物性学研究[J].黑龙江商学院学报(自然科学版) ,2000(3):8-10,17.
[4] 尤传誉,冶雪艳,张海燕,等.五大连池地区矿泥分布特征及储量评价[J].地质与勘探, 2015(1): 61-66.
[5] 赵颖,史晓爽,周连仁,等.土壤样品风干后对土壤酶活性的影响[J].东北农业大学学报, 2011,42(11):126-129.
[6] 李振高,骆永明,滕应.土壤与环境微生物研究法[M].北京:科学出版社,2008:35-39.
[7] 吴金水,林启美,黄巧云.土壤微生物生物量测定方法及其应用[M].北京:气象出版社,2006:25-33.
[8] 孙凯,刘娟,凌婉婷.土壤微生物量测定方法及其利弊分析[J].土壤通报,2013,44(4):1010-1016.
[9] 关松荫.土壤酶及其研究方法[M].北京:农业出版社,1986:296-339.
[10] 孟立君,吴凤芝.土壤酶研究进展[J].东北农业大学学报,2004,35(5):622-626.
[11] 周斐德,邵则瑶.土壤全氮测定法:GB7173-87[S].国家标准局,1987.
[12] 肖国壮,张辉,苏方康,等.土壤全磷测定法:GB9837-88[S].中华人民共和国卫生部,1989.
[13] 傅绍清,王永真,张汝英,等.土壤全钾测定法:GB9836-88[S].中华人民共和国卫生部,1989.
[14] 李鸿恩,程岩,刘惠蓉,等.土壤有机质测定法:GB9834-88[S].北京:中国标准出版社,1989.
[15] 杨佳佳,安韶山,张宏.黄土丘陵区小流域侵蚀环境对土壤微生物量及酶活性的影响[J].生态学报,2015,35(17):5666-5674.
[16] 刘作云,杨宁.衡阳紫色土丘陵坡地退化植被和恢复植被土壤微生物生物量的研究[J].生态环境学报,2014,23(11):1739-1743.
[17] BARDGETT R D,IEEMANS D K.The short-term effects of cessation of fertilizer applications, liming and grazing on microbial biomass and activity in a reseeded upland grassland soil[J].Biology and fertility of soils, 1995,19: 148-154.
[18] FRANZLUBBERS A J,HONS F M,ZUBER D A.Seasonal changes in soil microbial biomass and mineralizable C and N in wheat management systems[J].Soil biology and biochemistry,1994,26(11):1469-1475.
[19] 黄昌勇.土壤学[M].北京:中国农业出版社,2000:50-64.
[20] 高雪峰,武春燕,韩国栋.草原土壤微生物受放牧的影响及其季节变化[J].微生物学通报,2010,37(8):1117-1122.
[21] HOFSTEDE R G M.The effects of grazing and burning on soil and plant nutrient concentrations in Colombia Páramo grasslands[J].Plant and soil, 1995,173:111-132.
[22] NOAH F,JOSHUA P S,PATRICIA A H.Variations in microbial community composition through two soil depth profiles[J].Soil biol biochem,2003,35(1):167-176.
[23] 朱美玲,貢璐,张龙龙.塔里木河上游典型绿洲土壤酶活性与环境因子相关分析[J].环境科学,2015,36(7):2678-2685.
[24] 胡雷,王长庭,王根绪,等.三江源区不同退化演替阶段高寒草甸土壤酶活性和微生物群落结构的变化[J].草业学报,2014,23(3):8-18.
[25] 褚洪龙,李莎,唐明.黄土高原油松根际土壤酶活性及真菌群落多样性研究[J].土壤学报,2015,52(1):154-161.
[26] 刘星,汪金松,赵秀海.模拟氮沉降对太岳山油松林土壤酶活性的影响[J].生态学报, 2015,35(14):4613-4624.
[27] 解丽娜,贡璐,朱美玲.塔里木盆地南缘绿洲土壤酶活性与理化因子相关性[J].环境科学研究,2014,27(11):1306-1313.
[28] 戴建军,宋朋慧,闫暮春,等.不同种植方式对苗期大豆、玉米根际土壤酶活性及微生物量碳、氮的影响[J].东北农业大学学报,2013,44(2):17-22.
[29] 赵兰坡,杨学明,丁桂云,等.长白山及五大连池火山灰土基本特性的研究[J].吉林农业大学学报, 1992,14(2):47-54.
