IL-37对白塞病患者单核细胞分泌炎症因子的影响
2016-10-21丁利平刘冬舟
丁利平,黎 丽,刘冬舟,黄 钟
1) 深圳大学医学部,广东深圳 518060; 2) 暨南大学第二临床医学院-深圳市人民医院风湿免疫科,广东深圳518020

IL-37对白塞病患者单核细胞分泌炎症因子的影响
丁利平1,2,黎丽1,刘冬舟2,黄钟1
1) 深圳大学医学部,广东深圳 518060; 2) 暨南大学第二临床医学院-深圳市人民医院风湿免疫科,广东深圳518020
通过合成白介素37(interleukin-37, IL-37)重组蛋白,对分离的活动期白塞病患者的外周血单核细胞(peripheral blood mononuclear cells, PBMC)进行预刺激,研究IL-37对白塞病炎症的影响.通过荧光定量PCR及酶联免疫吸附试验对白塞病人及正常人的外周血单核细胞中炎症细胞因子interleukin-1β(IL-1β)、interleukin-17A(IL-17A)和tumor necrosis factor alpha(TNF-α)的基因和蛋白表达水平进行分析,发现IL-37能有效降低白塞病PBMC中IL-1β、IL-17A及TNF-α的mRNA表达,减少炎性细胞因子IL-1β、IL-17A及TNF-α的细胞外分泌,从而证明IL-37在体外对白塞病的炎症具有抑制作用.
细胞免疫学;白塞病;白介素37;interleukin-1β; interleukin-17A; tumor necrosis factor alpha
白塞病(Behcet’s disease, BD)又称贝赫切特综合症,是一种系统性的以血管炎症为主的全身性免疫性疾病,其临床发病特征涉及多个器官,包括口腔和生殖器反复溃疡、眼睛色素膜炎、血管炎、关节炎、神经系统及肺部损害等[1].BD的发生机制尚不明确,可能与感染、遗传及免疫功能异常等因素有关[2],大量研究结果显示,BD患者的组织损伤与多种炎性细胞因子相关[3],患者的淋巴细胞能自发分泌interleukin-1β(IL-1β)、interleukin-17A(IL-17A)和tumor necrosis factor alpha(TNF-α)等促炎因子,这些炎性细胞因子的异常升高与BD发病及临床活动性紧密相关[4-6],白介素37(interleukin-37, IL-37)作为抑炎因子可以降低多种自身免疫性疾病的炎症反应[7].本研究就IL-37在体外对BD患者单核细胞中的主要炎症介质IL-1β、IL-17A和TNF-α的作用进行研究,以期探明IL-37对白塞病炎症的抑制作用.
1 材料与方法
1.1主要试剂与仪器
实验所用1640培养基及胎牛血清购自GIBCO公司;IL-37重组蛋白由深圳大学黄钟教授的实验室表达和纯化;脂多糖(lipopolysaccharide, LPS)购自Sigma公司;淋巴细胞分离液购自TBD科技公司;RNA提取试剂Trizol Reagent 购自Invitrogen 公司;反转录试剂盒购自Thermo公司;qPCR试剂盒购自BIO-RAD;酶联免疫吸附试验(enzyme-linked immunosorbent assay, ELISA)试剂盒购自eBioscience;生物安全柜购自香港力康HealForce;CFX-96荧光定量PCR仪购自美国BIO-RAD;Epoch微量分光光度计购自美国BIOTEK公司.
1.2外周血单核细胞(peripheral blood mononuclear cells, PBMC)的分离和培养
活动期BD患者血液样本(20例)是经患者同意后从北京大学深圳医院门诊部获取,与患者年龄和性别相当的健康人(healthy controls, HC)对照的血液样本(20例)是从北京大学深圳医院当天体检者的血液样本库中选取.拿到血液样本后3 h内使用淋巴细胞分离液,采用密度梯度离心法分离得到PBMC,以1×106mL-1铺于24孔板中并置于37 ℃,体积分数为5%的CO2恒温培养箱内培养.实验分为两组,分别加与不加质量浓度为100 ng/mL的IL-37蛋白,刺激过夜后加脂多糖(lipopolysaccharide, LPS) 1 μg/mL刺激6 h,培养结束后收集细胞,离心取细胞培养上清并于-80 ℃保存,以便后续进行ELISA实验来测定细胞上清中分泌的细胞因子.离心后的细胞加Trizol后立即或在-80 ℃条件下短期保存后提取RNA.
1.3RNA提取及qPCR检测PBMC细胞炎性细胞因子mRNA表达
细胞RNA经Trizol提取后用分光光度计进行定量,将不同样品的RNA质量调整一致后将RNA反转录为cDNA,反转录后的cDNA模板于-20℃条件下保存.白塞病的炎症因子主要有IL-1β、TNF-α及IL-17A,其引物序列分别为:IL-1β: 5′-CCACAGACCTTCCAGGAGAAT-3′(上游),5′-GTGCACATAAGCCTCGTTATCC-3′(下游);TNF-α: 5′-ACCTCTCTCTAATCAGC CCTCT-3′(上游),5′-GGGTTTGCTACAA CATGGGCTA-3′(下游);IL-17A:5′-CCCGGACTGTGATGGTCAAC-3′ (上游) ,5′- GCACTTTGCCTCCCAGATCA-3′(下游);β-actin: 5′-CCTGACTGACTACCTCATGAAG-3′(上游),5′-GACGTAGCACAGCTTCTCCTTA-3′(下游).上述引物由上海生物工程公司合成,按照BIO-RAD的SYBR体系进行qPCR扩增,所扩增的PCR产物经溶解曲线检验,目的基因扩增产物与看家基因β-actin比较,经2-ΔΔct 方法计算出该基因mRNA的相对表达量.
1.4ELISA检测PBMC炎性细胞因子的分泌
细胞上清中分泌的炎性细胞因子IL-1β、TNF-α及IL-17A是用ELISA方法测定,上述细胞因子的ELISA试剂盒均购自eBioscience,操作按照其说明书进行:将酶标板用包被抗体包被过夜,PBS洗涤3次,封闭液室温封闭1 h,PBS洗涤5次,标准品按2倍梯度稀释做标准曲线,设空白阴性对照,将待测样品稀释后分别加至酶标板中,每个样品3个复孔,室温1 h后,PBS洗涤5次,加酶标抗体室温0.5 h,PBS洗涤5次,加TMB显色10 min后加终止液终止显色反应,将酶标板于微量酶标仪上450 nm测光密度(optical density, OD)值.根据标准品读数绘制标准曲线,得到回归方程,再根据方程式计算得出样品质量浓度,乘以稀释倍数,即为样品的实际质量浓度.
1.5统计学方法
实验所得数据均以平均值±SEM形式表示.其中,SEM为标误差(stand error mean).用GraphPad Prism V.5.0 软件对实验所得数据进行分析,各组数据差异性比较采用t-test(非参数检验)方法进行分析, P<0.05表示差异具统计学意义; P<0.000 1表示差异具显著性; P>0.05则表示差异无统计学意义(not significant, NS).
2 结果与分析
2.1BD患者的PBMC中IL-37的mRNA水平表达降低
对BD患者及HC的PBMC进行qPCR检测,得到IL-37 mRNA本底水平的表达结果如图1.由图1可见,BD患者组的IL-37表达低于HC组, P<0.05, 差异具有统计学意义.
2.2BD患者的PBMC中炎性细胞因子的mRNA水平表达升高
将BD患者及HC的PBMC,分别加入质量浓度为1 μg/mL的脂多糖(lipopolysaccharide, LPS)并刺激6 h,收集细胞提取RNA,反转录后qPCR测BD组和HC组促炎细胞因子mRNA表达,结果如图2.由图2可见,BD组PBMC中的IL-1β(图2(a))、TNF-α(图2(b))和IL-17A(图2(c))的表达与HC对照组相比,分别增至2.8、3.0及3.5倍,得到P<0.05, 差异具有统计学意义.

图1 白塞病及健康者PBMC中IL-37 mRNA相对表达量Fig.1 The relative mRNA expression of IL-37 in PBMC from BD patients and HC

图2 白塞病及健康者PBMC中IL-1β、TNF-α及IL-17A的mRNA相对表达量Fig.2 Relative mRNA expression of IL-1β, TNF-α and IL-17A in PBMC from BD patients and HC
2.3促炎细胞因子的蛋白水平在BD患者的PBMC中分泌升高
将BD患者及HC的PBMC分别加入质量浓度为1 μg/mL的LPS,刺激6 h后收集上清,采用ELISA检测BD组和HC组单核细胞中促炎细胞因子的分泌,结果如图3.由图3可见,BD组PBMC上清中所检出的IL-1β(图3(a))、TNF-α(图3(b))和IL-17A(图3(c))蛋白显著高于对照HC组, P<0.000 1, 差异具有统计学意义.
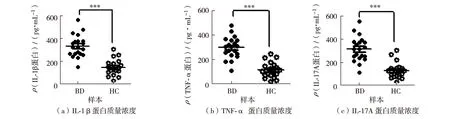
图3 白塞病及健康者PBMC的培养上清中IL-1β、TNF-α及IL-17A的蛋白质量浓度Fig.3 The mass concentration of protein of IL-1β, TNF-α and IL-17A in the supernatant of PBMC from BD patients and HC
2.4IL-37重组蛋白抑制了BD患者PBMC中促炎细胞因子mRNA的表达
将BD患者及HC的PBMC分别加与不加质量浓度为100 ng/mL的IL-37重组蛋白并刺激过夜,再加质量浓度为1 μg/mL的LPS刺激6 h,提取细胞RNA,反转录后进行qPCR检测,分析IL-37重组蛋白对BD组和HC组促炎细胞因子mRNA表达的影响,结果如图4.由图4可见,BD组PBMC中IL-37刺激组的IL-1β(图4(a))、TNF-α (图4(b))和IL-17A(图4(c))的表达显著低于IL-37未刺激组, P<0.05, 差异具统计学意义,而对照HC组在IL-37刺激后上述促炎因子的mRNA表达与IL-37不刺激组间无显著性差异.
2.5IL-37重组蛋白使BD患者PBMC中促炎细胞因子的分泌减少
将BD患者及HC的PBMC经上述IL-37和LPS刺激后,离心收集上清,ELISA检测IL-37对BD及HC单核细胞中分泌的炎性细胞因子的影响,结果如图5.由图5可见, IL-37预刺激后BD组PBMC上清中所检出的IL-1β(图5(a))、TNF-α(图5(b))和IL-17A(图5(c))蛋白质量浓度显著低于IL-37蛋白的未刺激组, P<0.000 1, 差异具显著性,而对照HC组在IL-37刺激后上述促炎因子的分泌与IL-37不刺激组间无显著差异.

图4 IL-37对白塞病及健康者PBMC中IL-1β、TNF-α及IL-17A的mRNA表达的影响Fig.4 Effects of IL-37 on the relative mRNA expression of IL-1β, TNF-α and IL-17A in PBMC from BD patients and HC

图5 IL-37对白塞病及健康者PBMC分泌IL-1β、TNF-α及IL-17A的蛋白的影响Fig.5 Effects of IL-37 on the protein levels of IL-1β, TNF-α and IL-17A in the supernatant of PBMC from BD patients and HC
3 讨 论
BD是一种慢性系统性的炎症疾病,介于自身免疫和自体炎症疾病之间[8],其发病机制虽然尚不明了,但可确定多种促炎细胞因子在BD发病中造成组织损伤[9].研究发现IL-1β、TNF-α和IL-17A在白塞病活动期患者的单核细胞中mRNA和蛋白水平较健康人相比显著升高,这与之前报道BD患者体内IL-1β、TNF-α和IL-17A表达与疾病活性正相关一致[6, 10].鉴于IL-1β、TNF-α和IL-17在BD发病中的重要作用,目前这些促炎因子已成为白塞病治疗的靶点,如抗IL-1抗体、抗TNF抗体等已进入临床试验阶段[11-12].
IL-37作为具有广泛抑炎作用的调节性细胞因子,已被证明能抑制多种自身免疫疾病及炎症性疾病中的炎症反应,如在炎症性肠病、强直性脊髓炎和系统红斑狼疮等疾病中起抑炎效应[13-15].本研究的分析表明,IL-37在白塞病中的表达较正常人有所降低,这与与文献[16]报道一致,但该报道是用IL-37蛋白刺激原代细胞72 h得出结论,原代细胞培养72 h后其存活状态及IL-37蛋白的活性都可能会受影响,因此其结果可信度有待检验.本研究采用IL-37重组蛋白对BD患者分出的单核细胞预刺激12 h,结果发现IL-37刺激12 h能显著抑制白塞病患者的单核细胞中促炎细胞因子IL-1β、TNF-α和IL-17A的mRNA的表达及蛋白的分泌,由此证明了IL-37对BD的炎症有很好的抑制作用.
结 语
BD是一种多系统受累的血管炎症疾病,迄今尚无有效疗法.IL-37作为天然免疫抑制因子,可显著抑制BD患者的外周血中促炎因子IL-1β、TNF-α及IL-17A的转录和分泌,因此可作为BD潜在的治疗靶点.后续仍需对IL-37抑制白塞病患者中促炎因子IL-1β、TNF-α及IL-17A表达的机制做深入研究.
/
[1] CantariniL, Lopalco G, Caso F, et al. Effectiveness and tuberculosis-related safety profile of interleukin-1 blocking agents in the management of Behcet’s disease[J]. Autoimmunity Reviews, 2015, 14(1): 1-9.
[2] Mendoza-Pinto C, Garcia-Carrasco M, Jimenez-Hernandez M, et al. Etiopathogenesis of Behcet’s disease[J]. Autoimmunity Reviews, 2010, 9(4): 241-245.
[3] Kapsimali V D, Kanakis M A, Vaiopoulos G A, et al. Etiopathogenesis of Behcet’s disease with emphasis on the role of immunological aberrations[J]. Clinical Rheumatology, 2010, 29(11): 1211-1216.
[4] Pineton de C M, Wechsler B, Geri G, et al. New insights into the pathogenesis of Behcet’s disease[J]. Autoimmunity Reviews, 2012, 11(10): 687-698.
[5] Emiroglu N, Cengiz F P, Erdem G B. Serum IL-17A in Behcet’s disease[J]. Postepy Dermatol Alergol, 2015, 32(5): 358-361.
[6] Zhou Zhenyuan, Chen S L, Shen Nan, et al. Cytokines and Behcet’s disease[J]. Autoimmunity Reviews, 2012, 11(10): 699-704.
[7] Xu Wangdong, Zhao Yi, Liu Yi. Insights into IL-37, the role in autoimmune diseases[J]. Autoimmunity Reviews, 2015, 14: 1170-1175.
[8] Hatemi G, Yazici Y, Yazici H. Behçet’s syndrome[J]. Rheumatic Diseases Clinics of North America, 2013, 39(2): 245-261.
[9] Leng Ruixue, Chen Guimei, Pan Haifeng, et al. The role of IL-23/IL-17 axis in the etiopathogenesis of Behcet’s disease[J]. Clinical Rheumatology, 2010, 29(10): 1209.
[10] Touzot M, Cacoub P, Bodaghi B, et al. IFN-α induces IL-10 production and tilt the balance between Th1 and Th17 in Behçet disease[J]. Autoimmunity Reviews, 2015, 14(5): 370-375.
[11] Vitale A, Rigante D, Lopalco G, et al. Interleukin-1 Inhibition in Behcet’s disease[J]. Israel Medical Association Journal, 2016, 18(3/4): 171-176.
[12] Chan E, Sangle S R, Coghlan J G, et al. Pulmonary artery aneurysms in Behcet’s disease treated with anti-TNFα: aa case series and review of the literature[J]. Autoimmunity Reviews, 2016, 15(4): 375-378.
[13] Ye Liang, Ji Ling, Wen Zhongyang, et al. IL-37 inhibits the production of inflammatory cytokines in peripheral blood mononuclear cells of patients with systemic lupus erythematosus: its correlation with disease activity[J]. Journal of Translational Medicine, 2014, 12(1): 69.
[14] Wang Weiqing, Dong Kui, Zhou Lu, et al. IL-37b gene transfer enhances the therapeutic efficacy of mesenchumal stromal cells in DSS-induced colitis mice[J]. Acta Pharmacologica Sinica, 2015, 36(11): 1377-1387.
[15] Chen Bingni, Huang Kunzhao, Ye Liang, et al. Interleukin-37 is increased in ankylosing spondylitis patients and associated with disease activity[J]. Journal of Translational Medicine, 2015, 13(1): 36.
[16] Bouali E, Kaabachi W, Hamzaoui A, et al. Interleukin-37 expression is decreased in Behcet’s disease and is associated with inflammation[J]. Immunology Letters, 2015, 167(2): 87-94.
【中文责编:英子;英文责编:艾琳】
2016-07-07;Accepted:2016-08-15
The anti-inflammatory effects of interleukin-37 on active Behcet’s disease
Ding Liping1,2, Li Li1†, Liu Dongzhou2†, and Huang Zhong1
1) College of Medicine, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China 2) Department of Rheumatology & Immunology, Shenzhen people’s Hospital, the Second Clinical Medical College of Jinan University, Shenzhen 518020, Guangdong Province, P.R.China
The recombinant protein interleukin-37 (IL-37) was synthesized for anti-inflammatory analyses in peripheral blood mononuclear cells (PBMC) from Behcet’s disease (BD). The protein levels of inflammatory cytokines such as interleukin-1β (IL-1β), interleukin-17A (IL-17A) and tumor necrosis factor alpha (TNF-α) in cell culture supernatant of patients with BD and healthy controls (HC) were measured by means of enzyme-linked immunosorbent assays (ELISA). The relative mRNA expression of these cytokines in PBMC was detected through real time quantitative PCR. We found that the protein and mRNA levels of inflammatory cytokines in active BD patients are significantly suppressed by recombinant IL-37 protein in vitro but not in the HCs. This finding suggests that IL-37 can significantly inhibit the inflammation in active BD patients.
cellular immunology; Behcet’s disease; interleukin-37; interleukin-1β; interleukin-17A; tumor necrosis factor alpha
Ding Liping, Li Li, Liu Dongzhou, et al. The anti-inflammatory effects of interleukin-37 on active Behcet’s disease[J]. Journal of Shenzhen University Science and Engineering, 2016, 33(5): 447-451.(in Chinese)
R 392
Adoi:10.3724/SP.J.1249.2016.05447
中国博士后科学基金资助项目(2015M572370);深圳市科技计划资助项目(JCYJ20130402092657775)
丁利平(1984—)女,深圳大学博士后研究人员.研究方向:自身免疫及炎症. E-mail: 13552432187@163.com
Foundation:Postdoctoral Science Foundation of China (2015M572370); Shenzhen Science and Techndogy Research Foundation (JCYJ20130402092657775)
† Corresponding author:Professor Liu Dongzhou. E-mail: liu_dz2001@sina.com; Postdoctoral Li Li. E-mail: wlili19860318123@163.com
引文:丁利平,黎丽,刘冬舟,等.IL-37对白塞病患者单核细胞分泌炎症因子的影响[J]. 深圳大学学报理工版,2016,33(5):447-451.
