薄荷醇麻醉剥离参苗与玻璃海鞘分离的研究
2016-10-20张艳萍李成林
张艳萍, 韩 莎, 李成林, 赵 斌, 胡 炜
薄荷醇麻醉剥离参苗与玻璃海鞘分离的研究
张艳萍1, 韩 莎2, 李成林2, 赵 斌2, 胡 炜2
(1. 青岛农业大学, 山东青岛 266109; 2. 山东省海洋生物研究院, 山东青岛 266104)
在刺参苗种工厂化生产期间, 以体积浓度为0.1%~0.5%薄荷醇作为麻醉剂, 通过对玻璃海鞘和不同规格参苗进行麻醉剥离实验, 研究参苗与敌害生物——玻璃海鞘分离的效果, 从而达到高效清除玻璃海鞘的目的。结果表明: 薄荷醇溶液对玻璃海鞘无剥离和杀除的作用效果; 大规格(0.58 g±0.05 g)刺参选用浓度0.4%~0.5%薄荷醇溶液麻醉20 min, 中规格(0.32 g±0.05 g)刺参选用浓度0.2%~0.5%薄荷醇溶液麻醉20min, 小规格(0.17 g±0.01 g)刺参选用浓度0.4%~0.5%薄荷醇溶液麻醉10min以及选用浓度0.1%~0.3%薄荷醇溶液麻醉20 min, 抖动脱落率均可达90%以上, 麻醉剥离效果显著。麻醉剥离后的刺参经1h的恢复即可达到自然状态, 营正常活动附着, 无排脏或化皮等不良应激反应。因此, 采用薄荷醇麻醉剥离参苗可为安全高效清除玻璃海鞘及分苗的生产环节提供省工省力、高效便捷的方法。
刺参苗种; 玻璃海鞘; 薄荷醇; 剥离; 麻醉
玻璃海鞘()属尾索动物亚门, 海鞘纲, 是沿海常见的附着生物, 雌雄同体, 繁殖快,附着率高, 给水产养殖业和海上设施带来了危害[1]。在刺参苗种工厂化生产期间, 自6月份开始, 玻璃海鞘会大量繁殖, 并附着在刺参苗种附着基上, 不仅与刺参争夺生活空间和饵料, 而且会大量消耗溶解氧, 同时还会向水中排泄大量代谢物, 从而抑制刺参的生长[2], 不同程度影响到刺参苗种培育的产量和质量, 是育苗系统中最为常见且危害较大的敌害生物。
多年来, 在刺参苗种工厂化生产过程中, 尚无有效控制和清除玻璃海鞘种群大量发生的方法, 通常只能通过勤倒池和更换附着基来减轻玻璃海鞘的大量繁生, 不仅劳动强度大、效率低, 而且对玻璃海鞘的清除极不彻底, 同时还会不同程度的伤及刺参苗种。目前, 国内已开展了玻璃海鞘生殖生物学[3-4]、代谢[1, 5]的相关研究, 而有关对玻璃海鞘防控及清除技术的研究仍然很少, 且多集中在寻找适宜的杀除药物方面[6-7], 应用于生产中的杀除效果不甚理想。为有效控制刺参育苗期玻璃海鞘的生长和繁殖, 需要在玻璃海鞘附着期及时将其从室内育苗池中清除, 或按时将其从附着基上清除。因此, 在实际生产中亟需一种劳动强度低、安全高效地清除玻璃海鞘的方法。薄荷醇作为水产麻醉剂已应用在多毛类[8]、双壳类[9]及腔肠类[10], 近年来应用在海参类中的研究也已陆续开展[11-13]。本研究选用薄荷醇为麻醉剂, 通过对玻璃海鞘和参苗的麻醉剥离实验, 探索不同规格参苗适宜的麻醉剥离浓度和时间, 以期达到安全高效、快速便捷清除玻璃海鞘的目的, 为刺参苗期玻璃海鞘的清除提供有效的技术方法和参考数据。
1 材料和方法
1.1 材料
实验用玻璃海鞘和刺参苗种来自山东省海洋生物研究院鳌山种质资源研究中心实验室, 在育苗池中随机抽取玻璃海鞘附着密度为280~450个/m2的波纹板筐参苗附着基, 放入60L的整理箱中进行暂养。所用刺参苗选取表观正常、肉刺坚挺、健康活力强的个体, 按平均体重(L)0.58 g±0.05g、(M)0.32 g± 0.05g、(S)0.17 g±0.01g分为大中小三个规格, 分别暂养于2 m3的玻璃钢槽中。每天15: 00按参苗体重的3%~6%投喂配合饲料, 投饲后停止充气1 h, 日换水2/3, 3d全量换水一次, 并清除残饵和粪便。实验海水为经过沙滤的自然海水, 水温19.4℃±0.8℃, 盐度30.6~31.8, pH8.1±0.2, DO>5.6mg/L。
1.2 麻醉剂配制方法
将薄荷醇晶体0.56 g溶解于99%的无水乙醇100 mL中配制成母液, 在每升海水水体中按体积百分比分别加入相应体积的母液配制成体积浓度的麻醉液。
1.3 方法
1.3.1 麻醉剥离及恢复实验
参苗的麻醉剥离及恢复实验均在60 L整理箱中进行, 在每个整理箱中放入附有玻璃海鞘的波纹板筐, 并按大中小3个规格, 在每个整理箱中分别放入30头参苗, 参苗经48h适应、营正常附着后进行实验。薄荷醇浓度设置为0.1%、0.2%、0.3%、0.4%、0.5%, 每一个浓度组设两个平行。实验按不同浸泡时间段分为六组, 浸泡时间分别为10、20、30、40、50和60 min, 在实验过程中, 观察玻璃海鞘的脱落情况以及参苗体表及肉刺的变化情况, 实验浸泡时间结束后记录自动脱落的参苗数, 然后提筐轻轻抖动附着基10 s, 统计抖动后脱落的玻璃海鞘数、参苗数和麻醉的参苗数, 最后将附着基及脱落的参苗转移到新鲜的海水中, 观察并统计刺参恢复和活动情况。
脱落率、麻醉率和附着率按下式计算:
脱落率(%)=实验中从附着基上脱落的参苗总数/实验参苗总数×100%
麻醉率(%)=实验中麻醉的参苗总数/实验参苗总数×100%
附着率(%)=实验中复苏附着的参苗总数/实验参苗总数×100%
1.3.2 结果判定
参苗脱落和麻醉状态判别标准: 经薄荷醇溶液浸泡后, 脱离附着基并掉落于整理箱底部即可确认为脱落; 当用玻璃棒刺激时无收缩反应并保持静止即可确认为达到麻醉状态。
参苗复苏状态判别标准: 初步复苏时活力较弱, 在整理箱底部不运动, 经外界刺激时有收缩反应, 附着力较弱; 完全复苏时活力正常, 附着于附着基或者容器壁上, 呈自由活动爬行状态, 附着力较强。
2 结果
2.1 薄荷醇对玻璃海鞘的作用
正常情况下, 玻璃海鞘的水孔呈现有规律地进行开闭。实验发现, 在浓度0.5%的薄荷醇溶液中, 部分玻璃海鞘的水孔有收缩的迹象, 开闭合节奏与正常情况下不同, 说明薄荷醇溶液对玻璃海鞘有一定的麻醉刺激作用。在所有实验组中, 随着麻醉浸泡时间的延长, 玻璃海鞘没有出现脱落及死亡的现象, 对人为刺激仍有较敏感反应。由实验可以得出, 在浓度0.1%~0.5%范围内, 薄荷醇溶液对玻璃海鞘无脱落和杀除的作用效果。
2.2 薄荷醇对不同规格参苗麻醉剥离的效果及复苏的影响
3种不同规格参苗在不同浓度薄荷醇溶液中的麻醉剥离效果及恢复情况, 如表1、表2、表3所示。
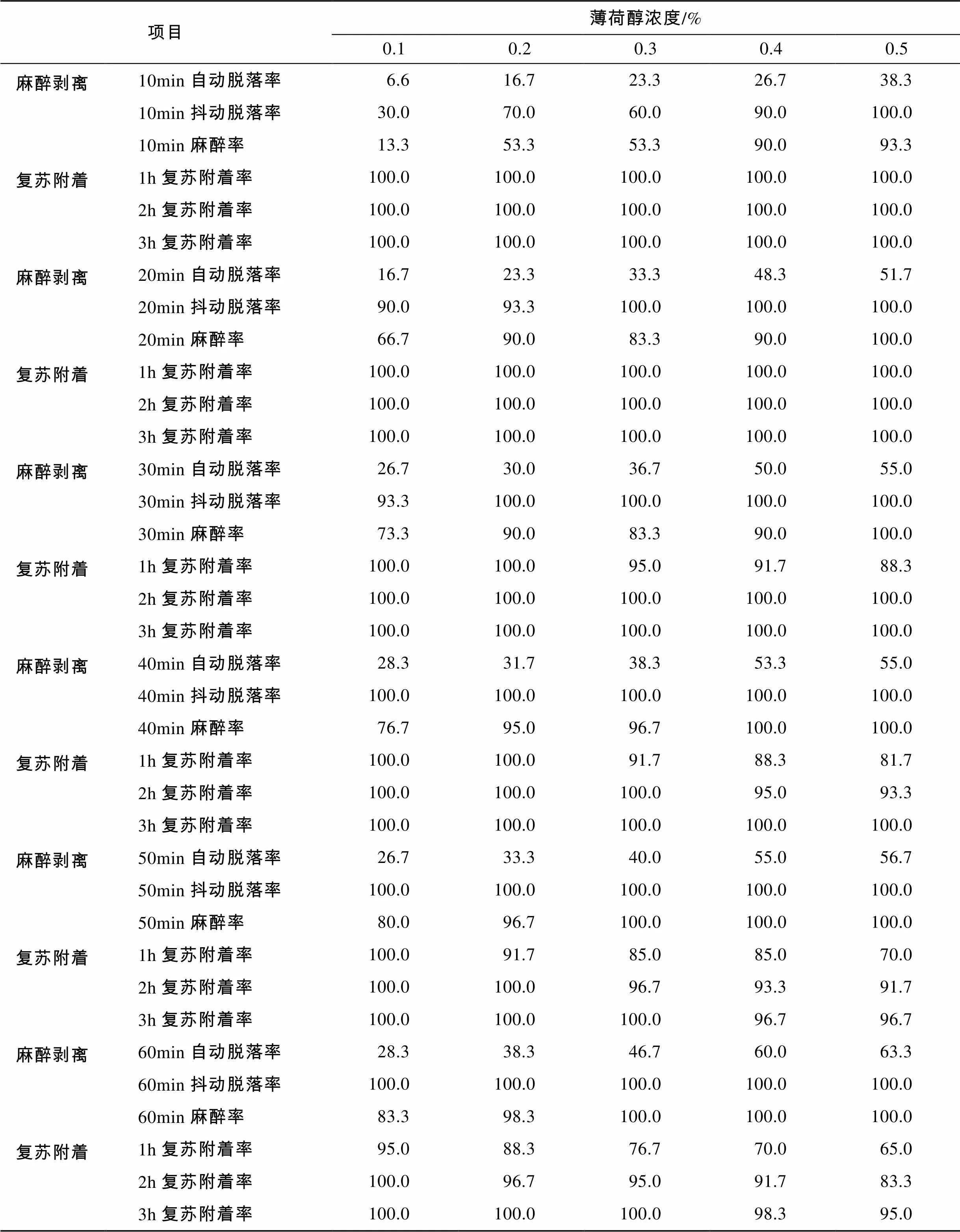
表1 薄荷醇对小规格参苗的麻醉剥离和复苏附着情况
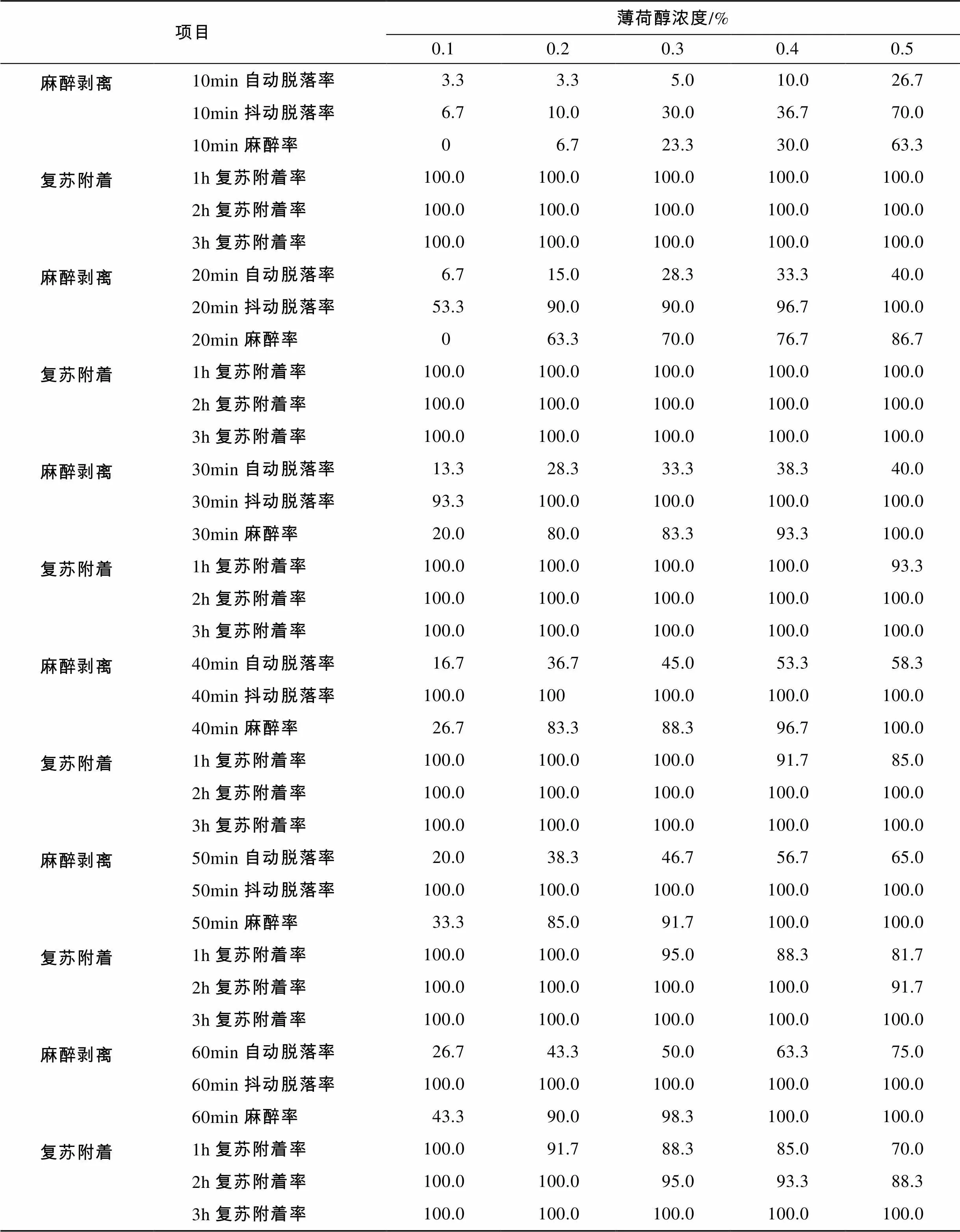
表2 薄荷醇对中规格参苗的麻醉剥离和复苏附着情况
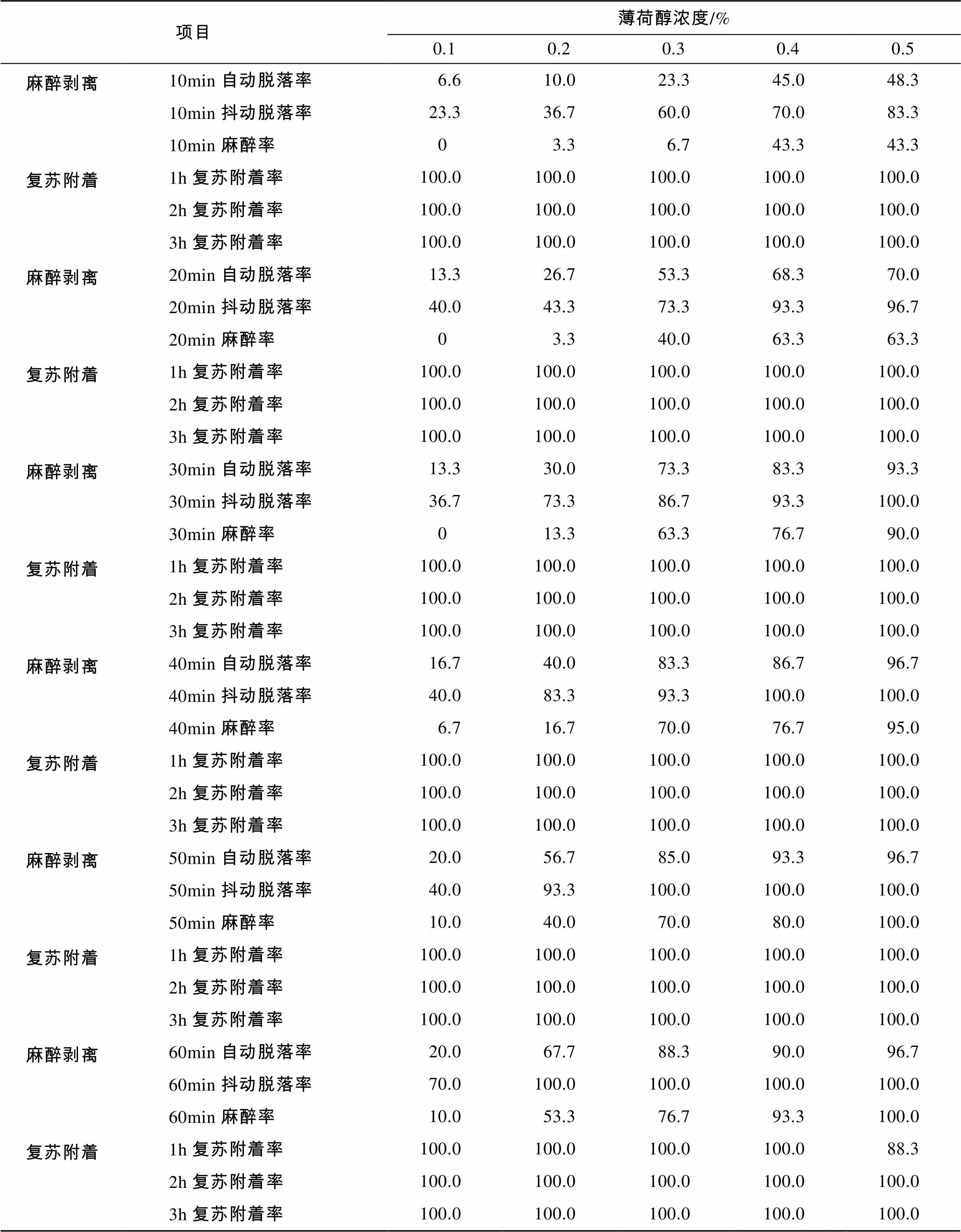
表3 薄荷醇溶液对大规格参苗的麻醉剥离和复苏附着情况
实验参苗在薄荷醇溶液中随浸泡时间的延长, 管足的附着力逐渐降低, 当粘附不牢时便自动脱落, 参苗的自动脱落率较低, 抖动后脱落率显著提高。从总体趋势来看, 参苗的脱落率随薄荷醇浓度的增大和浸泡时间的延长而增加。不同规格参苗剥离效率有较大差别, 参苗的自动脱落率随规格的增大而增大, 大规格参苗的自动脱落率显著高于中小规格, 而抖动脱落率的趋势则相反, 在薄荷醇溶液中浸泡20 min后, 抖动脱落率随规格的减小而增大。浸泡20 min时, 在0.1%~0.5%的薄荷醇溶液中的小规格参苗经抖动后, 90%以上脱落, 在0.2%~0.5%的薄荷醇溶液中的中规格参苗抖动脱落率也可达90%以上, 而大规格参苗要达到相同的剥离效率, 则需要较高的浓度, 在浓度0.4%~0.5%时, 浸泡20 min时抖动脱落率可达93.3%以上。其中, 浓度0.5%的薄荷醇溶液剥离效果最好, 抖动脱落率达100%时需时分别为大规格参苗30 min、中规格参苗20 min、小规格参苗10 min; 0.1%浓度的薄荷醇溶液对大规格参苗麻醉剥离效果最差, 麻醉40~50 min的抖动脱落率仅40%。
参苗的麻醉率随薄荷醇浓度的增大和浸泡时间的延长而增加, 大规格参苗麻醉率低于自动脱落率, 中小规格的麻醉率高于自动脱落率。同等条件下, 规格越大的参苗麻醉率越低, 复苏也越快。在浓度0.1%~0.5%的薄荷醇溶液中, 随着浸泡时间的增加, 参苗复苏后的附着率逐渐下降, 规格越小附着率越低, 附着率达100%所需的时间也越长。当浸泡30 min时, 在浓度0.1%~0.5%时, 大规格参苗恢复1 h的附着率均可达100%; 在浓度0.1%~0.4%时, 中规格参苗恢复1 h的附着率可达100%, 而在浓度0.5%时需恢复2 h附着率才达100%; 在浓度0.1%~0.2%时, 小规格参苗恢复1 h时的附着率可达100%, 而在浓度0.3%~0.5%时需恢复2 h附着率才达100%。当浸泡60 min时, 大规格参苗恢复1 h后, 除在浓度0.5%的附着率为88.3%外, 附着率均可达100%; 在浓度0.1%~0.2%时, 中规格参苗恢复2 h附着率可达100%,而在浓度0.3%~0.5%时需恢复3h附着率才达100%; 在浓度0.4%~0.5%时, 小规格参苗恢复3h附着率达95%以上。在麻醉剥离及恢复过程中参苗生理状态均正常, 没有出现诸如化皮、排脏等异常现象的过度应激反应, 表明在浓度0.1%~0.5%范围内, 薄荷醇麻醉剥离刺参苗种是安全有效的。
实验结果表明: 浓度0.4%~0.5%的薄荷醇对大规格参苗的剥离效果较好, 麻醉20 min的抖动脱落率可达93.3%以上; 浓度0.2%~0.5%的薄荷醇溶液对中规格的剥离效果较好, 麻醉20 min的抖动脱落率可达90%以上; 浓度0.1%~0.5%的薄荷醇溶液对小规格的剥离效果均较好, 浓度0.4%~0.5%的薄荷醇溶液麻醉10 min, 或浓度0.1%~0.3%的薄荷醇溶液麻醉20min, 抖动脱落率均可达90%以上, 麻醉剥离的参苗经过1h的恢复后附着率均可达100%。
3 讨论
3.1 刺参苗期敌害生物——玻璃海鞘的清除
玻璃海鞘是刺参生产过程中极为常见的主要敌害生物, 目前尚无有效控制其种群大量发生的方法, 一直是困扰刺参室内育苗及养殖的难题。在无脊椎动物生活史中, 常出现2个不同的发育阶段: 一为浮游生活阶段, 二为固着生活阶段[14]。玻璃海鞘的幼虫浮游期较短, 在刺参苗种培育过程中, 可通过加大换水量、换水时对海水进行过滤等方法来预防玻璃海鞘的附着。长期以来, 应对玻璃海鞘大量滋生仅能通过人工清除或化学药物杀除的方法, 既费时费力又增加了生产成本, 同时对参苗和海水水质也均有不同程度影响和危害。王印庚等研究的利用中草药组合杀除玻璃海鞘的方法低毒、无害, 通过每天药浴24 h后换水、连续3 d后倒池、7 d后更换附着基[7], 可达到良好的杀除玻璃海鞘效果。但是, 与其他或传统清除玻璃海鞘的方式不同的是, 本实验采用薄荷醇对参苗进行麻醉使之脱离附着基, 而玻璃海鞘可能由于体外套有一层类似植物纤维素的被囊的原因, 在薄荷醇作用下无应激和脱落的现象发生, 从而达到参苗与玻璃海鞘分离的效果。此种方法极大提高了清除效率和清除效果, 劳动强度小且对刺参无任何毒副作用, 为安全高效的清除玻璃海鞘提供了新的思路和途径。
3.2 薄荷醇麻醉剥离刺参脱离附着基的效果
海洋无脊椎动物与外部表面的附着主要分为两类: 一是分泌黏物质使身体固定在附着基上; 二是靠身体的运动器官, 使身体固定在附着基上, 这类动物用器官的变化和分泌的黏液来移动换位, 如刺参靠管足和触手粘附于基质上[15], 可以用物质刺激其运动器官使其脱离附着基, 当刺参的附着力无法抵消重力时刺参便脱落。据研究报道, 酒精[15]、盐度[15]、氯化钾[16]等均有刺激刺参收缩而脱落的作用, 但这些物质对刺参刺激性较大, 易引起刺参身体收缩、体表棘刺及口收入体内, 更有甚者引起刺参排脏或皮肤受损而化皮。韩莎等[11]研究表明, 在薄荷醇溶液浓度小于4%时对仿刺参麻醉安全有效, 刺参不仅能够较快地达到麻醉状态, 且能在短时间内复苏达到良好的自然状态, 能够正常摄食并保持较好的活力, 无化皮或排脏等不良现象。在麻醉剥离参苗脱离附着基与玻璃海鞘分离的实验中发现, 参苗在麻醉后管足伸展呈直立状态, 附着力逐渐下降, 在重力作用下自动脱落或者轻微抖动便可脱落, 剥离效果较佳, 不仅剥离效率高, 而且剥离后可以迅速恢复正常活动和附着。
不同规格参苗的剥离效率有较大的差异, 自动脱落率与参苗的体重和麻醉程度均相关。大规格参苗因自身体重较大, 自动脱落率明显高于中小规格。但同等情况下, 薄荷醇对中小规格麻醉程度高于大规格, 因此中小规格的抖动脱落率要高于大规格。实验中还发现, 在一定的薄荷醇浓度下, 随浸泡时间的增加抖动脱落率增加不显著, 但麻醉率显著增加。在麻醉剥离过程中, 提高效率与降低对苗种的损伤无疑都是非常重要的, 单一麻醉处理不能使刺参完全自动脱落。因此, 适当地辅助一定程度的手工操作, 如选用抖动附着基的方式, 不仅能够大大提高参苗的剥离效率, 同时还可以避免参苗受过度麻醉的影响, 对参苗的迅速恢复是非常必要的。综合不同规格苗种的抖动脱落效果及恢复情况考虑, 可以得出: 大规格刺参选用浓度为0.4%~0.5%的薄荷醇溶液、中规格刺参选用浓度为0.2%~0.5%薄荷醇溶液麻醉剥离20 min, 小规格刺参选用浓度为0.4%~0.5%薄荷醇溶液麻醉剥离10 min, 或选用浓度0.1%~ 0.3%薄荷醇溶液剥离20 min的剥离效果较佳, 抖动脱落率均可达90%以上甚至100%, 麻醉剥离后刺参经1 h即可完全恢复到自然状态, 营正常活动、附着与摄食。
据研究, 薄荷醇在水温高时作用效果更好[13]。因此, 在刺参苗种生产中应根据不同水温环境, 适当调节麻醉剂的使用剂量和作用时间, 建立清除玻璃海鞘的技术工艺, 为有效清除玻璃海鞘和工厂化刺参苗种安全生产提供可靠的技术方法。同时, 针对玻璃海鞘的不同发育阶段, 探求其适宜的清除方法, 诸如在浮游期, 通过电灭卵装置进行海水处理的方式, 在固着期, 通过查找抑制玻璃海鞘生长的生物来控制玻璃海鞘的生长和繁殖等等, 有待于今后进一步实验研究。
此外, 在刺参育苗生产中, 不同规格的刺参要定期进行分级培育, 不同规格苗种的筛选, 剥离作业必不可少, 传统分苗方式不仅损伤参苗, 而且分苗后通常会施用化学药物来避免刺参的病害发生和应激反应。因此, 为减轻在分苗环节中的劳动强度, 提高分苗效率并降低或避免对参苗的损伤, 采用薄荷醇麻醉剥离使其脱离附着基不失为一种行之有效的方法。
[1] 郑成兴. 大亚湾海鞘类的生态. 大亚湾海洋生态文集(Ⅱ)[M]. 北京: 海洋出版社, 1990, 397-403. Zheng Chengxing. The ecology of ascidian in Daya Bay. Marine Ecological of Daya Bay Corpus(Ⅱ), Beijing: China Ocean Press, 1990, 397-403.
[2] 王印庚, 荣小军, 张春云, 等. 养殖海参主要疾病及防治技术[J]. 海洋科学, 2005, 29(3): 1-7. Wang Yingeng, Rong Xiaojun, Zhang Chunyun, et al. Main diseases of cultured: prevention and treatment[J]. Marine Sciences, 2005, 29(3): 1-7.
[3] 吕豪, 檀永凯. 玻璃海鞘胚胎发育的研究[J]. 大连水产学院学报, 2006, 21(4): 357-360. Lü Hao, Tan Yongkai, The embryonic development of[J]. Journal of Dalian Fisheries University, 2006, 21(4): 357-360.
[4] 吕豪, 李霞, 檀永凯. 刺参培育池中玻璃海鞘生殖腺组织学的初步研究[J]. 水产科学, 2008, 27(2): 89-91. Lü Hao, Li Xia, Tan Yongkai. Histological observation of Gonad in tunicatein sea cucumber culture pond[J]. Fisheries Science, 2008, 27(2): 89-91.
[5] 张继红, 方建光. 几种常见海鞘的呼吸代谢的研究[J]. 中国水产科学, 2000, 7(1): 16-19. Zhang Jihong, Fang Jianguang. Study on the oxygen consumption rates of some common species of ascidian[J]. Journal of Fishery Sciences of China, 2000, 7(1): 16-19.
[6] 周书衍, 王印庚, 李胜忠, 等. 刺参育苗系统中的敌害生物——玻璃海鞘的杀除试验[J]. 渔业科学进展, 2009, 30(2): 14-19. Zhou Shuheng, Wang Yingeng, Li Shengzhong, et al. Lethal effect of ten chemicals to sea squirtin sea cucumber hatchery[J]. Progress in Fishery Sciences, 2009, 30(2): 14-19.
[7] 王印庚, 陈宗阳, 廖梅杰, 等. 一种中草药复方对刺参苗期玻璃海鞘的杀除效果[J]. 水产科技情报, 2013, 40(5): 245-249. Wang Yingeng, Chen Zongyang, Liao Meijie, et al. Lethal effect of chinese herb medical compound to sea squirt ciona intestinalis in sea cucumber hatchery[J]. Fisheries Science & Technology Information, 2013, 40(5): 245-249.
[8] Costa-paiva E.M, Paiva P C and Klautau M. Anaesthetization and fixation effects on the morphology of sabellid polychaetes[J]. Journal of the Marine Biological Association of the United Kingdom, 2007, 87: 1127- 1132.
[9] Anorton J H, Dashorst M , Lansky T M and Mayer R J. An evaluation of some relaxants for use with pearl oysters[J]. Aquaculture, 1996, 144: 39-52.
[10] 杨海萍, 王储庆, 吴建平, 等. 几种麻醉剂对中华仙影海葵的麻醉效果的比较[J]. 水产养殖, 2015, 36(4): 8-13. Yang Haiping, Wang Chuqing, Wu Jianping, et al. Comparison of anaesthetic effect of 3 anaesthetic reagents in sea anemone Cereus sinensis Verrill[J]. Journal of aquaculture, 2015, 36(4): 8-13.
[11] 韩莎, 胡炜, 李成林, 等. 薄荷醇对仿刺参幼参的麻醉效果[J]. 海洋科学, 2016, 40(3): 10-16. Han Sha, Hu Wei, Li Chenglin, et al. Anesthetic effect of menthol on juvenile sea cucumber, Apostichopus japonicas[J]. Marine Sciences, 2016, 40(3): 10-16.
[12] Yusuke Yamana, Tatsuo Hamano, Ken-ichi Yamamoto. Anesthetizer of the adult sea cucumber[J]. Nippon Suisan Gakkaishi, 2005, 71(3): 299-306.
[13] Satoshi W, Jacques M Z, Joemel G S, et al. Size measurement and nutritional condition evaluation methods in sandfish(Holothuria scabra Jaeger)[J]. Aquaculture Research, 2012, 43: 940-948.
[14] 李太武, 苏秀榕, 迟庆宏, 等. 柄海鞘生殖系统的组织学研究[J]. 辽宁师范大学学报: 自然科学版, 2000, 23(3): 35-40. Li Taiwu, Su Xiurong, Chi Qinghong, et al. Histology of reproductive system of(Urochordata Ascidiacea)[J]. Journal of Liaoning Normal University (Natural Science Edition), 2000, 23(3): 35-40.
[15] 王吉桥, 王玉琴, 张玉满, 等. 几种物质使刺参脱离附着基效果的比较[J]. 水产科学, 2012, 31 (2): 83-88. Wang Jiqiao, Wang Yuqin, Zhang Yuman, et al. Effect of several chemicals and Chinese herb medicines on attachment of sea cucumber()[J]. Fisheries Science, 2012, 31 (2): 83-88.
[16] Ito S. Study on the technical development of the mass production for sea cucumber juveniles,[C]. Saga Prefectural Sea Farming Center, March 1995, Technical Report.
Detaching effect of menthol on the attachment of sea cucumber (Apostichopus japonicus) apart from sea squirt (Ciona intestinalis)
ZHANG Yan-ping1, HAN Sha2, LI Cheng-lin2, ZHAO Bin2, HU Wei2
(1. Qingdao Agricultural University, Qingdao 266109, China; 2. Marine Biology Institute of Shandong Province, Qingdao 266104, China)Received:Nov. 11, 2015
seeding;; menthol; detach; anesthetization
This study aims to develop an efficient method for removing sea squirtfrom the sea cucumber nursery system. The detaching effects of menthol (0.1%~0.5% in volume) on the attachment of sea squirtand different-sized sea cucumber () were tested. The results showed that menthol was ineffective in killing or detachingfrom the attachment. The detaching effect of menthol on different-sized sea cucumbers significantly differed. Over 90% of detachment shaking from settlement substrate was found in the large-sized (0.58 g ± 0.05 g) juveniles exposed to 0.4%~0.5% of menthol for 20 min, medium-sized (0.32 g ± 0.05 g) juveniles exposed to 0.2%~0.5% of menthol for 20 min, and small-sized (0.17 g ± 0.01g) exposed to 0.4%~0.5% of menthol for 10 min or exposed to 0.1%~0.3% of menthol for 20 min. These juveniles, after being detached from the attachment, recovered to reattach after 1 h without ulceration and evisceration. Therefore, this method is highly effective and requires minimum effort, which is desired when removing sea squirt or seed grading from a sea cucumber nursery system.
S917.4
A
1000-3096(2016)07-0083-08
10.11759/hykx20160412001
2015-11-11;
2016-05-22
山东省现代农业产业技术体系刺参产业创新团队建设项目(SDAIT-22-01、SDAIT-22-05); 山东省农业良种工程项目(2014-2016); 山东省自然科学基金项目(ZR2014CQ056); 国家海洋局海洋公益性行业科研专项经费项目(201305001-4); 山东省农业科技成果转化资金项目(2014-2016)
[Foundation: Sea cucumber Innovation Team of Shandong Province Agriculture Research System, No.SDAIT-22-01, SDAIT-22-05; Agriculture Seed Project of Shandong Province; Natural Science Foundation of Shandong Province, No. ZR2014CQ056; Oceanic Research Special Funds for Public Welfare Projects of State Oceanic Administration, No. 201305001-4; Agricultural Science and Technology Achievement Transformation Program of Shandong Province, No. 2014-2016]
张艳萍(1980-), 女, 山东临沂人, 实验师, 主要从事细胞与分子生物学和生理学研究, E-mail: yanpingzh@163.com
(本文编辑: 梁德海)
