1985~1986年长江口生态系统能流网络分析
2016-10-20张效嘉线薇微
张效嘉, 线薇微
1985~1986年长江口生态系统能流网络分析
张效嘉1, 2, 线薇微1, 3
(1. 中国科学院海洋研究所, 山东青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室海洋生态与环境科学功能实验室, 山东青岛 266071)
为构建1985~1986年长江口生态系统的Ecopath模型, 作者根据1985~1986年全年12个航次长江口及邻近海域综合调查数据, 分析此历史时期长江口及邻近海域生态系统的能流结构, 并对生态系统总体特征进行了综合评估。1985~1986年长江口水域生态系统包括16个功能群, 各功能群的营养级在1~4.52, 中上层游泳生物食性鱼类占据最高营养级。各功能群间关系主要由3种途径导致: 控制类型、生态位重叠和营养级联。营养级聚合分析表明, 1985~1986年长江口生态系统能流中牧食食物链占据主导地位, 直接来自初级生产者的占比57%。此历史时期长江口生态系统各营养级平均转化效率为12.4%, 其中来自碎屑的能流转换效率为12.9%, 来自初级生产者的转换效率为12%。生态系统总体特征分析显示, 该历史时期连接指数和系统杂食指数分别为0.471和0.103, 长江口及邻近海域循环指数和平均路径长度分别为9.35%和2.778, 总初级生产量/总呼吸量为1.724。
长江口; 能量流动; 网络分析; 生态通道模型
河口位于淡水和海水交汇处, 河口生态系统重要特征之一在于其复杂性。径流和海流在此相互消长, 复杂的水动力条件背景带来生物生态习性的多样化。同时, 河口又是受人类活动影响广泛且深远的地区之一, 生态系统既脆弱又敏感。河口生态系统的结构和功能一直受到广泛关注。长江口是中国第一大河口, 长江径流输入大量的营养物质, 使其成为近海生产力较强水域之一, 孕育了中国最大的河口渔场。作为产卵场、育幼场、索饵场以及洄游的必经通道, 众多生物种类在此渡过全部或部分生命周期。长江口水域与中国两大著名的渔场——舟山渔场和吕泗渔场紧密相连, 长江口生态系统结构成分变化, 将直接影响中国东、黄海渔业资源可持续发展和生态系统健康程度[1]。若要完整研究长江口生态系统能流网络模式这一较大科学问题, 必先研究其历史情况以作为背景, 而目前关于生态系统层次上的长江口历史研究甚少。作者旨在通过构建1985~1986年长江口及邻近海域生态系统能流结构并分析其总体特征, 为后续年限研究提供历史资料和对比基础。
目前评估渔业群落结构和功能的方法主要有3种: 单鱼种数量评估模式、多鱼种模拟评估模式和Ecopath模式[2]。与其他两种模式相比, Ecopath模式可以分析在系统背景下种群数量和生物量的动态变化, 并可简化参数估计运算, 更具有使用价值[3-4]。目前, Ecopath模型在水生生态系统中得到广泛应用, 国内外学者利用Ecopath模型描述了渤海[5]、南黄海[6]、东海[7]和南海北部[8]等不同中国近海海域生态系统的能流过程, 河口水域的研究相对较少。作者利用Ecopath模型研究1985~1986年长江口及邻近海域生态系统的能流网络模式, 并对此历史时期生态系统结构与功能进行综合评估, 为后续研究长江口生态系统功能演变提供重要背景支持。
1 材料与方法
1.1 研究区域及数据来源
本研究数据来源于1985年9月~1986年8月长江口及邻近海域逐月调查数据。调查站位在口门内的沿长江南支布设, 在口门外的按棋盘式布设(图1)。调查内容包括浮游植物、浮游动物、渔业资源、底栖动物以及环境要素(温度、盐度、DO、COD、营养盐、溶解有机碳和颗粒有机碳等)。渔业资源(主要包括鱼类、虾类、蟹类和头足类)调查是用150马力底层双拖网渔船进行(网目250 mm, 囊网网目40 mm), 各站位拖网1 h。浮游动物样品则是通过中型浮游动物网(口径50 cm, XX9筛绢制)和大型浮游动物网(口径80 cm, GG36筛绢制)垂直拖网获取。底栖生物样品则是通过各站位用采泥器(取样面积0.1 m2)取两次做一个样品, 经0.5 mm筛网冲洗获取。
1.2 研究方法
1.2.1 Ecopath模型基本原理
Ecopath模型是以功能群为基本单位, 并遵循热力学定律研究生态系统能量流动与网络分析。功能群应基本涵盖生态系统能流全过程[9-10]。该模型假定在给定一段时间内(通常为1 a)系统能量守恒。它包含两个核心方程, 一个方程描述各功能群生产量的流向(1), 另外一个方程用来描述各功能群的能量守恒(2)。
各功能群生产量可以分为5个流向:
P=Y+M2B+E+BA+M0B(1)
式中,P表示生产量,Y为渔获量,M2为捕食死亡率,B为生物量,E为净迁出量,BA为生物量累积,M0为其他死亡率, 即功能群未被生态系统所利用的那部分能量所占的比重。
功能群内能量平衡公式:
Q=P+R+U(2)
式中,Q表示第功能群对其他功能群的消费量,P表示生产量,R表示呼吸量,U表示未同化量。
方程(1)可另表达为:
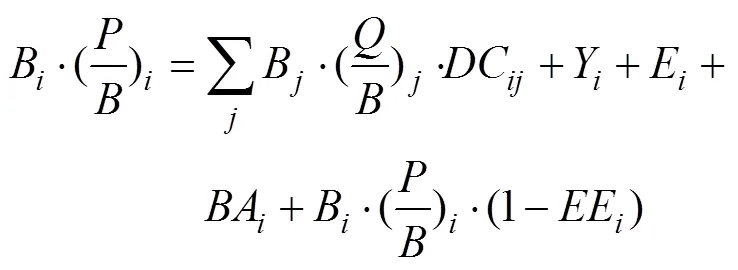
式中,DC表示第功能群在第功能群的消费量中所占的比重,EE表示生态营养效率。其中在建立Ecopath模型中, 各功能组生物量、生产量与生物量比值、消费量与生物量比值和生态营养效率这4个参数需要输入其中3个, 另外一个参数(通常为)由模型估计得出, 同时食物组成矩阵、渔获量与未同化率也必须输入, 另外一般假定净迁出量和生物量累积为零。
1.2.2 功能群划分
根据物种生态学与生物学特征(如: 摄食、栖息地、死亡率等)的相似性以及在渔业方面的重要程度, 将1985~1986年长江口及邻近海域生物划分为碎屑、浮游植物、浮游动物、中上层浮游生物碎屑食性鱼类、中上层游泳生物食性鱼类、中上层混合食性鱼类、中下层浮游生物碎屑食性鱼类、中下层游泳生物食性鱼类、中下层混合食性鱼类、底层无脊椎动物食性鱼类、底层游泳生物食性鱼类、底层混合食性鱼类、虾类、蟹类、头足类和隐埋性底栖动物共16个功能群。
1.2.3 功能群生物学参数计算
Ecopath模式中, 生态系统的能量流动以能量形式(碳质量gC/m2或生物湿质量t/km2)来表示, 时间一般为1 a。生物量主要通过调查数据来估计。其中, 鱼类、虾类、蟹类和头足类的生物量通过扫海面积法估计, 隐埋性底栖动物与浮游动物的生物量分别靠底泥样品和浮游动物垂直拖网样品估计, 有机碎屑生物量用有机碎屑与初级生产力的经验公式估算[11]。在生态系统能量平衡情况下, 鱼类生产量/生物量等于总死亡系数Z[12], 可通过Beverton-Holt[13]方法进行估计。渔获量通过中国渔业统计年鉴中的资料估计得出, 由于渔获舍弃量数据无法获得, 所以Ecopath模型中不包括该项。对于难以估计的参数(如和等), 则通过相关文献或历史资料[6, 14-25], 并结合渔业数据库网站来确定[26]。生态营养效率作为未知参数, 通过Ecopath模型估计得出。
1.2.4 Ecopath模型调试
原始参数输入并运行Ecopath模型后, 会出现许多功能群>1的情况。为使生态系统的输入和输出达到平衡, 利用其中的自动平衡函数修改输入参数(通常是生物量与食物组成矩阵)迭代运行[27], 直至所有功能群的0<<1为止。利用指数评价数据和模型的整体质量[28], 利用敏感性分析来量化模型输入参数的不确定度。
1.2.5 网络分析与生态系统指标
Lindeman[29]提出营养级概念, 它反映了功能群在食物网中的营养地位。Pianka[30]于1974年发展了生态位重叠理论, 捕食者捕食猎物生态位重叠程度通过猎物重叠分析估计。其中猎物重叠指数范围为0~1, 指数越高表明重叠程度越高, 其中0表示完全不重叠, 1表示完全重叠。
Leontief[31]率先提出Leontief矩阵, 将流动分析应用于经济学研究中。Ulanowicz等[32]将其修改并被整合到了EwE模型中, 形成混合营养分析(Mixed trophic impact, MTI)。MTI研究假定某个功能群生物量瞬时增加, 会对其他功能群生物量产生的影响, 反映了生态系统中功能群间直接或间接的联系。其基本原理如下:
MTI=DC–FC
式中,MTI表示第功能群对第功能群的混合营养影响,DC表示第功能群在第功能群的食物中所占的比重,FC代表第功能群对第功能群的捕食量在第功能群的总被捕食量中所占的比重。
Lindeman模式将复杂的食物网简化成线性的食物链。通过营养级分解[33], 将各功能群的能流重组, 形成生态系统各营养级的能流分布。其中, 转移效率为一个营养级的生产量转移到下一营养级所占的比重。
Ecopath模型还可以计算许多生态指标以估计生态系统的特征。其中系统总流量反映了生态系统的规模, 系统连接指数和系统杂合指数反映了生态系统的复杂程度, Finn循环指数和Finn平均路径长度反映了生态系统的成熟度[34]。
2 结果与分析
2.1 长江口功能群划分
依据1985~1986年调查数据, 根据物种生态学与生物学特征(如: 摄食、栖息地、死亡率等)的相似性, 将长江口近海生态系统功能群分为16个功能群(表1)。这些功能群基本涵盖了长江口及邻近海域生态系统能量流动的全部过程。

表1 长江口及邻近海域生态系统功能群及主要种类

2.2 Ecopath模型运行结果与模型数据质量
1985~1986年长江口及邻近海域生态系统Ecopath模型的输入数据与输出参数估计值见表2。各功能群的生态营养效率(Ecotrophic Efficiency, EE)均位于0~1, 表明通过参数调整, 已使生态系统的输入和输出达到平衡。
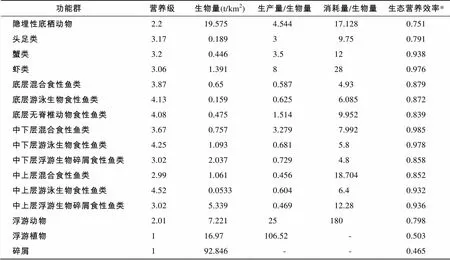
表2 长江口及邻近海域生态系统Ecopath模型功能群参数
注: *表示模型估计的参数
该Ecopath模型指数为0.685, 与南黄海Ecopath模型的指数0.64相比[6], 这个数值较高, 模型数据质量可以接受。敏感性分析表明, 某一功能群的输入参数的改变将对同功能群的输出参数的影响最大, 而对其他功能群的输出参数影响较小。
由表2可见, 1985~1986年长江口近海生态系统各功能群的营养级在1~4.52。其中, 浮游植物与碎屑营养级为1, 浮游动物与隐埋性底栖动物营养级分别为2.01和2.2, 虾类、蟹类、头足类等无脊椎动物的营养级位于3.06~3.2。鱼类营养级分布较广, 除中上层游泳生物食性鱼类功能群占据最高营养级4.52之外, 其他功能群营养级位于2.99~4.25, 与鱼类的栖息空间及食性有着密切的联系。
2.3 长江口及邻近海域生态系统的能流通道
图2反映了1985~1986年长江口近海生态系统的能量流动情况。图中y轴表示各功能群所对应的营养级, 而功能群间的能量流动关系则主要体现在由消费量、呼吸量、未被同化食物量以及捕捞量所构成的网络体系中。
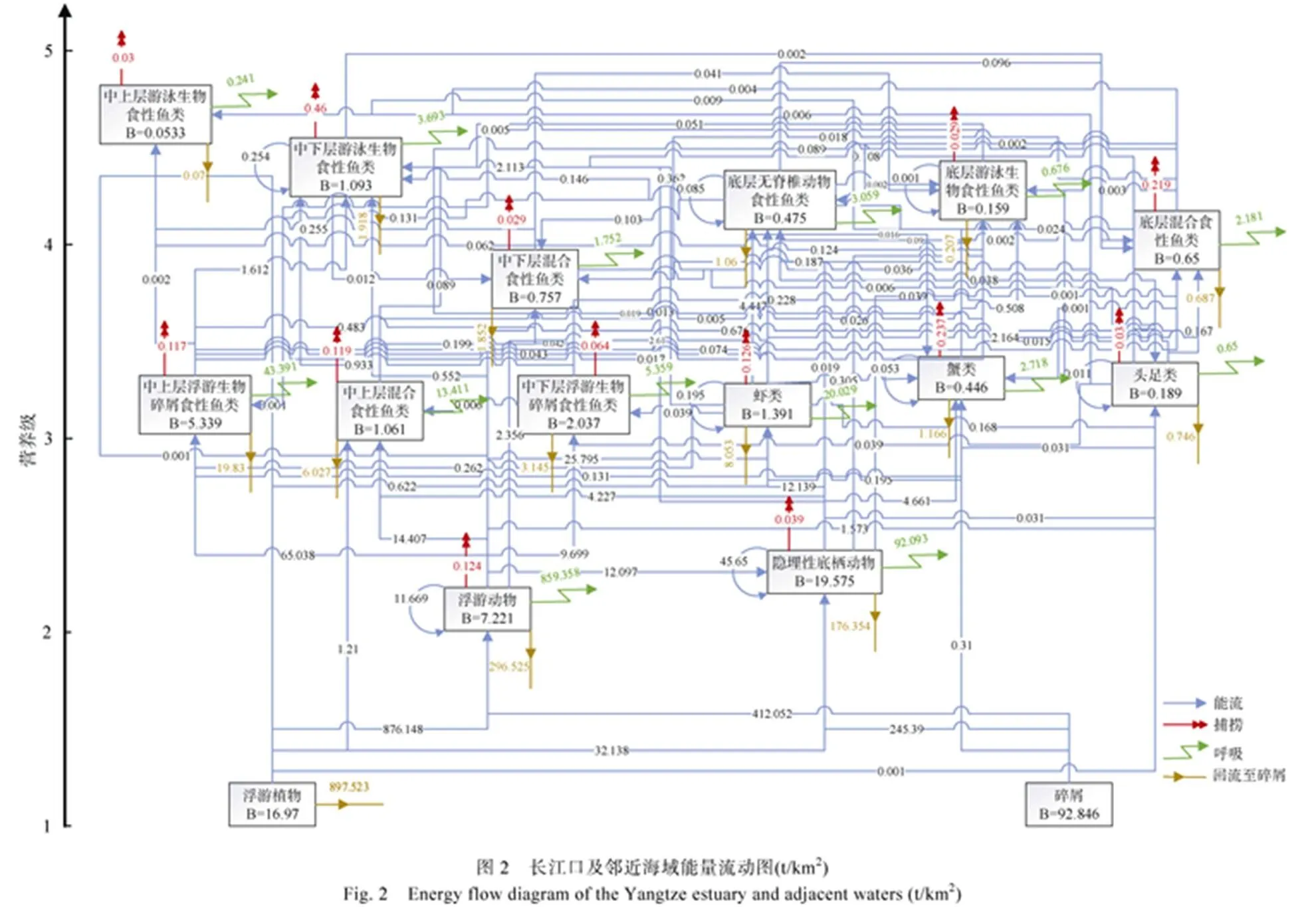
从图2中可见来自第一营养级的能量主要流向浮游动物。浮游动物在长江口近海生态系统中的作用十分重要。来自浮游动物的能量主要流向中上层、中下层浮游生物碎屑食性或混合食性鱼类, 虾类, 头足类以及隐埋性底栖动物。浮游动物在虾类的食物来源中占比66.23%, 在中上层混合食性鱼类的食物来源中占比72.58%, 在头足类的食物来源中占比85.21%。对于中上层和中下层浮游生物碎屑食性鱼类而言浮游生物尤为重要, 其在食物来源中分别占比99.19%、99.20%。1985~1986年间中上层、中下层浮游生物碎屑食性鱼类以及中上层混合食性鱼类主要是鯡科、鳀科和鲳科的一些种类, 这3个功能群生物量占鱼类总生物量的72.58%, 由此可见浮游动物作为食饵对于鱼类资源尤为重要。
2.4 生态位重叠分析
通过猎物生态位重叠分析, 可发现功能群间在捕食方面的竞争关系。猎物重叠指数范围为0~1, 指数越高表明重叠程度越高, 其中0表示完全不重叠, 1表示完全重叠。通过表3可见头足类与中下层浮游生物碎屑食性鱼类、头足类与中上层混合食性鱼类、头足类与中上层浮游生物碎屑食性鱼类、虾类与中上层混合食性鱼类的猎物重叠指数接近于1, 直接表明它们作为捕食者在生态系统中的地位是相似的, 间接说明这些功能群捕食活动空间与捕食种类等生态位重叠程度大, 在捕食方面竞争较强。而中下层浮游生物碎屑食性鱼类与中上层浮游生物碎屑食性鱼类的猎物重叠指数为1, 且这两个功能群与其他功能群的猎物重叠指数几乎相同, 表明它们作为捕食者在生态系统中的地位完全一样, 在捕食上的竞争尤为强烈。
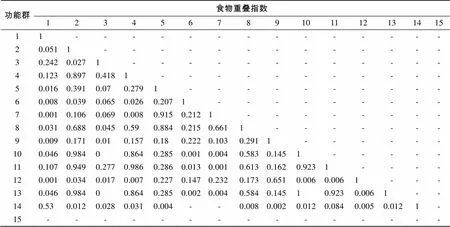
表3 长江口及邻近海域功能群间食物重叠估计
注: 1. 隐埋性底栖动物; 2. 头足类; 3. 蟹类; 4. 虾类; 5. 底层混合食性鱼类; 6. 底层游泳生物食性鱼类; 7. 底层无脊椎动物食性鱼类; 8. 中下层混合食性鱼类; 9. 中下层游泳生物食性鱼类; 10. 中下层浮游生物碎屑食性鱼类; 11. 中下层混合食性鱼类; 12. 中上层游泳生物食性鱼类; 13. 中上层浮游生物碎屑食性鱼类; 14. 浮游动物; 15. 浮游植物
2.5 长江口及邻近海域生态系统功能群间的关系
混合营养分析研究某一功能群生物量增加对其他功能群生物量产生的影响, 反映了功能群间直接或间接的联系[31-32]。分析结果以图形矩阵的形式呈现, 位于基线上的空心矩形表示积极影响, 位于基线下的黑色矩形表示消极影响; 矩形的高度反映了影响程度。1985~1986年长江口及邻近海域生态系统的混合营养分析结果见图3。作为第一营养级的碎屑和浮游植物, 对大部分功能群有积极影响。次级消费者中浮游动物对中上层及中下层活动的捕食者有积极影响, 对栖息或活动于底层的大部分捕食者起消极影响; 隐埋性底栖动物对大部分中上层及中下层的捕食者有消极影响, 对混合食性鱼类及栖息或活动与底层的大部分捕食者起积极影响。渔业对于大部分功能群有消极影响。
2.6 长江口及邻近海域生态系统的能流分布
Lindeman模式将复杂的食物网简化成线性的食物链。通过营养级分解[33], 将各功能群的能流重组, 形成生态系统各营养级的能流分布。1985~1986年该系统能流分布主要集中在营养级Ⅰ~Ⅲ中, 当营养级为Ⅳ甚至更高时能流可以忽略不计。其中来自营养级Ⅰ的能流在系统总能流中所占比重最高, 为64.94%。紧随其后的是营养级Ⅱ, 其能流占比31.59%。营养级I包括初级生产者和碎屑, 其能流在系统总能流中分别占比36.42%和28.52%。浮游动物和隐埋性底栖动物在营养级Ⅱ的能流中占据主导地位(99.87%)。营养级Ⅲ主要包括中上层浮游生物碎屑食性鱼类、中上层混合食性鱼类、中下层浮游生物碎屑食性鱼类、虾类、蟹类和头足类, 能流占该营养级的88.44%。营养级Ⅲ的能流占系统总能流的3.077%。营养级Ⅳ主要包括中上层游泳生物食性鱼类、中下层游泳生物食性鱼类、中下层混合食性鱼类、底层无脊椎动物食性鱼类、底层游泳生物食性鱼类和底层混合食性鱼类这6个功能群。
P. 初级生产者; D. 碎屑; TL. 营养级 P. primary producer; D. detritus; TL. trophic level
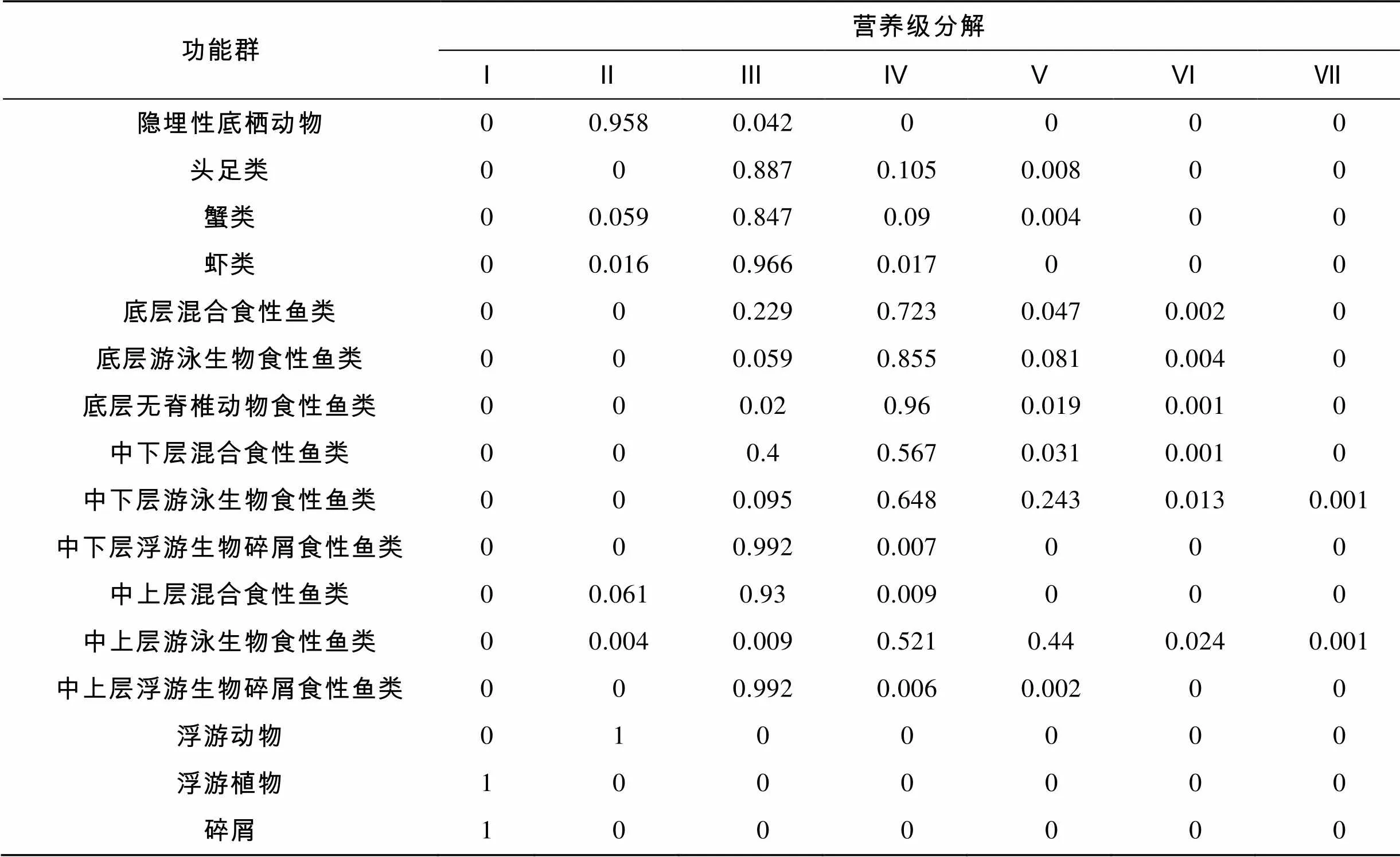
表4 长江口及邻近海域生态系统功能群营养级分解
从表5中可见, 1985~1986年该系统碎屑食物链营养级Ⅱ的转换效率为10.2%; 牧食食物链营养级Ⅱ的转换效率略低, 为9.2%; 营养级Ⅱ的平均转换效率为9.7%。营养级Ⅳ的总体转换效率最高, 达到16.8%; 在营养级Ⅴ及以上时的总体转换效率逐步下降。从营养级Ⅱ到营养级Ⅳ, 来自初级生产者和碎屑的平均转换效率分别为12.0%和12.9%, 而总的平均转换效率为12.4%。
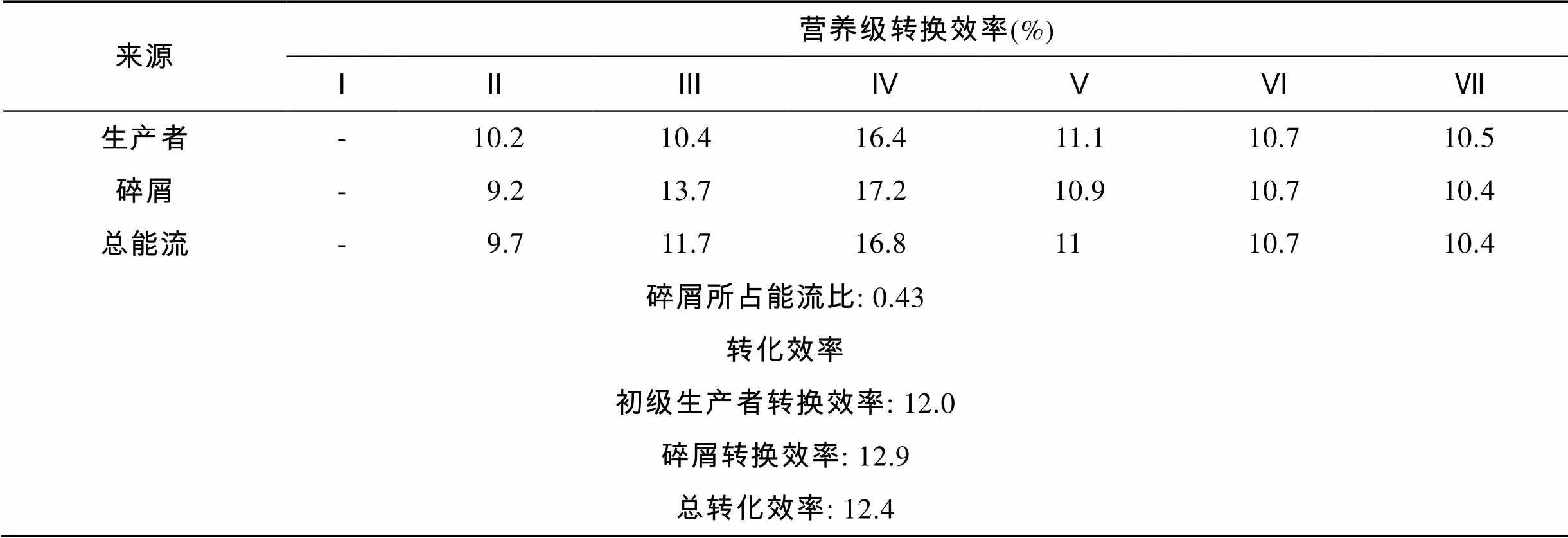
表5 长江口及邻近海域各营养级的转换效率
长江口生态系统能量流动来源中, 直接来自碎屑的占总能流的43%, 直接来自初级生产者的所占能流比为57%, 后者要高于前者。说明1985~1986年度长江口及邻近海域生态系统是以牧食食物链略占主导。
2.7 长江口生态系统的总体特征
1985~1986年长江口及邻近海域生态系统的整体特征见表6。系统总生物量为57.416 31 t/km2(不含碎屑)。系统总流量是总消耗量、总输出量、总呼吸量和流向碎屑总量的总和, 长江口生态系统总流量为5 020.886 t/(km2·a)。其中总消耗量为1 798.019 t/(km2·a), 所占比重最大, 占35.8%; 流向碎屑总量1 415.223 t/(km2·a)次之, 占28.2%; 总呼吸量1 048.565 t/(km2·a)占20.9%,总输出量759.0792 t/(km2·a)占15.1%。
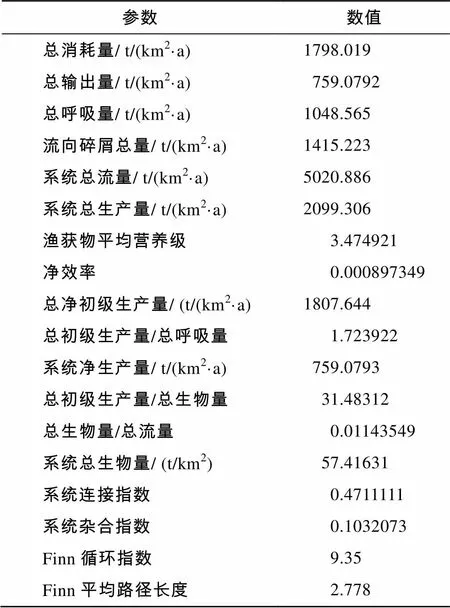
表6 长江口及邻近海域生态系统总体特征
3 讨论
1985~1986年长江口及邻近海域生态系统混合营养分析表明各功能群对自身均有消极影响, 这是由于功能群内部存在竞争。功能群间关系主要由以下3种途径导致: 控制类型、生态位重叠和营养级联[35]。当浮游动物生物量瞬时增加时, 以浮游动物为主要食物的功能群(头足类、虾类、中下层浮游生物碎屑食性鱼类、中上层混合食性鱼类和中上层浮游生物碎屑食性鱼类)的生物量相应增加, 这可能与上行效应[36]有关。中上层浮游生物碎屑食性鱼类会对中上层混合食性鱼类产生单向消极影响, 这是由于两功能群中主要种类为鳀科或鯡科的物种, 一般均栖息于中上层, 且猎物重叠指数为0.923, 栖息空间与食物这两种生态位重叠程度高, 而影响具有单向性则表明前者在竞争中相对后者占有优势。中上层浮游生物碎屑食性鱼类与中下层浮游生物碎屑食性鱼类这两功能群相互产生消极影响, 这是由于后者主要种类为银鲳, 虽然银鲳被划分为中下层, 但早晨及黄昏在水的中上层[37], 且两功能群的猎物重叠指数为1, 作为捕食者在生态系统中的地位完全相同, 生态位重叠程度高, 而影响具有双向性则表明两功能群对于生态位的竞争能力相当。中上层浮游生物碎屑食性鱼类与浮游植物产生双向积极影响。前者对后者的积极影响是由于浮游动物在中上层浮游生物碎屑食性鱼类的食物中所占比重高(99.19%), 捕食作用会使浮游动物生物量降低, 通过营养级联效应, 会使浮游植物生物量增多; 后者对前者的积极影响是由于浮游植物是牧食食物链的起点, 通过上行效应, 会对中上层浮游生物碎屑食性鱼类产生积极影响。
此历史时期渔业捕捞对许多功能群的影响是消极的, 尤其直接对中上层游泳生物食性鱼类(= 4.52)、中下层游泳生物食性鱼类(=4.25)和底层混合食性鱼类(=3.87)这些顶层营养级的功能群产生剧烈负面影响。同时可以看到渔业对中下层混合食性鱼类产生积极影响, 这是因为其为中上层游泳生物食性鱼类的主要食物功能群, 由于捕食者大量减少, 下行效应[36]导致其功能群生物量瞬时增加。
系统连接指数(Connectance Index, CI)是指对于一个指定的食物网其实际链数与可能链数之比。系统杂合指数(System Omnivory Index, SOI)是指各消费者杂合指数的以食物摄入量对数为权重的加权平均数。这两个指标反映了生态系统的复杂程度。与的数值越接近与1, 表明生态系统越为复杂[38]。而1985~1986年长江口及邻近海域的和值分别为0.471和0.103, 远小于1。循环指数(Finn’s Cycling Index, FCI)是指生态系统中循环能流在总能流中所占的比重, 平均路径长度(Mean Path Length, MPL)是指流经食物链的每个循环的平均长度。一个成熟的生态系统总能流中循环能流所占比重要高, 每个循环流经食物链平均长度要长[34]。长江口及邻近海域生态系统的值为9.35%, 远低于大西洋塞纳河口 (16.1%)[39]和地中海西北部的南迦太兰海(25.19%)[40]等近海生态系统;值为2.778, 远低于地中海西北部的南迦太兰海(4.27)[40]和墨西哥湾西南部的特尔米诺斯泻湖 (10)[41]等近海生态系统。
总初级生产量/总呼吸量()比是反映生态系统稳定程度的指标。当()<1时, 总呼吸量大于总初级生产量, 表明生态系统中有机物质在减少; 当()>1时, 总呼吸量小于总初级生产量, 表明生态系统中有机物质在增加。的值越接近于1, 表明生态系统越稳定[42]。1985~1986年长江口及邻近海域生态系统值为1.724, 比大西洋塞纳河口(1.37)[39]和地中海西北部的南迦太兰海 (1.18)[40]等近海生态系统略高。渔获物平均营养级的数值大小反映了渔业开发利用程度。随着渔业生产强度不断增强, 渔业资源势必会受到过度利用, 一些占据食物网顶层营养级的经济鱼类资源一旦受到破坏很难恢复, 从而使得渔获物平均营养级下降。1985~1986年长江口及邻近海域生态系统的渔获物平均营养级为3.475, 这为研究以后不同时期渔业活动对该生态系统的影响提供了一个背景基础。
虽然作者采用较为先进的方法在生态系统层次上进行了研究, 但是仍存在一些不足之处。首先, Ecopath模型是以一年为时间单位研究一年内该生态系统的能量流动情况, 参数多为一年内的均值, 并没有考虑到季节变化等诸多因素。若要讨论生态系统能量流动的季节变化, 甚至对生态系统能量流动进行长时间、多层次尺度分析, 则需要采用Ecosim模型进行研究。鉴于本研究是为研究后续年限长江口及邻近海域生态系统的能流状况提供背景基础, 因而Ecopath模型还是可取的。其次, 目前对于描述生态系统健康度的指标的研究尚不完善。一些有关生态系统总体特征的指标例如循环指数、平均路径长度、系统连通指数、系统杂合指数等只是量化了有关生态系统能流特征, 但是缺少统计学意义, 在描述生态系统健康度时可信度下降, 难以较科学的反映生态系统特征的真实面貌, 在此方面的研究有待进一步的完善。
[1] 刘瑞玉, 罗秉征. 三峡工程对长江口及邻近海域生态与环境的影响[J]. 海洋科学集刊, 1992, 33: 1-13.Liu Ruiyu, Luo Bingzheng. Impacts of the three gorges project on the ecology and environment of the Changjiang River Estuary and adjacent waters[J]. Studia Marina Sinica, 1992, 33: 1-13.
[2] 仝龄. Ecopath—一种生态系统能量平衡评估模式[J]. 海洋水产研究, 1999, 20(2): 102-107. Tong Ling. Ecopath model- a mass-balance modeling for ecosystem estimation[J]. Marine Fisheries Research, 1999, 20(2): 102-107.
[3] Sparre P. Introduction to multispecies virtual population analysis[J]. ICES Marine Science Symposium, 1991, 193: 12-21.
[4] Walters C, Pauly D, Christensen V, et al. Representing density dependent consequences of life history strategies in aquatic ecosystems: EcoSim II[J]. Ecosystems, 2000, 3(1): 70-83.
[5] 仝龄, 唐启升. 渤海生态通道模型初探[J]. 应用生态学报, 2000, 11(3): 435-440. Tong Ling, Tang Qisheng. A preliminary approach on mass-balance ecopath model of the Bohai Sea[J]. Chinese Journal of Applied Ecology, 2000, 11(3): 435-440.
[6] Lin Q, Jin X, Zhang B. Trophic interactions, ecosystem structure and function in the southern Yellow Sea[J]. Chinese Journal of Oceanology and Limnology, 2013, 31(1): 46-58.
[7] Jiahua C, Cheung W W, Pitcher T J. Mass-balance ecosystem model of the East China Sea[J]. Progress in Natural Science, 2009, 10: 1271-1280.
[8] 陈作志, 邱永松. 南海北部生态系统食物网结构, 能量流动及系统特征[J]. 生态学报, 2010, 30(18): 4855- 4865. Chen Zuozhi, Qiu Yongsong. Assessment of the food-web structure, energy flows, and system attribute of northern South China Sea ecosystem[J]. Acta Ecologica Sinica, 2010, 30(18): 4855-4865.
[9] Polovina J J, Ow M D, Center S F. ECOPATH: a user’s manual and program listings[M]. Honolulu: National Marine Fisheries Service, NOAA, 1983: 46.
[10] Christensen V, Pauly D. ECOPATH II—a software for balancing steady-state ecosystem models and calculating network characteristics[J]. Ecological Modelling, 1992, 61(3): 169-185.
[11] Christensen V, Pauly D. Trophic models of aquatic ecosystems[M]. Metro Manila: International Center for Living Aquatic Resources Management, 1993.
[12] Allen K R. Relation between production and biomass[J]. Journal of the Fisheries Board of Canada, 1971, 28(10): 1573-1581.
[13] Beverton R, Holt S. A review of methods for estimating mortality rates in exploited fish populations, with special reference to sources of bias in catch sampling[J]. Rapp R-Réun CIEM, 1956, 154.
[14] 张宝琳, 相建海, 吴耀泉. 长江口海区三疣梭子蟹和细点圆趾蟹食性生态学的研究[J]. 海洋科学, 1991, 15(5): 64-67. Zhang Baolin, Xiang Jianhai, Wu Yaoquan. The feeding ecology of the two crabs (and) in the estuary and the adjacent sea waters of Changjiang River[J]. Marine Sciences, 1991, 15(5): 64-67.
[15] 唐逸民, 吴常文. 浙江近海海鳗食性的分析研究[J]. 浙江水产学院学报, 1992, 11(2): 98-101. Tang Yimin, Wu Changwen. Feeding habit of conger pikein Zhejiang coastal waters[J]. Journal of Zhejiang College of Fisheries, 1992, 11(2): 98-101.
[16] 王军, 丘书院, 贺玉玲, 等. 福建南部沿岸水域尖头斜齿鲨的食性[J]. 台湾海峡, 1996, 15(4): 400-406. Wang Jun, Qiu Shuyuan, He Yuling, et al. Feeding Habits of spadenose shark,from southern coast of Fujian[J]. Journal of Oceanography in Taiwan Strait, 1996, 15(4): 400-406.
[17] 杨纪明, 谭雪静. 渤海3种头足类食性分析[J]. 海洋科学, 2000, 24(4): 53-55. Yang Jiming, Tan Xuejing. Food analysis of three Cephalopod species in the Bohai Sea[J]. Marine Sciences, 2000, 24(4): 53-55.
[18] 杨纪明. 渤海鱼类的食性和营养级研究[J]. 现代渔业信息, 2001, 16(10): 10-19. Yang Jiming. A Study on Food and Trophic Levels of Bohai Sea Fish[J]. Modern Fisheries Information, 2001, 16(10): 10-19.
[19] 黄美珍. 台湾海峡及邻近海域4种头足类的食性和营养级研究[J]. 台湾海峡, 2004, 23(3): 331-340. Huang Meizhen. Study on feeding habits and nutrient level of four cephalopod species from Taiwan Strait and its adjacent areas[J]. Journal of Oceanography in Taiwan Strait, 2004, 23(3): 331-340.
[20] 张波. 东、黄海带鱼的摄食习性及随发育的变化[J]. 海洋水产研究, 2004, 25(2): 6-12. Zhang Bo. Feeding habits and ontogenetic diet shift of hairtail fish () in East China Sea and Yellow Sea[J]. Marine Fisheries Research, 2004, 25(2): 6-12.
[21] 黄美珍. 台湾海峡及邻近海域6种对虾食性特征及其营养级研究[J]. 台湾海峡, 2005, 23(4): 481-488. Huang Meizhen. Study on feeding habits and nutrient level of shrimp species from Taiwan Strait and its adjacent seawaters[J]. Journal of Oceanography in Taiwan Strait, 2005, 23(4): 481-488.
[22] 庄平, 王幼槐, 李圣法, 等. 长江口鱼类[M]. 上海: 上海科学技术出版社, 2006: 155-159.Zhuang Ping, Wang Youhuai, Li Shengfa, et al. Fishes of the Yangtze Estuary[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2006: 155-159.
[23] 林龙山. 长江口近海小黄鱼食性及营养级分析[J]. 海洋渔业, 2007, 29(1): 44-48. Lin Longshan. Study on feeding habit and trophic level of redlip croaker in Changjiang estuary[J]. Marine Fisheries, 2007, 29(1): 44-48.
[24] 卢占晖, 朱增军, 林显鹏. 东海区短尾大眼鲷的食性分析[J]. 海洋渔业, 2010, 32(2): 199-203. Lu Zhanhui, Zhu Zengjun, Lin Xianpeng. Food habits ofin East China Sea region[J]. Marine Fisheries, 2010, 32(2): 199-203.
[25] 彭士明, 施兆鸿, 尹飞, 等. 利用碳氮稳定同位素技术分析东海银鲳食性[J]. 生态学杂志, 2011, 30(7): 1565-1569. Peng Shiming, Shi Zhaohong, Yin Fei, et al. Feeding habits of silver pomfret () in East China Sea based on stable isotope techniques[J]. Chinese Journal of Ecology, 2011, 30(7): 1565-1569.
[26] Fröese R, Pauly D. Fishbase 2006: World Wide Web electronic publication 2006[EB/OL]. [2014-7-4].http: // www.fishbase.org/.
[27] Kavanagh P, Newlands N, Christensen V, et al. Automated parameter optimization for Ecopath ecosystem models[J]. Ecological Modelling, 2004, 172(2-4): 141- 149.
[28] Funtowicz S O, Ravetz J R. Uncertainty and quality in science for policy[M]. Dortrecht: Kluwer Academic Publishers, 1990.
[29] Lindeman R L. The trophic-dynamic aspect of ecology[J]. Ecology, 1942, 23(4): 399-417.
[30] Pianka E R. Niche overlap and diffuse competition[J]. Proceedings of the National Academy of Sciences, 1974, 71(5): 2141-2145.
[31] Leontief W W. The Structure of the U.S. Economy[M]. New York: Oxford University Press, 1951.
[32] Ulanowicz R, Puccia C. Mixed trophic impacts in ecosystems[J]. Coenoses, 1990, 5(1): 7-16.
[33] Ulanowicz R. Ecosystem trophic foundations: Lindeman exonerata[J]. Complex Ecology: The Part–Whole Relation in Ecosystems Prentice-Hall, Englewood Cliffs, NJ, 1995: 549-560.
[34] Finn J T. Measures of ecosystem structure and function derived from analysis of flows[J]. Journal of Theoretical Biology, 1976, 56(2): 363-380.
[35] Menge B A. Indirect effects in marine rocky intertidal interaction webs: patterns and importance[J]. Ecological Monographs, 1995, 65(1): 21-74.
[36] Hunter M D, Price P W. Playing chutes and ladders: heterogeneity and the relative roles of bottom-up and top-down forces in natural communities[J]. Ecology, 1992, 73(3): 723-732.
[37] 苏锦祥. 鱼类学与海水鱼类养殖(第二版)[M]. 北京: 中国农业出版社, 1995: 233.Su Jinxiang. Ichthyology and cultivation of marine fishes(2nded)[M]. Beijing: China Agriculture Press, 1995: 233.
[38] Christensen V. Ecosystem maturity—towards quantification[J]. Ecological Modelling, 1995, 77(1): 3-32.
[39] Rybarczyk H, Elkaım B. An analysis of the trophic network of a macrotidal estuary: the Seine Estuary (Eastern Channel, Normandy, France) [J]. Estuarine, Coastal and Shelf Science, 2003, 58(4): 775-791.
[40] Coll M, Palomera I, Tudela S, et al. Trophic flows, ecosystem structure and fishing impacts in the South Catalan Sea, Northwestern Mediterranean[J]. Journal of Marine Systems, 2006, 59(1): 63-96.
[41] Manickchand‐Heileman S, Arreguín‐Sánchez F, Lara Domínguez A, et al. Energy flow and network analysis of Terminos Lagoon, SW Gulf of Mexico[J]. Journal of Fish Biology, 1998, 53(sA): 179-197.
[42] Odum E P. The strategy of ecosystem development[J]. Science, 1969, 164: 262-270.
Energy flow and network analysis of the Yangtze Estuary ecosystem during 1985–1986
ZHANG Xiao-jia1, 2, XIAN Wei-wei1, 3
(1. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory of Marine Ecology and Environment Science, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, China)Received:Dec. 24, 2014
Yangtze Estuary; energy flow; network analysis; ecopath model
The term ‘energy flow’ expresses the substantial relationship between organisms and their connection with the environment. It reflects the productivity level, structure, and function of a particular ecosystem. In this research, based on a comprehensive marine survey conducted during 1985-1986, we developed a mass-balance model for Yangtze Estuary to analyze the energy flow of this ecosystem. Using the Ecopath model, we evaluated the overall characteristics of the Yangtze Estuary and adjacent waters ecosystem. Ecosystem organisms were divided into sixteen functional groups. The Pedigree Index of the Ecopath model was 0.685, indicating that the quality of the model data was acceptable. Sensitivity analysis showed that changes in input parameters may influence the output parameters more significantly in some functional groups than in others. The Ecopath model suggested that during 1985-1986 the trophic level of functional groups ranged from 1 to 4.52, with pelagic nekton-feeding fish occupying the highest trophic level. The trophic level of macroinvertebrates, including shrimps, crabs, and cephalopods was approximately 3. Mixed trophic impact analysis suggested a direct or indirect relationship between functional groups, including the direction and degree of its influence. The impact was mainly caused by control type, niche overlap, and trophic cascades. Trophic aggregation analysis showed that the ecosystem was dominated by the grazing food chain. A linear food chain was derived from the mixed trophic network with a mean transfer efficiency of 12.4%, 12.9% from detritus and 12% from primary producers within the ecosystem. During this period, the total system throughput was 5020.886 t/(km2·a). The sums of all consumption, all detritus flows, all respiratory flows, and all exports were 35.8%, 28.2%, 20.9%, and 15.1%, respectively. The evaluation of the ecosystem structure and function showed that the connectance index and system omnivory index were 0.471 and 0.103, respectively. The Finn cycling index and mean path length were 9.35% and 2.778, respectively, and the ratio of total primary production to total respiration was 1.724. The mean trophic level of the catch was 3.475 in the Yangtze Estuary and adjacent waters ecosystem during 1985-1986. This provides a background value for exploring the impact of fisheries on the ecosystem in the coming decades.
Q147
A
1000-3096(2016)07-0060-13
10.1759//hykx20141224002
2014-12-24;
2015-04-22;
国家自然科学基金面上资助项目(41176138号和 31272663 号); 国家基金委-山东省联合基金资助项目( U1406403); 国务院三峡工程建设委员会项目(JJ 2012-2013号)
[Foundation: National Natural Science Foundation of China , No. 41146138, No. 31272663; NSFC-Shandong Joint Fund for Marine Ecology and Environmental Sciences, No. U1406403; Program of State Council Three Gorges Project Construction Committee, No. JJ 2012-2013]
张效嘉(1991-), 男, 山东省潍坊人, 硕士研究生, 主要从事海洋生态系统生态学研究, 电话: 18511599851, E-mail: zhangxiaojia.ok@163.com;线薇微,通信作者, E-mail: wwxian@qdio.ac.cn.
(本文编辑: 谭雪静)
