猪恒定链的原核表达及其分子结构与功能分析
2016-10-20王艳萍吕素芳王金良沈志强
董 林,王艳萍,吕素芳,2,王金良,2,唐 娜,2,沈志强*
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600)
猪恒定链的原核表达及其分子结构与功能分析
董林1,2,王艳萍1,吕素芳1,2,王金良1,2,唐娜1,2,沈志强1,2*
(1.山东省滨州畜牧兽医研究院,山东滨州 256600;2.山东绿都生物科技有限公司,山东滨州 256600)
为研究猪恒定链(Ii)分子结构与功能,通过PCR扩增编码完整Ii及其异构体的基因片段,克隆至T pMD18-T载体,在对目的基因进行测序及分析其基因与编码蛋白分子结构,确定功能域及其分子遗传变异的基础上,构建pET-32a-Ii重组载体,转化BL21进行诱导表达,并分析表达产物的免疫活性。结果显示,PCR扩增了645 bp和837 bp的Ii及其异构体编码基因,DNA序列分析其编码氨基酸分别为215个和279个,异构体Ii多出了64个氨基酸构成的Tg区;分子结构分析显示,猪Ii分子由胞内区、跨膜区和胞外区3部分组成,包含有内体定位基元、Ii-key、CLIP、TRIM等功能域,其中内体定位基元含有特征性L7I和PML17双亮氨酸基序,Ii-key、CLIP、TRIM氨基酸序列与人和小鼠Ii具有高度一致性。遗传变异分析表明,猪Ii分子与人、小鼠等哺乳动物的Ii同源性为62.7%~95.6%,与鸡、鸭、鸽、鹅等禽类Ii的同源性为48.7%~49.5%;空间结构分析显示,猪Ii有3个相似的α-helix构成,其间间隔由相似氨基酸构成的2个转角,转角关键位点氨基酸具有高度一致性;Ii编码基因在BL21细胞获得了有效表达,目的蛋白大小约41 ku,Western blot和免疫荧光检测显示,表达产物具有良好的反应原性。试验成功获得了猪Ii及其异构体编码基因,明确了其功能区、分子遗传变异等特征,诱导表达获得了具有良好免疫活性的Ii重组蛋白,为进一步研究猪Ii分子结构与功能奠定了基础。
猪;恒定链;原核表达;分子结构;功能分析
恒定链(invariant chain,Ii)在不同物种间表现为非多态性,属Ⅱ型跨膜糖蛋白,其结构由胞浆区、跨膜区和内质网区3部分构成,包含内体定位基元、CLIP、Ii-key、三聚体区、Tg区等功能结构域[1-3]。作为MHCⅡ类分子重要的分子伴侣蛋白,Ii在确保MHCⅡ类分子正确折叠、组装、维持空间结构、内体靶向转运、抗原肽递呈及B淋巴细胞成熟中发挥重要作用[4]。研究显示,Ii作为多种免疫活性分子的相关受体,在机体免疫应答和免疫调节过程中发挥多种作用[5]。近年来,对Ii作为MIF、幽门螺旋杆菌及CD74抗体的受体功能的相关研究逐年增加[6]。
Ii基因为单拷贝结构,与MHCⅡ类分子组成型表达于多种细胞表面,包括T、B淋巴细胞、巨噬细胞、树突状细胞和胸腺上皮细胞等,在肠道肿瘤细胞和乳腺上皮细胞表面也有表达[7]。由于mRNA转录和剪接方式不同,Ii在人类、小鼠、禽类等物种中均存在不同的异构体,其中人类Ii存在p33、p41、p35和p43 4种异构体,p33是主要的存在形式,由216个氨基酸残基组成,p41、p43较p33和p35多出由外显子6b编码的Tg区,具有蛋白酶抑制功能,对确保外源性抗原的稳定递呈具有积极意义[8]。小鼠Ii存在p31和p41两种形式异构体。国内学者研究确定,鸡、鸭、鸽等物种的Ii也存在异构体[9-10]。
基于Ii的DNA疫苗与多肽疫苗已成为近年疫苗研究的热点。构建以Ii为载体的靶向基因疫苗,能明显增强疫苗的抗原递呈效率。“C-末端添加”和“CLIP 替换”是现阶段设计靶向性DNA疫苗的主要手段[11]。设计、构建Ii-Key修饰的多肽疫苗可以为人类自身免疫性疾病、肿瘤和传染病的免疫治疗和预防提供新的思路。本试验对猪Ii基因进行克隆、表达及分子结构与功能分析,为深入研究猪Ii结构、功能及新型疫苗设计奠定基础。
1 材料与方法
PyrobestTMDNA Polymerase、pMD T-18 Vector Cloning kit、DNA Marker DL 2 000、限制性内切酶BamHⅠ、XhoⅠ、DH5α、BL21感受态细胞,宝生物工程(大连)有限公司产品;高纯度质粒小量提取试剂盒、多功能DNA回收试剂盒,北京百泰克生物技术有限公司产品;NC膜、DAB显色剂,北京天根生物技术有限公司产品;预染蛋白Marker,Thermo Scientific公司产品;pET-32a载体,山东省滨州兽医生物技术实验室保存。
1.2方法
1.2.1引物设计与合成根据山东省滨州兽医生物技术实验室克隆扩增Ii全基因序列和GenBank已知基因序列保守区,设计1对扩增猪Ii完整ORF的引物Ii-F1、Ii-R1;根据pET-32a酶切位点和Ii序列特性,设计1对表达Ii用引物Ii-F2、Ii-R2。具体引物序列见表1。
1.2.2目的基因PCR扩增以实验室保存的T-Ii-1337 nt和Ii-1145 nt重组质粒为模板,用合成的Ii-F1、Ii-R1,PCR扩增猪Ii不同异构体基因完整编码区基因片段。PCR反应体系:10×Pyrobest buffer Ⅱ 2.5 μL、dNTP Mixture 1.0 μL、Ii-F1/Ii-R1各1.0 μL,T-Ii-1337/1145 nt分别2.0 μL,ddH2O 17.0 μL,Pyrobest DNA Polymerase 0.5 μL,总体积25.0 μL。PCR扩增程序:94 ℃ 4 min;94 ℃ 30 s,56 ℃ 40 s,72 ℃ 40 s,35个循环;72 ℃ 10 min,4 ℃ 终止反应。PCR产物经10 g/L琼脂糖凝胶电泳检测分析结果。
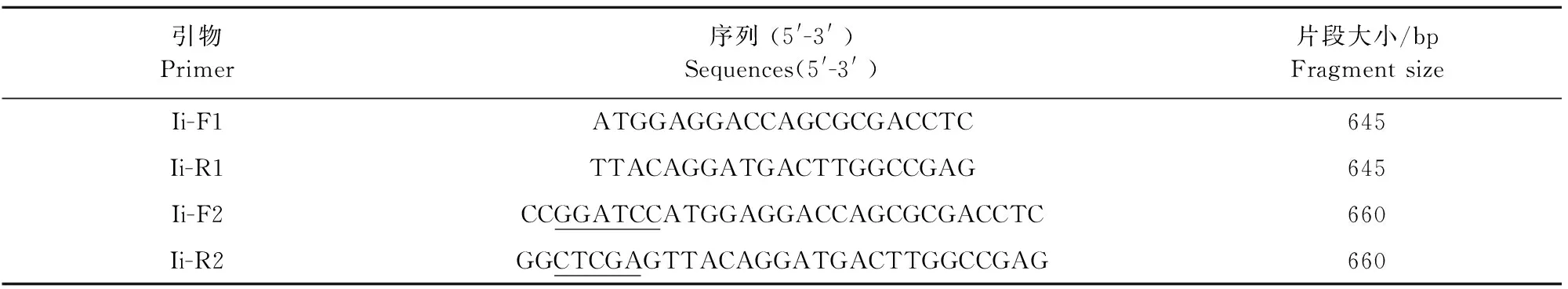
表1 特异性扩增Ii基因PCR引物Table 1 The specific PCR primers for Ii gene amplification
1.2.3Ii编码基因序列测定与分析用多功能DNA回收试剂盒分别回收Ii不同异构体编码基因PCR产物,16℃连接pMD T-18 Vector 3 h,转化DH5α感受态细胞,经Amp+抗性筛选,重组质粒酶切鉴定后,取阳性克隆提取质粒,送上海生工生物工程技术服务有限公司进行测序。测序结果用NCBI Blast在线进行同源性分析,用Clustalx v1.83、MEGA5.10软件进行不同物种间Ii编码蛋白遗传进化分析。
1.2.4Ii分子功能区定位分析与结构预测用Simple Modular Architecture Research Tool (http://smart.embl-heidelberg.de )、the Scan Prosite programs in the PROSITE database (http://ca.expasy.org/prosite)、Motif Scan (http://hits.isb-sib.ch/cgi-bin/PFSCAN) 等对功能区、信号肽及基序等进行推测,用Expasys translate tool ( http://www.expasy.org/ )进行结构预测,与其他物种Ii 结构进行同源性比对,理论模型由RasMol software (http://www.RasMol.org)演示和分析。
1.2.5表达Ii重组载体构建与诱导表达以Ii-1145 nt重组质粒为模板,用Ii-F2、Ii-R2引物PCR扩增,回收纯化目的基因,BamHⅠ、XhoⅠ对目的基因和pET-32a同时进行双酶切,回收纯化后,T4 DNA Ligase连接4 h,转化BL21(DM3)感受态细胞。经Amp+、PCR和酶切鉴定筛选阳性菌落,接种LB培养基培养,添加IPTG进行目的基因诱导表达,SDS-PAGE电泳检测蛋白表达情况。
1.2.6Ii重组蛋白纯化及活性鉴定收集诱导后菌体,超声破碎收集上清,His-Trap亲和层析纯化目的蛋白,SDS-PAGE分析纯化效果。以纯化的目的蛋白为抗原,采用Abnova公司的鼠抗猪Ii单抗为一抗,山羊抗鼠-HRP为二抗,Western blot分析表达的Ii蛋白的反应活性。以纯化的Ii蛋白为抗原,免疫Balb/c小鼠,制备抗血清,收集、分离脾淋巴细胞,培养至48 h后,铺制单层细胞,以小鼠抗Ii血清为一抗,山羊抗鼠-FITC为二抗,免疫荧光分析结果,鉴定制备的Ii抗体与脾淋巴细胞表达的Ii蛋白的反应活性。
由于出库含沙量较建库前相比偏小,可能将引起沿程悬沙和床沙的粗化现象发生。以武汉河段汉口站为例分析三峡蓄水运用前后悬移质泥沙特征值变化情况,见表1。
2 结果
2.1Ii基因PCR扩增
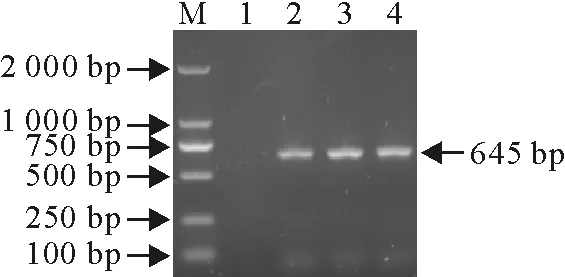
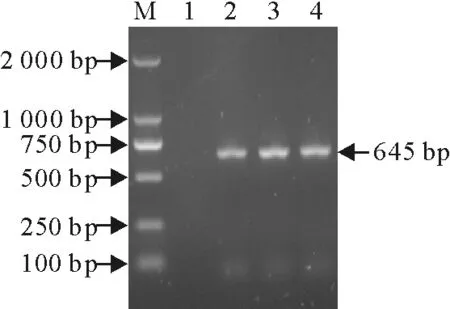
用合成的Ii-F1、Ii-R1以T-Ii-1337 nt和T-Ii-1145 nt重组质粒为模板,进行PCR扩增,琼脂糖凝胶检测显示,分别在约645 bp和837 bp出现特异性目的条带,说明成功扩增到Ii及其异构体编码基因(图1和图2)。
2.2阳性克隆筛选鉴定
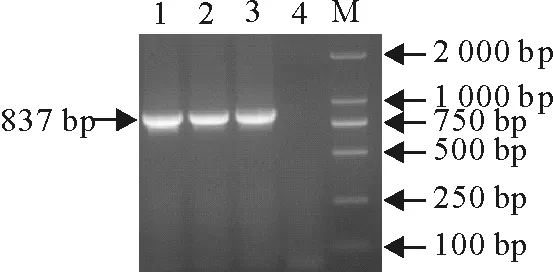
回收Ii及其异构体编码基因PCR产物,连接T载体,挑取单菌落,菌液PCR鉴定显示,分别扩增到约645 bp和837 bp特异性条带(图3)。提取PCR阳性质粒DNA,BamHⅠ、XhoⅠ酶切鉴定显示,分别获得约645 bp和837 bp的条带(图4)。说明成功构建了Ii及其异构体编码基因重组T克隆载体。
M.DNA标准DL 2 000;1.阴性对照;2~4.Ii基因PCR产物
M.DNA Marker DL 2 000;1.Negative control;2-4.PCR products of Ii gene
图1猪Ii编码基因PCR扩增
Fig.1PCR amplification of porcine Ii gene
1~3.Ii异构体基因PCR扩增产物;4.阴性对照;M.DNA标准DL 2 000
1-3.PCR products of Ii isomer gene;4.Negative control;M.DNA Marker DL 2 000
图2猪Ii异构体编码基因PCR扩增
Fig.2PCR amplification of porcine Ii isomer gene
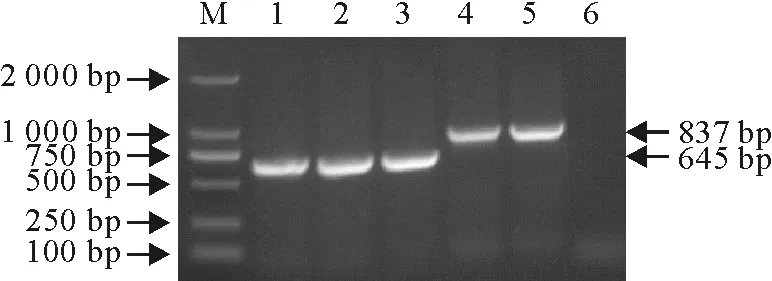
M.DNA标准DL 2 000;1~3.Ii-645 nt PCR扩增;4~5.Ii-837 nt PCR产物;6.阴性对照
M.DNA Marker DL 2 000;1-3.PCR products of 645 nt;4-5.PCR products of 837 nt;6.Negative control
图3菌液PCR鉴定结果
Fig.3Results of PCR identification of bacterial fluid

1.Ii-837 nt重组质粒;2.空质粒;3.Ii-645 nt重组质粒;4.空质粒:M.DNA标准 DL 15 000
1.pMDTM-T18-Ii-837 plasmid;2.T18-vectot;3.pMDTM-T18-Ii-645 plasmid;4.T18-vectot;M.DNA Marker DL 15 000
图4酶切鉴定结果
Fig.4Results of enzyme digestion identification
2.3编码Ii DNA测序结果
DNA测序获得645 nt和837 nt两种基因序列,分别编码215个和279个氨基酸序列,其中Ii-837较Ii-645多出192个碱基序列,编码64个氨基酸,构成Ii异构体Tg区(图5)。同源性分析显示,Ii在不同物种间表现出高保守性,其中猪Ii与人、小鼠和牛等哺乳类物种的Ii间有62.7%~95.6%的同源性,与鸡、鸭、鸽、鹅等禽类Ii的同源性为48.7%~49.5%,与树蛙、斑马鱼等低等物种Ii的同源性较低,仅为25.8%~3.04%。用Clustalx v1.83、MEGA5.10分析结果显示,不同物种Ii基因及其编码氨基酸具有同源性,其中编码内体定位基元、Ii-key区、CLIP区和三聚体区等关键功能区氨基酸高度保守,同源性越接近的物种,其Ii越具有相似的特征性编码氨基酸序列,保证了Ii在免疫递呈通路稳定发挥作用。
2.4猪Ii分子功能区分析
Smart软件在线分析显示,猪Ii胞内区由1-30位氨基酸组成,含有L7I和PML172个内体定位基元;跨膜区由31-56位氨基酸组成,为Ii保守性最强区域;胞外区由57-214位氨基酸组成,包含L77RMK80构成的Ii-key区、81-104位氨基酸构成的CLIP区,118-192位氨基酸构成的TRIM区,其中Ii异构体在TRIM区多出Tg区。ScanProsite (Applied Biosystems)软件分析发现,在122-125位点有1个N-糖基化位点,Motif Scan software 未发现信号肽序列。

图5 猪Ii及其异构体主要结构域氨基酸序列
2.5Ii分子结构预测
应用SWISS-MODLR在线数据库,对人、小鼠、猪、鸡、鸭等5个物种Ii部分氨基酸序列进行3-D结构建模结果显示,不同物种间Ii的空间构型具有高相似度,其中人、小鼠、猪、鸡、鸭等物种的都有3个相似的α-helix构成,其间间隔由相似氨基酸构成的2个转角,转角关键位点氨基酸具有高度一致性(图6)。
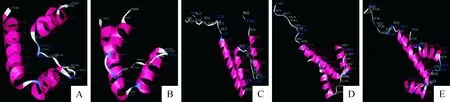
A.鸡;B.鸭;C.猪;D.小鼠;E.人类
2.6Ii重组蛋白表达与纯化
从Ii-1145 nt重组质粒亚克隆获得了约645 bp特异性目的基因片段(图7)。菌液PCR鉴定,PCR产物在约645 bp出现特异性目的条带(图8)。重组质粒经酶切鉴定出现约5 900 bp和645 bp特异性条带(图9)。DNA序列测定证实,成功构建了表达载体pET-32a-Ii,无碱基缺失或突变发生。转化BL21(DM3)感受态细胞,进行体外诱导表达,SDS-PAGE电泳显示,在约41 ku处有特异性目的条带,与预期大小相符,表明目的基因获得有效表达(图10)。His-Trap亲和层析纯化后,重组Ii蛋白纯度可达90%以上,满足免疫抗原纯度要求(图11)。

1.阴性对照;2.Ii基因PCR产物;M.DNA标准DL 2 000
1.Negative control;2.PCR products of Ii gene;M.DNA Marker DL 2 000
图7Ii基因PCR扩增
Fig.7 PCR amplification of Ii gene
2.7Ii免疫活性鉴定
Western blot显示,Ii重组蛋白与鼠抗猪Ii单抗,在约41 ku处出现特异性显色条带(图12),说明重组Ii蛋白与鼠Ii单抗具有良好的反应性。免疫荧光检测显示,脾淋巴细胞上出现清晰的绿色荧光信号,强荧光信号主要集中在脾淋巴细胞的细胞质,说明以纯化的Ii重组蛋白为抗原制备的抗体与脾淋巴细胞表达的Ii分子能发生良好的免疫反应(图13)。
M.DNA标准DL 2 000;1.阴性对照;2~4.Ii基因PCR产物
M.DNA Marker DL 2 000;1.Negative control;2-4.PCR products of Ii gene
图8菌液PCR鉴定
Fig.8Identification of bacteria liquid by PCR
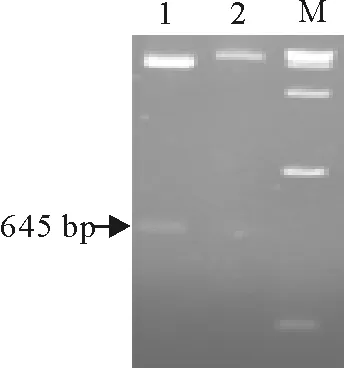
1.pET-32a-Ii重组质粒2.pET-32a质粒;M.DNA标准 DL 15 000
1.pET-32a-Ii;2.pET-32a;M.DNA Marker DL 15 000
图9pET-32a-Ii酶切鉴定
Fig.9Identification of pET-32a-Ii by enzyme digestion

1.未诱导pET-32a-Ii;2~3.诱导pET-32a-Ii;M.蛋白分子质量标准(低);4.未诱导pET-32a;5.诱导pET-32a
1.Non induced pET-32a-Ii;2-3.Induced pET-32a-Ii;M.Protein molecular weight Maker(Low);4.Non induced pET-32a;5.Induced pET-32a
图10Ii重组蛋白的诱导表达
Fig.10Induced expression of Ii recombinant proteins
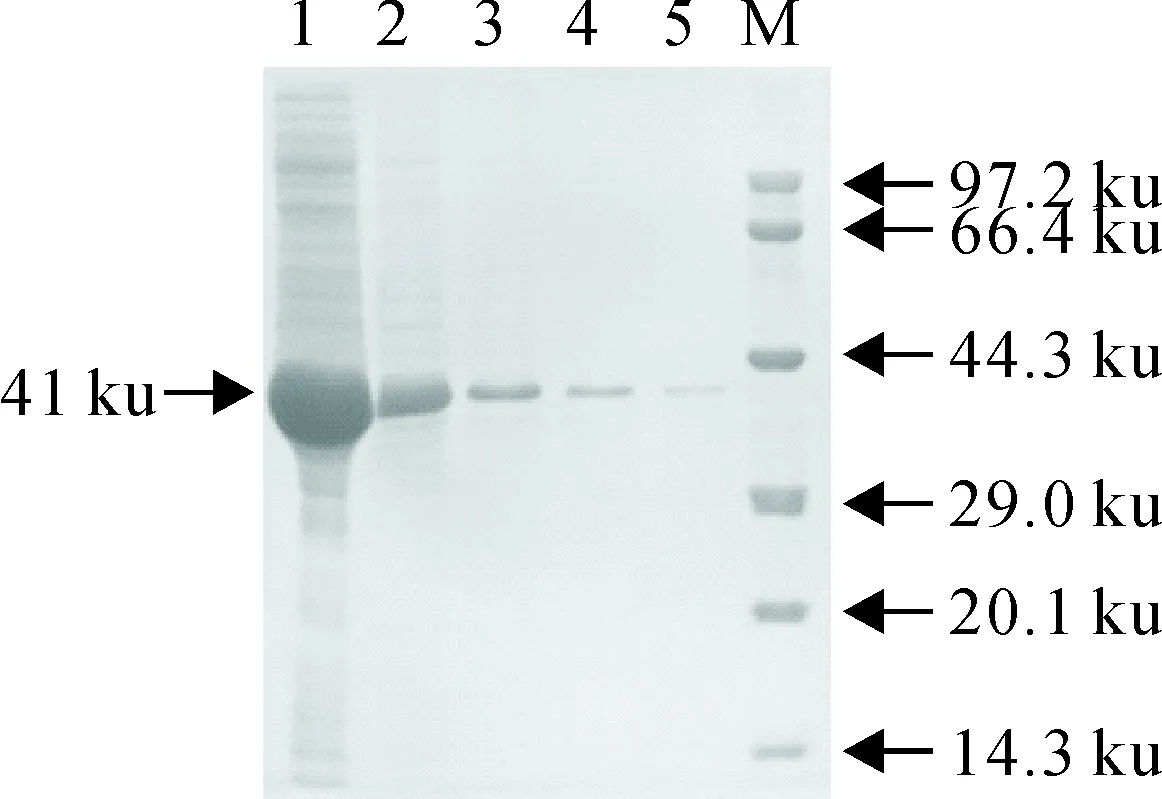
1.诱导的pET-32a-Ii;2~5.纯化的Ii重组蛋白;M.蛋白分子质量标准(低)
1.Induced pET-32a-Ii;2-5.Purified Ii recombinant proteins;M.Protein molecular weight Maker(Low)
图11Ii重组蛋白纯化
Fig.11Purification of Ii recombinant proteins
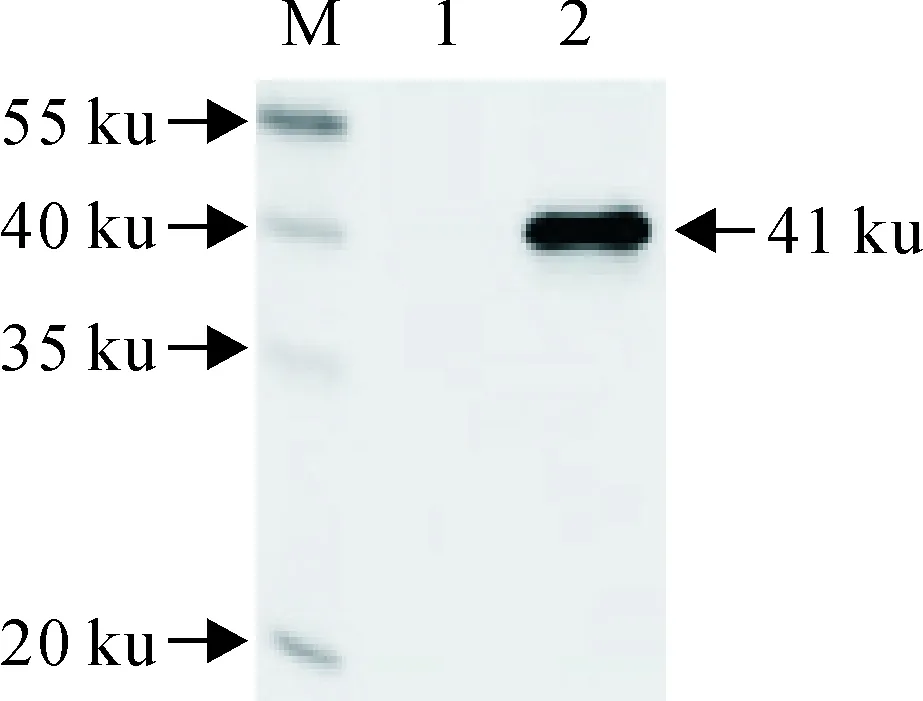
M.蛋白分子质量标准(低);1.阴性对照;2.Ii重组蛋白
M.Protein molecular weight Maker(Low);1.Negative control;2.Ii recombinant protein
图12Ii蛋白Western blot鉴定
Fig.12Identification of Ii protein by Western blot
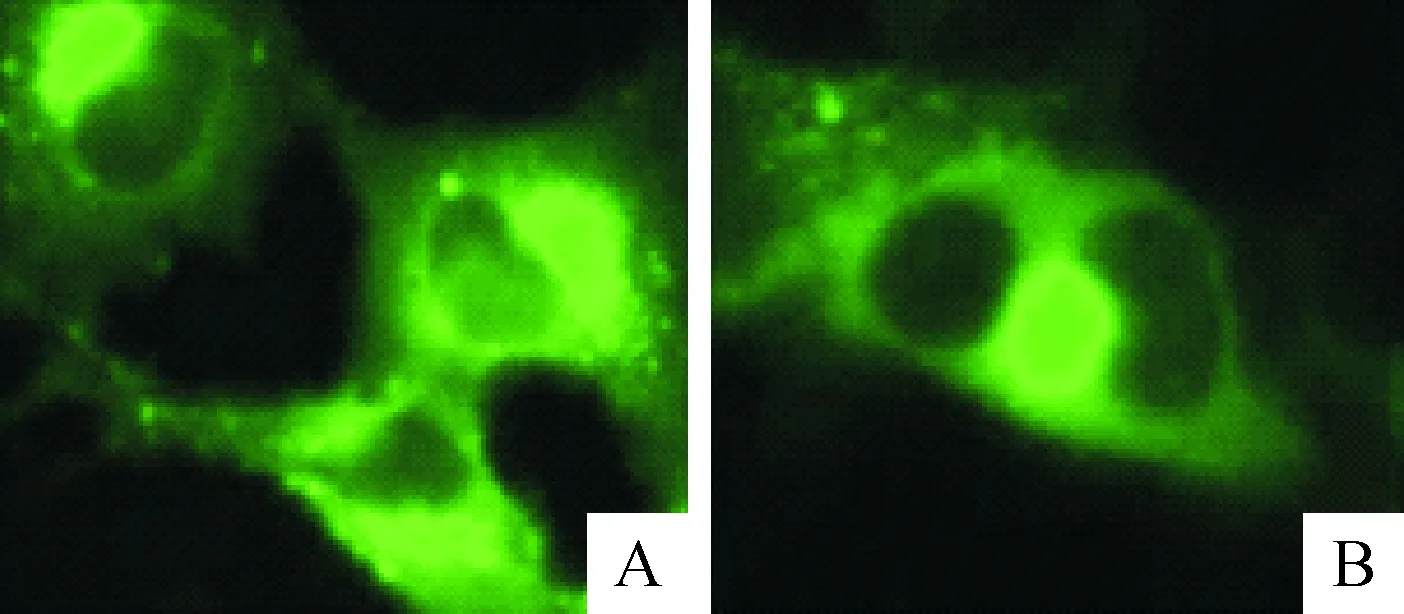
A.单层淋巴细胞;B.单个淋巴细胞
A.Monolayer lymphocytes;B.Single lymphocyte
图13脾淋巴细胞表达的Ii免疫荧光检测
Fig.13Immunofluorescence assay of Ii expression by splenic lymphocytes
3 讨论
研究表明,Ii作为MHCⅡ类分子的分子伴侣组成型表达于B淋巴细胞、单核-巨噬细胞和树突状细胞等多种抗原递呈细胞,在免疫应答中发挥重要作用;同时,Ii作为一种新型免疫因子,在炎症反应、抗菌机制中也起到一定作用[12]。关于Ii分子的研究主要集中在人和小鼠的Ii分子上,对猪Ii分子特征、功能及其结构等国内外研究不多[13]。我们获得了猪Ii及其异构体编码基因,编码215个和279个氨基酸残基,其中异构体Ii多了64个氨基酸残基组成的Tg区,这与已报道的人、小鼠、鸡、鸭等Ii异构体基因结构类似。结构分析表明,猪Ii分子分为胞内区、跨膜区和胞外区3个结构域,包含内体定位基元、Ii-key区、CLIP区和三聚体区等功能区,其中L7I和PML17内体定位基元与已知其他物种的Ii存在2个Leu靶向基序高度一致,表明猪Ii也可能存在基于该基序的定位功能。
空间结构分析表明,猪Ii三聚体区具有3个相似的α-helix构成,其间隔为由相似氨基酸构成的2个转角,这也与人Ii结构高度相似,说明猪Ii三聚体区也具有通过自身三聚体化调节和维持MHCⅡ类分子结构的功能[14-15]。遗传进化分析显示,不同物种Ii分子保持高度同源性,特别是维持Ii分子空间构型和功能的关键氨基酸位点非常保守,这也说明在长期的物种进化过程中,作为免疫系统重要组成分子的Ii在免疫压力下维持了结构的一致性。
本研究构建了表达猪Ii分子的表达载体pET-32a-Ii,目的蛋白在BL21细胞获得了有效表达,大小约41 ku,经Western blot和免疫荧光检测,具有良好的反应原性,与国内学者的报道一致[16],说明表达的重组Ii蛋白具有免疫活性。免疫荧光检测显示,制备的抗猪Ii抗体与脾淋巴细胞内天然表达的Ii蛋白能发生明显反应,表明制备的Ii抗体具有良好的免疫活性。
[1]叶红,许发芝,余为一 ,等.鸡Ⅰ类抗原递呈分子亚单位与恒定链的细胞定位及相互关系研究[J].中国免疫学杂志,2010,26(6):528-532.
[2]Gautam A M,Yang M,Milburn P J,et al.Identification of residues in the class II-associated Ii peptide (CLIP) region of invariant chain that affect efficiency of MHC class Ⅱ-mediated antigen presentation in an allele dependent manner[J].J Immunol,1997,159(6):2782-2788.
[3]郑凤荣,郭湘云,刘洪展,等.星斑川鲽MHCⅡ恒定链Ii基因的克隆表达和表达特性[J].水产学报,2016,40(2):145-153.
[4]Faure-Andre G,Vargas P,Yuseff M I,et al.Regulation of dendritic cell migration by CD74,the MHC class Ⅱ-associated invariant chain[J].Science,2008,322(5908):1705-1710.
[5]Guncar G,Pungercic G,Klemencic I,et al.Crystal structure of MHC Ⅱ-associated p41 Ii fragment bound to cathepsin L reveals the structural basis for differentiation between cathepsins L and S [J].Embo J,1999,18(4):793-803.
[6]Liu S J,Chen F F,Dai Y,et al.Molecular characterization and tissue specific expression of invariant chain in muscovy duck (Cairinamoschata) [J].Genet Mol Res,2011,10(4):2867-2880.
[7]Chen F F,Pan L,Dai Y,et al.Characteristics of expression of goose invariant chain gene and comparison of its structure among different species[J].Poult Sci,,2011,90(8):1664-1670.
[8]Zhong D,Yu W Y,Liu Y H,et al.Molecular cloning and expression of two chicken invariant chain isoforms produced by alternative splicing[J].Immunogenetics,2004,56(9):650-656.
[9]Dixon A M,Stanley B J,Matthews E E,et al.Invariant chain transmembrane domain trimerization:a step in MHC class Ⅱ assembly[J].Biochemistry,2006.45(16):5228-5234.
[10]Maharshak N,Cohen S,Lantner F,et al.CD74 is a survival receptor on colon epithelial cells[J].World J Gastroenterol,2010,16(26):3258-3266.
[11]刘伟,许发芝.猪Ia相关恒定链定位基元突变对其定位功能的影响[J].细胞与分子免疫学杂志,2014,30(9):925-929..
[12]Xu F Z,Dai Y,Li L M,et al.Molecular cloning and site-directed mutagenesis of leucine based sorting motifa of the porcine invariant chain[J].Genet Mol Res,2013,12(4):4489-4499.
[13]陈芳芳,余为一.一种新型的免疫载体—MHCⅡ类分子的恒定链[J].中国免疫学杂志,2010,26(6):573-576.
[14]Xu F Z,Ye H,Wang J J,et al.The effect of site-directed mutagenesis of the ambient amino acids of leucine based sorting motifs on the localization of chicken invariant chain [J].Poult Sci,2008,87(10):1980-1986.
[15]King G,Dixon A M.Evidence for role of transmembrane helix-helix interactions in the assembly of the Class Ⅱ major histocompatibility complex[J].Mol Biosyst,2010,6(9):1650-1661.
[16]Bosch B,Berger A C,Khandelwal S,et al.Disruption of multivesicular hody vesicles does not affect major hisocompatibility complex(MHC) class Ⅱ peptide complex formation and antigen presentation by dendritic cells[J].J Biol Chem,2013,288(34):24286-24292.
Prokaryotic Expression of Porcine Ii and Analysis of Its Molecular Structure and Function
DONG Lin1,2,WANG Yan-ping1,LÜ Su-fang1,2,WANG Jin-liang1,2,TAN Na1,2,SHEN Zhi-qiang1,2
(1.BinzhouAnimalScienceandVeterinaryMedicineInstitudte,Binzhou,Shandong,256600,China;2.ShandongLvduBio-Sciences&TechnologyCo.Ltd,Binzhou,Shandong, 256600,China)
The molecular structure and function of porcine Ii were researched by PCR amplification of Ii and its isomers conding cDNA,which the gene fragment was cloned into T-Vector for DNA sequence.The gene and encoding protein molecular structure were analyzed and the functional domain and its molecular genetic variation were detemined.The expression vector of pET-32a-Ii was constructed and transformed into BL21 that was induced for protein expression, and the immune activity of protein was analyzed.The results showed that the complete genes of porcine invariant chain and its isomer were 645 nt and 837 nt respectively,each coding 215 aa and 279 aa.Compared to the invariant chain,the isomer had an extra Tg domain encoded by 64 aa.Molecular structure analysis predicted that the porcine invariant chain had intracellular, transmembrane and extracellular zones which included several function domains such as inner body positioning element,Ii-key,CLIP and TRIM.The inner body positioning element had distinctive dual leucine motifs L7I and PML17,and all the amino acid sequences of Ii-key,CLIP,TRIM showed high consistencies with human and mouse Ii.The genetic variation analysis illustrated that porcine invariant chain was 62.7%-95.6% homologous to human or mouse invariant chain,and 48.7%-49.5% to chicken,duck,dove,goose and other birds.The porcine invariant chain was composed of three similar α-helixes,spaced with two corners which had highly similar amino acids.The 41 ku recombinant protein was also effectually expressed in BL21 cells,showed good reactivity in Western blot and IFA tests.The present study will provide useful information for the further study of porcine invariant chain molecular structure and function.
pig;invariant chain;prokaryotic expression;molecular structure;function analysis
2016-01-29
山东省自然科学基金项目(ZR2013CQ006)
董林(1980-),男,安徽阜阳人,助理研究员,博士,主要从事动物免疫学研究。*通讯作者
S852.42;Q513.2
A
1007-5038(2016)10-0064-06
