马链球菌对树突状细胞Toll样受体和MyD88及细胞因子mRNA表达的影响
2016-10-20杜润慈冉多良刘建华
杜润慈,冉多良,李 静,付 强,刘建华
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
马链球菌对树突状细胞Toll样受体和MyD88及细胞因子mRNA表达的影响
杜润慈,冉多良,李静,付强,刘建华*
(新疆农业大学动物医学学院,新疆乌鲁木齐 830052)
为探究马链球菌马亚种(Streptococcusequisubsp.equi,S.equi)对小鼠骨髓源树突状细胞(bone marrow derived dendritic cells,BMDCs)TLR1、TLR2、TLR6、MyD88、IL-1、IL-6、IL-10、IL-12、TNF-α mRNA表达的影响,用GM-CSF、IL-4细胞因子刺激小鼠骨髓细胞使其诱导分化成未成熟的BMDCs,感染S.equi后16、20、26 h,采用SYBR Green Ⅰ实时荧光定量PCR检测感染组及未感染组细胞TLRs、MyD88和细胞因子mRNA的表达情况。结果显示,S.equi感染BMDCs后16、20、26 h,TLR1、TLR2、TLR6、MyD88 mRNA的表达量均显著或极显著的高于未感染组(P<0.05或P<0.01)。S.equi感染DCs后16、26 h,IL-1的分泌量较未感染组没有变化(P>0.05),IL-10、TNF-α的分泌量显著或极显著增加(P<0.05或P<0.01)。IL-6在S.equi感染DCs后16 h的分泌量显著增加(P<0.05),但感染后26 h无显著变化(P>0.05)。IL-12在S.equi感染DCs后16 h的表达没有变化(P>0.05),但感染后26 h分泌量有所增加(P<0.05)。说明S.equi具有调节DCs TLRs、MyD88和细胞因子表达的能力,从而介导机体的免疫应答反应。
马链球菌马亚种;树突状细胞;Toll样受体;细胞因子
Toll样受体(Toll-like receptors,TLRs)是一种古老而又保守的模式识别受体(pattern recognition receptors,PRRs),被科学界称为机体最主要的病原体“传感器”。果蝇Toll蛋白的发现导致TLRs在生物免疫学领域快速发展[1]。目前,在人类共发现10种TLRs家族成员,在老鼠共发现12种TLRs。TLR1、2、4、5、6主要表达于细胞表面并能识别来自细菌、真菌和原生动物的病原相关分子模式(pathogen-associated molecular patterns,PAMPs),TLR3、7、8、9则表达于细胞内,主要识别病毒和细菌的核酸[2-3]。树突状细胞(dendritic cells,DCs)是另一个在宿主抵御病原微生物方面的“哨兵”[4],PAMPs或炎性细胞因子可促进DCs成熟,增强其抗原递呈功能,将病原体从外周组织递呈到引流淋巴结,通过T淋巴细胞诱导获得性免疫应答,因此DCs是联接自然性免疫应答与获得性免疫应答的桥梁[5]。近年来,多个研究表明链球菌感染宿主与TLRs有关[6-7],但关于马链球菌与TLRs关联的报道较少。本试验以马腺疫病原菌马链球菌马亚种(Streptococcusequisubsp.equi,S.equi)作为研究对象,GM-CSF、IL-4诱导小鼠骨髓细胞获得小鼠骨髓源树突状细胞(bone marrow derived dendritic cells,BMDCs),应用SYBR GreenⅠ实时荧光定量PCR技术,检测S.equi感染BMDCs后不同时间细胞TLR1、TLR2、TLR6、MyD88、IL-1、IL-6、IL-10、IL-12、TNF-α mRNA的表达水平,探讨这些基因与S.equi感染BMDCs之间的关系,为了解马腺疫的致病机制提供理论依据。
1 材料与方法
1.1材料
1.1.1菌株及实验动物S.equi新疆株,新疆农业大学动物医学学院传染病实验室保存;C57BL/6纯系雄性小鼠,6周龄~8周龄,购自新疆医科大学动物实验中心。
1.1.2主要仪器倒置光学显微镜,日本尼康公司产品;恒温细胞培养箱,美国Thermo公司产品;低温台式离心机,德国Eppendorf公司产品;ABI7300 Real-time PCR仪,美国ABI公司产品;流式细胞仪及分析软件,美国Beckman公司产品。
1.1.3主要试剂 重组小鼠GM-CSF、IL-4细胞因子,美国Pepretech公司产品;FITC anti-mouse CD11c流式抗体及同型对照、PE anti-mouse I-A/I-E(MHCⅡ)流式抗体及同型对照、PE anti-mouse CD80流式抗体及同型对照、PE anti-mouse CD86流式抗体及同型对照,美国Biolegend公司产品;RPMI-1640培养基、胎牛血清,美国Gibco公司产品;Trizol和cDNA第一条链合成试剂盒,Invitrogen公司产品;pMD19-T载体,宝生物工程 (大连) 有限公司产品;DNA凝胶回收试剂盒,Promega公司产品;Trans Start Tip Green qPCR Super Mix试剂盒,北京全式金生物技术有限公司产品。
1.2方法
1.2.1分离诱导培养BMDCs将C57BL/6小鼠处死后,浸入750 mL/L乙醇中消毒5 min~10 min,无菌状态下取出胫骨和股骨,剪去骨一端,用注射器吸取RPMI-1640培养液刺入骨髓腔反复冲洗,收集骨髓细胞至无菌培养皿中,吹散细胞后,1 500 r/min离心5 min,弃上清,加入3倍体积的Tris-NH4Cl红细胞裂解液溶解红细胞5 min,RPIM-1640培养液中和后再次离心,弃上清。用含100 mL/L胎牛血清、20 ng/mL GM-CSF、10 ng/mL IL-4 的RPMI-1640培养液悬浮细胞,接种于6孔细胞培养板(1×106/孔),置于37 ℃、体积分数为5%的CO2的细胞培养箱中培养,48 h后除去未贴壁细胞并补足培养液,隔日半量换液。培养至第7天时,轻轻吹打培养板,收获半悬浮细胞,即BMDCs。
1.2.2流式细胞术分析细胞免疫表型 收集第7天的BMDCs,PBS洗涤1遍后,将细胞计数为每管1×106个/100 μL,分别加入相应的FITC-CD11c、PE-D80、PE-CD86和PE-MHCⅡ流式抗体,使其终浓度分别达到2.5、5、10、2.5 μg/mL,4 ℃避光孵育20 min。PBS洗涤2遍~3遍,去除未结合的抗体。取细胞悬液于流式细胞仪进行细胞表型分析。
1.2.3S.equi感染BMDCs将BMDCs培养在6孔细胞培养板中(1×106个/孔),用S.equi以感染复数20∶1的比例分别感染细胞16、20、26 h,设置未感染对照组,每组3个重复孔。
1.2.4实时荧光定量PCR检测S.equi感染BMDCs后TLRs、MyD88和细胞因子的表达 SYBR GreenⅠ实时荧光定量PCR中,TLRs、MyD88和细胞因子引物的设计和合成、β-actin和目的基因阳性质粒的构建、熔解曲线和标准曲线的建立、细胞总RNA提取和制备cDNA的方法均按照新疆农业大学传染病实验室已经建立的实时荧光定量PCR检测方法进行[8]。每个试验样品进行3次重复。
1.2.5数据分析 采用2-△△Ct方法处理数据,用SPSS19.0对TLR1、TLR2、TLR6 、MyD88、IL-1、IL-6、IL-10、IL-12、TNF-α在感染组和未感染组的表达量进行t检验显著性分析,P<0.05为差异有统计学意义。
2 结果
2.1小鼠骨髓来源树突状细胞的鉴定
小鼠骨髓细胞经GM-CSF、IL-4体外诱导培养至第7天时,大部分细胞呈半悬浮集落状,吹散后单个细胞表面有明显树枝样突起,为典型的树突状细胞形态(图1)。采用流式细胞术双标法对细胞表型进行检测,即以树突状细胞表面特异性分子CD11c设门,在CD11c阳性细胞中检测CD80、CD86、MHCⅡ阳性的比例。结果显示,CD11c和CD80、CD86、MHCⅡ双阳性率分别为52.4 %、49.4 %和29.7 %,为典型的BMDCs表型特性(图2)。
2.2S.equi对BMDCs TLR1、TLR2、TLR6和MyD88 mRNA表达的影响
以β-actin为内参基因,采用 SYBR GreenⅠ实时荧光定量PCR技术分别检测S.equi感染小鼠BMDCs后16、20、26 h组及未感染组TLR1、TLR2、TLR6和MyD88 mRNA转录水平(图3)。TLR1在S.equi感染小鼠BMDCs后16、20、26 h的表达量高于未感染组,并且感染后16、20 h的表达极显著高于对照组(P<0.01),感染后26 h的表达显著高于未感染组(P<0.05)。TLR2在S.equi感染小鼠BMDCs后16、20 、26 h的表达量显著高于未感染组(P<0.05),TLR6的表达极显著高于未感染组(P<0.01)。MyD88在S.equi感染小鼠BMDCs后16、20、26 h的表达量高于未感染组,并且在感染后20 h的表达极显著高于未感染组(P<0.01),感染后16、26 h的表达显著高于未感染组(P<0.05)。
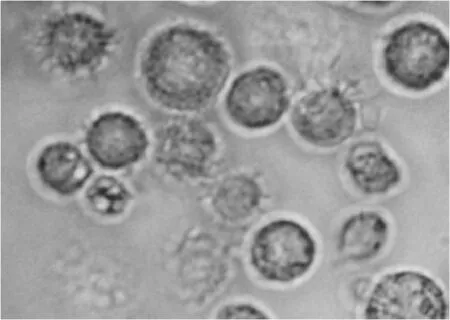
图1 BMDCs的形态学特征
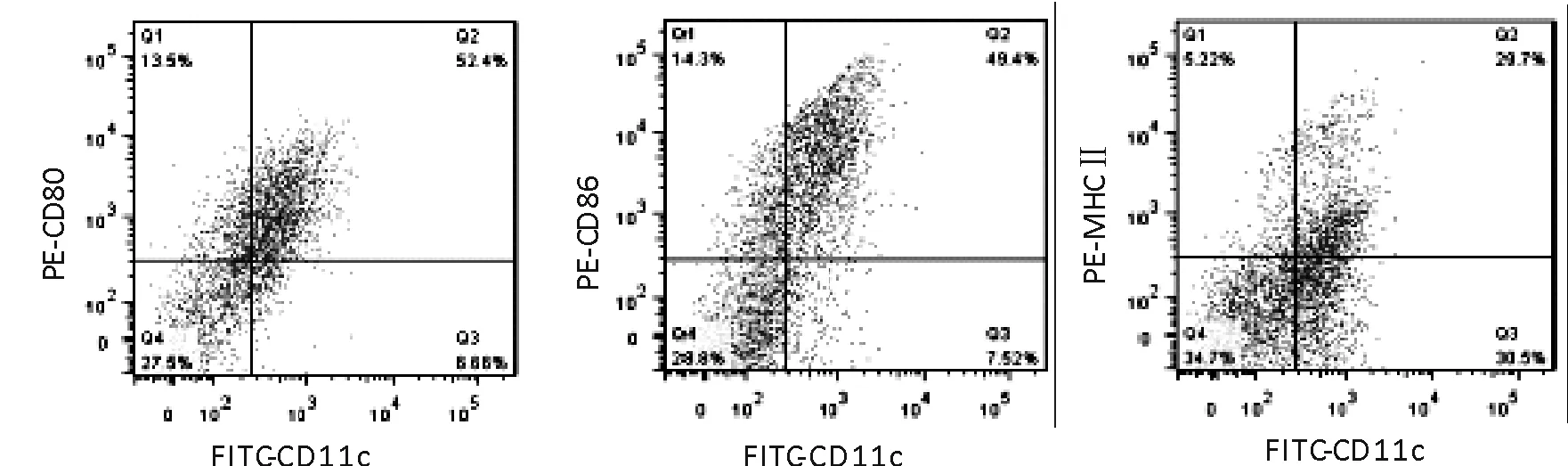
图2 流式细胞术分析树突状细胞表型
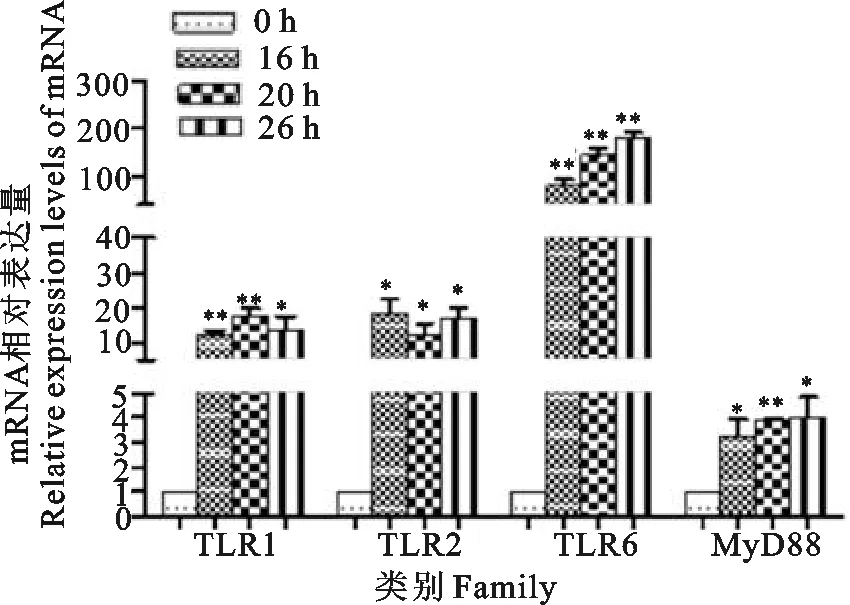
**表示与0 h相比差异极显著(P<0.01),*表示与0 h相比差异显著(P<0.05)
**indicates extremely significant difference compared with 0 h(P<0.01),*indicates significant difference compared with 0 h(P<0.05)
图3S.equi感染BMDCs不同时间后TLRs和MyD88 mRNA相对表达量
Fig.3Relative expression levels of TLRs and MyD88 mRNA in BMDCs at different time intervals afterS.equiinfection
2.3S.equi对BMDCs IL-1、IL-6、IL-10、IL-12和TNF-α mRNA表达的影响
采用 SYBR GreenⅠ实时荧光定量PCR分别检测S.equi感染小鼠BMDCs后16、26 h组及未感染组IL-1、IL-6、IL-10、IL-12和TNF-α mRNA转录水平。结果见图4,IL-1在S.equi感染小鼠BMDCs后16、26 h的表达量较未感染组没有变化(P>0.05)。IL-6在S.equi感染小鼠BMDCs后16 h的表达显著高于未感染组(P<0.05),感染后26 h的表达较未感染组没有变化(P>0.05)。IL-10在S.equi感染小鼠BMDCs后16、26 h的表达极显著高于未感染组(P<0.01)。IL-12在S.equi感染小鼠BMDCs 后16 h的表达较未感染组没有变化(P>0.05),但感染后26 h的表达显著高于未感染组(P<0.05)。TNF-α在S.equi感染小鼠BMDCs后16、26 h的表达量高于未感染组,感染后16 h的表达显著高于未感染组(P<0.05),感染后26 h的表达极显著高于未感染组(P<0.01)。
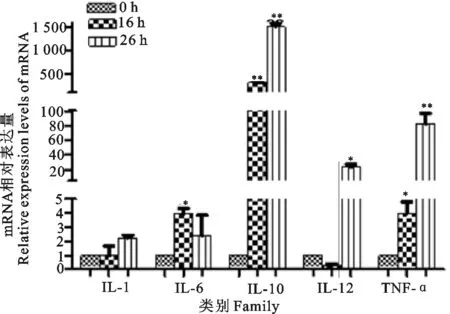
**表示与0 h相比差异极显著(P<0.01),*表示与0 h相比差异显著(P<0.05)
**indicates extremely significant difference compared with 0 h(P<0.01),*indicates significant difference compared with 0 h(P<0.05)
图4S.equi感染BMDCs不同时间后细胞因子 mRNA相对表达量
Fig.4Relative expression levels of cytokines mRNA in BMDCs at different time intervals afterS.equiinfection
3 讨论
高等动物的免疫防御机制主要由天然免疫和获得性免疫两个部分组成。天然性免疫系统可以快速识别病原体,并以非特异性的方式抵御外来感染;获得性免疫系统则以体液免疫或细胞免疫的方式来清除病原微生物。TLRs作为一种最具代表性的PRRs在识别病原微生物的过程中起着至关重要的作用。TLRs胞外区富含多个重复的亮氨酸序列,可识别病原体的PAMPs,经过跨膜区后将信号传递给胞内区。胞内区存在一段与IL-1受体胞内区高度同源的序列,被称为Toll/IL-1(TIR)区域,该区域可与下游同样具有TIR结构域的MyD88(myeloid differentiation factor 88,MyD88)相互作用,激活NF-κB(nuclear factor-kappa B,NF-κB)或者AP-1(activator protein-1,AP-1),诱导细胞因子的分泌[9]。因此,了解S.equi是否介导TLRs途径传递信号对探明S.equi的感染机制有重要意义。
本研究发现,S.equi感染小鼠BMDCs后8、32 h时,TLR1、2、6、MyD88的表达量没有变化(此部分数据未表示出来),但感染后16、20、26 h,TLR1、TLR2、TLR6和MyD88的表达量较未感染组均显著或极显著升高(P<0.05或P<0.01),说明DCs的TLRs可以识别S.equi的PAMPs,导致接头蛋白MyD88的激活,调控下游信号的转导,这与许多其他链球菌的试验结果是一致的[10-11]。
TLRs不仅在天然免疫中发挥作用,而且还在调节获得性免疫中扮演重要的角色[12-13]。DCs是体内功能最强的抗原递呈细胞(antigen-presenting cell,APC),当未成熟DCs的TLRs识别特异的PAMPs后,可以通过上调主要组织相容性抗原复合物(major histocompability complex,MHC)和共刺激分子,促进DCs成熟,分泌不同的细胞因子,激活Th0细胞分化成Th1型、Th2型等各种不同的免疫效应细胞[14]。
IL-1为促炎性细胞因子,在介导机体炎症反应中起到关键作用,可以增强NK细胞和B细胞的活性,并在一定程度上反映细胞的受损情况[15]。IL-6能调节多种细胞的生理功能,可以刺激B细胞产生免疫球蛋白,促进T细胞的增殖与分化[16]。IL-10作为一种抗炎性细胞因子,可以抑制Th1细胞产生干扰素、TNF-α、IL-1等细胞因子,抑制炎症反应,维持机体免疫平衡,并且在抑制细胞免疫的同时能有效地提高B细胞活性,促进体液免疫[17]。IL-12是一种非常重要的诱导Thl型免疫应答的细胞因子,能够抵抗细胞内部的病原菌[18]。TNF-α是一种具有双重功能的细胞因子,在调节机体免疫和抗感染等方面具有重要作用,但TNF-α的过度表达会导致机体组织坏死[19]。本试验结果表明,S.equi感染小鼠BMDCs后16、26 h,IL-10 mRNA水平极显著高于未感染组,并与时间呈正相关关系。感染期IL-10分泌量升高会抑制树突状细胞的活化,产生一定的免疫抑制反应,减缓对细菌的清除,这可能是机体难以清除S.equi的免疫学机制之一。本试验还观察到感染S.equi16、26 h后,IL-6、IL-12、TNF-α的分泌量有所增加,暗示在抵抗S.equi感染中,细胞免疫也发挥了作用,但可能以IL-10介导的体液免疫为主。有研究表明,猪链球菌感染树突状细胞16 h后,通过TLRs-MyD88途径大量分泌IL-1β、IL-6、IL-10、IL-12p70、TNF-α,猪链球菌诱导促炎性因子的过度表达,引发了IL-10的上调来抑制炎性因子的产生,这是细胞的一种自我保护反应[20]。
本研究通过SYBR Green Ⅰ实时荧光定量PCR检测数据,发现S.equi感染DCs可引起TLR1、TLR2、TLR6、MyD88及细胞因子IL-1、IL-6、IL-10、IL-12、TNF-α mRNA转录水平的变化,说明TLRs介导的信号通路参与了S.equi感染DCs的过程,可为研究马腺疫链球菌的致病机制奠定理论基础。
[1]Lemaitre B,Nicolas E,Michaut L,et al.The dorsoventral regulatory gene cassette spatzle/Toll/cactus controls the potent antifungal response inDrosophilaadults [J].Cell,1996,86(6):973-983.
[2]Kawai T,Akira S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J].Nat Immunol,2010,11(5):373-384.
[3]Takeuchi O,Akira S.Pattern recognition receptors and inflammation[J].Cell,2010,140(6):805-820.
[4]Banchereau J,Steinmanr M.Dendritic cells and the control of immunity[J].Nature,1998,392(6673):245-252.
[5]Reis S C,Sher A,Kaye P.The role of dendritic cells in the induction and regulation of immunity to microbial infection[J].Curr Opin Immunol,1999,11(4):392-399.
[6]Mogensen T H,Berg R S,Ostergaard L,et al.Streptococcuspneumoniaestabilizes tumor necrosis factor alpha mRNA through a pathway dependent on p38 MARK but independent of Toll-like receptors[J].BMC Immunol,2008,9(52):1471-2172.
[7]Graveline R,Segura M,Radzioch D,et al.TLR2-dependent recognition ofStreptococcussuisis modulated by the presence of capsular polysaccharide which modifies macrophage responsiveness[J].Int Immunol,2007,19(4):375-389.
[8]杜润慈,刘建华,史茜,等.TLRs介导的信号通路在马链球菌感染RAW264.7细胞中的作用[J].中国畜牧兽医,2016,43(5):1270-1276.
[9]Takeda K,Kaisho T.Toll-like receptors[J].Annu Rev Immunol,2003,21(1):335-376.
[10]Zheng H,Luo X,Segura M,et al.The role of toll-like receptors in the pathogenesis ofStreptococcussuis[J].Vet Microbiol,2012,156(1-2):147-156.
[11]Fieber C,Janos M,Koestler T,et al.Innate immune response toStreptococcuspyogenesdepends on the combined activation of TLR13 and TLR2[J]. PLoS One,2015,10(3):e0119727.
[12]Akira S,Akeda K,Kaisho T.Toll-like receptors:critical proteins linking innate and acquired immunity[J].Nat Immunol,2001,2(8):675-680.
[13]Medzhitov R.Toll-like receptors and innate immunity[J].Nat Rev Immunol,2001,1(2):135-145.
[14]Sharma S,Benjamin R,Nathalie G,et al.Triggering the interferon antiviral response through an IKK-related pathway[J].Science,2003,300(5622):1148-1151.
[15]Greaney A J,Leppla S H,Moayeri M.Bacterial exotoxins and the inflammasome[J].Front Immunol,2015,10(6):570.
[16]严琳.猪白细胞介素2(pIL-2)与猪白细胞介素6(pIL-6)的基因表达及作为疫苗佐剂的研究[D]. 湖北武汉:华中农业大学,2005.
[17]Liu B,Tonkonogy S L,Sartor R B.Antigen-presenting cell production of IL-10 inhibits T-helper 1 and 17 cell responses and suppresses colitis in mice[J].Gastroenterology,2011,141(2):653-662.
[18]佘志成,范红结,李春林,等.副猪嗜血杆菌外膜蛋白P5对豚鼠树突状细胞成熟及功能影响[J].畜牧兽医学报,2011,42(7):967-973.
[19]Huang B,Zhang L,Du L.Molecular characterization and functional analysis of tumor necrosis factor receptor-associated factor 2 in the Pacific oyster[J].Fish Shellfish Immunol,2015,24(11):1050-4648.
[20]Lecours M P,Sequra M,Lachance C,et al.Characterization of porcine dendritic cell response toStreptococcussuis[J].Vet Res,2011,2(42):1186-1297.
Effects ofStreptococcusequion mRNA Expressions of
TLR1,TLR2,TLR6,MyD88 and Cytokines in Dendritic Cells
DU Run-ci, RAN Duo-liang, LI Jing, FU Qiang, LIU Jian-hua
(CollegeofVeterinaryMedicine,XinjiangAgriculturalUniversity,Urumqi,Xinjiang,830052,China)
To study the effects ofStreptococcusequisubspequi(S.equi) on the mRNA expressions of TLR1,TLR2,TLR6,MyD88,IL-1,IL-6,IL-10,IL-12 and TNF-α in mouse bone marrow derived dendritic cells (BMDCs) culturedinvitro,Naive DCs were cultured with GM-CSF and IL-4,SYBR Green Ⅰfluorescence quantitative PCR was used to detect mRNA transcriptional levels of TLRs,MyD88 and cytokines after infection withS.equiabout 16,20,26 h.The results showed that at 16,20,26 h post-infections,the expression levels of TLR1,TLR2,TLR6 and MyD88 inS.equiinfected BMDCs were significantly or extremely significantly higher than those of the negative control group (P<0.05 orP<0.01 ).At 16,26 h post-infections,the concentration of IL-1 had no obviously change (P>0.05),IL-10,TNF-α were significantly or extremely significantly increased than those of the negative control group (P<0.05 orP<0.01).IL-6 was significantly increased at 16 h post-infection (P<0.05),however,it had no change at 26 h post-infection (P>0.05).At 16 h post-infection,the concentration of IL-12 had no obviously change (P>0.05),while at 26 h post-infection,it was significantly increased (P<0.05). These results indicated thatS.equiwas able to regulate the mRNA expressions of TLRs,MyD88 and cytokines,which mediated immune responses.
Streptococcusequisubsp.equi;dendritic cell;Toll-like receptor;cytokine
2016-03-04
国家科技支撑计划项目(2012BAD46B00)
杜润慈(1991-),女,新疆乌鲁木齐人,硕士研究生,主要从事动物传染病诊断与防治的研究。*通讯作者
S852.611
A
1007-5038(2016)10-0016-05
