m TOR通路在PTSD杏仁核细胞凋亡进程中的作用研究*
2016-10-20林张良沈秋星吴仲敏
林张良,沈秋星,吴仲敏
(台州学院 医学院,浙江 台州 318000)
m TOR通路在PTSD杏仁核细胞凋亡进程中的作用研究*
林张良,沈秋星,吴仲敏*
(台州学院医学院,浙江台州318000)
创伤后应激障碍(PTSD)杏仁核神经元萎缩,体积变小,存在明显的细胞凋亡现象。许多研究报道哺乳动物雷帕霉素靶蛋白(m TOR)信号通路与杏仁核神经元的凋亡有密切关系,m TOR通过调节细胞周期、蛋白质合成、细胞能量代谢等影响PTSD杏仁核细胞的调亡进程,通过靶向干预m TOR信号通路关键分子有望减缓PTSD杏仁核细胞凋亡,达到有效抗PTSD效果。
PTSD;m TOR信号通路;杏仁核神经元;凋亡
当今社会,伴随自然灾害、交通意外、战争、恐怖事件等应急事件的日趋增多,创伤后应激障碍(posttraumatic stress disorder,PTSD)的患者越来越多[1],但其具体发病机制仍未阐明[2]。许多研究均报道PTSD杏仁核神经元数量不断减少,出现明显的细胞凋亡和自噬现象[3-4],而哺乳动物雷帕霉素靶蛋白(Mammalian target of rapam ycin,m TOR)信号通路[5-6]从中起着重要作用。本文就m TOR通路在PTSD杏仁核细胞凋亡进程中的作用作一综述。
1 m TOR基因的结构
m TOR是一类广泛存在于各类细胞中的蛋白激酶[7]。人的m TOR基因的分子量为289ku,由2549个氨基酸构成,位于1号染色体短臂(1p36.2)上。m TOR分子的氨基端存在20个串联重复序列,每个序列都包含了2个由40个氨基酸残基结合成的α螺旋结构,一个α螺旋结构由1个亲水基团和1个疏水基团构成[8,9,10],其作用是介导蛋白质之间的相互传导,m TOR分子的羧基端是和磷脂酰肌醇激酶(PI3K)有着高度同源性的催化结构域,在羧基末端有FATC(the focal adhesion targeting domain of C-term inal,FATC)和NRD(negative regulatory domain,NRD)两个结构域[8],其中FATC域主要决定m TOR的活性,FATC域中任何一个氨基酸残基的替换或缺失都会致m TOR丧失催化活性,
NRD域位于FATC域和激酶催化域之间,起着重要的负反馈调节作用[8,9,10]在m TOR不同的结构域部位可以和不同的蛋白质结合,形成的复合物主要是m TOR-Raptor复合物和m TOR-Richtor复合物。
2 m TOR信号通路的上、下游调控分子
m TOR信号通路由2条上游调控途径和2条下游调控途径组成(见图1)。m TOR的生物活性主要受PI3K/Akt/m TOR信号通路和LKB1/AMPK/m TOR信号通路的调节。m TOR在上游信号分子作用下被磷酸化激活,活化的m TOR主要通过真核细胞始动因子4E结合蛋白1(4E binding protein,4EBP1)和核糖体S6蛋白激酶1(S6 kinase,S6K1)通路,分别调控特定亚组的mRNAs翻译[8,9] 。
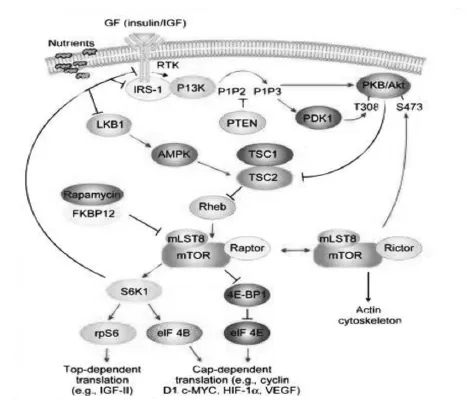
图1 m TOR 信号通路的上、下游调控分子
3 m TOR信号通路在PTSD杏仁核神经元凋亡进程中的作用
3.1PTSD杏仁核神经元凋亡增强
创伤后应激障碍杏仁核神经元萎缩,体积变小,杏仁核的活动量与症状的严重程度呈正相关[1,12,14]。近来的研究显示PTSD杏仁核存在明显的细胞凋亡现象。流式细胞术检测结果表明,PTSD杏仁核神经元凋亡率明显升高[13];透射电镜[14]下发现杏仁核神经元细胞核萎缩,核染色质浓缩,分布于核的边缘,呈新月形,核中心区染色质溶解,核膜皱缩,胞质内线粒体模糊,内质网断裂,偶见结构不完整的粗面内质网残留,提示PTSD大鼠杏仁核神经元发生了明显的细胞凋亡;应用免疫组化和蛋白印迹方法检测凋亡相关蛋白均发现PTSD大鼠杏仁核神经元凋亡增强[15,16]。
3.2m TOR信号通路在PTSD杏仁核神经元凋亡进程中的作用
目前研究表明,在介导杏仁核细胞凋亡的众多信号转导途径中,以PI3K/AKT/m TOR信号转导途径尤为重要[17],该通路活化可以抑制PTSD诱发的杏仁核细胞凋亡。Akt和m TOR是Akt/m TOR信号通路的关键分子,Akt又称蛋白激酶B(PKB),其磷酸化可激活其下游的m TOR与靶受体之间的相互作用并产生一系列的级联反应,从而参与调控细胞的增殖、生长与凋亡等多种生物效应。
正常的杏仁核内PI3K处于静息状态,且普遍存在于胞质中,当杏仁核神经元PI3K/AKT/m TOR信号被激活后,PI3K便从胞质会聚到胞膜上,PI3K会聚到一定程度便会激活AKT蛋白,激活后的AKT蛋白可以作用于其下游的m TOR分子,并使其产生生物活性。活化的m TOR分子调控着真核细胞始动因子4E结合蛋白1(4E-BP1)和核糖体S6蛋白激酶(S6K)2条不同的下游通路。4EBP1主要是和真核细胞翻译启动因子4E(elF-4E)相结合,对蛋白的翻译起抑制作用。4EBP1经m TOR作用磷酸化后,从elF-4E中释放出来,其翻译抑制作用减弱。同时由于4EBP1的不断释放,elF-4E的表达作用增强,促使某些特定蛋白的翻译加强,加速细胞的生长和分裂。而核糖体S6蛋白与S6K相互作用后,S6蛋白磷酸化活性增高,使含嘧啶基因的m RNA的翻译功能增强,一些特定的翻译调节蛋白以及核糖体蛋白翻译编码增多[8,9,10]。最新研究表明,在PTSD大鼠的杏仁核内人第10号染色体缺失的磷酸酶及张力蛋白同源基因(Phosphatase and tensin homologue deleted on chromosome 10,PTEN)[8,9,10]表达明显增高,而p-Akt和p-m TOR却较正常情况明显降低,因PTEN能去除PIP3的3′磷酸而将其转变为PI(4,5)P2而降解,从而阻断了下游效应分子m TOR的有效活化,造成m TOR的磷酸化水平降低,低水平的磷酸化m TOR能直接抑制下游的2条传导通路,进而抑制特定亚组mRNA的翻译活动,造成相关蛋白的合成减少,对杏仁核神经元凋亡的抑制作用减弱,导致杏仁核神经元凋亡增加,同时m TOR活性的抑制激活了调控细胞凋亡的信号调节蛋白激酶1(apoptosis signal-regulating kinase 1,ASK1),其与一种受m TOR调控的自噬分子FIP200(focal adhesion kinase interacting protein of 200 KD,FIP200)相互作用促进杏仁核细胞凋亡的发生[18]。
4 展望
已有的研究表明,m TOR信号通路参与了PTSD杏仁核细胞凋亡进程,通过抑制m TOR信号通路可在一定程度上减缓PTSD症状,甚至逆转PTSD杏仁核神经元的病理改变,然而,活化的m TOR具体通过哪条途径调控杏仁核细胞的凋亡,以及如何通过精准干预m TOR信号通路来防治PTSD等有待深入研究。
[1]耿菲,刘昊,王海涛,等.创伤后应激障碍大鼠杏仁核神经元Akt和m TOR磷酸化降低[J].承德医学院学报,2014, 31(5):382-384.
[2]North CS,Pfefferbaum B,Kaw asaki A,et al.Psychosocial adjustment of directly exposed survivors 7 years after the Oklahoma City bombing[J].Compr Psychiatry,2011,52(1):1-8.
[3]Petersen T,Elk lit A,Olesen JG.Victim ization and PTSD in a Faroese youth total-population samp le[J]. Scand J Psychol,2010,51(1):56-62.
[4]Xiao B,Yu B,Wang HT,et al.Single-prolonged stress induces apoptosis by activating cytochrome C/ caspase-9 pathw ay in a rat model of posttraumatic stress disorder[J].Cell M ol Neurobiol,2011,31(1):37-43.
[5]吴苗苗,苑玉和,陈乃宏.m TOR信号通路与神经退行性疾病研究进展[J].中国药理学通报,2011,27(11):1481-1483.
[6]马金赫,王德莹,陈秀慧.PI3K/AKT/m TOR和MAPK信号通路与子宫内膜异位症的研究进展[J].现代妇产科进展, 2015,24(1):78-80.
[7]Latres E,Am inl A R.Arakfi A A,et al.IGF-1 inversely regu-lates a-trophy-induced genes via the PI3K/ Akt/m TOR pathw ay[J].J Biol Chem,2005,280:2737-2744.
[8]马大鹏,肖建华,肖晖.m TOR在 TLR信号通路中对前炎症细胞因子表达的调控机制研究[D].衡阳:南华大学病原生物学研究所,2013:8-10.
[9]王泽宋,谭文松.Park Tai Hyun.家蚕30K基因对CHO细胞抗凋亡和促进目的产物表达的作用及其机制 [D].上海:华东理工大学,2012:1-3.
[10]朱荣,丁厚中.应用组织芯片技术检测m TOR和VEGF在结肠癌中的表达[J].中国现代手术学杂志,2012,16(4):241-244.
[11]Golub Y,Kaltw asser SF,Mauch CP,et al.Reduced hippocam pus volume in the mouse model of Posttraumatic Stress Disorder[J].J Psychiatr Res,2011,45(5):650-659.
[12]肖冰,韩芳,石玉秀.PTSD 样情感行为异常大鼠杏仁核Caspase 9的改变[J].中国组织化学与细胞化学杂志, 2010,19(1):6-10.
[13]Schmahl C,Berne K,Krause A,et al.Hippocam pus and am ygdala volumes in patients w ith borderline personality disorder w ith or w ithout posttraumatic stress disorder[J].J Psychiatry Neurosci,2009,34(4):289-295.
[14]丁金兰,韩芳,石玉秀.创伤后应激障碍大鼠杏仁核神经元凋亡及三偏磷酸酶活性的变化[J].解剖学杂志,2009,32 (1):19-22.
[15]李岩,赵萌萌,郑梦梦.PTSD样大鼠杏仁核神经元形态改变及凋亡机制[J].中国实用医药,2010,5(14):101-102.
[16]Saiki S,Sasazawa Y,Imam ichi Y,et al.Caffeine induces apoptosis by enhancement of autophagy via PI3K/ Akt/m TOR/p70S6Kinhibition[J].Autophagy,2011,7(2):176-187.
[17]Granville CA,Memmott RM.Gills JJ.et al.Handicapping the race to develop inhibitors of the phosphoinositide 3-kinase/Akt/mammalian target of rapamycin pathway[J].Clin Cancer Res,2006,(3 pt 1):679-689.
[18]Kuo JR,Kaloupek DG,Woodw ard SH.Amygdala volume in combat-exposed veterans w ith and w ithout posttraumatic stress disorder:a cross-sectional study[J].Arch Gen Psychiatry,2012,69(10):1080-1086.
Effect of m TOR pathway on Apoptosis of PTSD Cells in Am ygdala*
LIN Zhangliang,SHEN Qiuxing,WU Zhongm in*
(School of Medicine,Taizhou University,Taizhou 318000,China)
Ow ing to posttraumatic stress disorder(PTSD),am ygdala neurons atrophy and small volume,there is obvious phenomenon of apoptosis.Many studies have reported that the mammalian target of rapam ycin(m TOR) signaling pathw ay has a close relationship w ith the apoptosis of am ygdala neurons.m TOR regulates apoptosis in PTSD cells through regulating cell cycle,protein synthesis,and cell energy metabolism,and PTSD signaling pathw ay is expected to slow down the apoptosis of PTSD cells in the m TOR signaling pathw ay.
PTSD;m TOR signaling pathway;amygdalaneurons;apoptosis
10.13853/j.cnki.issn.1672-3708.2016.03.009
(责任编辑:耿继祥)
2015-10-18;
2015-11-11
浙江省科技厅公益性技术应用项目(2014C37026)
简介:吴仲敏(1966-),男,浙江临海人,副教授,硕士,主要从事人体形态学研究。
