孟鲁司特中间体酶促转化反应的HPLC测定方法
2016-10-20沈露梦钟永军施珊珊周超阳杨仲毅
沈露梦,钟永军,施珊珊,周超阳,杨仲毅
(台州学院 生命科学学院,浙江 台州 318000)
孟鲁司特中间体酶促转化反应的HPLC测定方法
沈露梦,钟永军,施珊珊,周超阳,杨仲毅*
(台州学院生命科学学院,浙江台州318000)
建立了孟鲁司特中间体酶促转化反应中底物和产物浓度变化的HPLC测定方法。采用C18反相色谱柱,以乙腈和0.1%磷酸(80:20)为流动相,检测波长为225 nm。结果表明,底物和产物浓度在50~400μg/m l范围内线性关系良好,适用于孟鲁司特中间体酶促反应的监控。
孟鲁司特中间体;酮还原酶;生物催化;高效液相色谱
孟鲁司特(Montelukast),中文商品名顺尔宁(英文商品名Singulair),是美国默克公司最早研发的一种白三烯受体拮抗剂,通过竞争性地结合I型半胱氨酰白三烯受体,进而有效控制哮喘症状[1,2]。临床上,孟鲁司特主要被用于治疗阿司匹林过敏性哮喘、运动性哮喘和季节性过敏性鼻炎等[3]。
2012年,孟鲁司特全球销售额达到43.8亿美元(http://www.evaluategroup.com)[4],其化合物专利EP480717B已于2012年到期[5],因而给国内的相关企业生产孟鲁司特提供了机会。为减少生产成本,许多生产厂家采用生物催化法合成孟鲁司特的关键中间体化合物1(图1)[6],取代原工艺中成本高、污染大且需高温高压的化学合成步骤[7]。

图1 酮还原酶催化的转化反应Fig.1 Transformation Catalyzed by Ketone Reductase
1的检测方法有手性和非手性两种,其酶促转化过程的优化及工业化开发更多的用到非手性HPLC检测方法。文献报道的非手性HPLC方法或者分析时间较长,如乐庸堂[8]等人采用HPLC方法样品分析时间需要30 m in,且未说明测定的具体条件;或者需要进行梯度洗脱,如Liang[6]等人采用4.5×50 mm C18短色谱柱,梯度洗脱方法测定1和2,出峰时间分别为4.4 m in和5.7 m in。本文报道利用常规HPLC和等度洗脱的分析方法,可以在12 m in内完成分析,且能同时测定反应液中产物1和底物2的浓度变化。
1 仪器与试药
LC3000型HPLC系统(北京创新通恒科技有限公司),配备P3000高压输液泵,UV3000紫外/可见波长检测器,KNAUER Dynam ic Mixing Chamber,RPL-D2000型柱温箱。
1、2对照品由浙江天宇药业提供,批号分别为140801和140803,含量分别为99.83%和99.65%;酮还原酶酶液来源于表达酮还原酶的大肠杆菌的全细胞裂解液,该菌种由本实验室保藏;无水乙醇、DMSO、硫酸镁、异丙醇、三乙醇胺、乙腈、磷酸、辅酶II购自国药集团或上海生工。
2 方法与结果
2.1对照品溶液配制
1、2对照品溶液:准确称取适量1和2对照品,分别先用无水乙醇和DMSO溶解,再用无水乙醇稀释制成1000μg/m L的贮存液,临用时直接用无水乙醇将贮存液稀释到所需浓度。
2.2色谱条件
色谱柱为Cosmosil 5C18-MS-II(4.6×250 mm,5μm),流动相为乙腈和0.1%磷酸(80:20),柱温40℃,流速1.0 m L/m in,检测波长225 nm,进样量20μL。
2.3专属性及系统适用性试验
取1、2对照品储存液按体积比1:1混匀,按2.2节色谱条件进行HPLC检测,典型的色谱结果见图2。结果显示,1、2的保留时间分别是6.346 m in和10.977 m in,理论塔板数分别为8911和11808,相互分离度为22.55,表明按2.2条件操作的HPLC分离效果良好。

图2 典型HPLC色谱图Fig.2 Typical HPLC Chromatogram
2.4线性试验
分别取50、100、150、200、250、300、350、400、450、500μg/m L的1、2对照品液进行HPLC测定。以1、2的浓度c(μg/m L)对峰面积A进行线性回归,典型的1、2的回归方程分别为:A=8×107c-81908,r= 0.998;A=9×107c+53364,r=0.997。结果表明,在50~400μg/m L浓度范围内,1、2的峰面积与浓度的线性关系良好。
2.5精密度试验
取1和2对照品溶液稀释到50、200、400μg/m L,分别重复进行HPLC测定5次,计算得1、2的RSD分别为0.43%、0.50%、0.58%和0.84%、1.02%、1.85%,表明1、2的HPLC检测结果的准确性良好。
2.6稳定性试验
分别取1、2对照品溶液,其中一管放置在4℃,另一管放置在25℃,并分别于0、3、6、9、16.5 h取样,以无水乙醇稀释3倍后进行HPLC测定。结果显示,在25℃条件下,1在6 h内稳定,其RSD为0.54%;2 在3 h内稳定,其RSD为0.12%。而在4℃条件下,1、2在16.5h内都稳定,其峰面积的RSD分别为0.92% 和0.77%。以上结果表明,温度对1和2的稳定性影响很大,低温可以有效增加1和2的稳定性。
2.7回收率试验
取酶促反应液样品10 m L,加入无水乙醇10 m L后混匀,于4℃ 10000 r/m in离心10 m in,上清取样以无水乙醇稀释100倍后进行HPLC测定,另取上清液各1.0 m L,分别加入6.3 mg 1和4.9 mg 2,分别取样测定3次,计算得1、2的平均回收率分别为104.1%和100.3%,RSD分别为1.5%和0.51%。
2.8酶促转化反应及反应液的HPLC测定
取200 mg 2,依次加入1 m L异丙醇,0.6 m L的三乙醇胺缓冲液(0.1 mol/L,pH 8.5),1.5μL 1.0 mol/L的MgSO4溶液、2.0 mg还原型辅酶II、0.4 m L酮还原酶酶液于5 m L离心管中混匀,在45℃,170 r/m in的恒温培养箱中反应。在反应不同时间取样,用无水乙醇稀释200倍,10000 r/m in离心2 m in,上清分别进行HPLC测定,结果见图3。虽然1和2的溶液在25℃条件下存在不稳定性,但根据HPLC测定,酶促反应过程中底物2不断向产物1转化,反应结束后转化率可以达到99%以上,说明反应过程中1和2降解较少。这可能与酶促反应采取的非均相体系有关,反应过程中大部分底物和产物处于固相状态,减少了破坏。
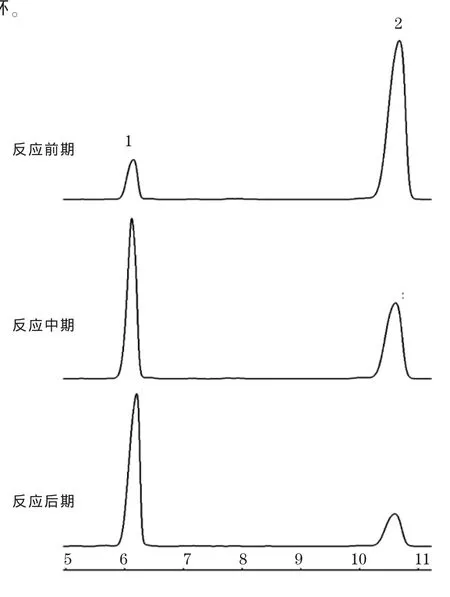
图3 转化过程检测Fig.3 Detection along w ith Transformation Process
3 讨论
本文研究过程中发现,底物2在无水乙醇中溶解度较小,而在DMSO中溶解度较大;产物1在无水乙醇中溶解度较大,而在DMSO中溶解度较小。为了保证产物1的检测灵敏性,我们只在配置底物2贮存液时用DMSO,而产物1的溶解和转化反应液的稀释都用无水乙醇。此外,本研究曾使用过乙腈和0.1%磷酸的配比为60:40时,底物和产物的保留时间分别为20.673和14.510 m in;乙腈和0.1%磷酸的配比为70:30时,底物和产物的保留时间分别为13.972和8.664 m in。上述结果表明,适当增加流动相中有机溶剂的比例可以有效缩短底物和产物的保留时间,同时不影响底物和产物的分离检测效果,进而可以提高HPLC的检测效率。
化合物1虽然是孟鲁司特的手性中间体,但对于工艺开发过程,非手性HPLC具有更大的实用价值。本文结果同时表明,常规的HPLC方法可以对孟鲁司特中间体的生物催化过程提供监控和指导作用。
[1]King AO,Corley EG,Anderson RK,et al.An efficient synthesis of Ltd4 antagonist L-699,392[J].J Org Chem,1993,58(14):3731-5.
[2]Zhang HP,Jia CE,Lv Y,et al.Montelukast for prevention and treatment of asthma exacerbations in adults: systematic review and meta-analysis[J].A llergy Asthma Proc,2014,35(4):278-87.
[3]武玉清.白三烯受体拮抗剂孟鲁司特的研究进展 [J].国外医学:药学分册,2003,30(5):284-7.
[4]http://www.evaluategroup.com/Universal/View.aspx?type=Entity&entityType=Product&lType=modData&id= 19133&componentID=1002#&&_View Args=%7b%22_EntityType%22%3a2%2c%22_Parameters%22%3a%7b% 22_ContextData%22%3a%22%7b%5c%22com ponentID%5c%22%3a%5c%221003%5c%22%2c%5c%22item ID%5c%22%3a%5c% 228709%5c%22%2c%5c%22lType%5c%22%3a%5c%22modData%5c%22%2c%5c%22pgaName%5c%22%3a%5c%22%5c%22%2c% 5c%22reportingCurrency%5c%22%3a%5c%22%5c%22%2c%5c%22sceName%5c%22%3a%5c%22%5c%22%2c%5c%22tab Id% 5c%22%3a%5c%22%5c%22%2c%5c%22conceptTab%5c%22%3a%5c%22%5c%22%7d%22%7d%2c%22_Type%22%3a3%7d
[5]Leger S,Roy P,Xiang YB,et al.Unsaturated hydroxyalkyquinoline acids as leukotriene antagonists:EP, 480717B[P].1992-04-15.
[6]Liang J,Lalonde J,Borup B,et al.Development of a biocatalytic process as an alternative to the(-)-DIP-Clmediated asymmetric reduction of a key intermediate of montelukast[J].Org Process Res Dev,2010,14(1):193-8.
[7]Zhao MZ,King AO,Larsen RD,et al.A convenient and econom ical method for the preparation of DIPChloride(TM)and its app lication in the asymmetric reduction of aralkyl ketones[J].Tetrahedron Lett,1997,38 (15):2641-4.
[8]乐庸堂,鞠鑫.一种生物法制备孟鲁斯特中间体的方法[P].中国专利:103710405,2014-04-09.
HPLC M ethod for Analyzing Enzamatic Transformation of M ontelukast Intermediate
SHEN Lumeng,ZHONGYongjun,SHI Shanshan,ZHOU Chaoyang,YANG Zhongyi*
(School of Life Science,Taizhou University,Taizhou 318000,China)
HPLC method w as established to analyze enzamatic transformation of montelukast intermediate.The column was Cosmosil 5C18-MS-II,the mobile phase was acetonitrile and 0.1%phosphoric acid(80:20),and the detection w avlength w as 225 nm.The results indicates that both the substrate and product of the enzymatic transformation show good linear relation at the range of 50~400μg/m l,and the method is suitable for the control of enzymatic transformation of montelukast intermediate.
Montelukast intermediate;Ketone reductase;Biocatalyst;HPL
10.13853/j.cnki.issn.1672-3708.2016.03.004
(责任编辑:耿继祥)
2015-10-13;
2016-03-21
简介:杨仲毅(1971-),男,浙江台州人,高级工程师。
