昆虫Allatostatin神经肽的生物信息学分析
2016-10-19常菊花何月平
常菊花 何月平


摘要:根据已报道的昆虫咽侧体抑制激素(Allatostatin,AS)神经肽序列,基于转录组和基因组学数据库,通过同源性比较分别查找到53、33、57和35种昆虫的AS-A、AS-B、AS-C和AS-CC前体氨基酸序列,并对这些AS前体序列进行系统发育树的构建及分析。结果表明,昆虫AS-A、AS-B、AS-C和AS-CC分别在各自的进化分支上,且AS-C和AS-CC之间的亲缘关系较近,AS-A是最早分化出来的。在4种AS的进化树中,不同种类昆虫间的亲缘关系不尽相同。其中在AS-C进化树中,除了膜翅目,完全变态类昆虫都在一个进化分支,而膜翅目和不完全变态类昆虫在一个进化分支。在AS-CC进化树中,发现鳞翅目和双翅目分别在一个进化分支上,而膜翅目、鞘翅目和不完全变态类昆虫在一个进化分支上。目前尚未找到鞘翅目昆虫的AS-A序列和膜翅目昆虫的AS-B序列。
关键词:昆虫;神经肽;生物信息学;系统进化树;Allatostatin
中图分类号:Q966 文献标识码:A 文章编号:0439-8114(2016)06-1566-06
DOI:10.14088/j.cnki.issn0439-8114.2016.06.052
昆虫神经肽通过激素或递质的形式调控着昆虫的生长发育、脱皮变态、滞育、代谢、生殖等多种发育过程[1]。由脑神经内分泌细胞分泌的神经肽类激素咽侧体活化激素(Allatotropin,AT)或咽侧体抑制激素(Allatostatin,AS)刺激或抑制咽侧体的保幼激素(Juvenile hormone,JH)的生物合成[2]。咽侧体合成的保幼激素在大多数昆虫中控制幼虫的生长、变态和成虫发育等重要生理过程[3]。AS神经肽广泛存在于各种昆虫中,最早是从太平洋折翅蠊(Diploptera punctata)的后脑复合体中分离出来[4],随后在多种昆虫中都分离出AS。目前,在昆虫中分离鉴定出4种AS神经肽类型(AS-A、AS-B、AS-C和AS-CC)[5]:①A型AS的酰胺化C末端有非常保守的五肽序列Y/FXFGL/I-amide。从太平洋折翅蠊中分离出来的AS神经肽序列就是A型,因此也叫蟑螂型AS,或FGLamide。②B型AS的特征是在多肽序列酰胺化C末端的2位和9位上有共同的色氨酸(Trp,W),最初从咖啡两点蟋(Gryllus bimaculatus)中分离出来[6],因此也称蟋蟀型AS,或W(X)6W-amide。该类神经肽因其具有抑制前胸腺活性,先前被称为myoinhibitory peptide(MIP)。③C型AS是一个含有15个氨基酸的单一多肽,其C末端为未酰胺化的五肽序列PISCF,首先从烟草天蛾(Manduca sexta)中分离出来[7],故也称蛾型AS,或PISCF型AS。④Allatostatin double C(AS-CC)是AS-C的旁系同源神經肽。先前与AS-C通称为类AS-C肽(AS-C like peptides),近年才被命名为AS double C(AS-CC)。AS-C和AS-CC的前体氨基酸序列C末端的2位和9位上有相同的半胱氨酸(Cys,C)组成一个二硫键。
AS神经肽的功能除抑制咽侧体内保幼激素的生物合成外,还影响昆虫的生长发育、生殖和行为等生理过程。由于神经肽在昆虫体内含量很低,因此昆虫神经肽分离工作进展迟缓,随着结构鉴定技术和肽分离技术的发展,鉴定的神经肽数目大大增加,特别是随着基因组学的发展,越来越多的昆虫神经肽序列可以被预测出来。因此,本研究根据现报道的昆虫AS神经肽序列,通过同源性比较来查找其他昆虫AS神经肽序列,并对昆虫AS神经肽家族进行进化分析,为昆虫AS神经肽的结构和功能分析提供理论基础。
1 材料与方法
1.1 昆虫Allatostatin神经肽家族氨基酸序列的查找
根据报道的黑腹果蝇(Drosophila melanogaster)[8],冈比亚按蚊(Anopheles gambiae)[9],意大利蜜蜂(Apis mellifera)[10],家蚕(Bombyx mori)[11],赤拟谷盗(Tribolium castaneum)[12],长红锥蝽(Rhodnius prolixus)[13],东亚飞蝗(Locusta migratoria)[14],湿木白蚁(Zootermopsis nevadensis)[14]和褐飞虱(Nilaparvata lugens)[15]的Allatostatin前体氨基酸序列作为参照,在NCBI数据库(http://www.ncbi.nlm.nih.gov/)、昆虫基因组和转录组资源库(http://www.insect-genome.com/)和水稻害虫转录组数据库(http://rptdb.hzau.edu.cn/)中采用TBLASTN查找其他昆虫可能的Allatostatin前体基因序列。采用ExPASy网站的翻译工具(http://web.expasy.org/translate/)对前体基因序列进行翻译,并逐一核对活性肽序列的同源性。
1.2 多序列联配和系统进化树构建
利用EMBL-EBI在线程序ClustalW2(http://www.ebi.ac.uk/Tools/msa/ clustalw2/)对蛋白序列进行多序列比对分析,利用BioEdit软件输出。使用MEGA5软件中的邻接法(Neighbor-joining)对蛋白序列构建系统进化树。其中,程序的重复次数(Number of bootstrap replications)设为1 000,替换方法(Substitution method)选择p-distance,空缺数据的处理方法(Gap data treatment)选择95%partial deletion,其他参数采用默认设置。
2 结果与分析
根据已报道的几种昆虫Allatostatin神经肽序列,通过BLAST查找其他昆虫Allatostatin神经肽序列,分别找到了53、33、57和35种昆虫Allatostatin A、Allatostatin B、Allatostatin C和Allatostatin CC氨基酸序列。通过预测神经肽的活性肽并进行序列比对,验证所查找的神经肽氨基酸序列。
从图1中可以看出,昆虫4种类型AS的神经肽前体序列分别在各自的进化分支上,且AS-C和AS-CC之间的亲缘关系较近,AS-A是最早分化出来的。
2.1 昆虫AS-A神经肽前体序列的进化树分析
51种昆虫的AS-A前体氨基酸序列分成两个进化分支,双翅目、膜翅目AS-A在一个进化分支上,鳞翅目、半翅目、等翅目、直翅目和蜚蠊目在另一个进化分支上(图2)。对这51种昆虫AS-A神经肽预测活性肽序列,发现C末端有3种情况,即F/YXFGL、F/YXFGI和F/YXFGV。其中所有昆蟲都有F/YXFGL,而F/YXFGI只在15种昆虫(分属膜翅目、半翅目、直翅目和等翅目)中发现,F/YXFGV只在4种昆虫[东亚飞蝗(L. migratoria)、沙漠蝗(S. gregaria)、双斑蟋(G. bimaculatus)和达尔文澳白蚁(M. darwiniensis)]中发现。AS-A前体序列的进化树构建结果基本符合昆虫形态学分类,除了体虱AS-A与完全变态类双翅目和膜翅目在一个进化分支上。目前尚未在鞘翅目中发现AS-A序列。
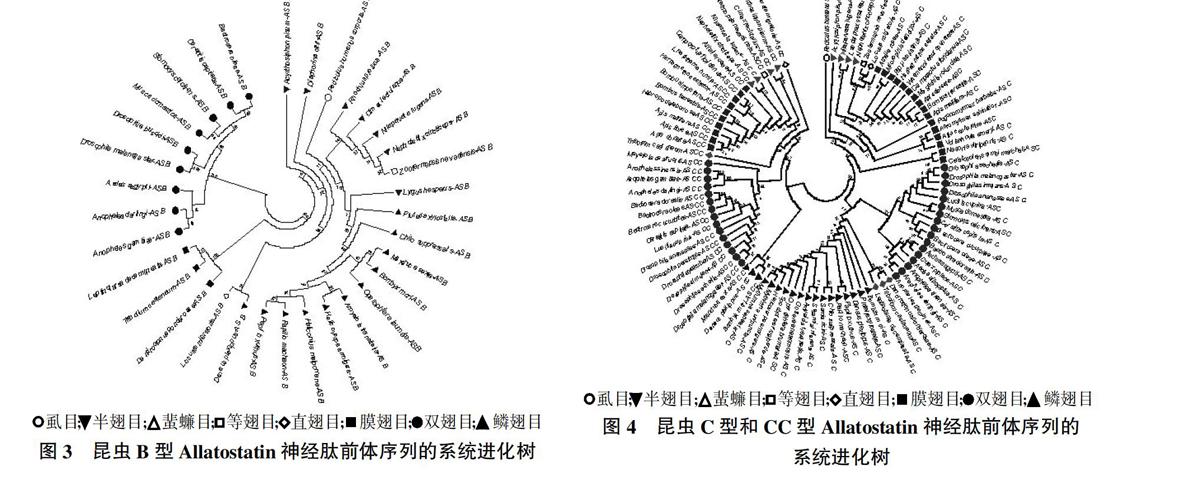
2.2 昆虫AS-B神经肽前体序列的进化树分析
由图3可以看出,双翅目在单独一个进化分支,鞘翅目、鳞翅目、半翅目、直翅目、等翅目和虱目在一个进化分支。对这33种昆虫AS-B神经肽预测活性肽序列,发现有3种类型,即W(X)6W-amide、W(X)7W-amide和W(X)8W-amide。所有昆虫都含有W(X)6W-amide,然而只含有W(X)6W-amide的昆虫种类为双翅目所有昆虫、黑脉金斑蝶(D. Plexippus)、柑橘卷叶蛾(A. transitella)、赤拟谷盗(T.castaneum)、中欧山松大小蠹(Dendroctonus ponderosae)、内华达古白蚁(Z. nevadensis)和东亚飞蝗(L. migratoria),同时有W(X)6W-amide和W(X)7W-amide有12种昆虫,而只在鳞翅目5种昆虫[诗神袖蝶(Heliconius melpomene)、小菜蛾(P. xylostella)、棉铃虫(H. armigera)、柑橘凤蝶(P. xuthus)、玉带凤蝶(P. machaon)]中发现有W(X)8W-amide。目前尚未在膜翅目中发现AS-B序列。
2.3 昆虫AS-C神经肽前体序列的进化树分析
对57种昆虫的AS-C神经肽前体序列进行进化树分析,发现存在两个进化分支,鳞翅目、鞘翅目和双翅目在一个进化分支,而膜翅目、半翅目、等翅目、直翅目和虱目在另一个进化分支(图4)。膜翅目昆虫和不完全变态昆虫在一分支上,这可以支持一些昆虫分类学家最近提出的膜翅目昆虫位于完全变态昆虫进化的最底层的这个学说[16]。按照Allatostatin-C的进化树可以推论完全变态昆虫进化的顺序可能为膜翅目、鞘翅目、双翅目、鳞翅目。因此Allatostatin-C神经肽可能与昆虫变态密切相关。AS-C的活性肽序列非常保守,且含有二硫键。15种鳞翅目昆虫AS-C神经肽序列均为QVRFRQCYFNPISCF,6种蚊类昆虫AS-C序列均为QIRYRQCYFNPISCF,11种蝇类昆虫AS-C序列均为QVRYRQCYFNPISCF,7种不完全变态昆虫及部分膜翅目昆虫AS-C序列均为SYWKQCAFNAVSCF,而鞘翅目和部分膜翅目昆虫AS-C序列多样化(图5)。
2.4 昆虫AS-CC神经肽前体序列的进化树分析
对32种昆虫的AS-CC神经肽前体序列进行进化树分析,发现鳞翅目和双翅目分别在一个进化分支上,而膜翅目、鞘翅目、半翅目、等翅目和直翅目在一个进化分支上。AS-CC的C末端氨基酸序列非常保守,且含有二硫键(图4)。C末端10位氨基酸序列为R/K-C-Y/F-F-N-A-V-T/S-C-F,N末端序列差异较大(图6)。AS-C和AS-CC的二硫键之间都是含有6个氨基酸。虽然3种白蚁AS-C有类似AS-CC的CXXNAVXCF的C末端序列,AS-C和AS-CC的前体序列在两个独立的进化分支上,说明昆虫AS-C和AS-CC神经肽来自不同的起源,这也验证了将AS-CC作为一类新AS神经肽的可靠性。
3 小结与讨论
通过对昆虫AS神经肽前体序列的系统发育树的构建及分析,发现昆虫AS-A、AS-B、AS-C和AS-CC分别在各自的进化分支上,且AS-C和AS-CC之间的亲缘关系较近,AS-A是最新分化出来的。不同种类昆虫在4种类型AS的进化树中,不同种类昆虫间的亲缘关系不尽相同。在AS-A进化树中,完全变态类的双翅目和膜翅目昆虫在一个进化分支,而鳞翅目与不完全变态类昆虫在另一个进化分支上,但是尚未发现鞘翅目昆虫的AS-A序列。AS-B进化树中,双翅目在单独一个进化分支,而鞘翅目、鳞翅目和不完全变态类昆虫在一个进化分支,但尚未发现膜翅目昆虫的AS-B序列。在AS-C进化树中,除了膜翅目,完全变态类昆虫都在一个进化分支,而膜翅目和不完全变态类昆虫在一个进化分支,推测AS-C与昆虫变态密切相关。在AS-CC进化树中,发现鳞翅目和双翅目分别在一个进化分支上,而膜翅目、鞘翅目和不完全变态类昆虫在一个进化分支上。
在昆虫进化过程中,昆虫分化出多种多样的神经肽或神经激素,可以调控不同的昆虫生长发育,这也导致昆虫世界的多样化。在昆虫中发现了多种AS神经肽,这些神经肽的功能也不尽相同。已分离的大多数昆虫AS都能抑制源昆虫的CA对JH的合成,且AS还具有多效性。首次分离出来的蜚蠊型AS-A能够在CA中抑制JH合成[6,17],另外也在其他神经组织(如额神经节、食道下神经节等)或分泌细胞(如中肠内分泌细胞)中发现,还证明其具有抑制内脏(如肠道和心脏)肌肉的自主收缩[14]。AS-A还在德国小蠊脂肪体中发现且具有抑制卵原蛋白合成[18]。在德国小蠊中还发现AS-A具有通过影响消化酶的分泌和肠道蠕动性来抑制食物摄取和消化的功能[19]。在蛾类中,注射AS-A可以提高血淋巴中的JH滴度,从而导致幼虫死亡升高和精细胞缩小[20,21]。AS-B首先在东亚飞蝗脑-心侧体-咽侧体-食道下神经节的提取物中发现,体外测定发现有抑制后肠和输卵管的收缩活性[22]。随后在双斑蟋(G. bimaculatus)脑提取物中也发现了AS-B,并证明其在咽侧体中具有抑制JH活性。在东亚飞蝗的脑、食道下神经节、背神经索的多个神经节、心脏、输卵管和后肠中被发现[22]。在家蚕和烟草天蛾的Epiproctodeal glands中发现,推测可能参与羽化行为[23]。在反吐丽蝇(Calliphora vomitoria)和果蝇(D. melanogaster)的视觉系统中发现AS-B,推测可能作用于昆虫生物钟[24,25]。另外在果蝇中发现AS-B可以靶定和激活性肽受体,推测可能参与繁殖行为[26]。AS-C首先在烟草天蛾的脑中分离出来,证明在咽侧体中对JH具有非常强的抑制活性[7]。AS-CC和AS-C的神经肽序列结构类似,功能也相似。AS-C具有多效性,例如还有调节前肠收缩活性[27],在蚊子中发现羽化后AS-C水平上升,推测可能参与变态[28],在海灰翅夜蛾(S. littoralis)和番茄夜蛾(Lacanobia oleracea)中注射AS-C导致妨碍幼虫发育和死亡率升高[29]。在马铃薯甲虫中,通过RNAi将AS-C沉默后,体内保幼激素酸甲基转移酶 (JHAMT)的mRNA水平上调,导致JH水平上升,从而妨碍幼虫生长和发育[30]。AS不是孤立地发挥作用,而是与其共存的其他肽能物质协同作用,这种协同作用可能表现为在行使某一功能的相互促进或抑制。
通過对神经肽的信号系统的干扰,使得昆虫内分泌系统失去平衡,影响昆虫正常的生理活动,从而达到控制害虫的目的[1]。本研究根据现报道的数种昆虫AS神经肽序列,基于转录组和基因组学数据库,通过同源性比较分别查找到昆虫的AS-A、AS-B、AS-C和AS-CC前体氨基酸序列分别是53、33、57和35种,并对这些AS前体序列进行了亲缘关系分析,这对之后的昆虫神经肽的结构和功能研究提供了理论基础。
参考文献:
[1] 欧阳迎春,唐 爽,关雪辰.昆虫神经肽类激素的研究及应用前景[J].植物保护,2003,29(1):9-11.
[2] 景天忠,戴芳天,刘宽余,等.昆虫抑咽侧体神经肽功能及作用机制[J].东北林业大学学报,2006,34(2):90-94.
[3] 曾辉明,黄俊生.昆虫神经肽allatostatin的研究进展[J].生命科学,2003,15(3):168-172.
[4] DONLY B, DING Q, TOBE S, et al. Molecular cloning of the gene for the allatostatin family of neuropeptides from the cockroach Diploptera punctata[J]. Proceedings of the National Academy of Sciences, 1993, 90: 8807-8811.
[5] STAY B, TOBE S S. The role of allatostatins in juvenile hormone synthesis in insects and crustaceans[J]. Annual Review of Entomology,2007,52:277-299.
[6] WOODHEAD A P,STAY B,SEIDEL S L,et al. Primary structure of four allatostatins:Neuropeptide inhibitors of juvenile hormone synthesis[J]. Proceedings of the National Academy of Sciences,1989,86:5997-6001.
[7] KRAMER S J,TOSCHI A,MILLER C A,et al. Identification of an allatostatin from the tobacco hornworm Manduca sexta[J].Proceedings of the National Academy of Sciences,1991,88:9458-9462.
[8] HEWES R S,TAGHERT P H. Neuropeptides and neuropeptide receptors in the Drosophila melanogaster genome[J].Genome Res,2001,11:1126-1142.
[9] HILL C A,FOX A N,PITTS R J,et al.G protein coupled receptors in Anopheles gambiae[J].Science,2002,298:176-178.
[10] HUMMON A B,RICHMOND T A,VERLEYEN P,et al. From the genome to the proteome: Uncovering peptides in the Apis brain[J].Science,2006,314:647-649.
[11] ROLLER L,YAMANAKA N, WATANABE K,et al. The unique evolution of neuropeptide genes in the silkworm Bombyx mori[J]. Insect Biochemistry and Molecular Biology, 2008,38:1147-1157.
[12] LI Y P, HERNANDEZ-MARTINEZ S, FERNANDEZ F, et al. Biochemical, molecular, and functional characterization of PISCF-allatostatin, a regulator of juvenile hormone biosynthesis in the mosquito Aedes aegypti[J]. J Biol Chem, 2006, 281: 34048-34055.
[13] ONS S, STERKEL M, DIAMBRA L, et al. Neuropeptide precursor gene discovery in the Chagas disease vector Rhodnius prolixus[J]. Insect Mol Biol, 2011, 20: 29-44.
[14] VEENSTRA J A. The contribution of the genomes of a termite and a locust to our understanding of insect neuropeptides and neurohormones[J]. Frontiers in Physiology, 2014, 5: 454-475.
[15] TANAKA Y, SUETSUGU Y, YAMAMOTO K, et al. Transcriptome analysis of neuropeptides and G-protein coupled receptors (GPCRs) for neuropeptides in the brown planthopper Nilaparvata lugens[J]. Peptides, 2014, 53:125-133.
[16] SAVARD J, TAUTZ D, RICHARDS S, et al. Phylogenomic analysis reveals bees and wasps (Hymenoptera) at the base of the radiation of Holometabolous insects[J]. Genome research, 2006, 16: 1334-1338.
[17] PRATT G E, FARNSWORTH D E, SIEGEL N R, et al. Identification of an allatostatin from adult Diploptera punctata[J]. Biochem Biophys Res Commun, 1989, 163: 1243-1247.
[18] MARTIN D, PIULACHS M D, BELLES X. Inhibition of vitellogenin production by allatostatin in the German cockroach[J]. Mol Cell Endocrinol, 1996, 121: 191-196.
[19] AGUILAR R, MAESTRO J L, VILAPLANA, et al. Allatostatin gene expression in brain and midgut, and activity of synthetic allatostatins on feeding-related processes in the cockroach Blattella germanica[J]. Regul Pept,2003,115: 171-177.
[20] GRIEBLER M, WESTERLUND S A, HOFFMANN K H, et al. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph[J]. J Insect Physiol, 2008, 54: 997-1007.
[21] MEYERING-VOS M, MULLER A. RNA interference suggests sulfakinins as satiety effectors in the cricket Gryllus bimaculatus[J]. J Insect Physiol, 2007, 53: 840-848.
[22] SCHOOFS L, HOLMAN G M, HAYES T K, et al. Isolation, identification and synthesis of locustamyoinhibiting peptide (Lom-MIP), a novel biologically active neuropeptide from Locusta migratoria[J]. Regul Pept, 1991, 36: 111-119.
[23] DAVIS N T, BLACKBURN M B, GOLUBEVA E G, et al. Localization of myoinhibitory peptide immunoreactivity in Manduca sexta and Bombyx mori, with indications that the peptide has a role in molting and ecdysis[J]. J Exp Biol, 2003, 206: 1449-1460.
[24] KOLODZIEJCZYK A, NASSEL D R. A novel wide-field neuron with branches in the lamina of the Drosophila visual system expresses myoinhibitory peptide and may be associated with the clock[J]. Cell Tissue Res, 2011a, 343: 357-369.
[25] KOLODZIEJCZYK A, NASSEL D R. Myoinhibitory peptide (MIP) immunoreactivity in the visual system of the blowfly Calliphora vomitoria in relation to putative clock neurons and serotonergic neurons[J]. Cell Tissue Res, 2011b, 345: 125-135.
[26] POELS J, VAN LOY T, VANDERSMISSEN H P, et al. Myoinhibiting peptides are the ancestral ligands of the promiscuous Drosophila sex peptide receptor[J]. Cell Mol Life Sci, 2010, 67: 3511-3522.
[27] MATTHEWS H J, AUDSLEY N, WEAVER R J. Alanine substitution and deletion analogues of Manduca sexta allatostatin: Structure-activity relationship on the spontaneous contractions of the foregut of larval Lacanobia oleracea[J]. J Insect Physiol, 2006, 52: 128-135.
[28] LI B, PREDEL R, NEUPERT S, et al. Genomics, transcriptomics, and peptidomics of neuropeptides and protein hormones in the red flour beetle Tribolium castaneum[J]. Genome Research, 2008, 18: 113-122.
[29] MATTHEW H J, AUDSLEY N, WEAVER R J. In vitro and in vivo effects of myo-active peptides on larva of the tomato moth Lacanobia oleracea and the cotton leaf worm Spodoptera littoralis (Lepidoptera; Noctuidae). Arch. Insect Biochem[J]. Physiol, 2008, 69: 60-69.
[30] MENG Q W, LIU X P, LU F G, et al. Involvement of a putative allatostatin in regulation of juvenile hormone titer and the larval development in Leptinotarsa decemlineata(Say)[J]. Gene,2015,554:105-113.
