软枣猕猴桃内生真菌的分离纯化及分子鉴定
2016-10-19廖林郭睿昕赵欣李泽敏毛子龙杨玉红
廖林 郭睿昕 赵欣 李泽敏 毛子龙 杨玉红


摘要: 以软枣猕猴桃(Actinidia arguta)枝条为试验原料,采用内生真菌三步消毒法(乙醇-次氯酸钠-升汞)对样品进行表面消毒,从软枣猕猴桃枝条组织分离出一株内生真菌菌株,命名为Y1,对Y1进行核糖体18S rDNA克隆测定,获得长度为1 020 bp的18S rDNA序列,在NCBI数据库上进行同源性比对,构建18S rDNA系统发育树,并进行系统发育分析,鉴定该菌为子囊菌(Sac fungi)。
关键词: 软枣猕猴桃(Actinidia arguta); 内生真菌; 分离; 纯化; 鉴定
中图分类号:S432.4+4 文献标识码:A 文章编号:0439-8114(2016)06-1459-04
DOI:10.14088/j.cnki.issn0439-8114.2016.06.024
软枣猕猴桃(Actinidia arguta),又名软枣子、猕猴梨、藤瓜,属于猕猴桃科猕猴桃属多年生落叶藤本植物。全世界猕猴桃属植物共有66种,中国分布有62种。软枣猕猴桃是9种光果猕猴桃种类之一[1-3]。软枣猕猴桃的单果平均重18 g,最大果重33 g,果皮绿色光滑,果肉绿色、多汁、细腻、酸甜适度,含可溶性固形物15%左右,总糖8.8%,有机酸1.5%,维生素C 430 mg/100 g,是苹果的100倍,氨基酸933.9 mg/100 g。而且,软枣猕猴桃富含各种营养成分,具有各种医疗保健功效。软枣猕猴桃汁具有阻断致癌性亚硝基化合物合成的作用,还含有硫醇蛋白酶的水解酶和超氧化物歧化酶(SOD),可以嫩化肉类,具有养颜、提高免疫功能、增强抗癌、抗衰老、软化血管、抗肿消炎的功能[4-9]。
植物内生菌是指那些在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部或细胞间隙的真菌或细菌,被感染的宿主植物(至少是暂时)不表现出外在症状[6-9],内生菌一般会产生一些在微生物-宿主关系中发挥作用的生物活性物质(如抗细菌、抗真菌、抗病毒物质等)。内生真菌研究的主要领域有内生真菌入侵宿主的分子机理、内生真菌与宿主的关系、内生真菌产生的生物活性物质的筛选等。内生真菌在医药、农业、工业领域越来越受到人们的关注[10-15]。
本试验以软枣猕猴桃为材料分离纯化其内生真菌,筛选可产生活性成分的猕猴桃溃疡病生防菌种,以便开发出农药活性物质,为猕猴桃溃疡病的防治和软枣猕猴桃其他病害防治奠定基础。
1 材料与方法
1.1 材料
软枣猕猴桃枝条采自沈阳农业大学东北野生猕猴桃资源圃。试剂有75%乙醇、2%次氯酸钠、0.1%升汞等。主要仪器有LDZX-40BI型立式自动电热压力蒸汽灭菌器(上海中安医疗器械厂)、SW-CJ-ICU双人单面净化工作台(浙江苏净净化设备有限公司)、HPX-9082 MBE数显电热培养箱(上海沪粤明科学仪器有限公司)、BX-53奥林巴斯显微镜(上海泽仕光电科技有限公司)、JD100-3电子天平(沈阳龙腾电子有限公司)。
1.2 方法
1.2.1 PDA培养基的配制及灭菌 称取300 g马铃薯,洗净去皮切碎,加去离子水1 000 mL煮沸0.5 h,纱布过滤,再加10~20 g葡萄糖和17~20 g琼脂,充分溶解后于0.1 MPa灭菌30 min,待温度冷却至40~50 ℃,在培养基中加入浓度为50 μg/mL的氨苄青霉素(防止细菌污染),充分混匀后将培养基倒入平皿中让其自然冷却凝固。
1.2.2 样品组织表面消毒 将采集到的样品组织在流水下冲洗掉表面尘土,室温晾干后选取新鲜完整的猕猴桃组织作为材料。在无菌环境中依次用75%乙醇、2%次氯酸钠、0.1%升汞分别消毒2 min。
1.2.3 内生真菌的分离纯化[16-21] 将消毒好的样品枝条用无菌刀切成约1 cm长的小段,每个平皿放4段,于28 ℃恒温箱中培养,每天观察内生菌的生长状况。分离纯化方法如图1所示。
1.2.4 菌种的鉴定方法[22,23] 内生真菌的鉴定通常根据主要的群体和个体形态特点进行归类与鉴定,同时可辅以生理生化及生态等特征加以鉴别。丝状真菌的群体形态(即菌落形态)是鉴定的重要依据,如菌落大小、颜色、表面特征、质地和生长速度等,个体形态有菌丝、子实体、孢子和产孢结构等特征[24]。
纯化后的菌株在生长的最佳时期,用接种针挑取位于尖端、底部及外缘等不同位置的菌丝,置于滴加去离子水的载玻片上,菌丝散开后盖上盖玻片,吸去多余的水分。在显微镜下观察孢子及菌丝体的形态,并对其进行拍照。根据菌株的菌丝体和孢子的形态特征,對照真菌鉴定手册进行初步鉴定[25]。显微镜观察时也可以染色观察,以方便观察结果。
1.2.5 分子鉴定 形态学鉴定是传统的方法,为确保鉴定的准确性,采用分子鉴定和形态鉴定相结合的方法。在rDNA中的18S基因具有高度保守性,可以用来进行在高分类水平上的系统发育关系的分析,以检测和鉴定真菌。通过18S rDNA序列分析来鉴定软枣猕猴桃内生真菌菌株,并反映菌株的系统发育关系。
2 结果与分析
2.1 软枣猕猴桃内生真菌的菌种特征
按照最佳消毒条件,做多组重复试验,对样品枝条进行内生真菌的分离纯化,最终筛选得到一株生长较好的内生真菌,并将其命名为Y1,以进行后续试验。
内生真菌菌株在PDA培养基上培养,形成的菌落密度高、呈绒毛状且菌丝体紧密。当菌株在PDA培养基上培养7 d后,形成菌落直径可达2 cm,菌落表面呈乳白色,无光泽,中心突起(图2左)。
分离纯化后得到的单菌落Y1,在PDA培养基上培养,形成的菌落密度高、菌落表面呈白色,菌丝体松散。棉絮状,菌丝体尖端有黑色孢子(图2右)。
2.2 软枣猕猴桃内生真菌的形态学鉴定
对软枣猕猴桃内生真菌Y1进行制片,显微镜下观察,菌株形态较简单,菌丝生长发达,有隔,较细,光滑,竹结状,且都是双核菌丝(图3)。根据观察到的菌落形态和菌丝的结构特征,查阅真菌鉴定手册及参考文献进行初步鉴定。结果表明,所分离纯化后得到的软枣猕猴桃内生真菌属于外囊菌属真菌。为了得到更加准确的结果,对Y1内生菌进行分子鉴定。
2.3 分子鉴定
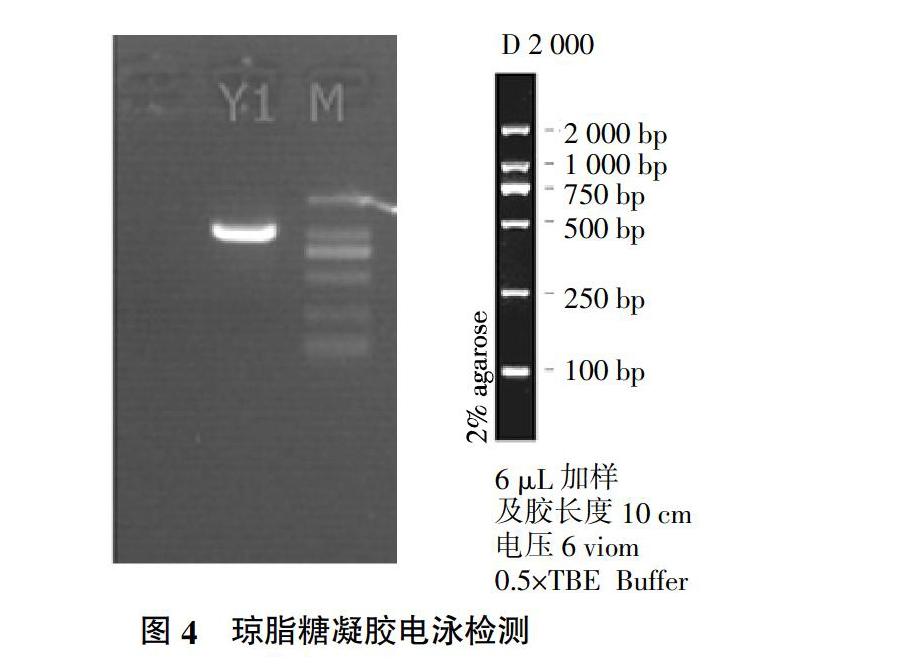
扩增Y1菌株18S rDNA序列,并进行电泳分析,如图4所示。由图4可知,Y1片段大小约1 000 bp,说明扩增的序列可以进行后续试验。
将扩增的Y1 18S rDNA序列送至金唯智生物科技有限公司测序,测序后去除载体及引物序列,共1 020 bp,判断正反方向,正向序列结果如下所示。
登陆NCBI网站Blast,下载同源性99%以上的序列,多重序列比对后,寻找最优核苷酸替代模型,并构建系统发育树(图5)。
Y1的18S rDNA序列在NCBI网站上Blast比对分析结果显示,Y1与子囊菌(Sac fungi)相似度100%,结合形态鉴定,确定菌株Y1为子囊菌。
3 小结
从软枣猕猴桃枝条中初步分离纯化和鉴定获得一株内生真菌,经过逐步纯化后得到单一菌落,这株软枣猕猴桃内生真菌命名为Y1。经形态学鉴定和分子鉴定,确定内生菌Y1为子囊菌。
参考文献:
[1] 曹家树,秦 岭.园艺植物种质资源学[M].北京:中国农业出版社,2005.
[2] 刘慧涛,张冰冰,吕耀双.东北地区野生猕猴桃资源现状及开发利用[J].河北林果研究,1999,14(4):326-330.
[3] 李坤明,胡忠荣,陈 伟.昭通地区野生猕猴桃资源及其利用评价[J].中国野生植物资源,2006,25(2):39-41.
[4] 王晓东,段全猛.软枣猕猴桃的利用与栽培[J].特种经济动植物,2006,9(2):33-34.
[5] 张菊明,林佩芳,何一中,等.中华猕猴桃多糖的免疫药理学作用[J].中西医结合杂志,1986,6(3):171-174.
[6] 候芳玉.长白山产软枣猕猴桃茎多糖抗感染和抗肿瘤作用的研究[J].白求恩医科大学学报,1995,21(5):472-475.
[7] 甘振威,张大旭,张娅婕,等.长白山区几种野生浆果营养成分及延缓衰老作用[J].西安交通大学学报(医学版),2004,25(4):343-345.
[8] 马月申,袁福贵,赵淑兰.软枣猕猴桃果实营养成分的测定[J].特产研究.1992(1):44-45.
[9] 祝晨蔯,刘中秋,刘 良.革叶猕猴桃果实不同提取部位抗心肌缺血作用的比较研究[J].中药药理与临床,2001,17(1):19-21.
[10] 毛 帆.软枣猕猴桃的栽培[J].特种经济动植物,2007,10(10):48-49.
[11] 饶卫华,敖礼林,熊振芳.软枣猕猴桃的基本特性及商业栽培前景[J].中国南方果树,2007,36(4):63.
[12] 朱建华,田金河.猕猴桃生物活性物质研究进展[J].酿酒,2006, 33(3):57-59.
[13] 朴一龙,赵兰花.软枣猕猴桃研究进展[J].北方园艺,2008(3):76-78.
[14] ZINNIEL D K,LAMBRECHT P,HARRIS N B. Isolation and characterization of endophytic colonizing bacteria from agronomic crops and prairie plants[J]. Applied and Environmental Microbiologyaem,2002,68:2198-2208.
[15] SIEGEL M R,JOHNSON M C,VARNEYD R. A fungal endophytic in tall fescue: Ncidence and dissemination[J]. Phytopathology,1984,74:932-937.
[16] 伍时华,黄翠姬,石媛靖.酸乳菌种分离纯化方法[J].食品科学,2004,25(10):162-166.
[17] 熊素玉,姚新奎,谭小海.酸马奶中乳酸菌的分离、纯化与鉴定[J].新疆农业科学,2007,44(5):696-701.
[18] 罗永兰,张志元,冉國华.柑橘内生真菌的分离与鉴定[J].湖南农业大学学报(自然科学版),2005,31(4):418-421.
[19] 吴 薇,盖宝川,籍保平.红茶菌混合菌种的分离与鉴定[J].食品科学,2004,25(4):55-58.
[20] 段海婧,韩 婷,吴秀丽,等.荒漠植物牛心朴子内生真菌的分离与鉴定[J].中国中药杂志,2013,38(3):325-329.
[21] 俞 超,罗胡科,齐 娜,等.蛇足石杉内生真菌的分离纯化与鉴定研究[J].江苏农业科学,2009(3):381-384.
[22] 陈贤兴,陈析丰,南旭阳,等.喜树果内生真菌的分离与鉴定[J].河南科学,2003,21(4):431-433.
[23] 李能章,彭远义.一株芦荟抗菌内生细菌的分离鉴定及生物学性质研究[J].生物技术通讯,2004,15(2):141-145.
[24] 王利娟,贺新生.植物内生真菌分离培养的研究方法[J].微生物学杂志,2006,26(4):55-60.
[25] 魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
