超声波辅助提取银杏叶黄酮及体外抗运动氧化作用研究
2016-10-18房磊
房磊
(吉林农业科技学院,吉林吉林132101)
超声波辅助提取银杏叶黄酮及体外抗运动氧化作用研究
房磊
(吉林农业科技学院,吉林吉林132101)
研究超声波辅助提取银杏叶黄酮及其体外抗运动氧化作用。在单因素基础上,采用正交试验优化超声波辅助提取银杏叶黄酮工艺,并分析银杏叶黄酮对小鼠肝组织丙二醛(MDA)、总抗氧化能力(T-AOC)的影响。结果表明:最佳工艺为提取功率80 W、提取时间40 min、提取温度70℃、料液比1∶25(g/mL),此条件下黄酮得率为27.32 mg/g。银杏叶黄酮能显著降低小鼠肝组织中MDA的含量(P<0.05),能提高小鼠肝组织中T-AOC水平,表明银杏叶黄酮可增强机体抗氧化能力。
银杏叶;黄酮;超声波辅助提取;抗氧化
银杏(Ginkgo biloba)是我国特有的宝贵资源。银杏叶中活性成分非常多,其中含有黄酮类化合物以及其他成分,能够抗氧化、改善心脑血管循环以及抗病毒、防止衰老、防止过敏、使胆固醇降低等功效,银杏叶提取物安全可靠,食用健康[1-2]。它可用于加工药品、保健食品等[3-4]。银杏叶中黄酮含量高,提取方法较多,用水可以提出黄酮,微波、超声波都可以用于提取黄酮。超声波法优点多,它可以节省能量、时间以及提高提取率等[5-6]。超声波辅助提取方法是一种提取成分的新技术,通过超声波作用能够改变细胞膜通透性,使得萃取过程得到优化,能够增强提取效果[7]。超声波辅助提取法能够大大地提高有机物提取率,提高提取效率[8]。补充黄酮类物质可增强人体抗氧化且有利于运动机体减少自由基的产生和加速其清除[9-10],用来对抗自由基的副作用,银杏叶黄酮类物质可延缓运动性氧化发生和加快体能恢复,因而对一般人和运动员的健康都有益[11-12]。本文采用超声波辅助提取银杏叶黄酮,并研究其抗运动氧化作用,为开发银杏叶黄酮类保健产品提供参考。
1 材料与方法
1.1材料与试剂
银杏叶:安国市健仁药材有限公司;NaNO2、Al(NO3)3、NaOH、无水乙醇:汇普试剂有限公司;芦丁(纯度>95%):西安瑞林生物科技有限公司;清洁级ICR小鼠,80只,雌雄各半,重量25 g~27 g:宜昌明德农业开发有限公司,合格证号SCXK2014-0009。
1.2仪器与设备
UV1800PC紫外可见分光光度计:上海奥析科学仪器有限公司;UC-900A1型数控超声波辅助清洗机:广州维力超声电子设备有限公司;AHC型电子计数秤:嘉兴市惠拓称重设备有限公司;SHY-2恒温水浴振荡器:常州市万丰仪器制造有限公司;DZF-6030型真空干燥箱:上海天呈实验仪器制造有限公司;LD5-2A型离心机:北京医用离心机有限公司;总抗氧化能力(T-AOC)测定试剂盒(批号:20100311)、丙二醛(MDA)测定试剂盒(批号:20100322)、超氧化物酶(SOD)测试盒(批号:20100324):南京建成生物工程公司。
1.3方法
1.3.1银杏叶黄酮的提取方法
准确称取一定量的银杏叶,将其剪成0.3 cm×0.3 cm碎片,加入一定浓度乙醇,利用超声波辅助提取银杏叶中的黄酮,然后进行过滤,得到滤液待测。
1.3.2银杏叶黄酮含量测定
取芦丁作为标准溶液,于510 nm处测定其标准曲线,芦丁标准曲线回归方程为A=10.760 5C+0.003 6(R2=0.999 8),式中C为黄酮浓度,g/L;A为吸光度值。1 mL待测液体,取乙醇浓度为30%的溶液将其稀释至5 mL,混合完毕再加入0.3 mL 5%NaNO2溶液,静置5min,再加0.3mL10%Al(NO3)3溶液,静放6min,再加4 mL 1 mol/LNaOH溶液及0.4 mL 30%乙醇溶液,混匀后静置10 min,于510 nm下测定其吸光度。
1.3.3单因素试验
分别以提取功率(60、70、80、90、100 W)、提取时间(30、35、40、45、50 min)、提取温度(40、50、60、70、80℃)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30)(g/mL)为影响因素,分别设定5个水平,研究各个因素对提取液中银杏叶黄酮含量的影响。
1.3.4正交试验对银杏叶黄酮提取工艺的优化
根据单因素试验结果,应用正交试验优化工艺参数。试验因素与水平见表1。

表1 因素与水平Table 1Factors and levels
1.3.5脂质过氧化小鼠实验[13]
把所取的80只小鼠分成4组,各组名称为对照组、四氯化碳组、阳性对照组、银杏叶黄酮组。对照组以及四氯化碳组灌胃生理盐水10 mg/(kg·d),阳性对照组(VE组)灌胃VE1.0 mg/(kg·d),黄酮组小鼠灌提取黄酮95 mg/(kg·d),不间断灌胃15 d。末次灌胃后2 h,将对照组注射橄榄油液体,其他组均注射0.1%CCl4橄榄油液体10 mg/(kg·d)。禁止吃食,16 h后分别取血。以3 500 r/min离心10 min,取血清,测定MDA含量和T-AOC、SOD活性;同时称量一定量肝组织,冷盐水洗净,制成10%肝匀浆,以4 000 r/min离心10 min,取上清液,测定MDA含量、T-AOC水平。采用硫代巴比妥酸比色法测定MDA含量,应用黄嘌呤氧化酶法测定T-AOC水平和SOD活性,具体步骤参照各试剂盒说明书。
2 结果与分析
2.1超声波辅助提取银杏叶黄酮单因素试验
2.1.1提取功率对银杏叶黄酮得率的影响
称取5 g按标准剪好的银杏叶,向其中加入100 mL 70%乙醇,在提取温度60℃,提取功率分别为60、70、80、90、100 W条件下提取40 min,以考察提取功率对银杏叶黄酮得率的影响。提取功率对黄酮得率的影响见图1。

图1 提取功率对黄酮得率的影响Fig.1Effect of extraction power on flavonoids yield
由图1可知,当提取功率为60 W时,黄酮得率较小,随着提取功率的增大,黄酮得率最高,原因可能是随着功率增大,使得溶剂扩散越快,越有利于黄酮的浸出,当功率为80 W时,黄酮得率最高,再增大提取功率后,黄酮得率开始下降,原因可能是功率过高,产生的瞬时高温会使许多活性成分遭到破坏,杂质溶出较多且操作不便[14-15],所以选择70、80、90 W为多因素研究水平。
2.1.2提取时间对银杏叶黄酮得率的影响
称取5 g剪好的银杏叶,分别加入100 mL 70%乙醇,在提取温度60℃,提取功率80 W条件下分别提取30、35、40、45和50 min,以考察提取时间对黄酮得率的影响。提取时间对黄酮得率的影响见图2。
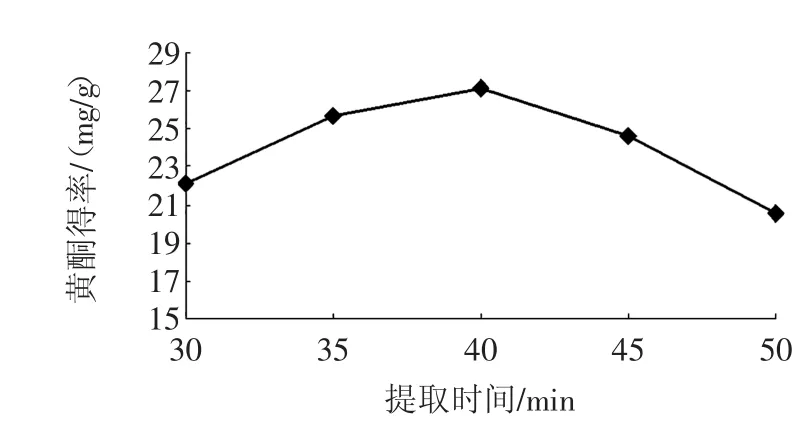
图2 提取时间对黄酮得率的影响Fig.2Effect of extraction time on flavonoids yield
由图2可知,随着提出时间的延长,黄酮得率逐渐提高,当时间为40 min时,黄酮得率最高,继续延长时间,黄酮得率下降。超声波能够促使黄酮进入溶液中,而且在较短时间内就可看到效果,但是过长时间的超声波作用可能导致部分黄酮发生降解,黄酮含量也随之下降[16],因此选择35、40、45 min为多因素研究水平。
2.1.3提取温度对银杏叶黄酮得率的影响
准确称量5 g按照标准剪好的银杏叶,向其中加入100 mL 70%乙醇,在提取功率80 W,提取温度分别为40、50、60、70、80℃的情况下,提取40 min,以考察提取温度对银杏叶黄酮含量的影响。取温度对黄酮得率的影响见图3。
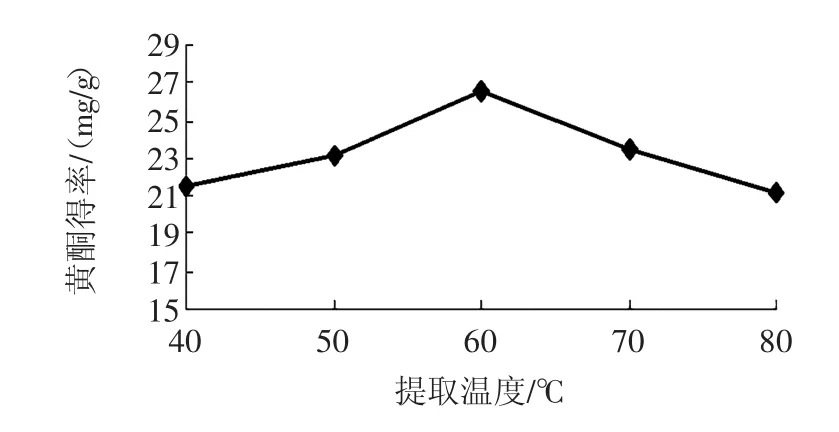
图3 提取温度对黄酮得率的影响Fig.3Effect of extraction temperature on flavonoids yield
由图3可知,银杏叶黄酮含量随着提取温度的升高而增大,当提取温度达到60℃时,黄酮得率最大,继续升高温度,黄酮得率下降,原因可能是温度过高后破坏了黄酮分子的结构致使黄酮含量减少[17]。因此选择50、60、70℃为多因素研究水平。
2.1.4料液比对银杏叶黄酮得率的影响
准确量取5 g按照标准剪好的银杏叶,向其中加入50、75、100、125、150 mL浓度为70%乙醇溶液,在温度60℃,功率80 W情况下提取40 min,以考察料液比对黄酮含量的影响。料液比对黄酮得率的影响见图4。
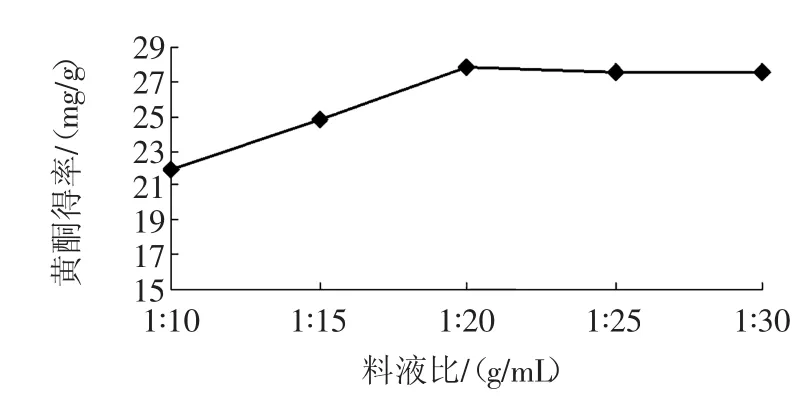
图4 料液比对黄酮得率的影响Fig.4Effect of liquid ratio on flavonoids yield
根据图4能够看出,当料液比为1∶10(g/mL)时,黄酮得率最低,当液体逐渐增加后,黄酮得率上升,当料液比达到1∶20(g/mL)后,进一步增加溶剂量,黄酮含量的变化不明显,几乎不变,原因可能是原料一定的情况下,黄酮溶出率一定,继续增加溶剂含量不会提高黄酮的溶出率[18],因此选择料液比为1∶15、1∶20、1∶25(g/mL)为多因素研究水平。
2.2超声波辅助提取银杏叶黄酮正交试验结果与分析利用软件SPSS16.0对本试验进行分析,结果见表2和表3。
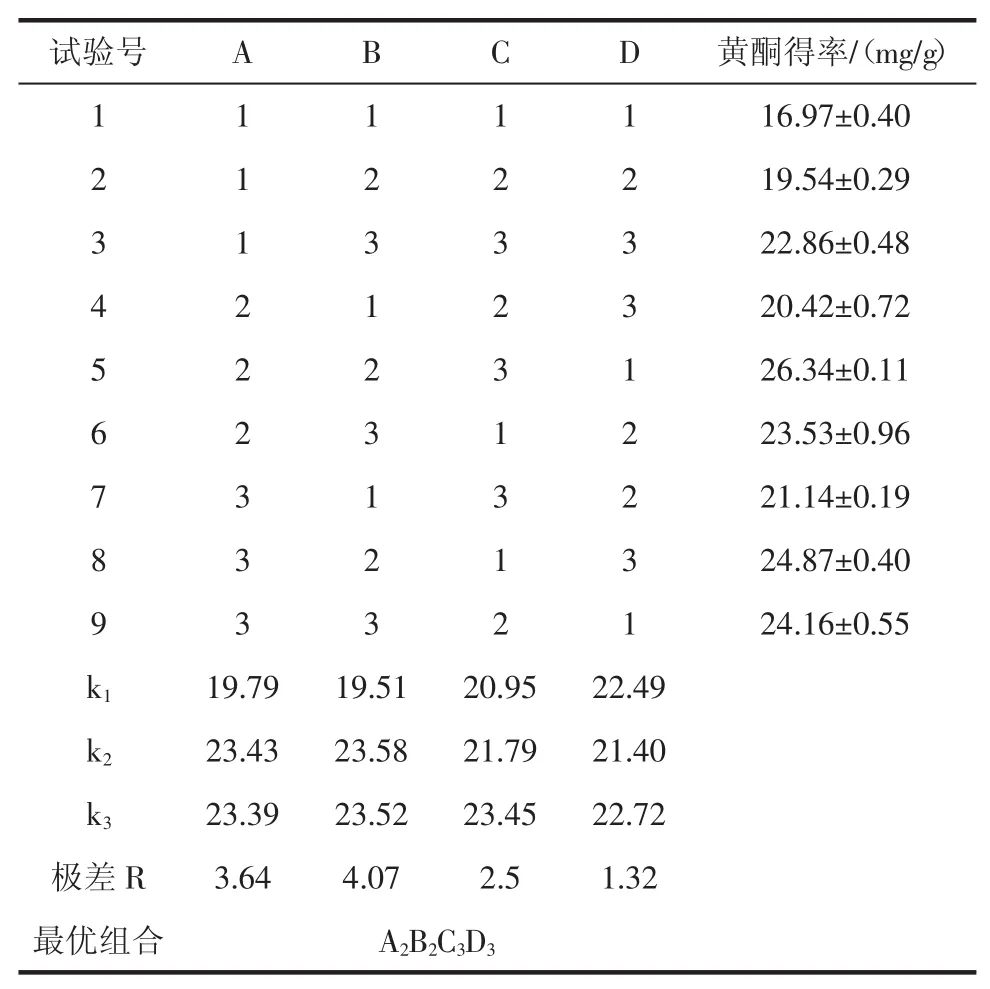
表2 正交试验结果Table 2Orthogonal test results

表3 正交试验结果方差分析Table 3Variance analysis of orthogonal array design experimental results
由表3可以看出,提取功率、提取时间、提取温度、料液比对超声波辅助提取银杏叶黄酮得率的影响均极显著。各因素对银杏叶黄酮得率的影响大小依次是提取时间>提取功率>提取温度>料液比,根据表2可知,最优试验方案是A2B2C3D3,不在9组试样中,对组别A2B2C3D3进行3次平行试验,其得率为(27.32± 0.24)(mg/g),故A2B2C3D3为最优组合。即提取功率为80 W、提取时间为40 min、提取温度为70℃、料液比为1∶25(g/mL)。在此条件下银杏叶黄酮得率为(27.32± 0.24)(mg/g)。
2.3银杏叶黄酮体内抗氧化活性指标分析
2.3.1银杏叶黄酮对脂质过氧化小鼠肝脏指标的影响
测定脂质过氧化小鼠肝匀浆中MDA含量和TAOC水平,结果见表4。
表4 银杏叶黄酮对脂质过氧化小鼠肝匀浆各指标的影响(±s,n=20)Table 4Effect of Ginkgo biloba flavonoids on lipid peroxidation in rat liver homogenates(±s,n=20)
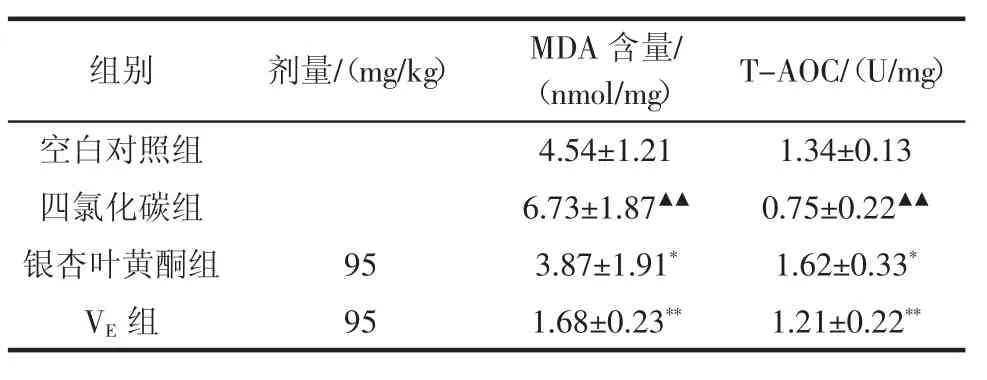
表4 银杏叶黄酮对脂质过氧化小鼠肝匀浆各指标的影响(±s,n=20)Table 4Effect of Ginkgo biloba flavonoids on lipid peroxidation in rat liver homogenates(±s,n=20)
注:▲表示与空白对照组比较有显著性差异(P<0.05);▲▲表示与空白对照组比较有极显著性差异(P<0.01);*表示与四氯化碳组比较有显著性差异(P<0.05);**表示与四氯化碳组比较有极显著性差异(P<0.01)。
组别剂量/(mg/kg)MDA含量/(nmol/mg)T-AOC/(U/mg)空白对照组4.54±1.211.34±0.13四氯化碳组6.73±1.87▲▲0.75±0.22▲▲银杏叶黄酮组953.87±1.91*1.62±0.33*VE组951.68±0.23**1.21±0.22**
通过表4能够得出,银杏叶黄酮组与空白组相比较,能够显著降低小鼠肝组织中MDA含量(P<0.05),小鼠肝组织里T-AOC水平明显升高,同四氯化碳组相比差异显著(P<0.05),从而可得出银杏叶黄酮组可降低肝组织细胞过氧化速度,抑制肝匀浆中生成MDA,从而提高小鼠抗氧化能力,说明银杏叶黄酮具有抗氧化作用。
2.3.2银杏叶黄酮对脂质过氧化小鼠血清各指标的影响
测定脂质过氧化小鼠血清中MDA含量和SOD活性、T-AOC水平,结果见表5。
根据表5可知,血清中抗氧化指标中,和四氯化碳组相比,银杏叶黄酮组MDA量变少,SOD活性、TAOC显著地提高(P<0.05),能够得出银杏叶黄酮可增强机体抗氧化的能力,对CCl4所导致的脂质过氧化能够起到明显抑制作用。银杏叶黄酮组增加SOD活性、T-AOC的效果好于VE组。
表5 银杏叶黄酮对脂质过氧化小鼠血清抗氧化指标的影响(±s,n=20)Table 5Effect of Ginkgo biloba flavonoids on lipid peroxidation in mouse serum antioxidant(±s,n=20)
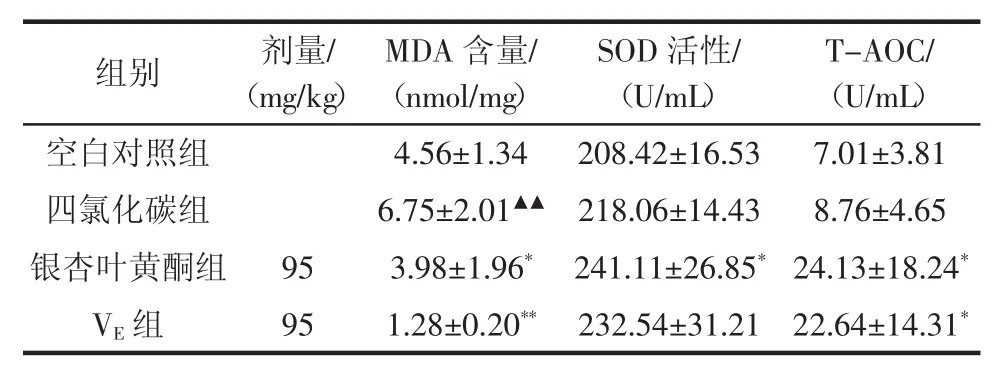
表5 银杏叶黄酮对脂质过氧化小鼠血清抗氧化指标的影响(±s,n=20)Table 5Effect of Ginkgo biloba flavonoids on lipid peroxidation in mouse serum antioxidant(±s,n=20)
注:▲表示与空白对照组比较有显著性差异(P<0.05);▲▲表示与空白对照组比较有极显著性差异(P<0.01);*表示与四氯化碳组比较有显著性差异(P<0.05);**表示与四氯化碳组比较有极显著性差异(P<0.01)。
T-AOC/(U/mL)空白对照组4.56±1.34208.42±16.537.01±3.81四氯化碳组6.75±2.01▲▲218.06±14.438.76±4.65银杏叶黄酮组953.98±1.96*241.11±26.85*24.13±18.24*VE组951.28±0.20**232.54±31.2122.64±14.31*组别剂量/(mg/kg)MDA含量/(nmol/mg)SOD活性/(U/mL)
3 结论
超声波辅助提取银杏叶黄酮各因素对银杏叶黄酮得率的影响大小依次是提取时间>提取功率>提取温度>料液比。最佳工艺条件为:提取功率80 W,提取时间40 min,提取温度70℃,料液比1∶25(g/mL),在此条件下银杏叶黄酮得率为27.32 mg/g。银杏叶黄酮组小鼠肝组织中MDA含量,能提高模型组小鼠肝组织中的T-AOC水平,表明银杏叶黄酮可增强机体抗氧化能力。银杏叶黄酮提高SOD活性、T-AOC水平的效果优于VE组。因此,银杏叶黄酮具有较好的抗氧化作用。
[1]林建原,季丽红.响应面优化银杏叶中黄酮的提取工艺[J].中国食品学报,2013,13(2):83-90
[2]汪素娟,康安,狄留庆,等.银杏叶提取物主要活性成分药动学研究进展[J].中草药,2013,44(5):626-631
[3]王敏,陆兆新,吕凤霞,等.响应曲面法优化酶法提取银杏叶总黄酮[J].食品科学,2007,28(3):117-121
[4]孙笑槐.银杏叶中有效成分的研究进展[J].中国科技信息,2011,12(4):111-116
[5]徐怀德,秦盛华.超声波辅助提取光皮木瓜多糖及其体外抗氧化性研究[J].食品科学,2010,35(10):106-111
[6]马亚琴,叶兴乾,吴厚玖,等.超声波辅助提取植物活性成分的研究进展[J].食品科学,2010,16(21):459-463
[7]周泉城,孙军凤.超声波辅助提取桔梗多糖研究[J].食品科学,2007,23(7):111-116
[8]徐建国,田呈瑞,胡青平,等.响应面法优化槐花水溶性多糖的超声波辅助提取工艺[J].食品科学,2011,11(4):112-116
[9]唐津忠,鲁晓翔,陈瑞芳.金莲花中黄酮类化合物的提取及其抗氧化性研究[J].食品科学,2003,34(6):88-91
[10]侯学敏,李林霞,张直峰,等.响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J].食品科学,2013,18(6):124-128
[11]王卫东,赵志鸿,张小俊,等.陈皮提取物中黄酮类化合物及抗氧化的研究[J].食品工业科技,2007,21(9):98-100
[12]Li Wang,XiaodanLi,MengNiu,etal.Effectofadditiveson flavonoids,d-chiro-Inositol and trypsin inhibitor during the germination of tartary buckwheat seeds[J].Journal of Cereal Science,2013,45(582):43-48
[13]孙丽萍,徐响,廖磊,等.油菜蜂花粉黄酮醇苷的体内外抗氧化研究[J].食品科学,2010,31(19):359-362
[14]Yuya Yang,Bai Lu,Xiaorong Li,et al.Transport of active flavonoids,based on cytotoxicity and lipophilicity:an evaluation using the blood-brain barrier cell and Caco-2 cell models[J].Toxicology in Vitro,2013,32(65):114-118
[15]Zun-Lai Sheng,Peng-Fei Wan,Chun-Liu Dong,et al.Optimization of total flavonoids content extracted from Flos Populi using response surface methodology[J].Industrial Crops&Products,2013,13(43):167-169
[16]Qinghu Wang,Bagenna Bao,Yulan Chen,et al.Simultaneous determination of six flavonoids in rat plasma by high-performance capillary electrophoresis and its application to a pharmacokinetic study[J].Journal of Food and Drug Analysis,2013,65(214):231-235
[17]Daniela Ribeiro,Marisa Freitas,Sara M.Tomé,Artur M.S,et al.Inhibition of LOX by flavonoids:a structure-activity relationship study[J].European Journal of Medicinal Chemistry,2014,34(72):217-220
[18]Yingling Wei,Ai-Yun Peng,Bo Wang,et al.Synthesis and biological evaluation of phosphorylated flavonoids as potent and selective inhibitors of cholesterol esterase[J].European Journal of Medicinal Chemistry,2014,43(74):43-48
Study on the Ultrasonic Assisted Extraction of Flavonoids from Ginkgo biloba and Its Anti-oxidation Effect in vitro
FANG Lei
(Jilin Agriculture Science and Technology College,Jilin 132101,Jilin,China)
Ultrasonic assisted extraction flavonoids of Ginkgo biloba and anti-oxidation effect in vitro.Singlefactor and orthogonal experiment to optimize ultrasonic assisted extraction flavonoids process,the effect of Ginkgo biloba flavonoids MDA and T-AOC of liver tissue.The results showed:the best technology:extraction power 80 W,extraction time 40min,extraction temperature 70℃,solid-liquid ratio 1∶25(g/mL),under this condition flavonoids was 27.32 mg/g.Ginkgo biloba flavonoids can significantly reduce the content of MDA in liver tissue(P<0.05),and improve the mouse liver tissue T-AOC level,indicated that Ginkgo biloba flavonoids can enhance the organism anti-oxidation capacity.
Ginkgo biloba;flavonoids;ultrasonic assisted extraction;anti-oxidation
10.3969/j.issn.1005-6521.2016.17.038
2016-02-01
房磊(1983—),男(汉),讲师,硕士,研究方向:体育运动营养保健。
