明日叶总黄酮的纯化工艺研究
2016-10-18朱芳郑奎玲韦万丽廖莉玲王正武
朱芳,郑奎玲,韦万丽,廖莉玲,*,王正武
(1.贵州师范大学化学与材料科学学院,贵州贵阳550001;2.上海交通大学农业与生物学院,上海200240)
明日叶总黄酮的纯化工艺研究
朱芳1,郑奎玲1,韦万丽1,廖莉玲1,*,王正武2
(1.贵州师范大学化学与材料科学学院,贵州贵阳550001;2.上海交通大学农业与生物学院,上海200240)
采用静态-动态吸附与解析相结合的方法,从12种树脂中筛选出纯化明日叶总黄酮最佳的树脂并对其纯化工艺条件进行探讨。结果表明:HPD-600大孔树脂对明日叶总黄酮有较好的吸附、解析效果。最佳纯化条件为:上柱液中总黄酮质量浓度控制在2 mg/mL~3 mg/mL之间,以3 BV/h的流速过柱,树脂达吸附饱和的上样量为2.7 BV;洗脱条件为:用蒸馏水冲洗至无色后,改用4 BV,50%乙醇以2 BV/h流速进行洗脱。经HPD-600树脂纯化后,明日叶总黄酮的纯度由14.46%提升至46.96%,提升近3.2倍。
明日叶;总黄酮;纯化;大孔树脂
明日叶又名长寿菜,属原生芹科多年生草本植物,原产于日本八丈岛[1]。它是一种药食兼用的植物,在临床上常用来治疗泌尿和便秘[2]。研究表明,明日叶富含查尔酮、类黄酮、香豆素、有机锗、维生素B12等多种有效成分[3]。查尔酮具有抗癌、抗糖尿病、降血脂、抗血管疾病等功效,类黄酮具有抗氧化、抗菌、抗肿瘤活性的功效[4],因此研究明日叶中总黄酮的分离、纯化有重要意义。
迄今为止,对明日叶的提取已有较多的研究报道[5-7],但明日叶总黄酮的纯化研究却鲜见报道。大孔树脂在天然产物活性成分的分离方面因具有操作简便、价格低廉、易吸附、解析、再生效果好等优点而备受青睐[8],为了寻求更适合纯化明日叶总黄酮的树脂,本文采用静态-动态吸附与解析相结合的方法,从12种树脂中筛选出纯化明日叶总黄酮的最佳树脂,并对该树脂纯化明日叶黄酮的条件进行研究,为明日叶的开发和应用提供理论参考。
1 材料与方法
1.1材料、试剂与仪器
芦丁:贵州迪大科技有限责任公司;明日叶:贵州健康茶科技有限公司;D301、NKA-9、S-8、ADS-7、HP-20、X-5、HPD-600、HPD-826、聚酰胺(60目~100目)、聚酰胺(30目~60目):沧材料州宝恩吸附材料有限公司;FL-1、FL-2:天津欧瑞生物科技有限公司;其余试剂均为分析纯。
L5s分光光度计:上海仪电;RE-52型旋转蒸发器:上海科导超声仪器有限公司;A200S型电子天平:sartorius公司。
1.2方法
1.2.1标准曲线的确定
采用NaNO2-Al(NO3)3比色法测定[10],以芦丁为标准品,在200 nm~700 nm波长范围扫描,确定其最大吸收波长为513 nm。在513 nm处测定标准系列的吸光度,以吸光度对浓度作图。得回归方程为:Y=11.223X-0.000 7,R2=0.999 6。
1.2.2明日叶粗提取液的制备
按照文献[6]将明日叶粉末与30%的乙醇按1∶15(g/mL)的料液比在超声波条件下,提取两次,每次40 min,提取温度50℃。合并两次提取液,抽滤,旋蒸至无乙醇味备用。
1.2.3树脂的预处理
先用蒸馏水把树脂充分泡涨后,加无水乙醇浸泡24 h,然后用蒸馏水冲洗至无乙醇味;改用3%HCl溶液浸泡5 h之后用蒸馏水冲至中性;再用3%NaOH溶液浸泡5 h后用蒸馏水冲洗至中性,处理好的树脂用蒸馏水浸泡待用。
1.2.4大孔树脂筛选
1.2.4.1静态吸附-解析试验
准确称量2g处理好的树脂放于250mL锥形瓶中,加入50mL明日叶提取液(总黄酮浓度为1.145mg/mL),放入恒温水浴振荡器上振荡12 h,使其达到饱和吸附,取上清液,按1.2.1方法显色测其吸光度,计算各树脂的吸附率。分离吸附饱和的树脂,用蒸馏水洗涤,再加入95%的乙醇50 mL解吸,同样条件下置于恒温振荡器上振荡12 h,测其上清液中黄酮的浓度,计算各树脂的解吸率。以吸附量、吸附率和解吸率为指标,考察各树脂的性能,选出适宜的树脂进行动态吸附。
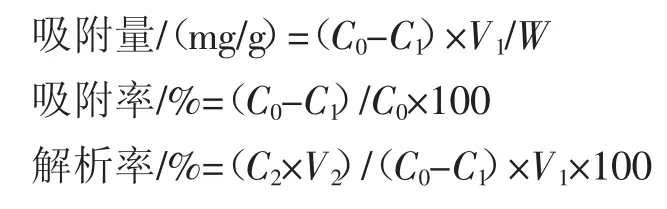
式中:C0为黄酮类化合物起始浓度,mg/mL;C1为吸附平衡后黄酮类化合物的浓度,mg/mL;C2为解析液中黄酮类化合物的浓度,mg/mL;V1为吸附原液体积,mL;V2为解吸液体积,mL;W为树脂质量,g。
1.2.4.2动态吸附-解析试验
通过静态吸附试验挑选出4种性能较好的树脂,进一步比较树脂的动态吸附和解吸性能。采用湿法装柱,分别将处理好的FL-1、HP-20、HPD-600、X-5 4种树脂装入(1.5 cm×40 cm)玻璃层析柱中,装柱体积为30 mL。各取200 mL(总黄酮浓度为1.81 mg/mL)明日叶提取液上柱,流速控制在2 BV/h,过柱液每10 mL收集1管,测其黄酮浓度。以总黄酮浓度对累积体积数作图,制作不同树脂的泄露曲线。用蒸馏水冲洗柱子至流出液无色,分别用100mL0%、10%、30%、50%、70%、90%的乙醇梯度洗脱,每25 mL收集1管测黄酮浓度,制作洗脱曲线。
1.2.5HPD-600纯化黄酮的单因素试验
1.2.5.1上样浓度对动态吸附的影响
将处理好的树脂装入层析柱中,装柱体积为30mL,取质量浓度分别为1.00、2.09、3.03、4.08、5.19 mg/mL的提取液各200 mL过柱,流速为2 BV/h,收集过柱液,测其吸光度,计算出不同浓度下树脂的吸附率。以吸附率对浓度作图,选出最佳上样浓度。
1.2.5.2上样流速对动态吸附的影响
湿法装柱,装柱30 mL,各取150 mL提取液(黄酮浓度为2.77 mg/mL)以2、3、4 BV/h的流速过柱,10 mL收集1管,以流出液黄酮浓度对上样体积作图得到不同的泄露曲线。
1.2.5.3洗脱量对动态吸附的影响
装柱30 mL,取80 mL上样液(黄酮浓度为2.462 mg/mL),以3 BV/h的流速过柱,收集过柱液,测其吸光度计算树脂吸附量。用蒸馏水冲至流出液无色,改用50%乙醇洗脱,洗脱流速控制在2 BV/h,每15 mL收集1管洗脱液,测其吸光度计算每管黄酮的含量,以总黄酮的含量对累积50%乙醇洗脱液体积作图,绘制洗脱曲线。确定最佳洗脱量。
2 结果与分析
2.1大孔树脂对总黄酮的静态吸附与解吸
不同树脂对明日叶总黄酮静态吸附、解析结果如表1所示。

表1 不同树脂对明日叶总黄酮静态吸附、解析结果Table 1The result of static adsorption and desorption on different types of macroporous resin

续表1不同树脂对明日叶总黄酮静态吸附、解析结果Continue table 1The result of static adsorption and desorption on different types of macroporous resin
由表1可以看出D301、NKA-9、S-8、ADS-7几种树脂的吸附率较高,但解析效果差。FL-2树脂容易解析,但吸附的少。综合考虑选择吸附率和解析率都较好的4种树脂FL-1、HP-20、HPD-600、X-5继续做动态试验考察。
2.2动态吸附试验筛选结果
2.2.14种树脂的动态泄露曲线
以柱流液黄酮浓度达上样液黄酮浓度的10%作为树脂吸附饱和点,作树脂的动态泄露曲线,如图1所示。
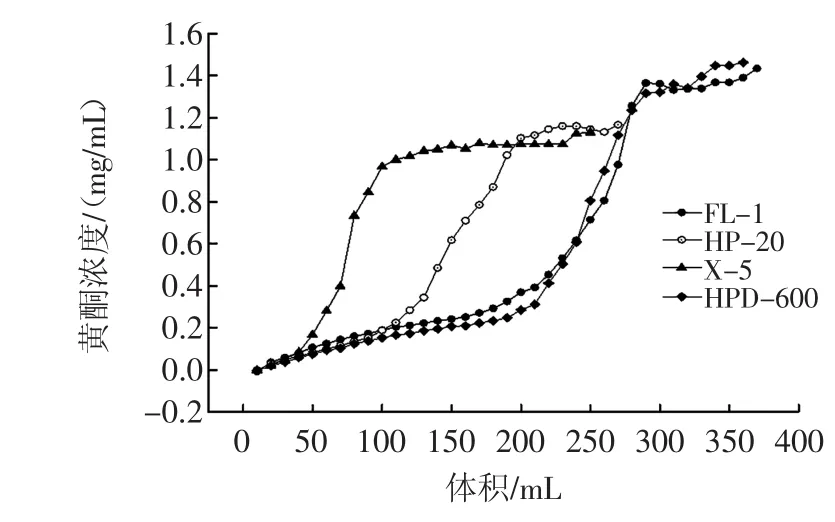
图1 树脂的动态泄露曲线Fig.1Dynamic leak curve of resin
由图1可以看出,在相同浓度(1.81 mg/mL)下,不同的树脂对明日叶总黄酮的吸附量不同,FL-1和HP-20两种树脂均在3.3 BV(100 mL)达吸附饱和,X-5树脂泄露较快,在2 BV(60 mL)达到吸附饱和,吸附量较少不予考虑。HPD-600在4.3 BV(130 mL)达吸附饱和,吸附量最大,所以对明日叶总黄酮纯化最佳树脂是HPD-600。
2.2.2洗脱曲线
树脂的洗脱曲线如图2所示。
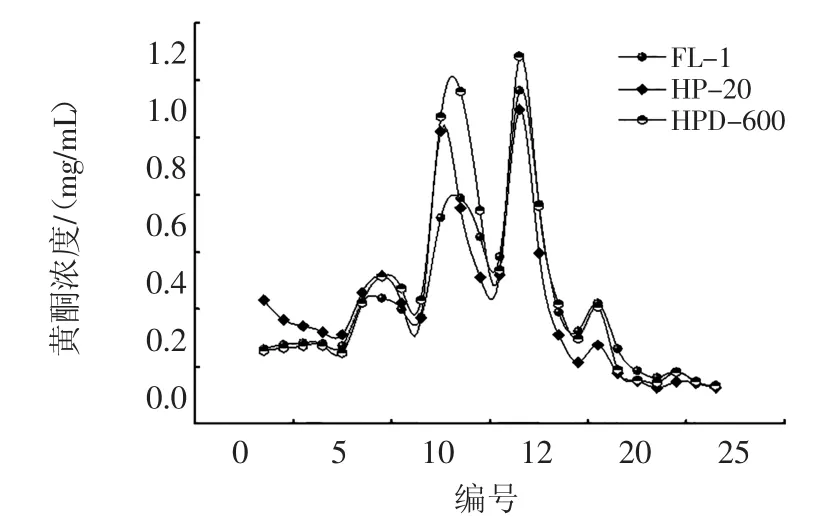
图2 洗脱曲线Fig.2The eluting curve
由图2可见,3种树脂的洗脱曲线大体一致,总黄酮主要在30%和50%乙醇洗脱部分,可以看出30%乙醇洗脱不完全,所以选用50%的乙醇洗脱。经计算FL-1的总解析率为75.51%,HP-20的总解析率为77.37%,HPD-600的总解析率为82.94%,结合动态穿透曲线和洗脱曲线,HPD-600不仅吸附量大,洗脱率也比其他两种高,所以选HPD-600纯化明日叶总黄酮。
2.3HPD-600动态吸附单因素试验结果
2.3.1上样浓度对树脂吸附率的影响
上样浓度对总黄酮吸附率的影响如图3所示。
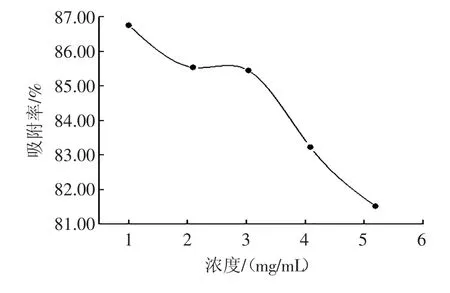
图3 上样浓度对总黄酮吸附率的影响Fig.3The effect of initial concentration on kinetic absorption capacity
由图3可见,上样浓度对树脂的吸附有明显的影响,随着上样浓度的增加,树脂对黄酮的吸附能力降低。上样浓度在1.00 mg/mL时吸附率最高,达86.75%,但浓度过低,增加上柱时间;浓度超过3.03 mg/mL时,吸附率明显下降。综合考虑,最佳上样浓度应控制在2 mg/mL~3 mg/mL之间。
2.3.2上样流速对吸附率的影响
上样流速对总黄酮吸附率的影响如图4所示。
由图4可见,以相同的浓度(2.77 mg/mL)上柱,流速为2、3 BV/h时,相同体积的流液中黄酮浓度相差不大,到2.7 BV(80 mL)时,树脂达吸附饱和。当流速为4 BV/h时,流出液中黄酮浓度明显高出2、3 BV/h流速,吸附量减少,而流速过慢,生产时间延长。综合考虑吸附量及生产时间,以3 BV/h为佳。

图4 上样流速对总黄酮吸附率的影响Fig.4Effect of sample flowing rate on the adsorption capacity
2.3.3洗脱剂用量试验的影响
洗脱剂用量曲线图如图5所示。

图5 洗脱剂用量曲线图Fig.5Determination of optimum elution volume
由图5可看出当洗脱量为3 BV(90 mL)时,洗脱液中黄酮含量很少,为了保证充分洗脱,洗脱量以4 BV(120 mL)为宜,此时洗脱率达87.12%。
2.4验证试验
取80 mL 2.453 mg/mL的明日叶提取液,以3 BV/h过柱,用蒸馏水冲洗柱子至流出液为无色,改用120 mL 50%的乙醇溶液洗脱,洗脱流速控制在2 BV/h收集洗脱液测其吸光度,测定洗脱液浓度为1.095 mg/mL,总黄酮量为131.4 mg。回收率达67%。将洗脱液旋干成粉末准确称取40.4 mg溶于25 mL容量瓶中,测黄酮含量,计算得样品中黄酮的纯度为46.96%,比郭晓青[9]等报道的纯化后明日叶黄酮纯度29.2%高出17.76%。将浓度为2.453 mg/mL的提取液旋干成粉末,准确称取42.1 mg溶于25 mL容量瓶中,测黄酮含量,计算其纯度为14.56%。经大孔树脂HPD-600纯化后,明日叶中总黄酮纯度提升近3.2倍。
3 结论
1)12种树脂的静态吸附-解析试验表明FL-1、HP-20、HPD-600、X-5 4种树脂的吸附解析效果都比较好。
2)通过动态吸附-解析试验以树脂最大吸附量以及解析率为指标筛选出最佳树脂为HPD-600。
3)HPD-600树脂纯化明日叶黄酮最佳的工艺条件为上样浓度在2 mg/mL~3 mg/mL,上样流速控制在3 BV/h,上样量2.7 BV,用蒸馏水冲至无色后,改用4 BV 50%乙醇进行洗脱。在最佳纯化工艺条件下,明日叶总黄酮的纯度由14.46%提升至46.96%,提升近3.2倍。
[1]韩曙,张云选,张宏,等.珍惜蔬菜-明日叶[J].长江蔬菜,2002(2):11-11
[2]Enoki T,Ohnogi H,Nagamine K,et al.Antidiabetic activities of chalcones isolated from a Japanese Herb,Angelica keiskei[J].Journal of agricultural and food chemistry,2007,55(15):6013-6017
[3]Li J,Gao L,Meng F,et al.PTP1B inhibitors from stems of Angelica keiskei(Ashitaba)[J].Bioorganic&medicinal chemistry letters,2015,25(10):2028-2032
[4]Akihisa T,Tokuda H,Ukiya M,et al.Chalcones,coumarins,and flavanones from the exudate of Angelica keiskei and their chemopreventive effects[J].Cancer letters,2003,201(2):133-137
[5]宁鸿珍,陈欣华,王曼曼,等.超声波辅助提取明日叶查尔酮的工艺优化[J].食品研究与开发,2014,35(8):34-37
[6]张卓,张彩云,郑青云,等.明日叶中总黄酮的超声提取工艺优化[J].安徽农业科学,2014,42(24):8156-8158
[7]邓锐,皱毓兰,单虎,等.明日叶中总黄酮的提取工艺优化和检测方法的对比研究[J].食品工业,2012(2):44-46
[8]Jia G,Lu X.Enrichment and purification of madecassoside and asiaticoside from Centella asiatica extracts with macroporous resins[J]. Journal of Chromatography A,2008,1193(1):136-141
[9]郭晓青,吴金鸿,周焱富,等.明日叶叶水溶性总黄酮提纯工艺[J].食品科学,2012,33(22):27-32
[10]刘程程,韦万丽,廖莉玲.6种黔产清热类中草药主要抗氧化成分的含量[J].贵州农业科学,2012,40(2):41-43
Studies on Purification of Flavonoids from Angelica Keiskei
ZHU Fang1,ZHENG Kui-ling1,WEI Wan-li1,LIAO Li-ling1,*,WANG Zheng-wu2
(1.School of Chemistry and Materials Science,Guizhou Normal University,Guiyang 550001,Guizhou,China;2.School of Agriculture and Biology,Shanghai Jiaotong University,Shanghai 200240,China)
In this paper,12 types of macroporous resins were tested by Static and dynamic adsorption and desorption experiments for purifying flavonoids from Angelica keiskei,and purifying conditions by the best resin were investigated.The results showed that:HPD-600 was the best resin;adsorption conditions were as follows:3 BV/h adsorption velocity,concentration of sample 2 mg/mL-3 mg/mL,2.7 times volume of resin as sample volume;desorption conditions were as follows:rinsing the resins with deionized water until the effluent was colorless and then eluting under 2 BV/h adsorption velocity,using 50%ethanol,4 times volume of resin as eluent. the purity of flavonoids purified with HPD-600 macroporous resin was improved from 14.46%to 46.96%,which was approximately 3.2 times higher than the original sample.
angelica keiskei;flavonoids;purification;macroporous resin
10.3969/j.issn.1005-6521.2016.17.019
2015-10-14
贵州省科学技术厅中药现代化攻关项目(黔科合ZY字[2012]3012号);贵阳市科技局现代药业计划项目(筑科合同[2012204]号)
朱芳(1989—),女(汉),硕士,研究方向:分析化学。
廖莉玲,教授,硕士。
