甘露醇和烯效唑对培育马铃薯试管壮苗的影响
2016-10-18王东霞杨宏羽
王东霞,杨宏羽,张 峰,曹 东
(1. 甘肃农业大学农学院,甘肃 兰州 730070; 2.甘肃农业大学园艺学院, 甘肃 兰州 730070;3.甘肃农业大学生命科学与技术学院, 甘肃 兰州 730070; 4.中国科学院西北高原生物研究所, 青海 西宁 810008)
甘露醇和烯效唑对培育马铃薯试管壮苗的影响
王东霞1,杨宏羽2,张峰3,曹东4
(1. 甘肃农业大学农学院,甘肃 兰州 730070; 2.甘肃农业大学园艺学院, 甘肃 兰州 730070;3.甘肃农业大学生命科学与技术学院, 甘肃 兰州 730070; 4.中国科学院西北高原生物研究所, 青海 西宁 810008)
用不同浓度甘露醇和烯效唑处理马铃薯试管苗,来探究在组织培养条件下甘露醇和烯效唑对培育马铃薯试管苗壮苗的影响。试验设置对照组(CK)和处理组,处理组分别A(10 g·L-1甘露醇)、B(20 g·L-1甘露醇)、C(30 g·L-1甘露醇)、D(40 g·L-1甘露醇)、E(0.001 mg·L-1烯效唑)、F(0.002 mg·L-1烯效唑)、G(0.003 mg·L-1烯效唑)和H(0.004 mg·L-1烯效唑)9个水平,分别在第30天和第60天取样测定。结果表明,培养30 d和60 d后,适宜浓度甘露醇(20 g·L-1)和烯效唑(0.003 mg·L-1)处理马铃薯试管苗,植株矮化(株高:82.54±3.84 mm和67.41±1.67 mm,30 d;93.74±1.30 mm和68.78±1.16 mm,60 d)且茎增粗(茎粗:1.45±0.03 mm和1.32±0.05 mm,30 d;1.80±0.13 mm和1.65±0.03 mm,60 d),鲜重达最大值(鲜重:1.35±0.04 g和1.32±0.04 g,30 d;1.75±0.09 g和1.53±0.04 g,60 d),马铃薯试管苗根长、根粗、根表面积和根体积也显著高于对照;同时,该处理下试管苗抗氧化酶超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性均达最大值。由此可知,甘露醇和烯效唑能促进马铃薯试管苗增粗矮化生长,使试管苗根系较发达,组织培养抗氧化酶活性增强,降低了活性氧对马铃薯试管苗造成的伤害,从而有利于培育壮苗。
甘露醇;烯效唑;马铃薯;组织培养;壮苗;抗氧化性
马铃薯(SolanumtuberosumL.)是一种无性繁殖作物,因此在大田种植过程中容易感染病毒,从而引起马铃薯品种种性退化,影响其品质和产量。利用植物组织培养技术培育茎尖脱毒试管苗能够有效防止马铃薯种性退化,但是在马铃薯种质资源的试管苗保存中也面临着种性退化的问题,主要是因为随着继代次数的增加,培养时间的延长,马铃薯试管苗长势变弱,茎变细,节间增长,叶片偏黄,根变粗变短等现象,使其繁殖系数和栽培成活率不断降低,最终影响微型薯的生产潜力;严重者会产生变异苗,种性退化,失去种质资源保存的意义。
甘露醇是一种高渗化合物,在培养基中不易被植物吸收,主要作用是通过调节培养基的渗透压,抑制植物对可利用水分和养分的吸收,直接降低植物可利用的水分,从而达到延缓生长的目的[1]。有研究报道,在培养基中加入具有生长抑制作用的生长调节物质如矮壮素、B9、甘露醇等,可以减缓植株生长速率,延长培养时间,使试管苗保存更久[2-6]。有关甘露醇对马铃薯试管苗保存的影响,结论各不相同,王娟等[7]认为在培养基中加入0.01%~0.1%的甘露醇,就能很好地抑制试管苗的生长,达到延缓生长的目的;周明德等[8]研究表明,在培养基中添加5%的甘露醇,试管苗的保存时间可以达11个月;黄萍等[9]认为在继代培养基中加1%~2%的甘露醇,试管苗可保存7个月,且成活率过半,不影响试管苗的繁殖培养。
烯效唑是一种植物生长延缓剂,由于烯效唑高效、低毒、残留量小、不污染环境,因此具有广阔的应用前景。园艺植物中,烯效唑有抑制植物生长,矮化增粗,改善株型,促进分枝和分蘖、促根壮苗、延缓衰老、提高抗逆性和增加产量等生理效应[10],并使得植物叶片面积增大、叶片增重增厚,叶绿素含量增高,光合作用增强[11],但烯效唑在马铃薯壮苗研究中较少。尹敬芳等[12]研究用1.0 mg/L的烯效唑浸种处理对番茄幼苗生长的影响,结果表明其幼苗根系活力和叶绿素含量都明显提高,光合速率也高于对照,生理上表现出壮苗,经烯效唑处理后的番茄幼苗,超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)等保护酶的活性比对照明显提高,从而增强了幼苗的抗逆能力。Krvg对风信子的矮化研究表明,使用烯效唑浸泡种球,能使植株矮化[13]。周祖富等[10]用不同浓度的烯效唑处理罗汉果试管苗,结果表明,浓度为0.01~0.1 mg·L-1的烯效唑能有效抑制罗汉果试管苗的伸长,使苗矮化增粗,且根系发达,苗健壮。
培育健壮的试管苗是马铃薯种质资源有效保存的关键,但目前有关甘露醇和烯效唑对培育马铃薯试管壮苗影响的研究较少,因此本研究以马铃薯普通栽培品种“大西洋”试管苗为实验材料,探究不同浓度的甘露醇和烯效唑在不同阶段对培育马铃薯壮苗的影响,并确定最佳浓度,为培育马铃薯试管壮苗提供指导,从而保证优良种质资源的长期保存。
1 材料与方法
1.1材料培养
供试材料为马铃薯“大西洋”试管苗,由甘肃省作物遗传改良与种质创新重点实验室提供。将生长较壮的马铃薯试管苗单节茎段,接种到普通MS培养基[14](MS+蔗糖3%,琼脂5%,pH 5.8)上,每瓶扦插5个茎段。培养温度23℃±1℃,光照时间16 h·d-1,光照强度2000 lx,培养25 d。将生长较壮,长势较一致的试管苗,剪取等长的单节茎段转接到加有不同浓度甘露醇(10、20、30 g·L-1和40 g·L-1,分别用A,B,C和D表示)和烯效唑(0.001、0.002、0.003 mg·L-1和0.004 mg·L-1,分别用E,F,G和H表示)的液体MS培养基(MS+蔗糖3%,不加琼脂,pH 5.8)中,每瓶扦插3个茎段,保证养分充足,每处理15株,三次重复,即每水平共15瓶。23℃±1℃,光照时间16 h·d-1,光照强度2000 lx,以不加甘露醇和烯效唑的处理作为对照,用CK表示。分别培养30 d和60 d。
本研究中用的甘露醇(分析纯)和烯效唑(分析纯)分别由国药集团化学试剂有限公司和金坛生物科技有限公司提供。
1.2试验方法
1.2.1生长指标的测定在第30天和第60天分别从各处理的试管壮苗中,选择长势一致且具代表性植株,对株高、茎粗和鲜重进行测定。株高是茎基部到生长点的距离(mm);茎粗为主茎基部的粗度(mm);单株鲜重为整个植株的重量(g)。
1.2.2根形态测定在第30天和第60天分别从各处理的试管壮苗中,选择长势一致且具代表性植株,剪取整个根部,将取得的根样用Regent公司生产的WinRHIZO根系形态分析系统进行分析测定,统计根长、根表面积、根粗和根体积。
1.2.3抗氧化酶活性测定超氧化物歧化酶(SOD)活性采用NBT光还原法;过氧化物酶(POD)活性的测定采用用愈创木酚氧化法;过氧化氢酶(CAT)活性采用紫外吸收法。均参照植物生理学实验指导[15]。
1.3统计分析
试验进行3次重复,各数据均以平均数±标准误表示。数据应用Excel 2003和SPSS 19.0软件完成统计分析。各处理间数据采用方差分析(ANOVA),以Duncan法检测差异显著性,差异水平P<0.05。
2 结果与分析
2.1甘露醇和烯效唑对试管苗生长的影响
由表1可知,所有处理浓度的甘露醇和烯效唑对试管苗都有矮化作用,且矮化效果显著。生长30 d,与CK相比,试管苗株高分别降低了17.97、22.05、48.30、72.77、19.80、29.16、37.18 cm和61.38 cm(P<0.05);与培养30 d相比,培养60 d后,各处理的株高变化无显著差异,且与对照相比,其变化规律和30 d处理一致(P<0.05)。茎粗是衡量壮苗的重要指标之一,本研究中,通过测试管苗主茎基部来获取茎粗数据,由表1可以看出,生长30 d,与对照相比,高浓度的甘露醇(40 g·L-1)和低浓度的烯效唑(0.001 mg·L-1)使得试管苗茎变细,其他处理均使试管苗茎增粗,0.003 mg·L-1和0.004 mg·L-1烯效唑和20 g·L-1甘露醇处理增粗较多,分别比对照增粗0.23、0.11 mm和0.36 mm;但生长60 d,20 g·L-1甘露醇和0.003 mg·L-1烯效唑处理茎增粗较多,分别比对照增粗0.53 mm和0.38 mm。试管苗的鲜重由根和地上部分共同决定,是通过协调茎粗和株高,根粗与根长以及整个植株碳水化合物的积累来决定的。培养30 d,与对照相比,0.003 mg·L-1烯效唑和20 g·L-1甘露醇处理,试管苗鲜重增加最多,分别比对照增多0.27 g·株-1和0.30 g·株-1;生长60 d,20 g·L-1甘露醇处理,试管苗鲜重增加最多,比对照增加了0.60 g·株-1,0.003 mg·L-1烯效唑处理次之,比对照增加了0.38 g·株-1。由此得出,0.003 mg·L-1烯效唑和20 g·L-1甘露醇处理,可以有效矮化试管苗,且有利于茎粗以及鲜重的增加,可以有效地培育壮苗,但相比之下,20 g·L-1甘露醇比0.003 mg·L-1烯效唑的作用效果好。

表1 不同浓度甘露醇和烯效唑处理30天和60天对马铃薯试管苗株高、茎粗和鲜重的影响
注:不同字母表示在P<0.05水平有显著差异。
Note: Different letters represent significant difference ofP<0.05.
2.2甘露醇和烯效唑对试管苗根形态的影响
2.2.1甘露醇和烯效唑对试管苗根长的影响由图1可知,甘露醇和烯效唑处理30天,试管苗根长的变化趋势基本一致。与对照相比,低浓度的甘露醇使得试管苗根长有所增长,10 g·L-1处理比对照显著增长2.78 cm,20 mg·L-1处理增长不显著;高浓度甘露醇和烯效唑,抑制根的伸长。30 g·L-1和40 g·L-1的甘露醇使得根长比对照减少2.77 cm和4.06 cm;0.001、0.002、0.003 mg·L-1和0.004 mg·L-1的烯效唑分别使根长比对照减少0.36、0.64、1.61 cm和3.79 cm(P<0.05)。与30 d相比,60 d处理根长均明显增长。与对照相比,10 g·L-1和20 g·L-1甘露醇,0.003 mg·L-1烯效唑处理后的根长显著增长,分别比对照增长5.10、4.10 cm和8.73 cm。由此可得出,10 g·L-1和20 g·L-1甘露醇,0.003 mg·L-1烯效唑促进根的伸长,有利于培育试管壮苗。
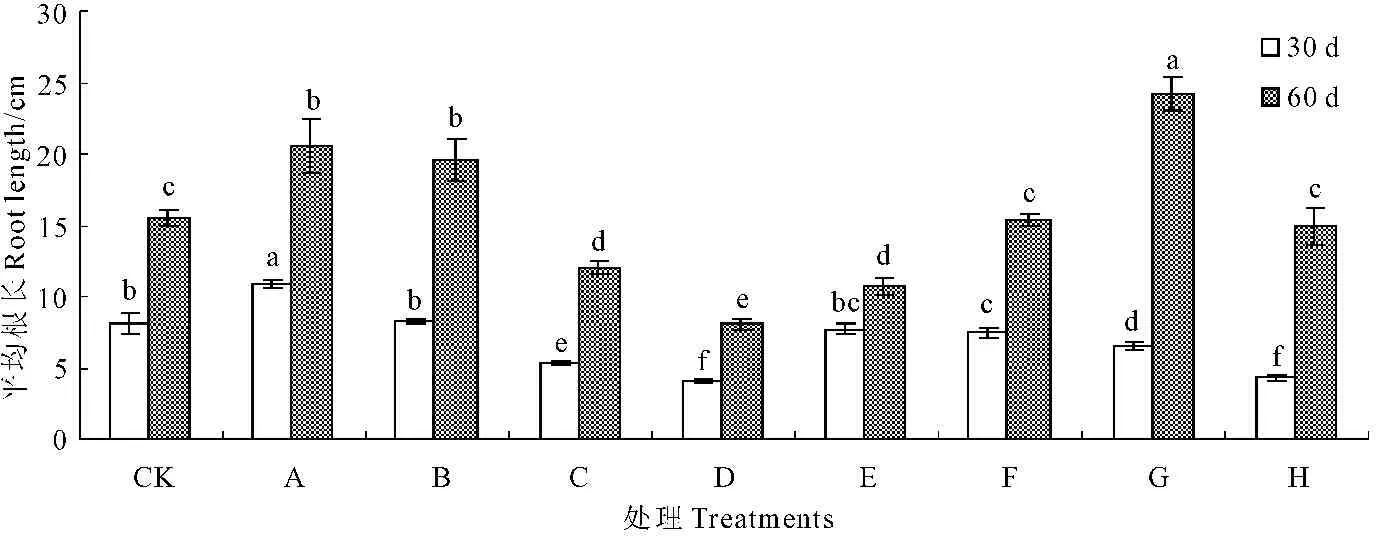
注:不同字母表示在P<0.05水平有显著差异。下同。
Note: Different letters represent significant difference ofP<0.05, and hereinafter.
图1不同浓度甘露醇和烯效唑处理30 d和60 d对马铃薯试管苗根长的影响
Fig.1Influence of mannitol and uniconazole with different concentrations on the potato seedlings
root length at the 30th day and the 60th day
2.2.2甘露醇和烯效唑对试管苗根表面积的影响
不同浓度甘露醇和烯效唑对马铃薯试管苗根表面积的影响较显著。如图2所示,培养30 d,与对照相比,10 g·L-1和20 g·L-1的甘露醇使得根表面积比对照分别增大0.28 cm2和0.66 cm2,其他浓度甘露醇和烯效唑处理下的根表面积增加不显著或使得表面积显著减小。培养60 d后,与30 d相比,包括对照在内的一些处理,根表面积大幅度增加。20 g·L-1的甘露醇处理,根表面积达最大值,是对照的2.4倍;10 g·L-1的甘露醇和0.003 mg·L-1,0.004 mg·L-1烯效唑次之,分别是对照的1.86、1.74倍和1.06倍。由此说明,低浓度的甘露醇(10 g·L-1和20 g·L-1)和高浓度的烯效唑(0.003 mg·L-1和0.004 mg·L-1)有利于根表面积的增加。
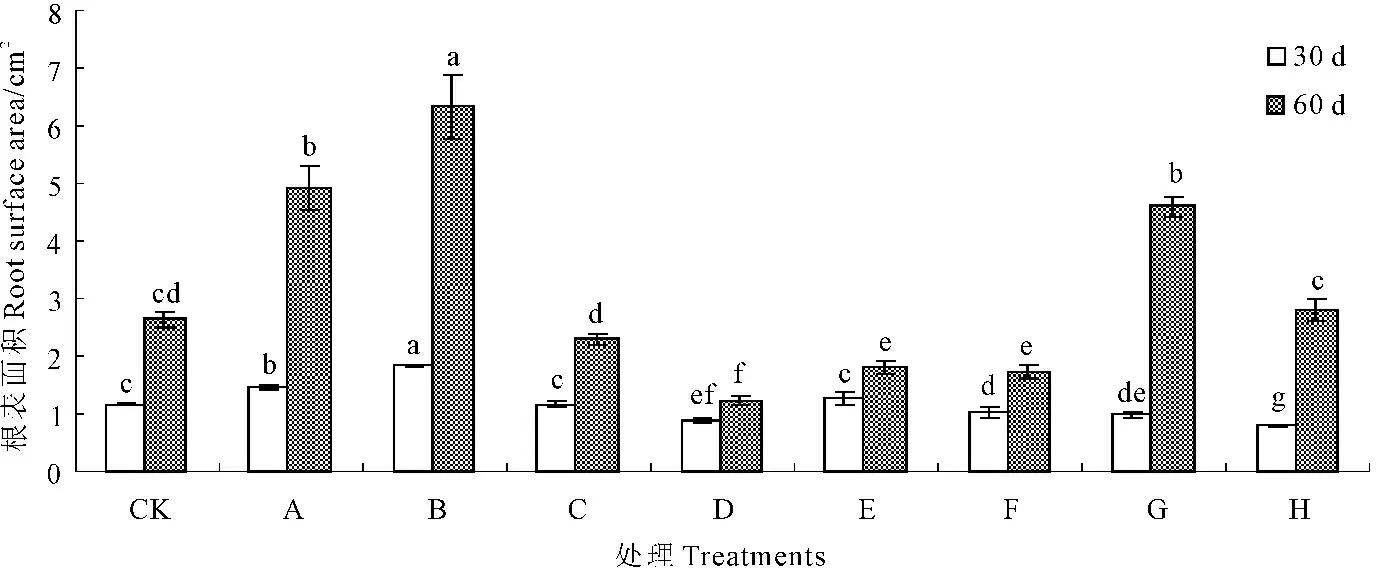
图2不同浓度甘露醇和烯效唑处理30 d和60 d对马铃薯试管苗根表面积的影响
Fig.2Influence of mannitol and uniconazole with different concentrations on the potato seedlings
root surface area at the 30th day and the 60th day
2.2.3甘露醇和烯效唑对试管苗根粗的影响由图3可知,培养30 d或60 d,不同浓度的甘露醇和烯效唑处理,试管苗根粗的变化趋势基本一致,均随浓度的增大而呈现增粗的趋势,但增粗的程度不同。培养30 d时,0.003 mg·L-1烯效唑处理,根粗达最大值,是对照的1.80倍,0.001、0.002、0.003 mg·L-1和0.004 mg·L-1的烯效唑处理,根粗分别是对照的0.83、1.09倍和1.20倍;不同浓度甘露醇处理分别增加1.23、1.63、1.34倍和1.02倍。培养60 d时,20 g·L-1的甘露醇处理,根增粗最多,是对照的2.83倍,10、30 g·L-1的甘露醇和0.003 mg·L-1的烯效唑次之,根粗分别是对照的2.00、1.66倍和2.11倍。由此说明,20 g·L-1的甘露醇和0.003 mg·L-1的烯效唑最有利于马铃薯试管苗根增粗。
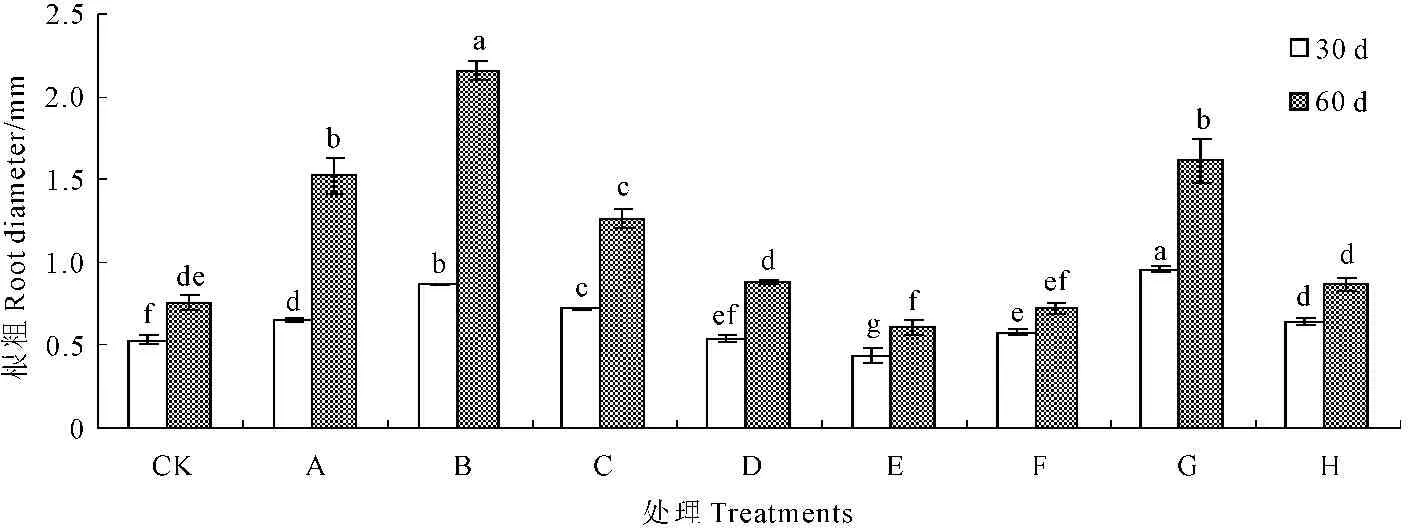
图3不同浓度甘露醇和烯效唑处理30 d和60 d对马铃薯试管苗根粗的影响
Fig.3Influence of mannitol and uniconazole with different concentrations on the potato seedlings
root diameter at the 30th day and the 60th day
2.2.4甘露醇和烯效唑对试管苗根体积的影响甘露醇和烯效唑对试管苗根体积的影响由图4可知。培养30 d,与对照相比,低浓度的甘露醇(10 g·L-1和20 g·L-1)促进试管苗根体积的增大,分别是对照的1.09倍和1.36倍,高浓度的甘露醇(30 g·L-1和40 g·L-1)抑制试管苗根体积的增大,分别是对照的0.42倍和0.37倍。不同浓度的烯效唑(0.001、0.002、0.003 mg·L-1和0.004 mg·L-1)处理,根体积依次是对照的0.72、0.83、1.09倍和0.69倍;与30 d相比,培养60 d,包括对照在内的所有处理根体积都增大,与对照相比,低浓度的甘露醇(10 g·L-1和20 g·L-1)和较高浓度烯效唑(0.003 mg·L-1)促进根体积增大,分别是对照的1.17、1.96倍和1.35倍。其他处理均有不同程度的抑制作用。由此可见,20 g·L-1甘露醇和0.003 mg·L-1烯效唑处理,根体积增大较多,其中20 g·L-1甘露醇处理增大最多。
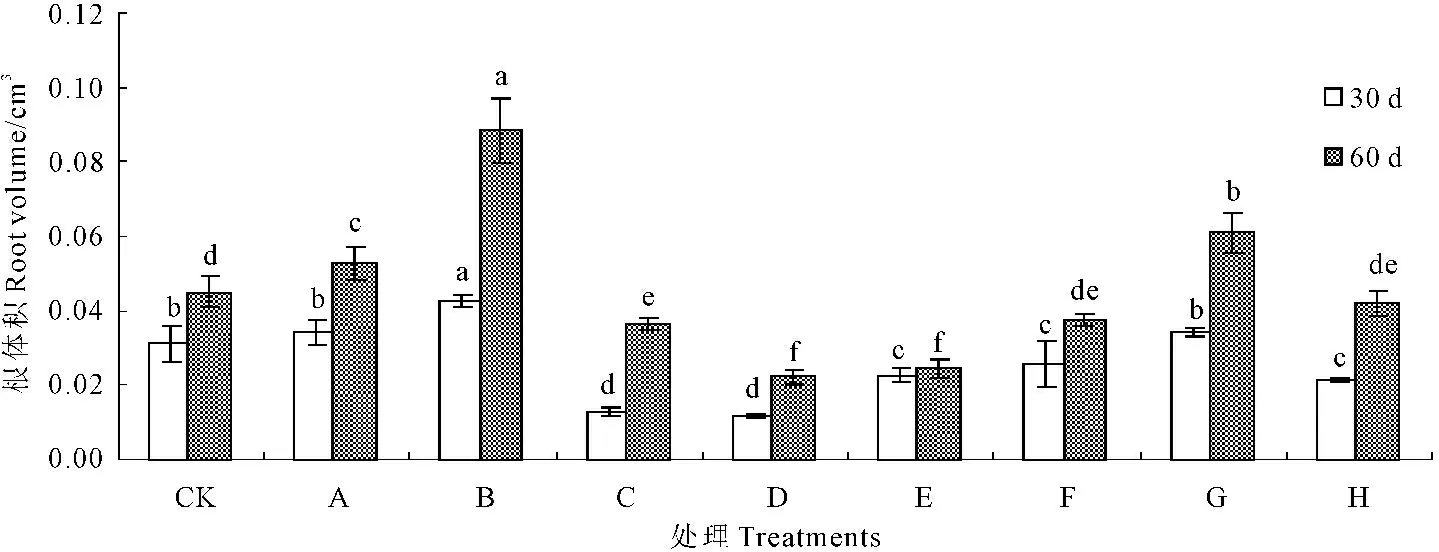
图4不同浓度甘露醇和烯效唑处理30 d和60 d对马铃薯试管苗根体积的影响
Fig.4Influence of mannitol and uniconazole with different concentrations on the potato seedlings
root volume at the 30th day and the 60th day
2.2.5甘露醇和烯效唑对试管苗抗氧化酶的影响SOD是植物体内抑制氧自由基对细胞膜系统伤害的一类金属酶(金属酶是指含有一种或几种金属离子作为辅基的结合酶)。由图5可以看出,培养30 d,经不同浓度甘露醇和烯效唑处理后的马铃薯试管苗,SOD活性变化各不相同,其中20 g·L-1甘露醇和0.003 mg·L-1烯效唑处理,SOD活性比对照显著升高,其他浓度的甘露醇和烯效唑处理使其SOD活性有不同程度的降低,其中0.001 mg·L-1烯效唑处理,SOD活性最低,是对照的0.78倍。培养60 d,与培养30 d相似,SOD活性也出现两个峰值,分别是20 g·L-1甘露醇和0.003 mg·L-1烯效唑处理,由此说明,马铃薯试管苗SOD活性受20 g·L-1甘露醇和0.003 mg·L-1烯效唑影响最大。
POD是一种活性氧自由基清除剂,可以防止由细胞膜脂过氧化作用而引起的损害。由图6可以看出,培养30 d或60 d,随着甘露醇和烯效唑浓度的升高,POD活性先升高后降低,当甘露醇浓度20 g·L-1和烯效唑浓度0.003 mg·L-1时,POD活性最高,分别是对照的1.79倍和1.42倍(30 d)、1.80倍和1.45倍(60 d)。其他浓度的甘露醇和烯效唑处理,无论是培养30 d还是60 d,均使POD活性不同程度增强。


图5 不同浓度甘露醇和烯效唑处理30 d和60 d对马铃薯试管苗SOD活性的影响
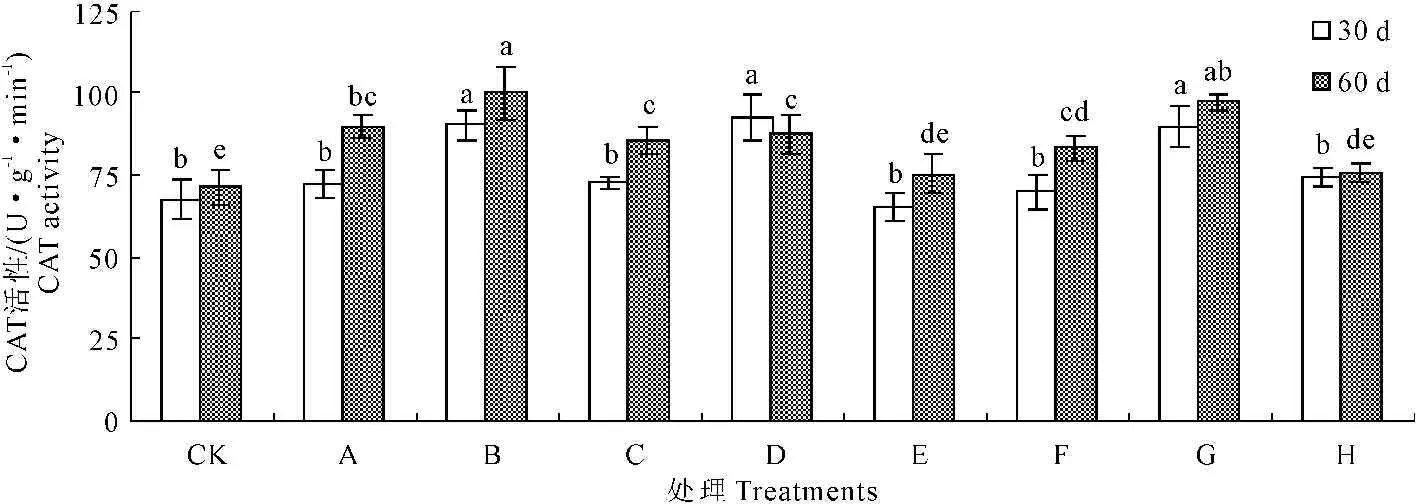
图6 不同浓度甘露醇和烯效唑处理30 d和60 d对马铃薯试管苗POD活性的影响
图7不同浓度甘露醇和烯效唑处理30天和60天对马铃薯试管苗CAT活性的影响
Fig.7Influence of mannitol and uniconazole with different concentrations on the potato seedlings
CAT activity at the 30th day and the 60th day
CAT是细胞内抗氧化防御酶之一,与POD一样,是一种活性氧自由基清除剂。由图7可知,培养30 d和60 d,各浓度的甘露醇和烯效唑处理马铃薯试管苗,其CAT活性均增强,在20 g·L-1甘露醇和0.003 mg·L-1烯效唑处理下出现峰值,培养30 d分别是对照的1.34倍和1.33倍;培养60 d分别是对照的1.40倍和1.36倍。
3 讨论与结论
培育壮苗是马铃薯种质资源能够长期稳定保存的先决条件之一。然而在马铃薯试管苗保存过程中,由于试管苗变弱,节间增长变细,叶片失绿,光合效率降低,侧根数减少,主根变细而影响了整个植株养分和水分的供应,不利于试管苗的继代培养,对马铃薯种质资源的保存更是较大的威胁。
甘露醇是一种调节植物渗透压的物质,培养时对植物细胞无毒害,在生理学研究中用作组织液吸收剂[16],在进行植物组织培养时,一定浓度的甘露醇可以抑制植物的生长,因此种质资源保存时运用比较广泛[17]。甘露醇是一种生长延缓剂,在植物组织培养过程中,可以有效改变植物的形态特征,杨卫民等[18]用甘露醇处理黑豆,其形态特征和生长态势发生明显变化。杜亚琼等[17]用甘露醇处理拟南芥,其形态特征发生显著变化,株型紧凑,叶面积减小,根系发达,抗氧化酶活性不同程度增强,从而提高植株的抗性。本研究中用不同度的甘露醇处理,结果表明20 g·L-1甘露醇处理30 d或60 d后,马铃薯试管苗植株矮化,节间缩短,茎变粗,叶片颜色暗绿,根系发达,SOD,POD和CAT活性随培养时间的延长而增强,可见只要供给充足的养分,该试管苗可以长期保存。
烯效唑是一种三唑类植物生长调节剂,其作用机理与多效唑(PP333)相似,可以减弱植株顶端优势,促进侧芽生长,延缓植株根茎的纵向生长,促进生根,增强抗逆性[19]。烯效唑的作用是减缓植物生长的速率,并提高其抗逆性。它对植物生长的调控作用是通过抑制生物体内赤霉素的生物合成过程而完成的[20]。杨伟力等[21]和杨国放等[22]通过对马铃薯叶面喷洒烯效唑,结果其烯效唑表现出控上促下,二者均可使植株高度降低,抗氧化酶(SOD,POD和CAT)活性增强。本研究中,0.003 mg·L-1烯效唑处理马铃薯试管苗,使植株矮化增粗,根系发达,SOD、POD和CAT活性均增强,提高了试管苗的抗性和适应性,这与前人的研究结果相吻合,更有利于马铃薯试管苗继代培养,有利于种质资源稳定长期的保存。
综上所述,适宜浓度的甘露醇(20 g·L-1)和烯效唑(0.003 mg·L-1)均可矮化植株,并使其适应性和抗性增强,二者都可用于大量实验研究和种质资源保存研究,且甘露醇的作用效果略好于烯效唑。
[1]李润,王伟,刘绍文,等.不同温度和甘露醇浓度对马铃薯试管苗保存的影响[J].农业科技通讯,2014,(9):155-158.
[2]李方,陈昆松,夏宜平,等.B9和PP333对马铃薯试管苗生长的影响[J].浙江农业学报,2001,13(2):67-71.
[3]裘文达,李芳,秦文清,等.PP333对马铃薯试管苗生长和长期保存的影响[J].浙江农业人学学报,1995,21(3):252-256.
[4]赵建萍,蒋小满,柏新富,等.PP333、B9和CCC对脱毒马铃薯试管苗繁殖的影响[J]. 植物生理学通讯,2003,39(6):571-574.
[5]张小静,李鹏程,陈富,等.三种植物生长延缓剂对马铃薯试管苗生长和保存的影响[J].作物杂志,2012,(5):117-120.
[6]艾辛,夏志兰,刘明月,等.植物生长调节剂对马铃薯试管苗生长和保存的影响[J].湖南农业大学学报(自然科学版),2005,31(5):514-517.
[7]王娟.马铃薯种质资源保存试验[J].中国马铃薯,2010,24(5):278-280.
[8]周明德.马铃薯种质试管苗保存[J].作物品种资源,1989,(3):43.
[9]黄萍,马朝宏,颜谦.甘露醇对马铃薯试管苗生长和有效保存期的影响[J].西南农业学报,2011,24(6):2446-2448.
[10]周祖富,艾素云,杨美纯,等.烯效唑对罗汉果试管苗生长的影响[J].福建果树,2005,(1):13-15.
[11]李宁毅,李之璞.烯效唑在园艺植物上的应用[J].北方园艺,2008,(6):62-64.
[12]尹敬芳,陈凤玉,李健强,等.烯效唑浸种处理对番茄幼苗生长及其生理性状的影响[J].中国农业大学学报,2004,9(2):8-11.
[13]Krvg B A,Whipker B E,Mccall I,et al. Comparison of flurprimidol to ethephon,Paclobutrazol and Uniconazole for hyacinth height control[J]. Hort Technoology,2005,15(4):872-874.
[14]Murashige T,Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures[J]. Physiologia Plantarum,1962,15:473-497.
[15]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:166-170.
[16]赵宇玮,郝建国,步怀宇,等.小麦耐甘露醇变异细胞系的离体筛选及植株再生I[J]. 西北大学学报(自然科学版),2005,(35):184-190.
[17]杜亚琼,王子成.甘露醇对拟南芥基因组DNA甲基化的影响[J].植物学报,2011,46(3):285-292.
[18]杨卫民,刘宝琦,张世珍.甘露醇、过氧化氢和氯化钠处理对黑豆苗期抗旱性的影响[J].大豆科学,2010,(29):350-353.
[19]张梅,孙治军,杨守军.多效唑(PP333)在马铃薯组培快繁中的应用[J].山东农业科学,2006,(4):43-44.
[20]郝建军,康宗利.植物生理学[M].北京:化学工业出版社,2005.
[21]杨伟力,刘涛,胡涛,等.烯效唑对马铃薯块墓品质的影响[J].黑龙江农业科学,2006,(3):49-50.
[22]杨国放,姜河,纪志雨,等.叶面喷施烯效唑对马铃薯生长及产量的影响[J].辽宁农业科学, 2006,(2):81-82.
The in vitro effects of mannitol and uniconazole on cultivation of potato seedlings
WANG Dong-xia1, YANG Hong-yu2, ZHANG Feng3, CAO Dong4
(1.CollegeofAgronomy,GansuAgricultureUniversity,Lanzhou,Gansu730070,China;2.CollegeofHorticulture,GansuAgriculturalUniversity,Lanzhou,Gansu730070,China;3.CollegeofLifeSciencesandTechnology,GansuAgriculturalUniversity,Lanzhou,Gansu730070,China;4.NorthwestInstituteofPlateauBiology,ChineseAcademyofSciences,Xining,Qinghai810008,China)
To explore the effects of mannitol and uniconazole with different concentrations on healthy potato seedlings by in vitro tissue culturing, a test containing a control group (CK) and treatments group including A (10 g·L-1Mannitol), B (20 g·L-1Mannitol), C (30 g·L-1Mannitol), D (40 g·L-1Mannitol), E (0.001 mg·L-1Uniconazole), F (0.002 mg·L-1Uniconazole), G (0.003 mg·L-1Uniconazole), and H (0.004 mg·L-1Uniconazole) was carried out by repeating three times for every level. Samples were measured at the 30th and 60th days, respectively. The results indicated that after 30 days and 60 days with appropriate Mannitol (20 g·L-1) and Uniconazole (0.003 mg·L-1) treatments, potato seedlings were dwarf (Plant height: 82.54±3.84 mm and 67.41±1.67 mm at the 30th day; 93.74±1.30 mm and 68.78±1.16 mm at the 60th day) and thickened (Stem diameter: 1.45±0.03 mm and 1.32±0.05 mm at the 30 th day; 1.80±0.13 mm and 1.65±0.03 mm at the 60th day). Also, fresh weight of potato reached to the maximum (Fresh weight per plant: 1.35±0.04 g and 1.32±0.04 g at the 30th day; 1.75±0.09 g and 1.53±0.04 g at the 60th day). In addition, seedlings root length, diameter, surface area and volumes were also significantly higher than CK. Meanwhile, the enzymatic activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) were increased and reached the maximum under these treatments. Therefore, Mannitol and Uniconazole were beneficial for thickening and dwarfing of potato seedlings, root system enhancement, and increased antioxidant enzyme activities and decrease in damage of potato seedlings by active oxygen, which is conducive in cultivating strong seedlings.
mannitol; uniconazole; potato; in vitro tissue culturing; seedlings; inoxidizability
1000-7601(2016)04-0094-07
10.7606/j.issn.1000-7601.2016.04.14
2015-06-20
甘肃省省青年科技基金计划项目(1308RJYA068)
王东霞(1988—),女,甘肃靖远人,博士研究生,主要从事马铃薯育种研究。E-mail:wangdx1127@163.com。
杨宏羽(1980—),女,甘肃敦煌人,讲师,主要从事马铃薯育种研究。E-mail:yanghongyu3969@gsau.edu.cn。
S532
A
