羧胺三唑与SAHA联合用药抑制Lew is肺癌细胞的体内外研究Δ
2016-10-18郭磊陈晨吴宏亮鞠瑞朱蕾李娟叶菜英中国医学科学院基础医学研究所药理学系北京00005中国医学科学院肿瘤医院麻醉科北京000
郭磊 陈晨 吴宏亮 鞠瑞 朱蕾 李娟 叶菜英#中国医学科学院基础医学研究所药理学系,北京00005中国医学科学院肿瘤医院麻醉科,北京 000
羧胺三唑与SAHA联合用药抑制Lew is肺癌细胞的体内外研究Δ
郭磊1*陈晨1*吴宏亮2鞠瑞1朱蕾1李娟1叶菜英1#
1中国医学科学院基础医学研究所药理学系,北京1000052中国医学科学院肿瘤医院麻醉科,北京100021
目的研究羧胺三唑(CAI)与组蛋白去乙酰化酶抑制剂辛二酰苯胺异羟肟酸(SAHA)联合用药对Lew is肺癌细胞的抑制作用,对比联合用药与单药使用的药效差异。方法采用SRB法检测体外培养的Lew is肺癌细胞系在单独使用CAI或SAHA以及联合用药时的细胞活力变化;建立C57小鼠Lew is肺癌细胞皮下移植瘤模型,随机分为4组:溶剂对照组、CAI组、SAHA组、CAI+SAHA联合治疗组,连续给药25天,观察各组小鼠体质量变化、肿瘤体积、肿瘤抑制率及动物死亡情况。结果CAI分别和两种剂量的SAHA联合用药后,对Lew is肺癌细胞活力的抑制作用高于CAI组,细胞活力的抑制率分别达到46.09%±5.50%和54.43%±3.69%,差异均有统计学意义(P<0.01)。动物实验显示,与对照组相比,CAI组、SAHA组以及联合治疗组均抑制小鼠皮下肿瘤生长,且联合治疗组的肿瘤体积小于其他3组;除对照组外,各药物治疗组动物死亡率均低于20%。结论SAHA与CAI联合使用能显著抑制Lew is肺癌细胞活力,并在Lew is肺癌细胞荷瘤动物中显现抗瘤增效作用。
Lew is肺癌细胞;羧胺三唑;辛二酰苯胺异羟肟酸;联合用药;体内外研究
Kew words:Lew is lung carcinoma;carboxyam idotriazole;suberoylanilide hydroxam ic acid;combined treatment;in vitro and in vivo study
Oncol Prog,2016,14(4)
肺癌是目前全球死亡率最高的肿瘤之一,虽然针对特定类型的肺癌治疗已取得突破性进展,但大部分肺癌依然无法攻克,关于肺癌的药物治疗仍有极大的探索空间。羧胺三唑(carboxyam idotriazole,CAI)是本课题组多年来一直研究的一种小分子药物,该药物能够抑制多种肿瘤细胞系的增殖、侵袭和转移,并可诱导多种肿瘤细胞凋亡。体外实验中,CAI对于Lew is肺癌细胞、A549肺腺癌细胞、NCI-H209和H345小细胞肺癌细胞的增殖均有显著抑制作用[1-2],且CAI用于治疗非小细胞肺癌的III期临床试验也正在进行中。本课题组在体内实验中发现,CAI单独使用时相比细胞毒类药物其抗肿瘤作用较弱,但其突出特点是不良反应轻微。为了改进羧胺三唑的抗肿瘤效果,特选取了一种组蛋白去乙酰化酶抑制剂辛二酰苯胺异羟肟酸(suberoylanilide hydroxam ic acid,SAHA)进行联合用药,从细胞水平和动物水平评估两种小分子药物联合使用的抗肿瘤效果,为建立高效低毒的肺癌治疗方案提供实验依据。
1 材料与方法
1.1实验材料
Lew is肺癌(lew is lung carcinoma,LLC)细胞购自中国科学院上海生命科学研究院细胞资源中心,用DMEM高糖培养基(加入10%胎牛血清、1% L-谷氨酰胺、50 mg/m l青霉素和100 mg/m l链霉素)在37℃、5%CO2培养箱中培养。CAI由本课题组合成,高效液相色谱法检测其纯度达99%以上。SAHA购自美国Selleck公司,用DMSO配制成10 mmol/L储存液,-20℃保存。磺酰罗丹明B(sulforhodamine B,SRB)染料、二甲基亚砜(DMSO)购自Sigma公司,三氯乙酸(trichloroacetic acid,TCA)、乙酸、Tris碱购自国药集团化学试剂有限公司,羟丙基-β-环糊精(hydroxypropyl-beta-cyclodextrin,HOP-β-CD)购自百灵威科技有限公司。
1.2实验动物
C57BL/6小鼠,雄性[许可证号:SCXK(京)2014-0004],6~8周龄,购自北京华阜康生物科技股份有限公司。常温环境饲养[温度(22±2)℃,湿度40%~70%],12 h明/暗周期。动物自由摄食、饮水。
1.3实验方法
1.3.1SRB法测定细胞活力将LLC细胞接种至96孔板,1×104/孔,培养12 h,待细胞贴壁后,弃去原培养基,分别加入空白培养基(不含血清)和含有DMSO、CA(I20 μM)、SAHA(1 μM和5 μM)以及SAHA(1 μM和5 μM)+CA(I20 μM)的完全培养基(含血清)200 μl进行孵育,SAHA单药及联合用药剂量参照同类研究用量而定[3],每个剂量组4孔。药物作用24 h后,每孔加入50 μl预冷的50%三氯乙酸进行固定。4℃静置1 h,去离子水洗涤5次。在空气中晾干后,每孔加入1%乙酸配制的0.4%SRB染料100 μl,室温静置20 min。弃去染料后,用1%的乙酸洗涤5次,在空气中晾干。用pH值为10.5的10 mM非缓冲Tris碱液150 μl溶解,振摇5 min后用全波长酶标仪在515 nm处测定吸光度。
1.3.2动物接种肿瘤LLC细胞贴壁长满单层后用0.25%胰蛋白酶消化,将细胞悬液缓慢吹打混匀,1000 r/min离心5 m in,收集细胞,用灭菌的PBS重悬,调整细胞密度为1×107/m l。每只小鼠取100 μl细胞悬液,皮下接种至左侧腋窝。接种肿瘤细胞后第5天,在动物腋窝下可触到瘤结节,荷瘤动物随机分组并给药,给药方案如表1所示。

表1 CAI及SAHA单独用药与联合用药给药方案
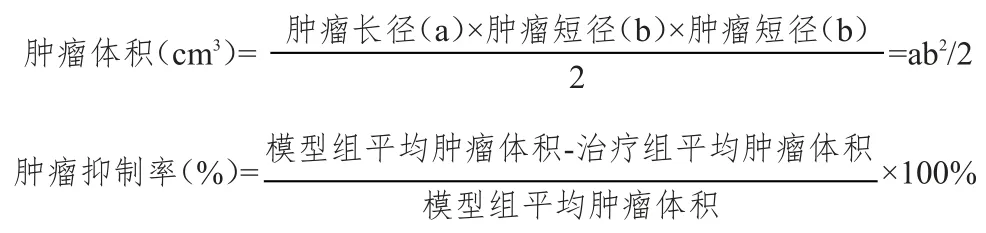
1.3.3测量肿瘤体积并评价肿瘤抑制率自接种肿瘤后第8天,每周测量3次肿瘤长、宽直径,根据如下公式,计算肿瘤体积(长、宽单位:cm):
1.3.4评价药物毒性每日称量小鼠体质量,并绘制小鼠体质量变化曲线。根据接种肿瘤后第5天(给药前)和接种肿瘤后第29天(给药后)的动物体质量,计算末体质量(FBW)/初体质量(IBW),其中FBW为29天时小鼠的去瘤体质量。FBW/IBW≥0.85,提示药物毒副作用轻微,小鼠能够耐受;FBW/IBW<0.85则提示小鼠对药物有一定的不良反应[4];治疗期间如果给药组动物死亡超过20%,表示药物具有毒性。
1.4统计学分析
实验结果采用SPSS 19.0软件进行统计分析。体外实验中,不同药物处理组进行单因素方差分析后,再进行两两组间LSD-t检验;动物荷瘤实验结果采用重复测量方差分析,评价药物单用及联合用药的抑瘤作用。P<0.05为差异有统计学意义。
2 结果
2.1CAI和SAHA单独或联合作用后对细胞活力的抑制作用
药物作用24 h后,CAI(20 μM)和SAHA(1 μM和5 μM)以及SAHA(1 μM和5 μM)+CAI(20 μM)均能够显著地降低LLC细胞的增殖活力,与溶剂对照组相比,分别下降了29.64%±2.42%(P<0.01),13.03%±4.67%(P<0.05)和39.56%±4.23%(P<0.01)。CAI和两种剂量SAHA联合用药组对细胞活力的抑制作用明显高于CAI单独治疗组,细胞活力的抑制率分别达到46.09%±5.50%和54.43%± 3.69%,差异均有统计学意义(P<0.01),SAHA对CAI的增效作用非常显著(图1)。
2.2CAI和SAHA单独或联合用药对荷瘤小鼠肿瘤体积的影响
从接种肿瘤后第20天(动物用药第16天)开始,CAI(30 mg/kg)与SAHA(50 mg/kg)联合治疗组的肿瘤体积开始明显小于溶剂对照(Control)组(P<0.05),同时也小于单药治疗组;接种肿瘤后第22、25、27、29天,SAHA单药治疗组的抑瘤作用逐步明显,肿瘤体积相比对照组显著缩小(P<0.05,P<0.01);CAI单药治疗组肿瘤体积虽有缩小趋势,但第22天和第25天的肿瘤体积与溶剂对照组相比差异无统计学意义;自第27天起,溶剂对照组肿瘤体积进一步增大,CAI组表现出显著的抑瘤作用(P<0.05)。CAI与SAHA联合治疗组的肿瘤体积则显著小于对照组和各单药治疗组,两者合用后的抗瘤增效作用十分明显(图2、图3)。

图1 CAI(20 μM)和SAHA(1μM和5μM)单独或联合作用后对细胞活力的抑制作用

图2 CAI组、SAHA组和联合治疗组荷瘤小鼠的肿瘤体积随时间的变化
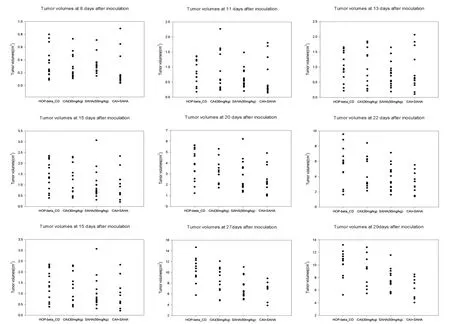
图3 接种肿瘤后第8~29天各组小鼠肿瘤体积分布图
2.3小鼠给药前后的体重比值(FBW/IBW)及各组动物的死亡情况
如表2所示,采用CAI(30 mg/kg)单药、SAHA(50 mg/kg)单药以及两者联合用药治疗25天后,各药物治疗组FBW/IBW值均大于0.85,提示药物毒副作用不明显,联合用药组的FBW/IBW为(0.99±0.05),相比单药治疗组并未减小,初步说明在此剂量下联合用药时药物的毒副作用没有增加。除对照组有4只小鼠因肿瘤体积过大死亡外,药物治疗组动物死亡比例均低于20%,亦说明药物的毒性低。
3 讨论
羧胺三唑是一种非细胞毒类的新型抗癌药物,它通过影响肿瘤细胞的信号传导体系干扰肿瘤细胞周期及促进肿瘤细胞凋亡,抑制肿瘤细胞增生和转移[5-8];此外,CAI还能够阻滞肿瘤血管生长因子(VEGF)的信号传导通路,抑制肿瘤新生血管内皮细胞,从而抑制肿瘤新生血管的生成,抑制肿瘤的生长和转移[9-10]。近年来,我们还证实CAI能明显地减轻化学物质引起的炎性反应及减轻炎症引起的疼痛,这一作用与其抑制多种炎性介质释放有关[11-12]。在美国进行的有关CAI抗肿瘤作用的一些临床试验未能得到理想的结果,迄今该药物尚未通过美国FDA的批准,但由于其作用靶点的特殊性,CAI不良反应轻微,明显低于细胞毒类药物,在肿瘤治疗领域仍具备独特的优势,寻找高效低毒的联合用药方案或可弥补CAI的不足。
表2 CAI、SAHA及CAI+SAHA组荷瘤小鼠的体质量变化和死亡情况(±s)

表2 CAI、SAHA及CAI+SAHA组荷瘤小鼠的体质量变化和死亡情况(±s)
?
组蛋白去乙酰化酶抑制剂(histone deacetylases inhibitor,HDACi)是一类新型的抗肿瘤药物,具有高效、低毒的特点,其作用于肿瘤细胞后能够抑制肿瘤细胞增殖,阻滞细胞周期,促进细胞分化或凋亡[13-14]。SAHA是最具代表性的组蛋白去乙酰化酶抑制剂之一,它能通过组蛋白的乙酰化使染色质重塑为促进基因转录的疏松结构,重新激活肿瘤细胞中由于异常的组蛋白去乙酰化而表达受阻的基因,诱导肿瘤细胞凋亡[15]。本研究首次考察了CAI与SAHA联合用药的抗肿瘤效果,体外实验结果显示,较低浓度的SAHA(1 μM和5 μM)能够明显增强CAI抑制Lew is肺癌细胞增殖的能力;体内实验则进一步证实SAHA(50 mg/kg)与CAI联合使用较单药更能有效地降低肿瘤负荷。而且,从荷瘤动物的体质量变化和死亡情况判断,该剂量的SAHA并未增加药物的毒性。
课题组近几年对CAI的抗肿瘤机制进行了深入研究后发现,CAI能够抑制肿瘤相关巨噬细胞分泌肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),基于此机制,体外实验显示其可抑制LLC细胞增殖、迁移和侵袭,在LLC荷瘤动物中降低肿瘤负荷并延长荷瘤动物生存期[2]。同样,SAHA除了具有抗肿瘤作用之外,还具有抗炎和抑制血管新生的特性。SAHA可阻断脐静脉内皮细胞中VEGF信号通路,抑制体内外致炎细胞因子的产生[16-17]。因此,关于SAHA与CAI合用时的抗瘤增效机制,一方面可能源于SAHA通过组蛋白的乙酰化,重新激活肿瘤细胞中表达受阻的基因,与CAI协同诱导肿瘤细胞凋亡;另一方面也可能是两者通过不同的、互补的机制抑制炎症,从而延缓肿瘤的发生发展。从分子、细胞和整体水平上证实上述作用机制将是我们后续的重点研究内容。
SAHA与CAI联合使用增加了对Lew is肺癌细胞的抑瘤效果而未增加毒副作用,这一优势为两者今后在临床上联合使用、增效互补提供了理论依据,也代表了一种可能的新型、有效、耐受良好的化疗方案。
[1]Moody TW,Chiles J,Moody E,et al.CAI inhibits the grow th of small cell lung cancer cells[J].Lung Cancer,2003,39(3):279-288.
[2]Rui J,Danwei W,Lei G,et al.Inhibition of pro-inflammatory cytokines in tumor associated macrophages is a potential anti-cancer mechanism of carboxyamidotriazole[J].Eur J Cancer,2011,48(7):1085-1095.
[3]Sato A,Asano T,Horiguchi A,et al.Combination of suberoylanilide hydroxam ic acid and ritonavir is effective against renal cancer cells[J].Urology,2010,76(3):764.e7-e13.
[4]王全凯,杨全会,郭静,等.人肝癌组织裸鼠移植瘤模型建立及其应用[J].中草药,2014,45(3):398-402.
[5]Winters ME,Mehta AI,Petricoin III EF,et al.Supra-additive grow th inhibition by a celecoxib analogue and carboxyam ido-triazole is primarily mediated through apoptosis[J]. Cancer Res,2005,65(9):3853-3860.
[6]Perabo FG,Wirger A,Kamp S,et al.Carboxyam ido-triazole(CAI),a signal transduction inhibitor induces grow th inhibition and apoptosis in bladder cancer cells by modulation of Bcl-2[J].Anticancer Res,2004,24(5A):2869-2877.
[7]Enfissi A,Prigent S,Colosetti P,et al.The blocking of capacitative calcium entry by 2-aminoethyl diphenylborate(2-APB)and carboxyam idotriazole(CAI)inhibits proliferation in Hep G2 and Huh-7 human hepatoma cells[J].Cell Calcium,2004,36(6):459-467.
[8]Guo L,Li ZS,Wang HL,et al.Carboxyamido-triazole inhibits proliferation of human breast cancer cells via G2/M cell cycle arrest and apoptosis[J].Eur J Pharmacol,2006,538(1-3):15-22.
[9]Ge S,Rempel SA,Divine G,et al.Carboxyam ido-triazole induces apoptosis in bovine aortic endothelial and human glioma cells[J].Clin Cancer Res,2000,6(4):1248-1254.
[10]Bauer KS,Cude KJ,Dixon SC,et al.Carboxyamido-triazole inhibits angiogenesis by blocking the calcium-mediated nitric-oxide synthase-vascular endothelial grow th factor pathway[J].J Pharmacol Exp Ther,2000,292(1):31-37.
[11]Guo L,Ye CY,Hao XJ,et al.Carboxyam idotriazole ameliorates experimental colitis by inhibitions of cytokine production,nuclear factor-κB activation and colonic fibrosis[J].J Pharmacol Exp Therap,2012,342(1):356-365.
[12]Guo L,Ye CY,Chen WY,et al.Anti-inflammatory and analgesic potency of carboxyamidotriazole,a tumorostatic agent[J].J Pharmacol Exp Therap,2008,325(1):10-16.
[13]Delcuve GP,Khan DH,Davie JR.Targeting class I histone deacetylases in cancer therapy[J].Expert Opin Ther Targets,2013,17(1):29-41.
[14]Newbold A,Lindemann RK,Cluse LA,et al.Characterisation of the novel apoptotic and therapeutic activities of the histone deacetylase inhibitor romidepsin[J].Mol Cancer Ther,2008,7(5):1066-1079.
[15]Kelly WK,Marks PA.Drug insight:Histone deacetylase inhibitors-development of the new targeted anticancer agent suberoylanilide hydroxamic acid[J].Nat Clin Pract Oncol,2005,2(3):150-157.
[16]Leoni F,Zaliani A,Bertolini G,et al.The antitumor histone deacetylase inhibitor suberoylanilide hydroxam ic acid exhibits antiinflammatory properties via suppression of cytokines[J].ProcNatlAcad SciUSA,2002,99(5):2995-3000.
[17]Deroanne CF,Bonjean K,Servotte S,et al.Histone deacetylases inhibitors as antiangiogenic agents altering vascular endothelial grow th factor signaling[J].Oncogene,2002(21):427-436.
In vitro and in vivo study of the inhibitory effect of the combination of CAI and SAHA on Lew is lung carcinoma cellsΔ
GUO Lei1*CHEN Chen1*WU Hong-liang2JU Rui1ZHU Lei1LI Juan1YE Cai-ying1#
1Department of Pharmacology,Institute of Basic Medical Sciences,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100005,China
2Department of Anesthesiology,Cancer Hospital,Chinese Academy of Medical Sciences and Peking Union Medical College,Beijing 100021,China
Objective To study the inhibitory effect of the combination of CAI and SAHA on Lew is lung carcinoma(LLC)and evaluate the pharmacodynam ic difference between the combined and single-agent treatment.Method SRB was performed to investigate the viability of LLC cells treated w ith CAI or SAHA alone,or in combination;LLC transplanted model was established in C57 m ice and the models were random ized into 4 groups,namely vehicle control group,CAI group,SAHA group and CAI+SAHA combination group.The indicated solvent or drugs were adm inistered continuously for 25 days and the change of body weight,tumor volume,tumor inhibition rate and death of mice were observed. Result The combinations of CAI and two different doses of SAHA showed stronger inhibitory effect on LLC cells viability than single CAI treatment.The inhibition rate of the combined treatment was 46.09%±5.50%and 54.43%±3.69%,(P<0.01),respectively.In vivo experiment showed that all treatments,including single CAI,single SAHA and combined treatment significantly inhibited LLC tumor grow th compared w ith vehicle control.Moreover the tumor volume in mice treated w ith the combination was significantly smaller than that in control group and single-drug treated groups.Death rate of animals in all study groups but the control group was below 20%.Conclusion The combination of CAI and SAHA inhibits LLC cells viability significantly and shows synergistic anti-tumor effect in vivo.
R734.2
A
10.11877/j.issn.1672-1535.2016.14.04.09
2016-03-16)
国家自然科学基金青年基金(81402923);北京协和医学院2015协同创新基金(3332015168)
*两位作者对本文的贡献一致
(corresponding author),邮箱:caiyingye@126.com
