重金属污染下的作物形态建成及其应对措施
2016-10-18洪华龙戴闽玥卢豪良刘景春严重玲
洪华龙,戴闽玥,卢豪良,刘景春,严重玲
(滨海湿地生态系统教育部重点实验室(厦门大学),福建厦门361102)

重金属污染下的作物形态建成及其应对措施
洪华龙,戴闽玥,卢豪良,刘景春,严重玲*
(滨海湿地生态系统教育部重点实验室(厦门大学),福建厦门361102)
在重金属污染愈发严重的背景下,探索出保障污染地区的农业生产水平可持续发展的技术,是保障粮食生产安全亟需解决的重要问题.通过综述农作物对重金属胁迫的形态建成响应机制与实践中的农艺管理技术手段,总结在重金属污染区域提高粮食产量的主要方法.重金属影响下的作物形态建成具有深刻的遗传基础和复杂的生理机制,这就决定了作物对重金属的响应受到作物类型与重金属种类的影响.通过对作物形态建成的更深入研究,建立一套从品种选择到田间管理的应对措施,可以为农业安全生产提供持久有效的保障.
重金属;农业生产;田间管理;作物育种;农业决策
粮食生产历来是文明产生和发展的支柱,目前世界上仍有大量人口面临饥饿的威胁.随着人口的增加,经济的发展,以及生物燃料生产带来的粮食消耗,粮食安全是我国乃至世界面临的巨大挑战.中国农田的重金属污染形势十分严峻,最近的一项农田污染研究推断我国受到重金属污染的农田占全国农田总量的1/6[1],在重金属污染的影响下我国每年粮食减产量超过1 000万t.提高受重金属污染农田上的作物产量,可以间接地减轻我国的粮食压力,在污染土地上增加的粮食产量即便由于重金属污染不能作为粮食或者饲料进行消费,在未来随着生物柴油技术的发展,增加的这部分作物产出也可以缓解能源消耗对人类粮食和动物饲料的占用.如何使具有较大重金属负荷的农田产出更多的粮食,是保障我国粮食安全迫切需要解决的问题.
农业的本质是通过合适的管理产出更多的粮食产品,对重金属胁迫下植物形态建成响应的深入了解可以为重金属污染农田上的粮食生产提供理论指导.形态建成描述的是植物体改变其结构的生物学过程,涉及到植物体在外界干扰下的能量平衡和物质分配策略,是植物学研究的根本问题之一.本文中对目前植物学研究中关于重金属对作物形态建成影响的基本认识以及实际工作中所运用到的技术手段进行了综述,希望为增加在污染区域作物产出的进一步研究提供参考.
1 重金属胁迫对植物形态建成的影响
1.1性质变化
重金属胁迫对植物形态结构的整体影响通常包括根伸长的抑制、根直径的增加、根冠比的改变、株高的降低以及叶片形态的变化等,这些性状通常称为胁迫诱发的形态响应(stress-induced morphogenic response)[2].一般来说,重金属胁迫会抑制植物根伸长,因而根伸长常作为重金属胁迫程度的重要指标[3-5].但通过对拟南芥(Arabidopsisthaliana)在Cd-Cu-Zn胁迫下根系结构的分析表明,在亚毒性水平重金属的胁迫下,根伸长并没有受到明显影响,反而促进了侧根的产生,体现出补偿生长的特点[6].在重金属胁迫下根直径增加是植物的形态响应方式之一,在植物响应重金属胁迫的研究中已有较充分的报道,如水稻(Oryzasativa)响应Al胁迫的过程[7].植物的株高是另外一个受到重金属胁迫影响的性状,如在Pb、Cu、Zn、As及Cd的复合胁迫影响下,水稻的株高平均降低4.0~5.0 cm[8].重金属胁迫同时也会影响叶片的形态发育,对能源作物杂交狼尾草(kinggrass,Pennisetumamericanum×P.purpureum)的研究发现,Cd胁迫下杂交狼尾草呈现叶片长度减小而叶片宽度增加的现象[9].
除了对植物造成直观可见的影响外,重金属胁迫还会导致植物微观结构的改变.如:Cd胁迫下欧洲油菜(Brassicanapus)叶片表皮细胞较叶肉细胞更为敏感,其气孔密度呈现明显的降低[10];Al可以干扰植物体内细胞骨架的正常功能,促进微管的非正常聚合[11],或者导致微管和微丝的解聚[12];在Cd胁迫下的拟南芥中,分生组织的减少则可与主根伸长的抑制相互验证[13];Cd胁迫下玉米(Zeamays)的微观结构遭到破坏,细胞中出现大量微小的液泡[14];在三七(Panaxnotoginseng)中也发现Cd胁迫会导致根系完整性被破坏[15].
1.2影响途径
1.2.1营养吸收及分配
植物根系的营养吸收为维持植物体正常的发育提供了物质基础,重金属会干扰植物对养分的吸收及运输.重金属可以通过与运输蛋白中的巯基结合,或者抑制原生质膜的ATPase,从而影响植物的N吸收.不同种类的重金属对N吸收和运输的抑制过程存在差异,这是因为在清除重金属后植物N吸收的恢复时间有所不同,如:Cd、Cu、Ni和W,对NO3-吸收的抑制可以持续较长时间[16-17],而受Pb影响的植物可以在重金属胁迫条件消失后很快恢复对NO3-的吸收[18].营养元素吸收的抑制在不同的植物间有不同的表现,如玉米在Cu胁迫下对N、P、K的吸收受到抑制,而Cu耐受性植物芦苇(Phragmitesaustralis)在相同条件下却不受影响[19],这强调了重金属耐受性物种的种质资源对于改良作物的巨大潜力.金属离子间的拮抗作用也会干扰重金属胁迫下植物对特定金属离子的吸收过程,如Al胁迫下小麦(Triticumaestivum)对Ca的吸收受到抑制[20];Cd不仅会干扰植物根系对Fe的吸收[21],而且会抑制Fe在根与茎之间的运输过程[22].
重金属对植物体内元素平衡的影响不仅反映在对特定金属的吸收与运输过程的干扰上,吸收到植物体内的重金属还会直接替代特定位点上的其他金属元素,如Cd可以替代碳酸酐酶中的Zn,这样的替代往往会导致被替代酶的稳定性或者活性的降低[23].值得注意的是,重金属对正常细胞中其他金属离子的取代往往会进一步导致其他生理过程的紊乱.La(Ⅲ)的胁迫会改变山葵(Armoraciarusticana)植株中的自由Ca2+浓度,干扰正常细胞代谢过程[24].
1.2.2光合过程
光合过程是植物重要的能量和物质来源,植物干物质有90%~95%来自光合作用.在重金属胁迫下光合作用过程的有序性被破坏.这个破坏过程可以通过多条途径实现.首先是对叶绿体结构的破坏,如Cd胁迫下欧洲油菜叶绿体的形成受到影响,细胞内的叶绿体数目下降,这导致其出现萎黄病的性状[10].其次受到重金属胁迫后,脂质过氧化会导致光合色素如叶绿素与类胡萝卜素含量的降低[25-26].再者,植物的光合作用原初反应由两个光系统,即光系统Ⅰ (PS Ⅰ)与光系统Ⅱ(PS Ⅱ)组成.PS Ⅰ在原初反应过程中的主要作用是还原型辅酶Ⅱ(NADPH)的生成,而PS Ⅱ的主要作用是水的光解和放氧,夺取水中的电子供给PS Ⅰ;受到重金属类型与植物物种的影响,重金属对原初反应两个光系统的影响往往有不同的具体表现.Cd胁迫下菠菜(Spinaciaoleracea)的PS Ⅰ系统受到更大的影响,表现为天线蛋白的减少[27].在对Cu胁迫下玉米的研究中,PS Ⅱ系统的有效光化学效率(effective quantum efficiency)受到Cu的胁迫而降低[26].此外,作为光合作用一个重要的组成部分,碳同化过程将ATP与NADPH中活跃的化学能转化为糖类,以更稳定的形式储存,在重金属胁迫下碳同化过程同样受到干扰.核酮糖-1,5-二磷酸羧化酶(RuBisCO)是碳同化过程中重要的酶,催化3-磷酸甘油酸的形成,是光合作用中卡尔文循环的关键限速步骤,因而是提高作物产量的关键调控目标[28-29].在重金属中Cd对RuBisCO活性的影响有较多的报道,Cd胁迫降低了RuBisCO在植物体内的浓度[30],从而影响光合过程.但也有结果表明Cd胁迫对植物体内RuBisCO的含量及活性并没有生理学意义上的影响[31].这表现出植物界对抗重金属污染的复杂机制,更体现了植物种质资源对基因改造的巨大潜力.
1.2.3活性氧信号通路
重金属胁迫可以通过干扰活性氧的平衡代谢来影响植物的形态建成.重金属可以通过多个位点提高植物的活性氧水平,对于光合电子传递链的干扰以及催化Fenton反应是重金属胁迫产生活性氧的两种主要方式.但是目前对于重金属胁迫对活性氧产生的具体机制及其关键位点仍未全部了解,一些重金属如Cd不能催化Fenton反应,却仍然可以提高活性氧浓度[32];通过深化对重金属胁迫下植物活性氧信号通路的研究,可以为改造作物提供理论指导,降低活性氧信号系统对特定重金属的敏感性.
活性氧一开始是作为胁迫下植物正常生理过程受到干扰积累的副产物被引入到重金属胁迫研究中的,因此活性氧的清除过程是其研究重点.高效的活性氧清除系统可以有效地维持在重金属胁迫下植物的活性氧水平,从而降低其对植物体内部结构的破坏.活性氧清除的酶促系统包括多种酶类,如超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶、谷胱甘肽还原酶等[4,26].植物体内的过氧化氢与丙二醛(MDA)含量是监控细胞活性氧水平与生物效应的关键指标,它们往往会受到重金属的胁迫而随其上升[33].
随着研究的深入,特别是活性氧与植物激素相互关系的阐明,活性氧在胁迫响应中的作用得到了更充分的认识.活性氧信号可以通过类似波的形式在细胞间传导,在拟南芥中活性氧信号传播的速度可以达到8.4 cm/min[34],可以作为细胞间信号传递的因子发挥胁迫响应的功能;在现有的工作中,活性氧更多地被视为细胞信号系统的关键组成部分.活性氧信号如何产生特异性的应激响应是研究胁迫生理过程的关键问题,对此有3种不同的假说:1) 活性氧信号作为通用的胁迫响应信号,其信号的特异性是通过其他的响应因子,如植物激素、脂质、细胞壁碎片等进行传递;2) 活性氧信号可以通过其传播过程的具体信号特征,以类似于钙信号的方式传递特异性的胁迫信息;3) 活性氧信号还可能通过不同的信号受体进行响应,而后者则根据胁迫的不同而变化[35].活性氧信号对不同胁迫,如干旱、低温等方面已有较多研究,但对于不同重金属胁迫下活性氧信号的响应差异及其对形态建成的影响仍需要进一步的研究.
1.2.4植物激素响应
重金属会干扰植物激素及信号因子发挥其正常的功能,从而影响植物的形态建成.重金属可以通过影响植物激素,包括生长素、赤霉素、乙烯、脱落酸、茉莉酸、水杨酸及油菜素内酯的代谢过程[36-37],从而影响植物的形态建成.1-氨基环丙烷-1-甲酸氧化酶(1-aminocyclopropane-1-carboxylic acidoxidase)与1-氨基环丙烷-1-甲酸合酶(1-aminocyclopropane-1-carboxylic acidsynthase)是植物中合成乙烯的重要酶类,在重金属胁迫下植物可以使这两个关键酶的活性增加,从而加快乙烯的合成,导致形态建成上植物对重金属胁迫的响应[38].激素的区域化分布是调控植物形态建成的重要因子.重金属还可以通过干扰植物体内激素的再分布影响植物的形态建成.这个过程是通过重金属对植物激素转运载体的调控而实现的,但是不同的重金属所涉及到的转运载体并不相同.Cu与Cd可以通过对拟南芥PIN1载体的抑制改变其根中的生长素分布从而使根系伸长减缓[13,39],而Al则通过对拟南芥AUX1与PIN2载体功能的抑制来扰乱生长素的极性分布[40].
1.3遗传基础导致不同植物对重金属响应的差异
植物对重金属胁迫的响应具有遗传基础,这可以通过对多种植物在相同胁迫下响应方式的差异推断出来[41-42].它意味着基因的导入或者修饰可以改进作物的性状以利于在重金属胁迫条件下生产,甚至可以控制粮食作物中的重金属积累[43].通过研究植物在重金属胁迫下基因调控差异,可以了解植物响应重金属胁迫的形态建成背后的分子基础,目前这一方面研究取得了初步的成果.Kuta等比较了堇菜属Violareichenbachiana与V.riviniana两种植物污染生态型与非污染生态型的形态指标及基因组扩增片段长度多态性(AFLP)标记的差异,发现相对于形态指标,AFLP标记具有更大的差异性[44].通过对比Cd胁迫与其他非生物因子胁迫在miRNA表达模式的差异,Khaksefidi等展示了向日葵(Helianthusannuus)响应Cd胁迫的共通性与独特性机制[45].近年来组学手段越来越多地被应用到植物响应重金属胁迫的相关研究中.利用蛋白质组学的研究手段,Fagionid等研究了菠菜类囊体上多蛋白复合物系统对Cd胁迫的响应,从而确定了Cd胁迫下植物光合作用中光能固定过程受到干扰的敏感部分[27].
已有的研究总结了重金属胁迫下植物生理响应与植物形态建成中从基因表达到蛋白质合成过程的响应,但目前对于形态指标与特定过程之间的关联性仍需要更深入的研究,对于重金属影响具体形态指标机理的研究仍需要通过模式植物进行.图1总结了与重金属对植物形态建成影响有关的机制.
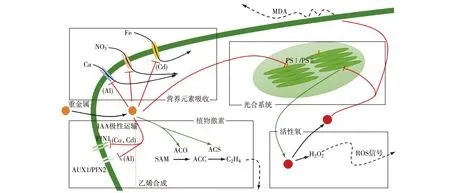
IAA:吲哚-3-乙酸;ACO:1-氨基环丙烷-1-甲酸氧化酶;ACS:1-氨基环丙烷-1-甲酸合酶;SAM:S-腺苷蛋氨酸;ACC:1-氨基环丙烷-1-甲酸;ROS:活性氧.图1 与重金属对植物形态建成影响有关的机制Fig.1Mechanism involved in morphogenesis under heavy metal stress
2 缓解农田重金属污染影响的技术手段
以上叙述了重金属对作物生长造成影响的机制.在长时间的农业实践及科学研究中,已经发展了一系列用于对抗重金属污染的技术手段,如:通过施加肥料改善植物的营养条件、利用土壤改良剂控制重金属的有效性、干预植物或者植物-微生物系统的功能,这些方法在解决耕地重金属污染方面已取得了部分成功.表1对比了这些技术手段的优点及不足.
表1 应对重金属污染的技术手段对比
Tab.1 The comparison of the technical means used under heavy metal pollution

类型措施优点不足肥料管理施加P肥[46],Si肥[47-48],Se和S[49],Ca[50]传统农业田间管理的步骤,不增加额外劳动受到重金属浓度的限制,有失效或者加剧重金属危害的可能性土壤性质改良施用乙二胺四乙酸(EDTA)[51-52],施用表面活性剂[53]可以同时修复多种重金属受到土壤性质,作物类型的限制,有促进重金属迁移的可能性,同时限制营养元素供应微生物接种接种Hg还原菌[54],接种根际促生菌[55],接种丛枝菌根真菌[56],接种深色有隔内生真菌[57]能够持久地改善作物生长菌种选育过程复杂,费用高昂,长期生态影响未知植物生理调控水杨酸浸种[58],施用甜菜碱[14,59]效果明显,可以同时改善作物对其他胁迫的响应成本较高,不利于广泛使用,受到植物发育状况的限制耐受性品种选育叶绿体转化[28],RNAi干扰[33,60],农杆菌介导转化[61-62]可极大地降低后期的管理工作,多样的育种方向可以满足不同种植目的选育工作的周期较长,作物食用的长期风险未知
2.1传统的田间管理方法
通过外加制剂调控土壤的理化性质,可以控制重金属元素的赋存形态或价态,或者恢复因重金属造成的微生物功能失调.多种制剂包括肥料、土壤改良剂、微生物制剂等,可用于缓解重金属污染造成的毒害.
通过施加肥料可以改善重金属胁迫下的植物生理过程,促进抗逆境植物激素的释放,以及通过拮抗作用抑制重金属的吸收,从而达到缓解污染地块上植物生长抑制的效果[63].通过施加P肥,小麦在Cd胁迫下对Cd的吸收降低,抗氧化系统效率提高,对微量元素Mn的吸收增加,光合速率升高,同时增加了干物质的累积[46].施加Si肥可以增加Cu胁迫下小麦根系的皮层厚度,提高光合色素含量,从而促进作物的生长[47];而在对水稻的研究中,通过适量施加Si,可以降低重金属Cd、Cu诱导的脱落酸、茉莉酸及水杨酸的合成,从而解除Cd、Cu对其根伸长的抑制,而对于Mn胁迫则可以降低其对Mn的吸收,维持叶片形态[48].适当施加Se和S可以改善植物的N和S同化,提高光合速率,增强活性氧清除系统功能,从而提高小麦对Cd的抗性[49].适当施加Co可以抑制植物体内乙烯的合成[64]或者调控分裂素下游通路,减缓重金属造成的症状[65].此外,可以通过对土壤施加微量元素,利用其与重金属在吸收上的拮抗作用,达到限制重金属进入植物造成危害的目的,例如:通过补充土壤中的Zn,可以降低Cd在多种植物中的富集[66];对小白菜(Brassicachinensis)施加适量的Ca,可以提高其光合作用与N同化能力,从而缓解土壤中Cd污染的胁迫[50].由于很多肥料来自工业生产的废料,如生产上使用的Si肥往往从炉渣分离而来[67-68],或者在肥料的工业生产中难免有重金属矿物的引入[69],所以肥料本身就是农田重金属的重要来源之一.因此肥料的长期施加对农作物生产的影响需要进一步的研究.
土壤改良剂可以改良土壤的理化性质,从而缓解重金属的危害.通过土壤改良剂可以改善土壤的pH、氧化还原电位、有机质等相关指标,增强土壤对重金属的固定能力,从而降低植物从土壤中吸收的重金属含量,改善重金属污染地块上的植物生长状况.
外源添加的螯合剂如柠檬酸、EDTA、谷胱甘肽等可以影响重金属的生物效应,但对其具体的效应仍存在较大分歧.如EDTA的施加增加了植物对重金属的吸收[51-52],但在对不同植物的生长效应方面却存在很大的差异:它可以缓解Pb对欧洲油菜生长和形态建成的的抑制作用[51],但在对向日葵的研究中,施加EDTA却增加了Cr的毒性作用[52].螯合剂与重金属亲和性的差异和螯合剂的化学特性都会影响其功效[70].
活性炭也是常用的土壤改良剂[71],它可以改善土壤的理化性质,调节土壤微生物结构,从而提升作物产量[72].活性炭还可以固定土壤中的重金属,降低其对植物生长的危害[73].但活性炭的施加需要充分考虑其来源,如活性炭在生产过程中由于生物物料的引入可能有额外的重金属负荷,会对植物的生长造成进一步的抑制[3];而且活性炭在固定重金属的同时也会固定营养元素,导致植物的养分缺乏,甚至反而增加重金属的吸收[74].
一些表面活性剂也用于改良土壤状况,例如通过使用十二烷基硫酸钠(SDS)、Triton X-100以及非离子型聚丙烯酰胺,可以提高土壤pH值和阳离子交换量,从而增加土壤对重金属Zn的固定[53].
除此之外,对微生物群落结构的调节也是一种调节重金属有效性的办法,可以降低污染地块上可以被植物吸收的重金属含量.通过接种Cr还原菌,黄秋葵(Hibiscusesculentus)在受到Cr污染的样地上生长状况得到大幅度的改善[75];通过对豇豆(Vignaunguiculata)接种Hg还原菌,可以促进其叶的发育,降低Hg往地上部的迁移,从而改善豇豆的生长[54].
2.2干预植物生理过程
根际促生菌可以通过分泌植物生长调节剂如IAA[76],或者通过降解乙烯调节植物根系组织内的激素水平[77],从而改善植物在重金属污染区域的生长[78-79].通过极端条件筛选到的根际促生菌可以在重金属胁迫下改善植物的生长状况[80],影响植物的形态建成,具有作为土壤修复剂的潜力[81].欧洲油菜在接种了具有Cd抗性的根际促生菌后,由于后者提供的IAA具有生长调节作用以及Fe载体缓解了植株因为重金属胁迫产生的Fe缺乏,因而在Cd污染地区的产量得到了提高[55].与植物共生的一些真菌也具有改善重金属胁迫下植物生长的作用.接种丛枝菌根真菌后,在Cd胁迫下番茄(Solanumlycopersicum)的叶绿素含量提高,活性氧损伤下降,株高增加[56].接种了深色有隔内生真菌的玉米在Cd胁迫下对Cd的吸收降低,抗氧化系统效率提高,同时增加了Cd在细胞壁上的吸收[57].
通过对植物的生理过程直接进行干预也可以缓解重金属对植物形态建成的不良影响,提高作物的产量.植物激素水杨酸是植物中重要的信号分子,在植物响应非生物胁迫中具有重要作用[82].通过预先在水杨酸中浸种,大麦在Cd胁迫下的生长得到改善,表现为淀粉酶和磷酸酶的活性上升,根系活力增加并促进根伸长[58].施加特定的阻断剂调节植物激素的代谢、分布及其响应也可以缓解重金属对植物生长的胁迫.除此之外,还有一些生长调节剂可以改善植物生长性状.甜菜碱是植物中一种重要的渗透调节物质,对Cd胁迫下的玉米施加甜菜碱可以增加其对微量元素Cu、Zn的吸收,降低氧化损伤,提高可溶性蛋白含量,维持结构的完整性,促进根伸长[14];而施加了甜菜碱的绿豆(V.radiata)在Cr胁迫下叶绿素的含量升高,株高增加,并促进了根的伸长和叶片的发育[59].油菜素内酯的施加则可以通过调节活性氧清除系统活性从而增强水稻对重金属Cr的耐受性[83].
2.3重金属耐受性品种的选育及推广
目前已筛选出许多重金属耐受性品种.Al耐受性小麦的筛选早有报道[20],对Cd胁迫下水稻重金属耐受性品种的选育工作也有不少进展[84-85].传统的作物育种依赖于杂交与诱变等方式,周期往往较长.转基因技术的出现,打破了植物性不亲和的壁垒,使得基因在物种间的转移速度加快,从而极大地加快作物品种改良的速度.重金属耐受性作物品种的选育,主要有两种方式:1) 降低重金属在植物中的吸收迁移,从而间接降低重金属的生物有效性及危害;2) 增强植物在非生物胁迫下自身生理活动的稳定性.
不同的植物品种间重金属累积趋势差异巨大.通过对48个水稻栽培品种的对比研究,在籽粒中Cd的含量差异巨大[86],随着实验植物品种的增多以及目标重金属的扩充[87],类似的规律不断被发现,这揭示了通过基因工具改善作物内重金属分布的巨大潜力.早在20世纪80年代,通过引入人的金属硫蛋白基因,欧洲油菜和烟草(NicotianatabacumL.)正常生长免受Cd影响的浓度可以提高到100 μmol/L CdCl2,而正常的对照植株在此浓度下生长则受到严重的抑制[61].通过引入水稻中与金属转运有关的基因OsNRAMP1,拟南芥在Cd与As胁迫下将更多的重金属固定在根部与茎干,从而防止重金属进入叶片造成更严重的伤害[88].水稻种植广泛受到Cd污染的危害[84],因此提高水稻Cd耐受性的育种研究受到关注.OsNRAMP5是水稻中与Cd吸收有关的重要基因[89],通过敲除OsNRAMP5基因,可以降低水稻对重金属Mn与Cd的吸收,但OsNRAMP5敲除的品种却容易因Mn吸收不足而产生生长抑制的情况;通过RNAi技术降低OsNRAMP5表达量的水稻中,同样会出现Mn缺乏条件下生长的抑制[60].通过基因的引入或敲除控制重金属的吸收与迁移,可以明显改善目标重金属胁迫下植物对重金属的吸收及转运,降低重金属的毒害,然而其适应范围较窄,不易于解决多种重金属复合污染的状况.另外一个棘手的难题是通常这些基因都与植物的关键生理过程有关,因此简单地调控一个基因,特别是敲除,往往会引起植物的生理紊乱[89],有可能无法达到促进植物生产的效果.
针对植物生长和发育生理过程稳态的转基因项目则在面对多重胁迫的情况下拥有较大的优势.过表达OsLEA4基因的水稻中不仅展现出了更强的重金属抗性,而且在干旱及高盐环境下的生长状况也得到改善[62].而引入了多胁迫响应基因OsMSR3的拟南芥获得了更高的Cd耐受性,其根系伸长抑制得到缓解[90].通过提高植物非生物胁迫耐受性的方式,也可以有效地提高植物的重金属耐受性,而且往往由于可以同步提高对多种胁迫的抗性,其育种效率较高、适用范围较广.但是由于其立足于植物对非生物胁迫的普遍响应机制,所以对重金属耐受性的提升幅度较小,而且可能造成植物中的重金属浓度升高[90],因而有一定的风险性.
谷氨酰半胱氨酸合成酶[91]与植物络合素合酶[92]在植物中分别是产生抗逆物质谷胱甘肽与植物络合素的关键调控因子,而谷胱甘肽与植物络合素不仅仅具有络合重金属、促进重金属在植物中区隔化分布的重要作用,而且还作为细胞内重要的抗氧化物质参与活性氧的清除过程[93-94],可增强植物的普遍抗逆能力.由于谷氨酰半胱氨酸合成酶与植物络合素合酶具有多重作用,近年来其基因编码成为重金属耐受性育种的研究热点之一.
植物的选育工作随着人类的发展进程而向前发展,具有强大的发展潜力与空间.随着人类对生命过程认识的深化,新的技术工具如CRISPR/Cas9系统[95-96]不断应用到植物的基因改造中,将会为对抗重金属污染提供更好的工具储备.而对更广泛的植物重金属耐受性机制的研究,则不仅提供了实践研究的理论背景[97],还提供了大量具有应用潜力的基因序列及蛋白结构信息[84].
通过育种手段增加植物的抗性具有很好的前景,但目前很多工作仍处在实验室阶段,少有专门为污染农田生产而选育的品种推广.通过转基因的手段进行重金属耐受性作物的开发,可以大大缩短开发时间.育种所存在的不足:1) 安全性未知,需要较长的时间周期确定品种的安全性,因此目前仍少有实际推广;2)对于不同的重金属胁迫,往往需要培育不同的品种,这样会造成应对重金属胁迫的作物品种开发及推广的困难.但长期来看,重金属耐受性物种的选育,可以长久地提高作物对重金属污染的适应性,同时也可以深化对植物耐重金属胁迫机制及策略的认识.目前重金属耐受性品种选育工作所遇到的困难,在于对植物的重金属耐受机制了解仍不够清楚,对于多种重金属复合污染、多基因甚至多系统间的相互关系尚待深入的研究;随着重金属研究的不断深入,重金属耐受性品种选育工作将会获得更充分的理论指导与更多的技术方法.
3 总结与展望
重金属胁迫下植物的形态建成是一个复杂的生理生态过程,其中既涉及到能量平衡与资源分配稳态的打破,也有植物信号系统对重金属胁迫的主动响应;而重金属胁迫下植物的具体性状因胁迫金属和受胁迫植物的不同又有很大的差异,显示出植物对重金属胁迫响应过程的差异性,这也为开发植物的基因资源或者通过对比研究深化对重金属胁迫机制的认识提供了巨大的宝库.
为了服务重金属污染农田的作物种植,改善作物的生长,开发了很多农业技术手段.目前的实际运用仍多依赖于土壤改良手段,在缓解重金属胁迫下植物生长抑制的研究中,对于肥料的施加与土壤性状的改良已经有了丰富的实验结果,在下一阶段应该加大成果的转化,为重金属污染地块上作物的生长提供科学的农业决策基础.植物根际过程是影响重金属效应的关键一环,肥料施加与土壤性状改良过程与植物根系行为影响下重金属的生物有效性,以及作物-微生物共生系统重金属耐受性的长期响应,是下一阶段值得深入探讨的重要问题.
肥料的施加存在二次污染的严重问题,而土壤改良手段的长期效应仍需要评估.从种质资源上改善作物物种对于重金属的耐受性可以从根本上改变这一问题.重金属耐受性育种主要依赖于降低重金属的吸收迁移效率与维持作物的内稳态.这两种方式有着各自的优点与不足.目前重金属耐受性品种的选育仍然以实验室内探索为主,侧重于植物对非生物胁迫的响应,这是由目前对植物重金属耐受机制研究的阶段性发展所决定的.随着基因工程技术的发展与植物重金属耐受性研究的深入进行,重金属耐受性品种的选育具有愈发广阔的应用前景.
[1]宋伟,陈百明,刘琳.中国耕地土壤重金属污染概况[J].水土保持研究,2013,20(2):293-298.
[2]KOLBERT Z.Implication of nitric oxide (NO) in excess element-induced morphogenic responses of the root system[J].Plant Physiology and Biochemistry,2016,101:149-161.
[3]VISIOLI G,CONTI F D,MENTA C,et al.Assessing biochar ecotoxicology for soil amendment by root phyto-toxicity bioassays[J].Environmental Monitoring and Assessment,2016,188(3):166.
[4]NANDA R,AGRAWAL V.Elucidation of zinc and copper induced oxidative stress,DNA damage and activation of defence system during seed germination inCassiaangustifoliaVahl[J].Environmental and Experimental Botany,2016,125:31-41.
[5]OSTONEN I,PÜTTSEPP Ü,BIEL C,et al.Specific root length as an indicator of environmental change[J].Plant Biosystems,2007,141(3):426-442.
[6]BOCHICCHIO R,SOFO A,TERZANO R,et al.Root architecture and morphometric analysis ofArabidopsisthalianagrown in Cd/Cu/Zn-gradient agar dishes:a new screening technique for studying plant response to metals[J].Plant Physiology and Biochemistry,2015,91:20-27.
[7]ALVAREZ I,SAM O,REYNALDO I,et al.Toxic effect of Al3+ion in the root tip of two Cuban rice cultivars (OryzasativaL.)[J].Revista Internacional de Contaminacion Ambiental,2013,29(4):315-323.
[8]ZHOU Q X,WANG X,LIANG R L,et al.Effects of cadmium and mixed heavy metals on rice growth in Liaoning,China[J].Soil & Sediment Contamination,2003,12(6):851-864.
[9]ZHANG X,ZHANG X,GAO B,et al.Effect of cadmium on growth,photosynthesis,mineral nutrition and metal accumulation of an energy crop,king grass (Pennisetumamericanum×P.purpureum)[J].Biomass and Bioenergy,2014,67:179-187.
[10]BARYLA A,CARRIER P,FRANCK F,et al.Leaf chlorosis in oilseed rape plants (Brassicanapus) grown on cadmium-polluted soil:causes and consequences for photo-synthesis and growth[J].Planta,2001,212(5/6):696-709.
[11]BLANCAFLOR E B,JONES D L,GILROY S.Alterations in the cytoskeleton accompany aluminum-induced growth inhibition and morphological changes in primary roots of maize[J].Plant Physiology,1998,118(1):159-172.
[12]SIVAGURU M.Impacts of aluminum on the cytoskeleton of the maize root apex.Short-term effects on the distal part of the transition zone[J].Plant Physiology,1999,119(3):1073-1082.
[13]YUAN H M,HUANG X.Inhibition of root meristem growth by cadmium involves nitric oxide-mediated repression of auxin accumulation and signalling in Arabidopsis[J].Plant,Cell & Environment,2016,39(1):120-135.
[14]LI M,WANG G R,LI J Y,et al.Foliar application of betaine alleviates cadmium toxicity in maize seedlings[J].Acta Physiologiae Plantarum,2016,38(4):95.
[15]KAN Q,WU W W,YU W Q,et al.Nitrate reductase-mediated NO production enhances Cd accumulation inPanaxnotoginsengroots by affecting root cell wall properties[J].Journal of Plant Physiology,2016,193:64-70.
[16]祖艳群,李元,BOCK L,等.重金属与植物N素营养之间的交互作用及其生态学效应[J].农业环境科学学报,2008,27(1):7-14.
[17]WEBER M B,SCHAT H,TEN BOOKUM-VAN DER MAAREL W M.The effect of copper toxicity on the contents of nitrogen compounds inSilenevulgaris(Moench) Garcke[J].Plant and Soil,1991,133(1):101-109.
[18]BURZYNSKI M,BUCZEK J.The influence of Cd,Pb,Cu and Ni on NO3-uptake by cucumber seedlings.Ⅰ.Nitrate uptake and respiration of cucumber seedlings roots treated with Cd,Pb,Cu and Ni[J].Acta Physiologiae Plantarum,1994,16(4):291-296.
[19]AIT ALI N,BERNAL M P,ATER M.Tolerance and bioaccumulation of copper inPhragmitesaustralisandZeamays[J].Plant and Soil,2002,239(1):103-111.
[20]HUANG J W,SHAFF J E,GRUNES D L,et al.Aluminum effects on calcium fluxes at the root apex of aluminum-tolerant and aluminum-sensitive wheat cultivars[J].Plant Physiology,1992,98(1):230-237.
[22]YOSHIHARA T,HODOSHIMA H,MIYANO Y,et al.Cadmium inducible Fe deficiency responses observed from macro and molecular views in tobacco plants[J].Plant Cell Reports,2006,25(4):365-373.
[23]BOUCKAERT J,LORIS R,WYNS L.Zinc/calcium- and cadmium/cadmium-substituted concanavalin A:interplay of metal binding,pH and molecular packing[J].Acta Crystallographica Section D:Biological Crystallography,2000,56(12):1569-1576.
[24]ZHANG X B,WANG L H,ZHOU A H,et al.Alterations in cytosol free calcium in horseradish roots simultaneously exposed to lanthanum(Ⅲ) and acid rain[J].Ecotoxicology and Environmental Safety,2016,126:62-70.
[25]GOSWAMI S,DAS S.Copper phytoremediation potential ofCalandulaofficinalisL. and the role of antioxidant enzymes in metal tolerance[J].Ecotoxicology and Environmental Safety,2016,126:211-218.
[26]TANYOLAÇ D,EKMEKÇI Y,ÜNALAN.Changes in photochemical and antioxidant enzyme activities in maize (ZeamaysL.) leaves exposed to excess copper[J].Chemosphere,2007,67(1):89-98.
[27]FAGIONI M,D′AMICI G M,TIMPERIO A M,et al.Proteomic analysis of multiprotein complexes in the thylakoid membrane upon cadmium treatment[J].Journal of Proteome Research,2009,8(1):310-326.
[28]WILSON R H,ALONSO H,WHITNEY S M.EvolvingMethanococcoidesburtoniiarchaeal rubisco for improved photosynthesis and plant growth[J].Scientific Reports,2016(6):22284.
[29]PRINS A,ORR D J,ANDRALOJC P J,et al.Rubisco catalytic properties of wild and domesticated relatives provide scope for improving wheat photosynthesis[J].Journal of Experimental Botany,2016,67(6):1827-1838.
[30]GALMÉS J,ARANJUELO I,MEDRANO H,et al.Va-riation in rubisco content and activity under variable climatic factors[J].Photosynthesis Research,2013,117(1/2/3):73-90.
[31]SON J A,NARAYANANKUTTY D P,ROH K S.Influence of exogenous application of glutathione on rubisco and rubisco activase in heavy metal-stressed tobacco plant growninvitro[J].Saudi Journal of Biological Sciences,2014,21(1):89-97.
[32]BASHIR H,QURESHI M I,IBRAHIM M M,et al.Chloroplast and photosystems:impact of cadmium and iron deficiency[J].Photosynthetica,2015,53(3):321-335.
[33]XU X Y,DING Z J,CHEN L,et al.An eukaryotic translation initiation factor,AteIF5A-2,affects cadmium accumulation and sensitivity in Arabidopsis[J].Journal of Integrative Plant Biology,2015,57(10):848-858.
[34]MILLER G,SCHLAUCH K,TAM R,et al.The plant NADPH oxidase RBOHD mediates rapid systemic signaling in response to diverse stimuli[J].Science Signaling,2009,2(84):ra45.
[35]MITTLER R,VANDERAUWERA S,SUZUKI N,et al.ROS signaling:the new wave?[J].Trends in Plant Science,2011,16(6):300-309.
[36]FARIDUDDIN Q,YUSUF M,AHMAD I,et al.Brassinosteroids and their role in response of plants to abiotic stresses[J].Biologia Plantarum,2014,58(1):9-17.
[37]SCHWARTZ C,MOREL J L,SAUMIER S,et al.Root development of the zinc-hyperaccumulator plantThlaspicaerulescensas affected by metal origin,content and localization in soil[J].Plant and Soil,1999,208(1):103-115.
[38]THAO N P,KHAN M I R,THU N B A,et al.Role of ethylene and its cross talk with other signaling molecules in plant responses to heavy metal stress[J].Plant Physiology,2015,169(1):73-84.
[39]YUAN H M,XU H H,LIU W C,et al.Copper regulates primary root elongation through PIN1-mediated auxin redistribution[J].Plant and Cell Physiology,2013,54(5):766-778.
[40]SUN P,TIAN Q Y,CHEN J,et al.Aluminium-induced inhibition of root elongation in Arabidopsis is mediated by ethylene and auxin[J].Journal of Experimental Botany,2010,61(2):347-356.
[41]WANG P,DENG X J,HUANG Y,et al.Root morphological responses of five soybean[Glycinemax(L.) Merr] cultivars to cadmium stress at young seedlings[J].Environmental Science and Pollution Research,2016,23(2):1860-1872.
[42]KELLER C,HAMMER D,KAYSER A,et al.Root development and heavy metal phytoextraction efficiency:comparison of different plant species in the field[J].Plant and Soil,2003,249(1):67-81.
[43]SHUKLA T,KUMAR S,KHARE R,et al.Natural variations in expression of regulatory and detoxification related genes under limiting phosphate and arsenate stress inArabidopsisthaliana[J].Frontiers in Plant Science,2015,6:898.
[45]EBRAHIMI KHAKSEFIDI R,MIRLOHI S,KHALAJI F,et al.Differential expression of seven conserved microRNAs in response to abiotic stress and their regulatory network inHelianthusannuus[J].Frontiers in Plant Science,2015,6:741.
[46]ARSHAD M,ALI S,NOMAN A,et al.Phosphorus amendment decreased cadmium (Cd) uptake and ameliorates chlorophyll contents,gas exchange attributes,antioxidants,and mineral nutrients in wheat (TriticumaestivumL.) under Cd stress[J].Archives of Agronomy and Soil Science,2016,62(4):533-546.
[47]KELLER C,RIZWAN M,DAVIDIAN J C,et al.Effect of silicon on wheat seedlings (TriticumturgidumL.) grown in hydroponics and exposed to 0 to 30 μM Cu[J].Planta,2015,241(4):847-860.
[48]CHE J,YAMAJI N,SHAO J F,et al.Silicon decreases both uptake and root-to-shoot translocation of manganese in rice[J].Journal of Experimental Botany,2016,67(5):1535-1544.
[49]KHAN M I R,NAZIR F,ASGHER M,et al.Selenium and sulfur influence ethylene formation and alleviate cadmium-induced oxidative stress by improving proline and glutathione production in wheat[J].Journal of Plant Physiology,2015,173:9-18.
[50]关昕昕,严重玲,刘景春,等.钙对镉胁迫下小白菜生理特性的影响[J].厦门大学学报(自然科学版),2011,50(1):132-137.
[51]KANWAL U,ALI S,SHAKOOR M B,et al.EDTA ameliorates phytoextraction of lead and plant growth by reducing morphological and biochemical injuries inBrassicanapusL.under lead stress[J].Environmental Science and Pollution Research,2014,21(16):9899-9910.
[52]ASLAM U,AHMAD I,HUSSAIN M,et al.Effect of heavy metal pollution on mineral absorption in sunflower (HelianthusannuusL.) hybrids[J].Acta Physiologiae Plantarum,2014,36(1):101-108.
[53]CHEN Y,ZHANG S R,XU X X,et al.Effects of surfactants on low-molecular-weight organic acids to wash soil zinc[J].Environmental Science and Pollution Research,2016,23(5):4629-4638.
[54]MATHEW D C,HO Y N,GICANA R G,et al.A rhizosphere-associated symbiont,Photobacteriumspp.strain MELD1,and its targeted synergistic activity for phytoprotection against mercury[J].PLoS One,2015,10(3):e0121178.
[55]DELL′AMICO E,CAVALCA L,ANDREONI V.Improvement ofBrassicanapusgrowth under cadmium stress by cadmium-resistant rhizobacteria[J].Soil Biology and Biochemistry,2008,40(1):74-84.
[56]HASHEM A,ABDALLAH E F,ALQARAWI A A,et al.Alleviation of cadmium stress inSolanumlycopersicumL. by arbuscular mycorrhizal fungi via induction of acquired systemic tolerance[J].Saudi Journal of Biological Sciences,2016,23(2):272-281.
[57]WANG J L,LI T,LIU G Y,et al.Unraveling the role of dark septate endophyte (DSE) colonizing maize (Zeamays) under cadmium stress:physiological,cytological and genic aspects[J].Scientific Reports,2016,6:22028.
[58]KALAI T,BOUTHOUR D,MANAI J,et al.Salicylic acid alleviates the toxicity of cadmium on seedling growth,amylases and phosphatases activity in germinating barley seeds[J].Archives of Agronomy and Soil Science,2016,62(6):892-904.
[59]JABEEN N,ABBAS Z,IQBAL M,et al.Glycinebetaine mediates chromium tolerance in mung bean through lowering of Cr uptake and improved antioxidant system[J].Archives of Agronomy and Soil Science,2016,62(5):648-662.
[60]ISHIMARU Y,TAKAHASHI R,BASHIR K,et al.Characterizing the role of rice NRAMP5 in manganese,iron and cadmium transport[J].Scientific Reports,2012,2:286.
[61]MISRA S,GEDAMU L.Heavy metal tolerant transgenicBrassicanapusL. andNicotianatabacumL. plants[J].Theoretical and Applied Genetics,1989,78(2):161-168.
[62]HU T Z,ZHU S S,TAN L L,et al.Overexpression ofOsLEA4 enhances drought,high salt and heavy metal stress tolerance in transgenic rice (OryzasativaL.)[J].Environmental and Experimental Botany,2016,123:68-77.
[63]PÉREZ-ESTEBAN J,ESCOLSTICO C,RUIZ-FERNNDEZ J,et al.Bioavailability and extraction of heavy metals from contaminated soil byAtriplexhalimus[J].Environmental and Experimental Botany,2013,88:53-59.
[64]PALIT S,SHARMA A,TALUKDER G.Effects of cobalt on plants[J].The Botanical Review,1994,60(2):149-181.
[66]连玉武,卢昌义,曾文彬,等.九龙江流域土壤-蔬菜系统中重金属的迁移、分布、积累[J].厦门大学学报(自然科学版),1996,35(6):959-965.
[67]杨丹,刘鸣达,姜峰,等.酸性和中性水田土壤施用硅肥的效应研究Ⅰ.对土壤pH、Eh及硅动态的影响[J].农业环境科学学报,2012,31(4):757-763.
[68]苏以荣,向万胜,何电源.炉渣硅肥的肥效及重金属对土壤和水稻的影响[J].农业现代化研究,1995,16(5):321-324.
[69]马榕.重视磷肥中重金属镉的危害[J].磷肥与复肥,2002,17(6):5-6.
[70]RULEY A T,SHARMA N C,SAHI S V,et al.Effects of lead and chelators on growth,photosynthetic activity and Pb uptake inSesbaniadrummondiigrown in soil[J].Environmental Pollution,2006,144(1):11-18.
[71]AKHTAR S S,ANDERSEN M N,LIU F.Biochar mitigates salinity stress in potato[J].Journal of Agronomy and Crop Science,2015,201(5):368-378.
[72]JEFFERY S,VERHEIJEN F G A,VAN DER VELDE M,et al.A quantitative review of the effects of biochar application to soils on crop productivity using meta-ana-lysis[J].Agriculture,Ecosystems & Environment,2011,144(1):175-187.
[73]YOUSAF B,LIU G J,WANG R W,et al.Investigating the potential influence of biochar and traditional organic amendments on the bioavailability and transfer of Cd in the soil-plant system[J].Environmental Earth Sciences,2016,75(5):374.
[74]REES F,GERMAIN C,STERCKEMAN T,et al.Plant growth and metal uptake by a non-hyper-accumulating species (Loliumperenne) and a Cd-Zn hyperaccumulator (Noccaeacaerulescens) in contaminated soils amended with biochar[J].Plant and Soil,2015,395(1/2):57-73.
[75]MAQBOOL Z,ASGHAR H N,SHAHZAD T,et al.Isolating,screening and applying chromium reducing bacteria to promote growth and yield of okra (HibiscusesculentusL.) in chromium contaminated soils[J].Ecotoxicology and Environmental Safety,2015,114:343-349.
[76]VIVAS A,BAREA J M,AZCN R.Brevibacillusbrevisisolated from cadmium- or zinc-contaminated soils improvesinvitrospore germination and growth ofGlomusmosseaeunder high Cd or Zn concentrations[J].Microbial Ecology,2005,49(3):416-424.
[77]SALEEM M,ARSHAD M,HUSSAIN S,et al.Perspective of plant growth promoting rhizobacteria (PGPR) containing ACC deaminase in stress agriculture[J].Journal of Industrial Microbiology & Biotechnology,2007,34(10):635-648.
[78]KAMRAN M A,EQANI S A M A S,BIBI S,et al.Bioaccumulation of nickel byE.sativaand role of plant growth promoting rhizobacteria (PGPRs) under nickel stress[J].Ecotoxicology and Environmental Safety,2016,126:256-263.
[79]HAYAT R,ALI S,AMARA U,et al.Soil beneficial bacteria and their role in plant growth promotion:a review[J].Annals of Microbiology,2010,60(4):579-598.
[80]SANGTHONG C,SETKIT K,PRAPAGDEE B.Improvement of cadmium phytoremediation after soil ino-culation with a cadmium-resistantMicrococcussp.[J].Environmental Science and Pollution Research,2016,23(1):756-764.
[81]MATEOS-NARANJO E,MESA J,PAJUELO E,et al.Deciphering the role of plant growth-promoting rhizobacteria in the tolerance of the invasive cordgrassSpartinadensiflorato physicochemical properties of salt-marsh soils[J].Plant and Soil,2015,394(1/2):45-55.
[82]HAYAT Q,HAYAT S,IRFAN M,et al.Effect of exo-genous salicylic acid under changing environment:a review[J].Environmental and Experimental Botany,2010,68(1):14-25.
[83]SHARMA P,KUMAR A,BHARDWAJ R.Plant steroidal hormone epibrassinolide regulate heavy metal stress tolerance inOryzasativaL.by modulating antioxidant defense expression[J].Environmental and Experimental Botany,2016,122:1-9.
[84]JHA U C,BOHRA A.Genomics enabled breeding approaches for improving cadmium stress tolerance in plants[J].Euphytica,2016,208(1):1-31.
[85]张锡洲,张洪江,李廷轩,等.水稻镉耐性差异及镉低积累种质资源的筛选[J].中国生态农业学报,2013,21(11):1434-1440.
[86]ARAO T,AE N.Genotypic variations in cadmium levels of rice grain[J].Soil Science and Plant Nutrition,2003,49(4):473-479.
[87]SHI J,LI L Q,PAN G X.Variation of grain Cd and Zn concentrations of 110 hybrid rice cultivars grown in a low-Cd paddy soil[J].Journal of Environmental Sciences,2009,21(2):168-172.
[88]TIWARI M,SHARMA D,DWIVEDI S,et al.Expression in Arabidopsis and cellular localization reveal involvement of rice NRAMP,OsNRAMP1,in arsenic transport and tolerance[J].Plant,Cell & Environment,2014,37(1):140-152.
[89]SASAKI A,YAMAJI N,YOKOSHO K,et al.Nramp5 is a major transporter responsible for manganese and cadmium uptake in rice[J].The Plant Cell,2012,24(5):2155-2167.
[90]CUI Y C,XU G Y,WANG M L,et al.Expression ofOsMSR3 in Arabidopsis enhances tolerance to cadmium stress[J].Plant Cell,Tissue and Organ Culture,2013,113(2):331-340.
[91]ZHAO C Z,QIAO M,YU Y C,et al.The effect of the heterologous expression ofPhragmitesaustralisγ-glutamylcysteine synthetase on the Cd2+accumulation ofAgrostispalustris[J].Plant,Cell & Environment,2010,33(6):877-887.
[92]LI J C,GUO J B,XU W Z,et al.RNA interference-mediated silencing of phytochelatin synthase gene reduce cadmium accumulation in rice seeds[J].Journal of Integrative Plant Biology,2007,49(7):1032-1037.
[93]NOCTOR G,FOYER C H.Ascorbate and glutathione:keeping active oxygen under control[J].Annual Review of Plant Physiology and Plant Molecular Biology,1998,49(1):249-279.
[94]TSUJI N,HIRAYANAGI N,OKADA M,et al.Enhancement of tolerance to heavy metals and oxidative stress inDunaliellatertiolectaby Zn-induced phyto-chelatin synthesis[J].Biochemical and Biophysical Research Communications,2002,293(1):653-659.
[95]MA X L,ZHANG Q Y,ZHU Q L,et al.A robust CRISPR/Cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants[J].Molecular Plant,2015,8(8):1274-1284.
[96]YAN L L,WEI S W,WU Y R,et al.High-efficiency genome editing in Arabidopsis using YAO promoter-driven CRISPR/Cas9 system[J].Molecular Plant,2015,8(12):1820-1823.
[97]LIU X,CHEN J,WANG G H,et al.Hydrogen sulfide alleviates zinc toxicity by reducing zinc uptake and regulating genes expression of antioxidative enzymes and metallothioneins in roots of the cadmium/zinc hyperaccumulatorSolanumnigrumL.[J].Plant and Soil,2016,400(1/2):177-192.
Crop Morphogenesis and Solutions Under Heavy Metal Pollution
HONG Hualong,DAI Minyue,LU Haoliang,LIU Jingchun,YAN Chongling*
(Key Laboratory of the Coastal and Wetland Ecosystems,Ministry of Education,Xiamen University,Xiamen 361102,China)
In consideration of the fact that agriculture is under increasing risk of heavy metal pollution,it is urgently needed to deve-lop a technology to ensure sustainable food production.Here we review the mechanism of morphogenesis change as a response of crops to heavy metal pollution,the methodology in heavy metal pollution risk assessment and promising agriculture technologies to alleviate the heavy metal stress.The genetic basis and physiological mechanism of crop under heavy metal pollution are complex,and the response depends on plant phylogeny and metal species.With the developing knowledge on morphogenesis response and effective guidance from varieties of choices to field management,the food production in zones polluted with heavy metals will be protected.
heavy metal;agriculture production;field management;crop breeding;agricultural decision
10.6043/j.issn.0438-0479.201604107农业生产专题
2016-04-14录用日期:2016-07-30
国家重点基础研究发展计划(973计划)(2013CB956504)
ycl@xmu.edu.cn
洪华龙,戴闽玥,卢豪良,等.重金属污染下的作物形态建成及其应对措施[J].厦门大学学报(自然科学版),2016,55(5):686-696.
HONG H L,DAI M Y,LU H L,et al.Crop morphogenesis and solutions under heavy metal pollution[J].Journal of Xiamen University(Natural Science),2016,55(5):686-696.(in Chinese)
Q 494
A
0438-0479(2016)05-0686-11
