龙眼DlIKU1基因的克隆与功能分析
2016-10-18田真真陈雪玮郑少泉
姜 帆,田真真,陈雪玮,郑少泉,陈 亮*
(1.福建省农业科学院果树研究所,福建福州350003;2.厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建厦门361102)

龙眼DlIKU1基因的克隆与功能分析
姜帆1,田真真2,陈雪玮2,郑少泉1,陈亮2*
(1.福建省农业科学院果树研究所,福建福州350003;2.厦门大学 生命科学学院,厦门市植物遗传重点实验室,福建厦门361102)
拟南芥(Arabidopsisthaliana)IKU1基因突变可以产生较小的种子.根据植物IKU1同源基因的高度保守性,设计引物,PCR扩增获得龙眼(DimocarpuslonganLour.)同源基因DlIKU1的编码序列,其编码的蛋白含有VQ保守基序,与其他物种中同源蛋白的氨基酸序列存在较高的同源性;由于龙眼遗传转化的限制,构建DlIKU1基因的超量表达载体并转化拟南芥iku1突变体,统计转基因植株子代种子的长宽变化,结果表明:龙眼DlIKU1基因的超量表达可以显著增加拟南芥种子的大小,说明龙眼DlIKU1基因可以影响种子发育.上述结果为研究龙眼种子发育机理提供了理论和实验依据,有助于龙眼产业的发展.
龙眼;DlIKU1基因;克隆;生物信息学分析
龙眼(DimocarpuslonganLour.)又称桂圆,是我国亚热带名贵果树,广泛分布于福建、广东、广西等省,其果实经济价值高,富含多种维生素、果糖和矿物质等对人体有益的营养成分,且有一定的药用保健功效[1-3].近年来,随着龙眼相关产业的逐步发展,人们对其果实品质的要求也越来越高,其中味甜、核小等特征已经成为筛选龙眼新品种的标准[4].培育小核优良品种一直倍受重视,随着龙眼焦核(成熟时种子皱缩焦小的现象)研究的深入,目前已发现多个优良的龙眼单株,它们均具有焦核的性状,但多数生产性状不够稳定,难以推广,严重影响龙眼焦核的选育进程[5].因此,对于龙眼种子发育等方面的研究有助于阐明其发育过程中存在的规律、改善龙眼品质等,为最终实现调控龙眼种子发育过程奠定基础.
VQ蛋白是一类植物特有的蛋白,其序列中含有保守的VQ基序[6].Garcia等[7]已经报道了2个拟南芥(Arabidopsisthaliana)突变体iku1和iku2,突变体中过早的细胞化引起胚乳发育缺陷,间接抑制了胚的增殖和珠被细胞的伸长,产生较小的种子.此外,Luo等[8]的研究进一步证明了IKU1基因突变能够产生较小的种子,且发现该基因没有内含子,其编码的蛋白含有1个保守的VQ基序,在多种组织中均能检测到该基因的表达,但其主要是在胚乳中发挥作用.本研究根据模式生物拟南芥种子发育相关基因的分析,挑选拟南芥IKU1基因作为参照,通过设计保守区引物开展龙眼中IKU1同源基因DlIKU1的克隆工作;进而构建超量表达载体,通过拟南芥的遗传转化研究克隆的DlIKU1基因的生物学功能.
1 材料与方法
1.1材料
生物材料:龙眼由福建省农业科学院果树研究所提供;拟南芥生态型Landsbergerecta(Ler)由本实验室保存,拟南芥iku1突变体材料由澳大利亚联邦科工组织植物研究所罗明教授课题组惠赠;大肠杆菌(Escherichiacoli)菌株DH5α和根癌农杆菌(Agrobacteriumtumefaciens)菌株GV3101均由本实验室保存.
主要试剂:Gateway®供体载体pDONR207和目标载体pK7WG2均由本实验室保存;pMD-19T克隆载体、T4 DNA连接酶、PrimeStar高保真DNA聚合酶、ExTaqDNA聚合酶、连接试剂Solution Ⅰ均购自大连宝生物有限公司;HSTMMix、DNA分子质量标记DL5000、质粒提取试剂盒购自广州东盛生物科技有限公司;DNA凝胶回收试剂盒(AxyPrep AP-GX-50)购自Axygen公司;植物RNA提取试剂盒(E.Z.N.ATMplant RNA kit)购自Omega公司;反转录试剂盒(M-MLV first strand kit)、Gateway®BP重组克隆酶BP ClonaseTMⅡ Enzyme mix、LR重组克隆酶LR ClonaseTMⅡ Enzyme mix均购自Invitrogen公司;氨苄青霉素(Amp)、卡那霉素(Kan)、利福平、庆大霉素等抗生素购自上海生工生物工程股份有限公司,壮观霉素购自Sigma公司.
主要仪器:DSH-系列超净工作台(上海淀山湖净化设备厂),W7022J型微波炉(顺德美的微波炉制造有限公司),GI54DS型高压灭菌器(厦门致微仪器有限公司),PYX-400G-C型光照培养箱(广东韶关科力实验仪器有限公司).
1.2方法
1.2.1龙眼叶片基因组DNA(gDNA)的提取及质量检测
gDNA提取:由于龙眼组织中含有单宁、多酚等多种代谢产物,其gDNA的提取具有一定的困难.有研究指出改良3×十六烷基三甲基溴化铵(CTAB)法能有效防止多酚类物质的氧化,去除细胞中的多酚、多糖等次生代谢物质的影响,最终得到呈无色透明状的DNA溶液[9].本实验采用改良3×CTAB法提取龙眼gDNA,具体步骤参照文献[9].
质量检测:选取龙眼内参基因Actin(GenBank登陆号为EU340557.1)[10],用Primer5软件设计引物DlActin-F(5′-ATCCAGGCTGTTCTCTCCCTTTATG-3′)和DlActin-R(5′-GAGAAACAAAGGTACATCAAAGCAA-3′)进行PCR扩增.
1.2.2龙眼叶片总RNA的提取和反转录
参照Omega公司的E.Z.N.ATM植物RNA提取试剂盒说明书,提取龙眼叶片总RNA;利用M-MLV反转录酶,根据Invitrogen公司的M-MLV反转录试剂盒说明书,合成cDNA第一链.
1.2.3DlIKU1基因保守区第1次克隆
Lai等[11]在龙眼胚性愈伤组织转录组测序分析的研究中发现一个编码蛋白序列含有VQ基序的基因.根据此序列设计特异引物DlIKU1-F1(5′-CGGAGGTGGTCTAATCTTCTGCAA-3′)和DlIKU1-R1(5′-CAGCAACCTCAGCCTCAAGTTTACA-3′),扩增DlIKU1基因保守区.
PCR反应体系:5×PrimeStar buffer (含Mg2+) 2 μL,正向引物 1 μL,反向引物1 μL,dNTP mixture (10 mmol/L) 0.8 μL,gDNA模板1 μL,PrimeStar高保真DNA聚合酶(2.5 U/μL) 0.1 μL,ddH2O 4.1 μL.反应程序:95 ℃ 5 min;95 ℃ 30 s,50~60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min.
扩增结束后,取5 μL产物,1%(质量分数,下同)琼脂糖凝胶电泳检测.根据电泳检测结果,将PCR反应体系扩大5或10倍进行扩增,全部扩增产物进行1%琼脂糖凝胶电泳,紫外灯下切割含有目的片段的凝胶,使用Axygen公司的AxyPrep DNA凝胶回收试剂盒回收目的片段;取适量经过纯化的终产物加A-tail后,与pMD-19T载体在T4 DNA连接酶催化下16 ℃连接过夜.连接产物分别转化DH5α感受态细胞,在含Amp终质量浓度为100 μg/mL的新鲜固体LB平板上进行筛选培养.
37 ℃培养过夜,挑取平板上生长的单菌落,放入无菌的含3 μL ddH2O的PCR管中,混匀后吸取1 μL菌液作为PCR鉴定的模板,另外2 μL转入含100 μg/mL Amp的500 μL LB液体培养基中,37 ℃、190~200 r/min培养过夜;将经电泳检测验证与目标片段大小一致的菌液,提取质粒送深圳华大基因科技有限公司进行测序.
1.2.4DlIKU1基因保守区第2次克隆
根据拟南芥中已克隆的IKU1基因(AT2G35230)的核酸序列和蛋白序列,在NCBI网站进行BLAST比对(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi),选取5个参考物种(蓖麻(Ricinuscommunis)、克莱门柚(Citrusclementina)、脐橙(Citrussinensis)、毛果杨(Populustrichocarpa)、葡萄(Vitisvinifera))序列以及龙眼中第1次保守区克隆获得的序列,用软件Vector NTI 11.5进行多重序列比对,设计引物DlIKU1-F3(5′-GATGATTTGATTGTGGGAGTGTT-3′)和DlIKU1-R3(5′-ATAGACATGGGAAAAGTAGACTACAAACT-3′)进行PCR扩增.
PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,50~60 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min.PCR反应体系、目的产物的回收与纯化、与pMD-19T连接、转化DH5α感受态细胞以及重组子质粒提取等步骤参见1.2.3.
以龙眼cDNA第一链产物为模板,选择DlIKU1-F3和DlIKU1-R3引物进行PCR扩增,反应体系和程序同上,回收PCR产物,连接pMD-19T,转化DH5α感受态细胞,将鉴定正确的重组质粒送样测序.
1.2.5生物信息学分析
对于已经获得的龙眼DlIKU1基因序列进行生物信息学分析:
1) 通过DNAMAN 6.0软件比对目的基因的gDNA扩增产物和cDNA扩增产物,分析已知保守序列是否有内含子;
2) 使用Vector NTI 11.5软件预测DlIKU1基因的开放阅读框(ORF),并分析其编码蛋白质的序列;
3) 在InterProScan网站(http:∥www.ebi.ac.uk/Tools/pfa/iprscan5/)进行保守结构域预测分析;
4) 利用DNAMAN 6.0软件对DlIKU1基因和参考物种的同源基因进行相似性分析.
1.2.6超量表达载体的构建
设计引物DlIKU1-ORF-F(5′-ATGGATGGCTCGAAAAACCGTCAT-3′)和DlIKU1-ORF-R(5′-CTATTGATCCCTCCATCTTGGACT-3′)扩增DlIKU1基因的ORF区,与pMD-19T载体连接,转化DH5α感受态细胞后,挑取单菌落进行PCR验证,鉴定正确的菌落扩大培养提取质粒并送样测序.测序正确的质粒命名为pMD19T-DlIKU1.根据龙眼DlIKU1基因的ORF区序列,设计含attB接头的引物DlIKU1-OE-F(5′-CAAAAAAGCAGGCTATGGATGGCTCGAAAAACCGTCATA-3′)和DlIKU1-OE-R(5′-CAAGAAAGCTGGGTCTATTGATCCCTCCATCTTGGACTT-3′);以pMD19T-DlIKU1质粒为模板扩增目的片段.回收PCR产物,通过BP重组反应构建到供体载体pDONR207上,转化DH5α感受态细胞,挑取单克隆进行菌落PCR鉴定,获得的阳性克隆测序正确后与目标载体pK7WG2进行LR重组反应,构建得超量表达质粒pK7WG2-DlIKU1;将构建成功的质粒转化GV3101感受态细胞,28 ℃暗培养2 d,待单克隆长出后挑取单菌落进行PCR鉴定获得阳性克隆.取阳性克隆菌液保菌,-80 ℃保存备用.
1.2.7根癌农杆菌介导的拟南芥遗传转化
拟南芥的培养、GV3101感受态细胞的制备、超量表达质粒(pK7WG2-DlIKU1)转化GV3101感受态细胞、根癌农杆菌侵染液的制备和侵染步骤参照文献[12].转化受体材料为Ler野生型植株和iku1突变体植株,侵染后的植株用透明罩盖住24 h后移去,继续按照土培条件培养;一周后,制备根癌农杆菌侵染液再侵染一次;侵染后植株继续按土培条件培养拟南芥直至结出果荚,收获成熟的种子,37 ℃烘箱中放置约一周烘干.之后将种子(T1代)存于含干燥剂的容器内备用.
1.2.8转基因植株鉴定与种子长宽测量
DlIKU1基因是从龙眼中克隆的基因,因此通过扩增DlIKU1基因来鉴定阳性拟南芥转基因植株.以转基因植株的gDNA为模板进行PCR鉴定,以野生型植株的gDNA为阴性对照.
取200粒拟南芥T3代种子,惠普扫描仪扫描后用Scion Image软件测量种子的长、宽,每组测量50粒种子,重复3次.
2 结果与分析
2.1龙眼gDNA提取及质量检测
3×CTAB法提取龙眼gDNA,提取到的gDNA无明显降解现象,条带清晰;电泳结果显示:以gDNA扩增内参基因Actin时,能够获得单一的条带,说明改良3×CTAB法提取的gDNA质量较好(图1).
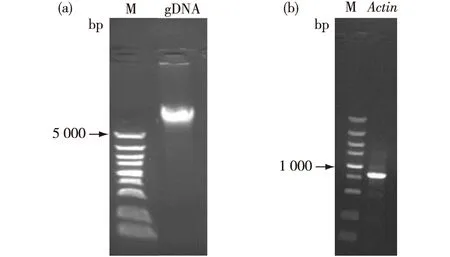
M:DNA分子质量标记 DL5000.图1 龙眼叶片基因组gDNA(a)和内参基因Actin扩增产物(b)电泳检测Fig.1Electrophoresis of gDNA of longan leaf (a) and the PCR product of control gene Actin (b)
2.2DlIKU1保守区第1次克隆分析
以gDNA为模板,用DlIKU1保守区的引物进行PCR扩增.1%琼脂糖凝胶电泳检测,割胶纯化目的片段,与pMD19-T载体进行TA克隆,转化DH5α感受态细胞.获得的阳性克隆提取质粒送样测序,结果如图2所示.

图2 DlIKU1保守区第1次扩增测序结果Fig.2First amplification of DlIKU1 conserved region
测序结果表明,第1次保守区克隆获得的片段大小为159 bp,与转录组测序结果[11]完全相同,且以gDNA和cDNA为模板均能够成功扩增到目的条带,说明该序列是龙眼DlIKU1基因的部分序列.
2.3DlIKU1保守区第2次克隆分析
根据5个参考物种核酸序列比对结果设计反向简并引物,并根据第1次保守区克隆结果设计正向引物进行PCR扩增.切胶回收纯化目的片段,经连接、转化、菌落PCR鉴定等步骤,获得阳性克隆.提取重组质粒,对质粒进行测序,结果如图3所示.结果表明龙眼基因DlIKU1第2次保守区扩增得到的目的片段长度为1 108 bp.

图3 DlIKU1保守区第2次扩增测序结果Fig.3Second amplification of DlIKU1 conserved regions
2.4DlIKU1基因及蛋白的生物信息学分析
目的基因以gDNA和cDNA为模板扩增产物的测序结果通过DNAMAN 6.0软件分析,除存在个别碱基不同外,其他序列均相同,说明克隆的DlIKU1基因片段不含内含子.
使用DNAMAN 6.0软件推测出DlIKU1基因ORF共有990 bp,编码330个氨基酸、等电点为11.45的蛋白质.将推导的氨基酸序列递交到InterProScan5网站进行蛋白结构预测,结果显示,DlIKU1与拟南芥IKU1一样,含有VQ基序.推测该基因可能与拟南芥IKU1基因具有相似的功能.
将DlIKU1与5个参考物种中同源蛋白的氨基酸序列通过DNAMAN 6.0软件进行多序列比对(图4).结果显示:DlIKU1与脐橙、克莱门柚、毛果杨、蓖麻、葡萄中同源蛋白序列都含有相同的保守结构域.比对结果显示:DlIKU1与脐橙、克莱门柚、蓖麻、葡萄、毛果杨中同源蛋白的覆盖率分别为99%,99%,89%,93%,99%;匹配率分别为80%,80%,75%,68%,75%.
2.5DlIKU1超量表达载体的拟南芥遗传转化
龙眼属于木本植物,其组织培养和植株再生比较困难,而且遗传转化的效率非常低[3,11],因此将DlIKU1基因导入拟南芥中进行功能的初步验证.

图4 VQ蛋白多序列比对Fig.4Multiple sequence alignment of VQ proteins
利用Gateway技术构建了超量表达质粒pK7WG2-DlIKU1(图5),将其转化GV3101感受态细胞,PCR鉴定得到阳性克隆;制备根癌农杆菌侵染液侵染拟南芥,获得超量表达转基因植株.分别提取转基因植株和野生型植株叶片gDNA,以转基因植株gDNA为模板、野生型植株gDNA为阴性对照,扩增DlIKU1基因片段,筛选阳性转基因植株.
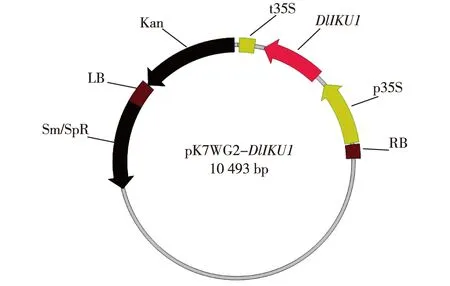
LB.T-DNA左边界;RB.T-DNA右边界;Sm/spR.壮观霉系抗性基因;Kan.卡那霉素抗性基因;p35S.35S启动子;t35S.35S终止子.图5 pK7WG2-DlIKU1质粒结构Fig.5Plasmid structure of pK7WG2-DlIKU1
2.6DlIKU1基因对种子大小的影响
为了研究DlIKU1基因是否能够影响种子发育,分别统计超量表达株系(OE,侵染转化Ler野生型植株后的株系)和回补株系(iku1/DlIKU1,侵染转化iku1突变体后的株系)T3代种子的长宽.使用Scion Image软件测量种子的长、宽;使用SPSS软件进行差异统计分析.结果表明:当DlIKU1超量表达的目的质粒转入野生型Ler植株时,超量表达株系的种子与野生型种子相比,长和宽均显著增大(图6(a));与之类似,回补株系的T3代种子与iku1突变体种子相比也有一定变大(图6(b)).由此说明DlIKU1基因在一定程度上能够影响种子发育.
3 讨 论
3.1VQ蛋白家族
近年来,VQ蛋白已陆续在拟南芥、大豆、蓖麻、杨树、葡萄和水稻等植物中鉴定出来,在水稻中发现39个成员,拟南芥中发现34个成员,而在大豆中发现74个成员[13-14].对于VQ蛋白家族成员的功能研究主要集中在拟南芥中,而对于大豆、水稻中VQ家族成员的研究主要在一些关于逆境胁迫下基因的表达分析[14].
拟南芥中大部分VQ基因没有内含子,一般编码的蛋白序列小于300个氨基酸.在拟南芥VQ蛋白家族的功能研究中,发现AtVQ29基因参与砷酸盐的抗性,表明AtVQ29可能在逆境防御反应中发挥重要作用[15];同时AtVQ29表达受到光的影响,并参与植物的开花时间调控,证实AtVQ29可能是光形态建成中一个新的调节因子[16].
此外,IKU1(AtVQ14)也是一个含VQ基序的蛋白,它能够与WRKY10转录因子存在相互作用.虽然IKU1基因在拟南芥的不同组织中都有表达,但它主要是在胚乳中发挥作用,IKU1基因通过影响种子发育过程中胚乳的发育,使胚乳细胞化时间提前,iku1突变体产生较小的种子;进化树分析发现IKU1基因与拟南芥中另一个基因(AT1G32610)处在同一组中,二者蛋白序列存在很大的同源性,可能导致二者基因功能的冗余,掩盖了IKU1基因的其他功能[8].
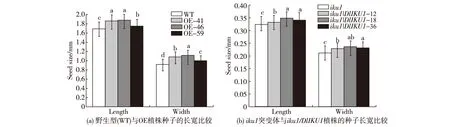
不同小写字母表示差异显著(p<0.05).图6 转基因植株种子的平均长宽变化Fig.6Changes of average seed lengths and widths of the transgenic plants
VQ基因的功能缺失突变体或者超量表达转基因植株在种子大小、生物胁迫、抗病等方面发生一定的改变,说明VQ蛋白家族在植物生长、发育和环境胁迫等方面具有重要的作用.
3.2龙眼DlIKU1基因功能
本研究根据拟南芥及其他物种的IKU1基因序列,克隆了龙眼DlIKU1基因,并对其在种子发育中的功能进行了研究.目前得到的DlIKU1基因ORF区为990 bp,编码330个氨基酸的蛋白,与其他物种中VQ蛋白在氨基酸序列上存在高度同源性.由于龙眼遗传转化效率较低,将DlIKU1基因导入拟南芥野生型植株以及iku1突变体植株进行初步功能验证.通过统计超量表达株系和回补株系后代种子长宽变化,发现超量表达株系以及突变体回补株系后代种子的长和宽均有增加,表明DlIKU1基因在一定程度上与种子发育相关.后续将进一步研究DlIKU1影响种子发育的分子机制,以求为龙眼种子遗传改良奠定基础.
[1]肖更生,黄儒强,曾庆孝,等.龙眼核的营养成分[J].食品科技,2004(1):93-94.
[2]邓九生.我国龙眼果实品质性状与改良途径的探讨[J].广西热作科技,1995(1):7-11.
[3]赖钟雄,桑庆亮,陈春玲,等.龙眼的遗传学研究[J].福建农林大学学报(自然科学版),2000,29(4):416-420.
[4]古小玲,李玉萍,梁伟红,等.中国龙眼产业发展概况[J].中国农学通报,2008(9):470-4.
[5]杨永青,陈志峰.焦核龙眼果实遗传性状及胚培养的研究[J].园艺学报,1987(4):217-22.
[6]XIE Y D,LI W,GUO D,et al.The Arabidopsis geneSIGMAFACTORBINDINGPROTEIN1 plays a role in the salicylate and jasmonate-mediated defence responses[J].Plant Cell & Environment,2010,33(5):828-839.
[7]GARCIA D,SAINGERY V,CHAMBRIER P,et al.Arabidopsishaikumutants reveal new controls of seed size by endosperm[J].Plant Physiology,2003,131(4):1661-1670.
[8]LUO M,DENNIS E S,BERGER F,et al.MINISEED3 (MINI3),aWRKYfamily gene,andHAIKU2 (IKU2),a leucine-rich repeat (LRR)KINASEgene,are regulators of seed size in Arabidopsis[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(48):17531-17536.
[9]肖璇,孙敏,王心燕,等.顽拗植物龙眼基因组DNA 提取方法的研究[J].生物技术,2005,15(1):44-47.
[10]蔡英卿,赖钟雄,陈义挺.龙眼14-3-3基因及其启动子的克隆以及在体胚发生过程中的表达分析[J].热带作物学报,2011,32(5):845-853.
[11]LAI Z X A,LIN Y L.Analysis of the global transcriptome of longan (DimocarpuslonganLour.) embryogenic callus using Illumina paired-end sequencing[J].BMC Genomics,2013,14:561.
[12]王晓娟.AtST39和AtST39H在盐胁迫干旱胁迫中的功能研究[D].厦门:厦门大学,2014:29-31.
[13]KIM D,KWON S,CHOI C,et al.Expression analysis of riceVQgenes in response to biotic and abiotic stresses[J].Gene,2013,529(2):208-214.
[14]WANG X,ZHANG H,SUN G,et al.Identification of active VQ motif-containing genes and the expression patterns under low nitrogen treatment in soybean[J].Gene,2014,543(2):237-243.
[15]刘安娜,腾瑶,徐文忠,等.一个编码含VQ模序蛋白的基因AtARVQ1参与拟南芥对砷酸盐的响应调控[J].科学通报,2011,56(23):1891-1898.
[16]刘清,唐蛟,曾娟,等.拟南芥AtVQ29 基因的克隆与植物表达载体构建[J].现代生物医学进展,2014,14(35):6814-6817.
Cloning and Functional Analysis of DlIKU1 Gene in Dimocarpus longan Lour.
JIANG Fan1,TIAN Zhenzhen2,CHEN Xuewei2,ZHENG Shaoquan1,CHEN Liang2*
(1.Fruit Research Institute,Fujian Academy of Agricultural Sciences,Fuzhou 350003,China;2.Xiamen Key Laboratory for Plant Genetics,School of Life Sciences,Xiamen University,Xiamen 361102,China)
IKU1 gene mutation inArabidopsisthalianaproduced small seeds.The primers were designed according to the highly conservative sequence ofIKU1 homologous genes. The longanDlIKU1 gene was obtained via PCR amplification.The amplified sequences of LonganDlIKU1,990 bp,contained VQ motif,and had high homology with the other species.Because of low efficiency of the longan genetic transformation,we constructed the overexpression vector ofDlIKU1 gene for genetic transformation in Arabidopsis.Then we summarized changes in length and width of the progeny seed to study the function ofDlIKU1 gene.The results showed thatDlIKU1 gene might affect seed development to a certain extent.This study provided theoretical and experimental basis for the development of longan seed,and it will be helpful to the development of longan industry.
DimocarpuslonganLour.;DlIKU1 gene;cloning;bioinformatic analysis
10.6043/j.issn.0438-0479.201604101农业生产专题
2016-04-06录用日期:2016-06-17
农业科研杰出人才及其创新团队项目(20120911);国家产业技术体系项目(CARS-33-05);福建省自然科学基金(2014J01100)
chenlg@xmu.edu.cn
姜帆,田真真,陈雪玮,等.龙眼DlIKU1基因的克隆与功能分析[J].厦门大学学报(自然科学版),2016,55(5):679-685.
JIANG F,TIAN Z Z,CHEN X W,et al.Cloning and functional analysis ofDlIKU1 gene inDimocarpuslonganLour.[J].Journal of Xiamen University(Natural Science),2016,55(5):679-685.(in Chinese)
Q 356.1
A
0438-0479(2016)05-0679-07
