超细晶氧化亚铜的制备研究
2016-10-17柴希娟
陶 磊, 柴希娟
(西南林业大学材料工程学院,云南昆明 650224)
超细晶氧化亚铜的制备研究
陶 磊, 柴希娟
(西南林业大学材料工程学院,云南昆明 650224)
以CuSO4·5H2O为铜源,NaOH为沉淀剂,葡萄糖为还原剂,采用简单的液相法制备了六边体、立方体、球体三种超细晶Cu2O.考察硫酸铜浓度、氢氧化钠浓度、反应温度、葡萄糖浓度等因素对Cu2O粉末形貌和粒径的影响,给出了可能的生长理论.采用XRD、SEM、UV-Vis等方法对产物进行表征.结果表明:液相法所制备的Cu2O粉末形貌、粒径可控,分散性良好;XRD、UV-Vis检测表明制得的Cu2O粉末结晶度好、纯度高,最大吸收峰在可见光范围内.
超细晶;氧化亚铜;液相法
环境污染等问题已成为21世纪人们所面临和急需解决的重大问题,特别是水污染已经造成严重的生态破坏并威胁到我们的生活.光催化降解环境中的有机污染物是近几年来出现的一种新型的有机污染物处理方法.在众多的半导体光催化材料中,氧化亚铜(Cu2O)是少有的能被可见光激发的P型半导体材料,其禁带宽带为2.0-2.2eV;在太阳能电池、可见光催化制氢等领域的应用,证明Cu2O是一种优异的可见光催化剂,能在可见光激发下催化降解有机污染物[1].研究表明,亚微米级即超细晶Cu2O在可见光下对水的分解有更好的催化性能[2].因此Cu2O因其优越的光催化性能,在环境污染治理中受到了众多学者的重视,渐渐成为了研究热点[3].目前,制备Cu2O的方法主要有辐射法[4],固相法[5]、液相法[6-9]和电化学法[10]等.但是上述方法中均存在一定的局限性,有的加入昂贵的表面活性剂、添加剂或者高浓度的反应物,导致制备过程复杂化、不易于操作、成本提高.
本研究在不加任何表面活性剂和低反应物浓度条件下,仅用葡萄糖为还原剂,采用液相法,在碱性体系下,通过控制温度和反应物等因素,制备得到六边体、球体和立方体亚微米级Cu2O粉末.
1 实验部分
1.1试剂与仪器
五水硫酸铜(CuSO4·5H2O)、氢氧化钠(NaOH)、葡萄糖(C6H12O6·H2O),所用试剂均为分析纯,无水乙醇,去离子水.
X射线衍射、扫描电子显微镜、紫外可见分光光度计,水浴恒温反应釜、离心机、恒温鼓风干燥箱、超声波震荡仪、磁力搅拌器.
1.2亚微米级Cu2O的制备
取适量配制好的CuSO4溶液至三口烧瓶中,在磁力搅拌下滴加NaOH溶液,磁力搅拌30min,使溶液完全呈蓝色絮状,将适量的葡萄糖溶液加入到混合液中,并移至设定温度的恒温水浴锅中,记录反应前10分钟溶液的颜色变化,磁力搅拌反应3h,待反应结束后离心过滤,用无水乙醇和去离子水洗涤多次,最后将样品置于55℃真空干燥箱中干燥3h,即得超细晶Cu2O粉体.
1.3样品的表征
采用X射线衍射仪进行物相分析;采用扫描电子显微镜观测样品形貌;采用紫外-可见分光光度计观察样品的最大吸收峰.
2 结果与讨论
本实验初步探讨了反应温度与反应物(NaOH、葡萄糖、CuSO4)等因素对亚微米级Cu2O粉体形貌及粒径的影响,其可能反应如下:

2.1反应温度对Cu2O晶型的影响
固定CuSO4溶液浓度为0.1mol/L,NaOH溶液浓度为6.0mol/L,葡萄糖溶液浓度为1.0mol/L.考察反应温度对Cu2O粒径及形貌的影响(如表1).
由表1可知,随着反应温度的升高,Cu2O粉体的形貌发生了相应的改变,在55℃时,Cu2O粉体的形貌为六边体;65℃时,形貌为球体且粒径最小为0.5μm左右;继续升温,粒径反而增大,出现了混合晶粒.
张克从等[11]认为晶体生长的形貌变化取决于各晶面相对生长的速率.生长速率较小的晶面最终会形成裸露面,而生长速率较快的晶面则在晶体生长中消失.立方晶系的晶体外貌是由(100)晶面和(111)晶面生长速度不同造成的,当晶体的(111)晶面生长较快时,晶体的(100)面裸露面增大,晶体形貌趋向于立方体;当晶体的(111)面生长速度接近于(100)面,晶体外貌趋向于类球体[12].根据热力学理论,在溶液体系中,相关离子的饱和度与晶体各晶面相对生长速率密切相关[12].在较低的饱和度下,反应体系有晶核形成后以层错生长和二维核生长模式缓慢生长,产物多为具有特定形貌的单晶[13];在高饱和度下,体系中晶核形成是一个快速过程,聚集机制成为晶体的主要生长模式,产物为球体多晶[14].因此,调整溶液中Cu+的饱和度,控制(111)面的生长,便可得到不同形貌的Cu2O粉体.
因此,当反应温度低、反应体系中Cu2+的来源为Cu(OH)2,此时Cu2+→Cu+阶段较快,导致Cu+的饱和度较高,Cu2O晶核以聚集生长模式为主,且各个晶面生长速率基本相同,最终得到六边体和球体多晶Cu2O;当反应温度过高,部分Cu(OH)2脱水变成CuO,Cu2+→Cu+阶段变慢,导致Cu+的饱和度较低,Cu2O晶核部分以层错和二维核模式生长,且指数较高的(111)晶面生长速率相对较大,(100)晶面生长速率较小,最终出现球体和立方体的混合晶粒.
2.2NaOH溶液浓度对Cu2O晶型的影响
固定反应温度为65℃,CuSO4溶液浓度为0.1mol/L,葡萄糖浓度为1.0mol/L.考察NaOH溶液浓度对Cu2O粒径及形貌的影响(如表2).
由表2可知,当NaOH浓度为4.0mol/L、6mol/L时,所得Cu2O粉体为单一的六边体(0.7μm)、球体(0.5μm);随着NaOH浓度不断增大,Cu2O粉体中均出现了混合晶粒.
这与温度组类似,NaOH溶液浓度较低时,Cu2O晶核以聚集生长模式为主,得到六边体和球体多晶Cu2O粉体;随着NaOH溶液浓度的增加,Cu(OH)2脱水生成CuO的速度增大,Cu2O晶核部分以层错和二维核模式生长,最终导致了混合晶粒的产生.
2.3葡萄糖溶液浓度对Cu2O晶型的影响
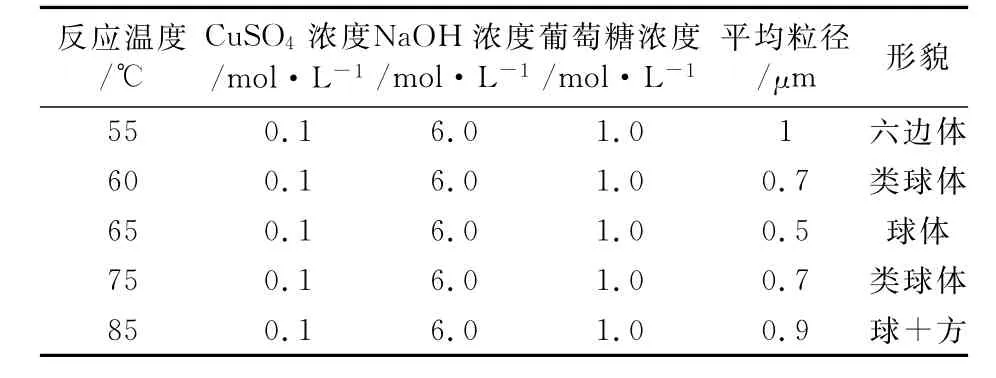
表1 不同反应温度下Cu2O的粒径及形貌Table 1 Effect of reaction temperature on particle size and morphology of Cu2O

表2 不同NaOH溶液浓度下Cu2O的粒径及形貌Table 2 Effect of concentration of NaOH on particle size and morphology of Cu2O
固定反应温度为65℃,CuSO4溶液浓度为0.1mol/L,NaOH溶液浓度为6.0mol/L.考察葡萄糖溶液浓度对Cu2O粒径及形貌的影响(如表3).
由表3可知,当葡萄糖浓度为0.8mol/L时,Cu2O形貌为立方体;随着葡萄糖浓度增加,Cu2O的形貌发生了改变,出现混晶及类球体晶粒;继续增加葡萄糖浓度,Cu2O的形貌变成球体.
这是由于葡萄糖浓度过低时,还原能力低,晶核以二维成核模式生长,因此出现了立方体的晶粒;随着葡萄糖浓度的增加,还原阶段加快,晶核以聚集成核模式生长,最终得到球体Cu2O粉末.
2.4CuSO4溶液浓度对Cu2O晶型的影响
固定反应温度为65℃,NaOH溶液浓度为6.0mol/L,葡萄糖溶液浓度为1.0mol/L.考察CuSO4溶液浓度对Cu2O形貌及粒径的影响(如表4).
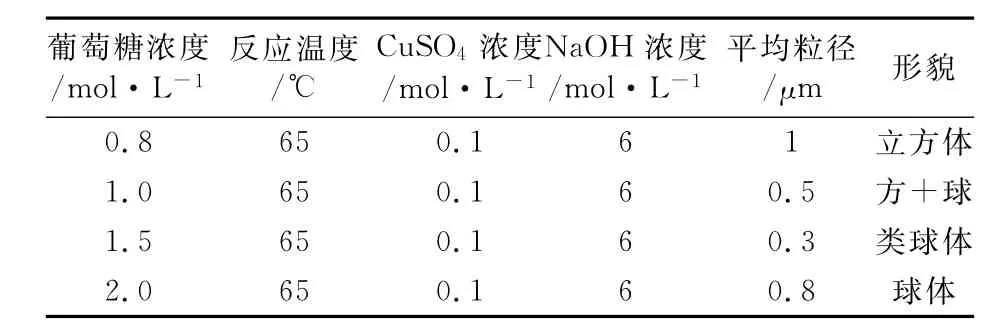
表3 不同葡萄糖溶液浓度下Cu2O的粒径及形貌Table 3 Effect of concentration of glucose on particle size and morphology of Cu2O
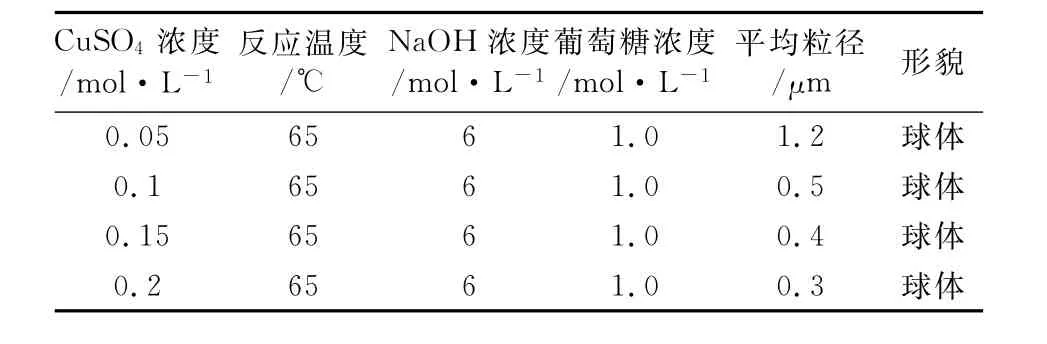
表4 不同CuSO4溶液浓度下Cu2O的粒径及形貌Table 4 Effect of concentration of CuSO4on particle size and morphology of Cu2O
由表4可知,随着CuSO4溶液浓度的增加,得到Cu2O的形貌均为球体且粒径逐渐减小.
这是由于Cu(OH)2为固相,体系内Cu2+的浓度随CuSO4溶液浓度的增加变化不大,晶核主要以聚集生长模式为主,CuSO4溶液浓度低时,成核数量少,反应生成的Cu2O在仅有的少量核周围继续长大,因此得到球体粒径大Cu2O粉末;CuSO4溶液浓度高时,反应开始成核的数量增多,Cu2O在核周围均匀生长,因而得到球体粒径小的Cu2O粉末.

图1 氧化亚铜的SEMFig.1 Plot of Cu2O SEM
2.4SEM分析
图1中为制备得到的氧化亚铜的SEM照片.其中(a)是CuSO4为0.1mol/L,NaOH浓度为4mol/L,葡萄糖浓度为1.0mol/L,反应温度65℃下制得的六边体体Cu2O粉末;(b)是CuSO4为0.1mol/L,NaOH浓度为6mol/L,葡萄糖浓度为1.0mol/L,反应温度65℃下制得的球体Cu2O粉末;(c)是CuSO4为0.1mol/L,NaOH浓度为6mol/L,葡萄糖浓度为0.8mol/L,反应温度65℃下制得的立方体Cu2O粉末,三种方法得到的Cu2O粉末粒径均匀、分散性好.(d)是CuSO4为0.1mol/L,NaOH浓度为8mol/L,葡萄糖浓度为1.0mol/L,反应温度65℃下制得的混合晶粒.
2.5XRD检测结果分析
采用X射线衍射仪对不同形貌的亚微米Cu2O粉体进行物相分析.从图2可以看出,所制备样品的XRD图谱中,衍射峰依次出现在2θ值为29.7°、36.6°、42.4°、61.5°及74.40°分别对应氧化亚铜的(110)(111)(200)(220)和(311)晶面,这与标准谱库Cu2O晶体谱图基本一致对应.另外,在图2中没有出现CuO和Cu的衍射峰,说明所制备的Cu2O纯度很高,结晶度较好.2.6 UV-Vis检测结果分析

图2 氧化亚铜的XRD衍射图谱Fig.2 Plot of Cu2O XRD
图3为不同形貌Cu2O粉体的紫外吸收光谱.从图3中可以看出,所制备的立方体和六边体Cu2O在400nm-560nm均有较高的吸收率,球体Cu2O在400nm-480nm具有较高的吸收率,即所制备的三种超细晶Cu2O均对可见光具有优异的响应效果.
根据一种经典的半导体公式αEP=K(EP -Eg)1/2计算氧化亚铜的禁带宽度.其中α表示吸收系数,K是常数,EP是不连续的光子能量,Eg代表能带隙[15].计算得到球体、立方体和六边体的禁带宽度分别为2.42eV、2.42eV和2.50eV,比理论Cu2O的禁带宽度(2.0-2.2eV)要大,可能是在紫外光谱中,由于尺寸效应展现出蓝移现象,但比yang[16]和卫玲[17]的计算得到的禁带宽度要小(2.60eV和2.58eV).
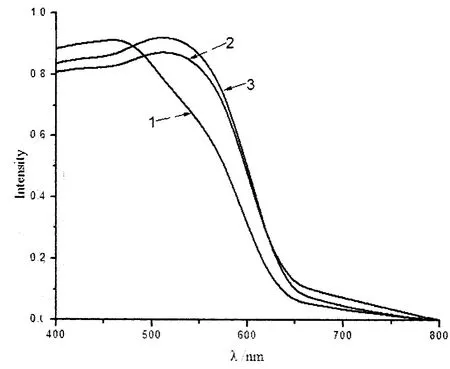
1hexagon Cu2O;2sphere Cu2O;3cube Cu2O 图3 样品Cu2O的紫外吸收光谱Fig.3 Plot of Cu2O UV-Vis
3 结论
(1)采用液相法制备的Cu2O粉末形貌规
整,粒径可控,分散性良好,其中反应温度和氢氧化钠浓度是控制Cu2O粉末形貌的关键因素;控制温度和反
应物浓度得到六边体、立方体、球体三种晶型的超细晶Cu2O粉末,粒径大小在200-500nm之间.
(2)XRD分析表明,液相法制得的三种晶型Cu2O粉末结晶度好,纯度高,没有杂质Cu和CuO出现;UV-Vis分析表明,制得的三种晶型Cu2O粉末最大吸收峰均在可见光的波长范围内,说明该法制得的Cu2O具有可见光响应.
[1] KOU C H,HUANG M H.Morphologically controlled synthesis of Cu2O nanocrystals and their properties[J].Nano Today,2010,5(2):106-116.
[2] HARA M,KONDO T,KOMODA M,et al.Cu2O as a photocatalyst for overall water spliting under visiable light irradiation[J].Chemical Communications,1998,32(3):357-358.
[3] 王野,杨峰.纳米氧化亚铜的制备及其应用的研究进展[J].化学世界,2011,52(9):573-576,537.
[4] ZHU Y J,QIAN Y T,ZHANG M W,et al.Preparation and characterization of nanocrystalline powders of cuprous oxide by usingγradiation[J].Materials Research Bulletin,1994,29(4):377-383.
[5] 钱红梅,李燕,赫成伟.纳米Cu2O粉体的室温固相合成及其光催化性能[J].半导体光电,2008,29(6):913-915.
[6] 黄锡峰,张福全,陈振华.水溶液球磨制备氧化亚铜粉末的研究[J].矿治工程,2010,30(1):73-76.
[7] DONG Y J,LI Y D,WANG C,et al.Preparation of cuprous oxide particles of different crystallinity[J].Journal of Colloid and Interface Science,2001,243(1):85-89.
[8] 郭雨,石国亮,王军峰,等.均相还原法制备八面体氧化亚铜晶体[J].合成化学,2008,16(3):340-341.
[9] 何开棘,丁慧,王开明.纳米Cu2O的特殊液相沉淀法制备及其光催化活性[J].化工进展,2009,28(6):975-977,981.
[10] 胡飞,陈镜昌,吴坚强,等.Cu2O半导体薄膜在酸性条件下的电化学沉积[J].功能材料,2011,42(SIII):488-491.
[11] 张克从,张乐溥.晶体生长科学与技术[M].北京:科学出版社.1996,63-89.
[12] 宋继梅,张小霞,焦剑,等.立方体和球状氧化亚铜的制备及其光催化性质[J].应用化学,2010,27(11):1328-1333.
[13] XU J,XUE D.Five branching growth patterns in the cubic crystal system:A direct observation of cuprous oxide microctystals[J].Acta Mater,2007,55(7):2393-2397.
[14] 李广慧,韩丽,方奇.晶体结构控制晶体形态的理论及应用[J].人工晶体学报,2005,34(3):546-549.
[15] 刘明辉,张丽莎,贾志勇,等.化学浴沉积法制备纳米氧化亚铜薄膜[J].华中师范大学学报:自然科学版,2006,40(1):75-78.
[16] YANG Ming,ZHU Junjie.Spherical hollow assembly composed of Cu2Onanoparticles[J].Cryst Growth,2003,256:134-138.
[17] 卫玲,李凡,高有辉,等.空芯纳米氧化亚铜颗粒的制备及其光学性质[J].复旦学报:自然科学版,2008,47(5):663-667.
Study on Preparation of Superfine Crystal Cuprous Oxide
TAO Lei, CHAI Xi-juan
(School of Material Engineering,Southwest Forestry University,Kunming 650224,China)
Superfine crystal Cuprous oxides(Cu2O)have been synthesized by the liquid phase method,with CuSO4·5H2O as source of copper,NaOH as precipitant,glucose as the reducing agent,which have three (hexagon,cube,sphere)different shapes.The effects of concentration of CuSO4,NaOH and glucose,reaction temperature on the morphology and particle size of Sub-micron Cu2O powder were investigated.The possible growth mechanism of the Cu2O crystal was discussed.Cuprous oxide was characterized by X-ray power diffraction(XRD),scan electron microscope(SEM)and ultraviolet and visible spectrophotometer(UV-Vis).The results indicate that the sample prepared by the liquid phase method was morphology and particle size controllable and dispersion well;Meanwhile,XRD and UV-Vis tests show that Cuprous oxide powder has good crystallinity,high purity and maximum absorption peaks in the range of visible light.
superfine crystal;cuprous oxide;the liquid phase method
O643
A
1001-2443(2016)03-0249-05
10.14182/J.cnki.1001-2443.2016.03.008
2015-05-20
云南省教育厅科学研究基金(51400614);云南省大学生创新创业项目(515006077).
陶磊(1990-),男,硕士研究生,主要从事生物质材料功能化研究.通讯作者:柴希娟,副教授,主要从事生物质化学转化与应用研究.
引用格式:陶磊,柴希娟.超细晶氧化亚铜的制备研究[J].安徽师范大学学报:自然科学版,2016,39(3):249-253.
