两种啮齿动物胶质瘤模型的构建和比较
2016-10-17陈家欢邵向前
戴 玥, 陈家欢, 邵向前, 陈 晶
(杭州师范大学生命与环境科学学院,浙江 杭州310036)
两种啮齿动物胶质瘤模型的构建和比较
戴玥, 陈家欢, 邵向前, 陈晶
(杭州师范大学生命与环境科学学院,浙江 杭州310036)
为了开发用于研究脑胶质瘤诊疗新方法的工具,构建和比较了两种侧脑室胶质瘤模型:C6-SD大鼠模型和U87MG-裸鼠模型.研究发现两种模型成瘤率都高达100%,其中C6-SD大鼠模型成瘤不稳定,表现为:肿瘤转移有个体差异性;在无治疗干预的情况下,短时期内大鼠体内肿瘤被清除.相对而言,U87MG-裸鼠模型成瘤特征稳定,表现为:瘤团大小均一,成瘤时间个体差异小,无肿瘤转移和肿瘤清除等情况.因此U87MG-裸鼠模型是适用于开发脑胶质瘤新疗法的工具.
胶质瘤模型;C6;SD大鼠;U87MG;裸鼠
胶质瘤是中枢神经系统最常见而又最难治的恶性肿瘤,约占颅内肿瘤的40%~50%,为了研究胶质瘤的生物学特征和开发抗胶质瘤的新疗法,需要创建稳定的体内胶质瘤模型作为研发工具[1].当前的脑肿瘤模型大体分为三类,根据获得肿瘤的来源可分为诱发性脑胶质瘤模型、移植脑胶质瘤模型和转基因型脑胶质瘤模型[1-2]:诱发性脑胶质瘤模型的遗传机制不清楚,成瘤率、成瘤周期和生物学特征不稳定,决定该模型的应用存在着一定的局限性;转基因型脑胶质瘤模型具有诱发率低、操作复杂、模型构建周期长、成本高等缺陷,也限制了其应用;相对前两种模型,移植脑胶质瘤模型具有较稳定的成瘤概率和生物学特性,且操作较简单,构建周期较短等优势,因此构建稳定的脑移植瘤模型将有助于脑瘤研究和抗脑瘤药物开发.
脑内移植瘤模型分两种:一种是脑瘤细胞移植到同源的动物脑内[3],形成肿瘤模型,理论上实验动物的免疫系统对同源性高的肿瘤细胞排斥作用较弱,所以该模型可能成瘤率较高、周期较短以及生物学特征较稳定,甚至可能有肿瘤细胞转移的可能,利用该模型可以研究免疫系统对肿瘤发生和发展的作用,而用该模型开发肿瘤药物便于研究药物对免疫功能正常动物的副作用;另一种脑移植瘤模型是人源脑瘤细胞移植到实验动物脑内,由于免疫系统对异源细胞的排斥作用,为了构建稳定和高效的模型,需要选用具免疫缺陷的实验动物作为脑瘤受体[4],比如裸鼠和SCID小鼠等[5],利用该模型能更准确模拟人源肿瘤在体内的发生和发展过程,以及反映抗肿瘤药物在体内抑制人源肿瘤的效果.本课题构建了两种啮齿类动物的脑内移植胶质瘤模型,一种是大鼠来源胶质瘤细胞——C6细胞移植到SD大鼠脑内的模型,另一种是人源胶质瘤细胞——U87MG细胞系移植到裸鼠脑内的模型,研究和对比了两种模型的成瘤率、成瘤周期和模型的稳定性等特征,确定了它们的应用价值.
1 材料和方法
1.1实验动物
雄性SD大鼠,年龄6-8周,体重约为200 g,购自上海斯莱克实验动物有限公司;雄性裸鼠,年龄6-8周,购自浙江省医学科学院.两种实验动物均由杭州师范大学动物中心饲养.
1.2细胞系
大鼠来源的胶质瘤C6细胞和人源胶质瘤U87MG细胞均购于中科院上海细胞库,由浙江理工大学生科院李恭楚课题组用含有Luciferase基因的慢病毒感染细胞,构建了转基因细胞系——C6-Luc和U87MG-Luc,再由本实验室传代和冷冻保存,用于脑瘤模型的构建.
C6-Luc和U87MG-Luc细胞的培养液均为DMEM细胞培养液(购自Gibco公司),添加体积比为10%的胎牛血清(购自四季青公司)、2 mmol/ml谷氨酸(购自Invitrogen公司)、100U/ml青霉素和链霉素(购自吉诺公司),细胞在37 ℃、5%CO2及饱和湿度的恒温箱中培养,细胞传代时用0.25%胰酶(购自Gibco公司)消化,细胞冻存液为体积比为9:1的胎牛血清和DMSO(购自Sigma公司).
1.3脑内移植肿瘤细胞
1.3.1C6细胞植入大鼠侧脑室
腹腔注射用无菌的磷酸缓冲液(无Mg2+、Ca2+)(购自吉诺公司)溶解的水合氯醛(质量体积比为10%)麻醉大鼠,注射量为3 ml水合氯醛/kg大鼠,麻醉后将大鼠头部固定于固定架,手术暴露颅骨标志,按坐标(前囟后1 mm,矢状缝右1.5 mm,硬脑膜下4.5 mm)用微型钻钻孔后注射细胞,按每只鼠1×106细胞悬液(C6大鼠脑胶质瘤细胞系)15 μl于30 min内注入靶区, 注射完成后留针5 min使细胞充分沉积后再缓慢拔针,防止细胞悬液随针返流,针取出后将手术部位擦拭干净并缝合头皮,之后将大鼠放至小电热毯上使其身体回暖,同时观察其心跳以确认存活,待大鼠麻醉消除后将其放回鼠笼,常规饲养.
1.3.2U87MG细胞植入裸鼠侧脑室
腹腔注射用无菌的磷酸缓冲液(无Mg2+、Ca2+)溶解的戊巴比妥钠(质量体积比为1%)(购自Sigma公司),0.2μm滤膜过滤除菌后,麻醉裸鼠,注射量为0.25-0.30μl,麻醉后固定头部,切开头皮,暴露颅骨,在坐标(前囟0 mm,矢状缝右0.7 mm,硬脑膜下2.5 mm)用微型钻钻孔后注射细胞,按每只鼠1×106细胞悬液(U87MG人脑胶质瘤细胞系)8-12μl于60 min内注入靶区, 注射完成后留针10 min使细胞充分沉积后再缓慢拔针,防止细胞悬液随针返流,针取出后将手术部位擦拭干净并缝合头皮,之后将裸鼠放至电热毯上苏醒,待裸鼠麻醉消除后将其放回鼠笼,常规饲养.脑部手术所用仪器均购自瑞沃德生命科技有限公司.
1.4肿瘤活体成像
用无菌的磷酸缓冲液(无Mg2+、Ca2+)配制D-荧光素钾盐(购自Thermo Fisher Scientific公司)工作液(15 mg/mL),0.2μm滤膜过滤除菌,按10 μl/g体重的浓度向每只鼠注射相应量的15 mg/mL荧光素溶液,腹腔注射10-15 min后用活体成像仪(购自Caliper Life Sciences公司)扫描动物全身,用相应软件(购自Caliper Life Sciences公司)进行成像分析,肿瘤大小以成像仪扫描每秒得到总光子数表示,单位是光子/s,脑内移植肿瘤细胞后,每隔5-7 d对动物进行成像分析一次.
1.5苏木精-伊红染色
麻醉动物后断颈处死,从颅骨中剥离脑,将脑浸入用磷酸缓冲液配置浓度为4%的多聚甲醛溶液中进行固定,12-24 h后,从多聚甲醛溶液中取出脑,将其浸入添加0.5% proclin(购自Sigma公司)的磷酸缓冲液中,在4 ℃保藏.染色前,从PB溶液中取出脑,用吸水纸吸去表面水分,之后用低熔点琼脂糖(购自TaKaRa Biotechnology公司)包埋左半脑,用振动切片机(购自Leica公司)切片,切片厚度为50μm,随后进行木精-伊红染色,染色步骤是:将切片置于苏木精溶液(购自南京建成科技有限公司)中约1 min,后水漂洗1-2次,再置于伊红溶液(购自南京建成科技有限公司)约10-15 min,用水漂洗干净切片上游离的染色剂后贴于载玻片上.待切片自然风干后用适量中性树脂(购自Sigma公司)将切片用盖玻片反压封片,树脂凝固后用倒置显微镜(购自ZEISS公司)观察拍照.
2 结 果
2.1C6-SD大鼠胶质瘤模型不稳定
C6细胞是大鼠胶质瘤细胞,源于远交系Wistar大鼠[6-7],C6-Wistar大鼠模型动物脑瘤模型常用于开发脑瘤新疗法,例如化学治疗[8]、抗血管治疗[9]、放射治疗[10]和基因治疗[11]等,但是现在实验用的Wistar大鼠是近交系,与C6细胞的同源性低,导致C6细胞在Wistar大鼠体内有一定免疫源性,植入细胞数量在104~107内,Wistar大鼠脑内肿瘤生长速率不会随植入细胞数量变化,并且大鼠存活率100%,因此该模型用于研究脑瘤的免疫治疗具有局限性[12].SD大鼠是用Wistar大鼠与其它杂种鼠交配培育而成的白化鼠,与C6细胞有一定程度的同源关系,C6-SD大鼠模型在移植瘤研究中的应用较少,本研究中我们尝试构建该模型,观察其稳定性,探讨其应用价值.
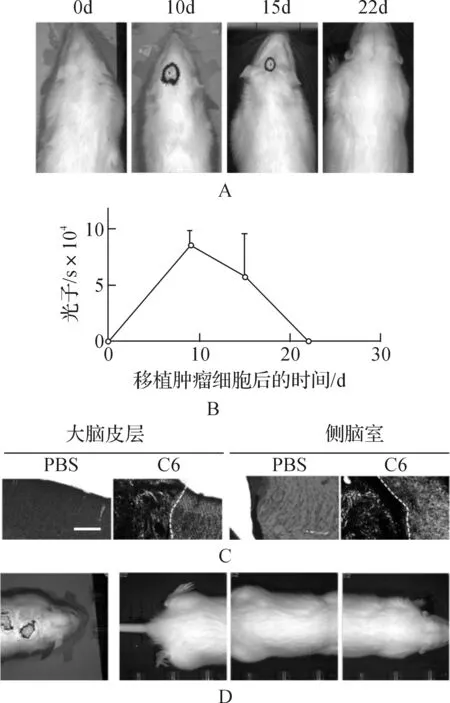
A. 活体成像检测移植C6细胞后大鼠荷瘤情况; B. 统计不同时间大鼠荷瘤体积变化; C. 苏木精-伊红染色检测脑内肿瘤发生部位,白色比例尺代表200 μm; D. 肿瘤转移大鼠脑瘤在7d内被清除.图1 C6-SD大鼠脑胶质瘤模型特征Fig. 1 Characteristics of C6-SD rat brain glioma model
移植106个C6细胞在SD大鼠脑室内,活体成像仪检测发现其成瘤特征如下:植入细胞10 d后原位形成肿瘤,脑瘤形成率100%,15 d后肿瘤体积开始缩小,第22 d所有移植了C6细胞并产生肿瘤的SD大鼠体内瘤团均消失(图1A和1B),说明虽然C6细胞在SD大鼠脑内能成瘤,但是C6激活SD大鼠体内的免疫反应足够清除已形成的瘤团.将成瘤大鼠解剖取脑,脑切片经苏木精-伊红染色,结果显示肿瘤细胞核较正常细胞大,瘤团填充了侧脑室,并迁移到脑室背侧的大脑皮层,形成肿瘤灶,正常的大脑皮层中细胞排列有序,而有瘤团的皮层中细胞排列紊乱(图1C),结果显示脑瘤破坏了大脑结构.脑室移植肿瘤细胞的SD大鼠中,有1例移植后第15 d,肿瘤发生转移,在第22 d,肿瘤消失(图1D),暗示C6细胞在SD大鼠侧脑室中可能随着脑脊液循环迁移,从而形成转移病灶,但是SD大鼠的免疫排异能够将转移的肿瘤病灶清除.C6-SD大鼠模型的存活率是100%,与C6-Wistar大鼠模型一致[12].综上所述,C6-SD大鼠模型移植肿瘤形成的时间和大小较稳定,肿瘤转移情况不稳定,形成的移植瘤在SD大鼠体内被其免疫机能清除,瘤团维持时间短,不是开发脑瘤新疗法的合适模型.
2.2U87MG-裸鼠模型是稳定的脑胶质瘤模型
U87MG是人源胶质瘤细胞,是脑瘤研究的重要模式细胞,为了防止动物对人源细胞的免疫排异而引起成瘤不稳定,用U87MG构建体内肿瘤模型需要免疫缺陷动物.裸鼠是先天性胸腺缺陷小鼠,其体内T淋巴细胞发育障碍,导致免疫机能严重缺损,是人源肿瘤细胞合适的移植受体.本研究将106个U87MG细胞植入裸鼠侧脑室,观察U87MG在裸鼠脑内能否形成稳定的胶质瘤模型,探讨该模型是否适用于脑瘤生物学研究和新疗法的开发.
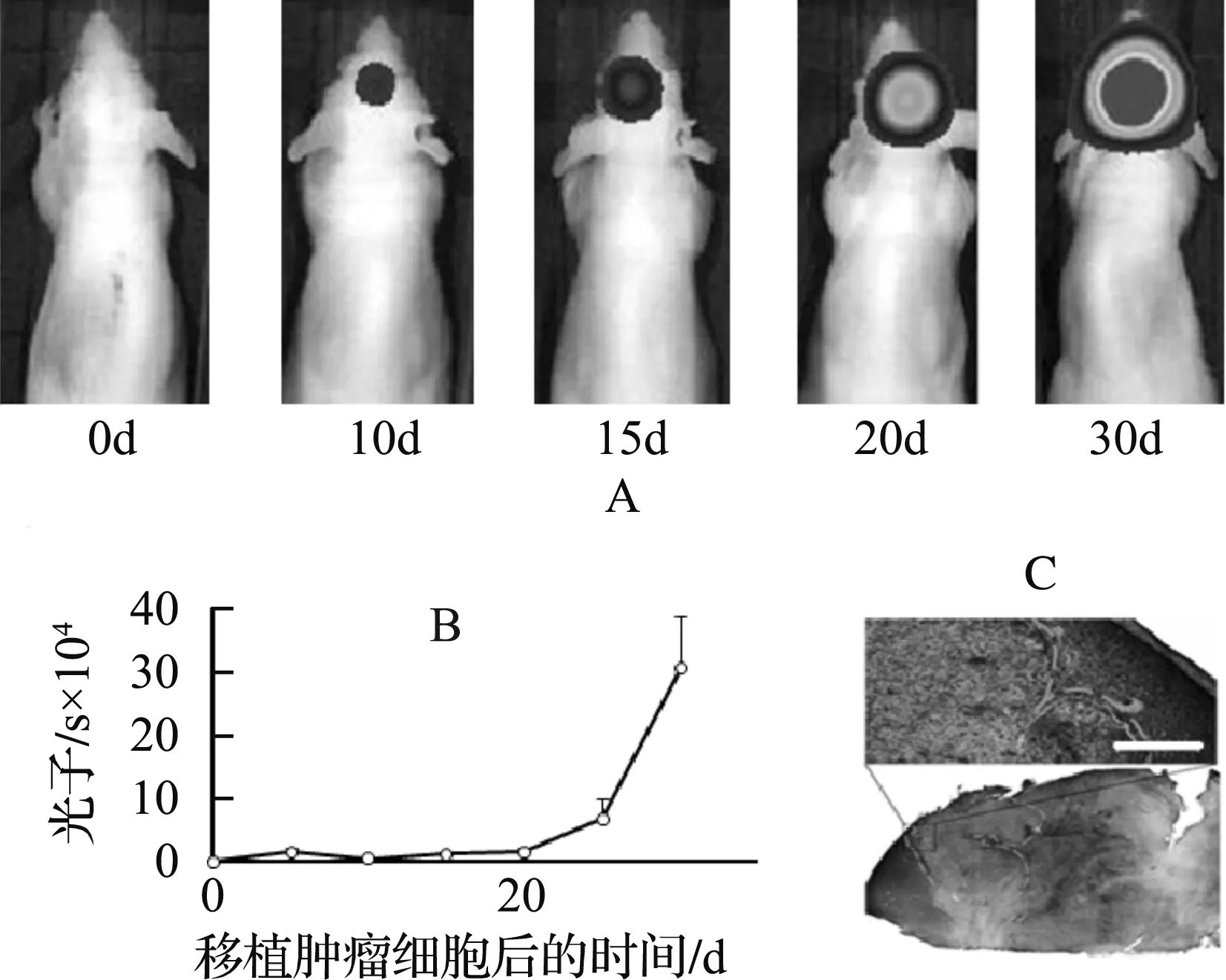
A. 活体成像检测移植U87MG细胞后裸鼠荷瘤情况; B. 不同时间裸鼠荷瘤体积变化; C. 苏木精-伊红染色检测脑内肿瘤发生部位,白色比例尺代表200 μm,黑色比例尺代表5 mm.图2 U87MG-裸鼠脑胶质瘤模型特征Fig. 2 Characteristics of U87MG-nude mouse brain glioma model
裸鼠侧脑室内植入U87MG细胞后,经活体成像仪追踪发现以下成瘤特征:U87MG植入裸鼠侧脑室第10 d内,脑内开始出现瘤团,成瘤率达到100%,之后瘤团体积逐步增长,第30 d起荷瘤裸鼠开始死亡,并于7 d内全部死亡(图2A和2B).解剖荷瘤裸鼠,其脑切片经苏木精-伊红染色,结果表明裸鼠的侧脑室被肿瘤细胞填满,瘤团扩张到了大脑皮层(图2C),提示裸鼠死亡的原因可能是瘤团过大引起的脑内压升高.研究结果表明:裸鼠从形成肿瘤到死亡的过程中,肿瘤形成和增长速率均一,个体差异较小,除了肿瘤植入位置,裸鼠身体其它部位没有出现转移病灶,U87MG-裸鼠模型是高效和稳定的脑瘤模型,是理想的研究脑瘤生物学特征及开发脑瘤新疗法的工具.
3 讨 论
原位移植胶质瘤模型是将胶质瘤细胞植入实验动物脑内形成脑瘤的实验样本,是研究脑瘤生物学特征和开发肿瘤新疗法及诊断方法的重要工具,理想的脑胶质瘤模型构建简单,具有稳定的成瘤特征.以往研究中将胶质瘤细胞注入动物大脑前额皮层,该模型形成瘤团结构规则,利于解剖后观察和比较[13-14],但是前额皮层是实体组织,移植肿瘤细胞的操作过程中,为了防止因为压力过大破坏皮层,压力过小针头堵塞无法注入细胞,以及细胞注入皮层后空间太小从皮层溢出等情况,操作过程比较复杂且耗时长,并且操作误差大,导致小鼠成瘤个体间差异大.本课题为了提高脑瘤模型构建的效率和减少操作误差,将胶质细胞定位植入非实体的侧脑室中,但是在侧脑室中肿瘤形成的瘤团形状不规则,且可能随脑脊液循环发生转移.活体成像技术的推广使用,使体内成瘤检测非常便利,即使瘤团形状不规则,也能够在不伤害动物生命的情况下,判断和比较不同个体的瘤团大小和肿瘤转移情况,帮助精确检测脑室成瘤的特征.
本课题构建和比较了两种侧脑室移植脑瘤模型,一种是存在一定同源关系的胶质瘤细胞C6移植到SD大鼠脑部,另一种是人源胶质瘤细胞U87MG移植到免疫缺陷的裸鼠脑部.从构建的操作比较,SD大鼠头部较大,脑定位手术较精准,其耐受的脑内压范围较大,决定了脑注射速度和流量的可变范围也较大,因此C6-SD大鼠模型的操作较U87MG-裸鼠模型简单,实验效率较高.从两种模型的特征比较,它们的应用范畴存在差异.
C6-SD大鼠模型中SD大鼠是免疫能力正常的动物,该模型利用的细胞和动物具有低程度的同源性,然而与Wistar大鼠类似[12],SD大鼠对C6细胞存在免疫排斥,虽然植入肿瘤细胞后成瘤时间稳定,成瘤率为100%,但是SD大鼠荷瘤时间短,消除肿瘤的概率和存活率高达100%,大鼠脑内形成的瘤团在没有药物干预的情况下被清除,如果该模型用于药物开发,很难区分清楚瘤团缩小和消除的原因是SD大鼠的免疫机能还是药效;另外荷瘤SD大鼠的肿瘤转移情况有明显的个体差异,决定了该模型不可用于抗肿瘤转移药物的开发.由于形成和消除肿瘤的规律较稳定,因此该模型适用于肿瘤诊断方法的开发,以及可能适用于体内肿瘤细胞具有免疫源性机制的研究.
U87MG-裸鼠模型中U87MG是人源胶质瘤细胞,鉴于肿瘤诊疗方法的受益对象是人类患者,U87MG比大鼠来源的C6细胞更能精准的反映新诊疗方法的效果,为了防止实验动物对人源细胞的免疫排异,我们选择免疫缺陷的裸鼠作为荷瘤动物.实验结果证明U87MG-裸鼠模型成瘤时间稳定,瘤团大小均一,瘤团增长速度和裸鼠死亡时间个体差异小,是理想的肿瘤诊疗新方法开发的模型.该模型没有肿瘤转移发生,因此不适用于研究肿瘤转移特征和开发抗转移药物.由于裸鼠胸腺缺失导致T淋巴细胞发育障碍,因此该模型可用于研究促进T淋巴细胞成熟的药物在肿瘤免疫治疗的潜能.
总之,与C6-SD大鼠模型比较,U87MG-裸鼠模型成瘤率高,瘤团体积、荷瘤时间和肿瘤转移等特征的个体差异小,是比较稳定的脑胶质瘤模型.
[1] FOMCHENKO E I, HOLLAND E C. Mouse models of brain tumors and their applications in preclinical trials[J]. Clinical Cancer Research,2006,12(18):5288-5297.
[2] 朱惠芳,张远旭,赵旭东.脑胶质瘤动物模型的研究及应用进展[J].动物学研究,2012,33(3):337-342.
[3] BARTH R F, KAUR B. Rat brain tumor models in experimental neuro-oncology: the C6, 9L, T9, RG2, F98, BT4C, RT-2 and CNS-1 gliomas[J]. Journal of Neuro-Oncology,2009,94(3):299-312.
[4] KRUSHELNYCKY B W, FARR-JONES M A, MIELKE B, et al. Development of a large-animal human brain tumor xenograft model in immunosuppressed cats[J]. Cancer Research,1991,51(9):2430-2437.
[5] RICHMOND A, SU Yingjun. Mouse xenograft models vs GEM models for human cancer therapeutics[J]. Disease Models & Mechanisms,2008,1(2/3):78-82.
[6] BENDA P, LIGHTBODY J, SATO G, et al. Differentiated rat glial cell strain in tissue culture[J]. Science,1968,161(3839):370-371.
[7] SCHMIDEK H H, NIELSEN S L, SCHILLER A L, et al. Morphological studies of rat brain tumors induced by N-nitrosomethylurea[J]. Journal of Neurosurgery,1971,34(3):335-340.
[8] DOBLAS S, SAUNDERS D, KSHIRSAGAR P, et al. Phenyl-tert-butylnitrone induces tumor regression and decreases angiogenesis in a C6 rat glioma model[J]. Free Radical Biology & Medicine,2008,44(1):63-72.
[9] SOLLY F, FISH R, SIMARD B, et al. Tissue-type plasminogen activator has antiangiogenic properties without effect on tumor growth in a rat C6 glioma model[J]. Cancer Gene Therapy,2008,15(10):685-692.
[10] SHEEHAN J, IONESCU A, POURATIAN N, et al. Use of trans sodium crocetinate for sensitizing glioblastoma multiforme to radiation: laboratory investigation[J]. Journal of Neurosurgery,2008,108(5):972-978.
[11] TANRIOVER N, ULU M O, SANUS G Z, et al. The effects of systemic and intratumoral interleukin-12 treatment in C6 rat glioma model[J]. Neurological Research,2008,30(5):511-517.
[12] PARSA A T, CHAKRABARTI I, HURLEY P T, et al. Limitations of the C6/wistar rat intracerebral glioma model: implications for evaluating immunotherapy[J]. Neurosurgery,2000,47(4):993-999.
[13] CHICOINE M R, SILBERGELD D L. Invading C6 glioma cells maintaining tumorigenicity[J]. Journal of Neurosurgery,1995,83(4):665-671.
[14] KURODA J I, KURATSU J I, YASUNAGA M, et al. Antitumor effect of NK012, a 7-ethyl-10-hydroxycamptothecin-incorporating polymeric micelle, on U87MG orthotopic glioblastoma in mice compared with irinotecan hydrochloride in combination with bevacizumab[J]. Clinical Cancer Research,2010,16(2):521-529.
Construction and Comparison of Two Rodent Glial Tumor Models
DAI Yue, CHEN Jiahuan, SHAO Xiangqian, CHEN Jing
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
To develop the tool for studying new diagnosis and therapy of brain glial tumor, this paper constructed and compared two models of lateral ventricular glial tumor, that was C6-SD rat model and U87MG-nude mouse model. The results demonstrated that the tumor formation rates of both models were 100%. Nevertheless, C6-SD rat model was an unstable glial tumor model in two aspects. Firstly, there was individual difference in tumor metastasis. Secondly, all tumors were erased without any therapy. Comparing to C6-SD rat model, U87MG-nude mouse model increased stability for little individual difference in the volume of tumor and the time of tumor formation, no tumor metastasis or tumor disappearance without therapy. Therefore, U87MG-nude mouse model was a proper tool for developing new therapy of glial tumors in brains.
glial tumor model; C6; SD rat; U87MG; nude mouse
2015-11-10
浙江省自然科学基金项目(LQ14C090003);浙江省大学生科技创新活动暨新苗人才计划项目(2014R421024).
陈晶(1982—),女,讲师,博士,主要从事肿瘤生物学研究.E-mail:chenjing@hznu.cn
10.3969/j.issn.1674-232X.2016.05.006
R73-35
A
1674-232X(2016)05-0479-05
