重金属对蚕豆种子萌发及体细胞分裂的影响
2016-10-17赵锦慧王智巧霍少杰
赵锦慧,王智巧,霍少杰
(周口师范学院 生命科学与农学学院,河南 周口 466001)
重金属对蚕豆种子萌发及体细胞分裂的影响
赵锦慧,王智巧,霍少杰
(周口师范学院 生命科学与农学学院,河南 周口 466001)
采用醋酸铅胁迫处理蚕豆种子及其侧根,研究其不同浓度对蚕豆种子侧根萌发情况、侧根根系活力、侧根根尖细胞微核率、侧根形态和颜色及蚕豆幼苗叶片中叶绿素含量等的影响.结果显示,同一处理浓度下,随着醋酸铅胁迫处理时间的延长,蚕豆侧根根系活力减弱,根尖细胞微核率上升,侧根根长增加幅度和侧根发生率升高幅度减小,幼苗叶片内叶绿素含量下降,而侧根弯曲度未发生变化;同一处理时间下,醋酸铅处理浓度与侧根根系活力、幼苗叶片内叶绿素含量成反比,与侧根根尖细胞微核率成正比.另外,随着醋酸铅胁迫处理时间的延长和处理浓度的增大,蚕豆幼苗侧根的颜色发生明显变化甚至出现烂根现象.与对照相比,不同浓度的醋酸铅胁迫对蚕豆种子侧根萌发、侧根根尖细胞微核率、侧根根系活力、侧根形态和颜色及蚕豆幼苗叶片内叶绿素含量均有不同程度的影响.
蚕豆;铅胁迫;微核率;形态变化;生理指标
近年来,各种来源的重金属不断引起环境污染,重金属污染是不可逆的,它在作物的可食部位过量积累,可以经食物链传递,并最终对人类的健康带来危害,因此重金属污染已引起人类广泛关注.植物对重金属的吸收、积累及重金属对植物的生长发育、生理生化和形态结构等的影响已有较多报道[1-8].蚕豆是很好的细胞遗传学研究材料,其体细胞染色体是六对较大的染色体,并且其根尖含有较多的分裂相细胞,有利于显微观察.蚕豆根尖微核实验是国际上常用的遗传毒理学检测技术,在国内外环境毒性检测中被广泛运用[9-12],因此可利用蚕豆根尖分裂细胞的微核率测知污染物的环境毒理效应.随着铅污染日趋严重,铅的毒理效应研究也不断深入[l3].本实验以蚕豆为材料,在蚕豆萌发和生长过程中采用不同浓度的醋酸铅胁迫,旨在探明不同浓度的醋酸铅溶液对蚕豆根系生长、叶片生理生化指标及根尖体细胞有丝分裂的影响,为开展重金属污染蚕豆的生物监测提供依据.
1 材料与方法
1.1实验材料
周口市售普通蚕豆.
1.2实验方法
1.2.1实验试剂制备
铅胁迫液的制备:精密称取10 mg醋酸铅(优级纯)放入烧杯中,加20 mL水,全部溶解后移入1 000 mL容量瓶中,加水定容至刻度,配成铅溶液浓度为10 mg/L.同法配制浓度分别为25,50,100,200,400,800 mg/L的醋酸铅溶液.
解离液制备:量取质量分数为36%的盐酸43 mL,倒入烧杯中,玻璃棒引流至500 mL容量瓶中,加入蒸馏水定容,此溶液即为1 mol/L的盐酸.
染色液制备:制备改良的苯酚品红染色液[14].
1.2.2蚕豆种子萌发及幼苗生长
选择饱满、大小均匀、无损伤的蚕豆种子,自来水洗净后用70%的乙醇消毒30 s,蒸馏水冲洗数次后,再用0.1%的HgCl2消毒10 min,蒸馏水冲洗3~4次后,在装有蒸馏水的烧杯中浸种1 d,放入托盘中进行暗培养,培养温度(25±1) ℃,培养期间每天换水1次[15].待多数胚根长至1~2 cm时,切去主根,将蚕豆转移至大培养皿中,按以下2种方式进行培养.第1种培养方式为:分别用浓度为0,10,25,50,100,200,400,800 mg/L的醋酸铅溶液胁迫培养,每种浓度培养1皿,每皿25颗,每天换培养液.第2种培养方式为:用蒸馏水培养,共8皿,每皿25颗,每天换蒸馏水一次,至侧根长出.2种培养方式用于测定不同指标.
1.2.3实验处理设计
第1种培养方式下共设置8个组,1个组为对照组(蒸馏水培养),另外7个组为醋酸铅胁迫组,侧根发生率、侧根弯曲度、侧根根长、叶绿素含量等指标的测定按照此处理设计进行.
第2种培养方式下也设置8个组,待侧根长至1~2 cm时,分别用浓度为0,10,25,50,100,200,400,800 mg/L的醋酸铅溶液染毒处理24 h,蒸馏水冲洗2~3次,再用蒸馏水恢复培养24 h.侧根根系活力、微核率等指标的测定按照此处理设计进行.
取材时间设定:测定微核率时,需要在蚕豆根尖细胞有丝分裂最旺盛时取材.蚕豆根尖生长点细胞在19 ℃时,一个细胞周期约为19.3 h,分裂期只持续不到0.5 h,而且分裂细胞并不同步,因此任何时刻只有一小部分细胞处于分裂期.一天中,细胞分裂有一定规律,实验表明,蚕豆一般上午8~10时、下午2~5时处于分裂高峰期.只有在分裂高峰期取材固定,才能保证观察到较多处于分裂期的细胞[16].因此本实验取材时间设定为上午9时左右,以期可以观察到更多分裂期的细胞,并减小根系活力测定误差.
1.2.4指标测定
侧根发生率的测定:在第1种培养方式下,每天观察1次侧根情况,统计各组1、2、3、4、5 d后的侧根发生率.侧根发生率%=(侧根长出的蚕豆种子数/总蚕豆种子数)× 100.
侧根根长的测定:待侧根长出后,用毫米刻度尺测量侧根生长量.弯曲的侧根先用细线测量,再将细线拉直测定其长度.
侧根弯曲度的测定:待侧根长出后,量角器量取侧根弯曲度.
微核率的测定:微核率‰=(观察到的微核数目/观察到的细胞数目)×1 000.
根系活力测定[17]:经染毒24 h,恢复培养24 h后,采用TTC法进行根系活力的测定.
叶绿素含量的测定:采用苏正淑[18]等的方法进行测定.
2 结果与分析
2.1不同浓度醋酸铅胁迫对蚕豆种子侧根发生率的影响
不同浓度醋酸铅胁迫对蚕豆种子侧根发生率的影响结果见表1.由表1可知,随着处理时间的延长,对照组与醋酸铅胁迫组侧根发生率均呈现增加趋势,在同样处理时间下,随着醋酸铅浓度的升高,侧根发生率大致呈现先增加后减少的趋势. 这说明处理时间越长,侧根发出的越多,而且低浓度的醋酸铅有利于侧根的发生;高浓度(≥400 mg/L)醋酸铅胁迫处理3 d时,蚕豆种子侧根发生率明显降低,说明高浓度可以抑制侧根的发生.
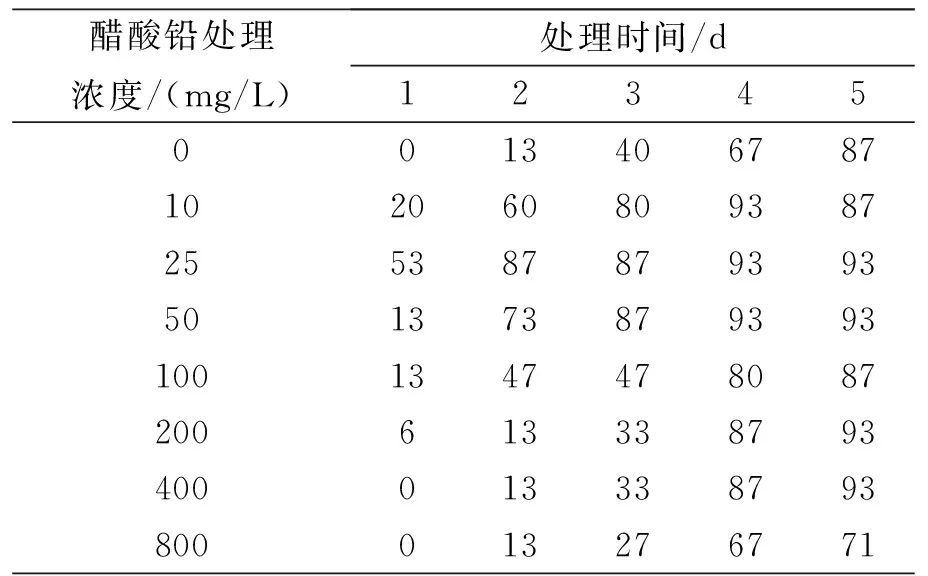
表1 不同浓度醋酸铅胁迫下蚕豆种子侧根发生率(%)
2.2不同浓度醋酸铅胁迫对蚕豆种子侧根根长的影响
不同浓度醋酸铅胁迫对蚕豆种子侧根根长的影响结果见表2.由表2可知,随着处理时间的延长,对照组与醋酸铅胁迫组侧根根长均呈现增加趋势,但对照组侧根根长增加幅度最大,与醋酸铅胁迫组差异明显,醋酸铅胁迫组侧根根长增加幅度大致与醋酸铅浓度成反比.从表2中还可以看出,低浓度醋酸铅处理1 d时侧根生长速度反而比对照快,处理2 d和3 d时侧根生长速度明显比对照慢,处理4 d与5 d时测得的根长未发生变化. 这说明低浓度醋酸铅短时间作用反而有利于蚕豆侧根的生长,但长时间作用会降低蚕豆侧根生长速度,甚至阻止蚕豆侧根的生长.
2.3不同浓度醋酸铅胁迫对蚕豆种子侧根弯曲度的影响
不同浓度的醋酸铅胁迫对蚕豆种子侧根弯曲度的影响结果见表3.表3显示,对照组与醋酸铅胁迫组侧根弯曲度差别明显,但自侧根长出后,随着醋酸铅处理时间的延长,对照组与醋酸铅处理组侧根弯曲度未发生变化. 这说明醋酸铅处理浓度对蚕豆侧根弯曲度有影响,但醋酸铅处理时间对蚕豆侧根弯曲度无影响.
2.4不同浓度醋酸铅胁迫对蚕豆种子侧根根尖细胞微核率的影响

表2 不同浓度醋酸铅胁迫下蚕豆种子侧根根长(cm)
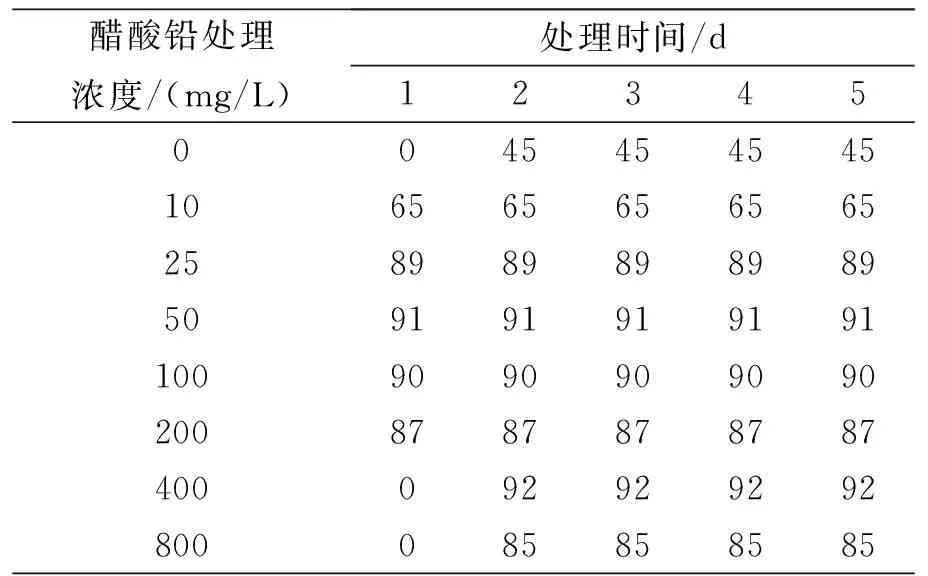
表3 不同浓度醋酸铅胁迫下蚕豆种子侧根弯曲度(°)

表4 不同浓度醋酸铅胁迫下蚕豆种子侧根根尖细胞微核率(‰)
不同浓度醋酸铅胁迫对蚕豆种子侧根根尖细胞微核率的影响结果见表4.由表4可知,随着处理时间的延长,对照组侧根根尖细胞微核率均为0,醋酸铅胁迫组侧根根尖细胞微核率呈上升趋势,高浓度(≥400 mg/L)醋酸铅胁迫处理5 d时,蚕豆种子侧根根尖细胞微核率达到100‰.表4还显示,同样处理时间下,醋酸铅浓度越大,根尖细胞微核率越高.上述分析结果说明蚕豆侧根根尖细胞微核率受醋酸铅处理时间与处理浓度的双重影响.
2.5不同浓度醋酸铅胁迫对蚕豆种子侧根根系活力的影响
不同浓度醋酸铅胁迫对蚕豆种子侧根根系活力的影响结果见表5.由表5可知,醋酸铅胁迫组根系活力明显低于对照组根系活力.随处理时间的延长,对照组与醋酸铅胁迫组根系活力均减弱,但对照组根系活力减弱不明显,醋酸铅胁迫组根系活力减弱明显,尤其是高浓度(≥400 mg/L)醋酸铅胁迫处理5 d时,蚕豆种子侧根根系活力降为0.同样处理时间下,蚕豆种子侧根根系活力与醋酸铅浓度大致呈反比.这说明不同浓度的醋酸铅溶液对蚕豆种子侧根根系活力的影响程度不同,根系活力大小是由醋酸铅处理时间与处理浓度共同决定的.

表5 不同浓度醋酸铅胁迫下蚕豆种子侧根根系活力(mg·g -1·h -1)
2.6不同浓度醋酸铅胁迫对蚕豆幼苗叶绿素含量的影响
不同浓度醋酸铅胁迫对蚕豆幼苗叶绿素含量的影响结果见表6.由表6可知,随处理时间的延长,对照组叶绿素含量变化不明显,醋酸铅胁迫组叶绿素含量呈下降趋势;同样处理时间下,醋酸铅胁迫组叶绿素含量随醋酸铅浓度增大而减少,这说明醋酸铅处理时间与处理浓度对蚕豆幼苗叶片中叶绿素含量均有影响.

表6 不同浓度醋酸铅胁迫下蚕豆幼苗叶绿素含量(mg·g -1 )
3 结论与讨论
3.1结论
本研究结果表明,与对照相比,不同浓度的醋酸铅胁迫对蚕豆种子侧根发生率、侧根根长、侧根根尖细胞微核率、侧根根系活力及蚕豆幼苗叶片内叶绿素含量均有不同程度的影响.随着醋酸铅胁迫天数的延长,蚕豆种子的侧根根系活力减弱,幼苗叶片内叶绿素含量下降,根尖细胞微核率上升,侧根根长增加幅度及侧根发生率升高幅度减小,而侧根弯曲度未发生变化;醋酸铅处理浓度与侧根根系活力、幼苗叶片内叶绿素含量成反比,与侧根根尖细胞微核率成正比.总之,除侧根弯曲度只受醋酸铅处理浓度影响外,其余各项指标均受醋酸铅处理时间与处理浓度的双重影响.
3.2讨论
植物对铅的吸收是由根系完成的,根系受到毒害后会出现生长速度减慢、胚根数量减少、根系活力降低等现象. 根部发育受到影响后,地上部幼苗的生长也会受到抑制,幼苗会表现出植株矮小、叶片色泽变化、叶片内各种生理活性物质发生变化等症状[19-21].本试验中,在醋酸铅胁迫下,蚕豆根系及叶片性状均发生类似的变化.
于拴仓[22]等用铅处理黄瓜、番茄、大白菜幼苗后发现,铅对3种蔬菜幼苗胚根的伸长均表现明显的抑制作用,并且随着处理浓度的增加,胚根伸长抑制百分率明显增加,侧根发生受到严重抑制,甚至胚根畸形、褐化坏死.本试验研究结果与其相似,蚕豆侧根受到毒害后,随着醋酸铅处理浓度的增加和处理时间的延长,侧根颜色变化过程为黄色—灰色―褐色―黑色,从变为褐色开始出现烂根现象,黑色出现烧苗现象,而变为灰色和黄色的根在恢复培养24 h后颜色有所缓解,表现出生长现象.蚕豆侧根弯曲度不受处理时间的影响,可能与侧根有丝分裂指数降低有关,侧根生长速度随醋酸铅浓度增加明显减慢,造成根长变化不明显,因此短时间内,侧根弯曲度未发生变化.
微核(micronucleus,简称MCN)是一种在细胞核以外,游离于细胞浆中的小块染色质,是真核生物细胞中的一种异常结构,是染色体畸变的一种表现形式[23].微核可作为反映外源因素对细胞染色体损伤程度的指标,因此,微核率在一定程度上可以反映植物受毒害的深浅.若植物细胞在分裂期间受到外源因素的污染,便会导致染色体断裂或DNA的损伤,染色体发生断裂时,若重接过程中,具有着丝粒的2条断裂染色体重新结合在一起,发生了错误重接,则在细胞分裂时,就会观察到染色体桥;如若未能重接,在初期细胞中,则看到染色体断片,具有双着丝粒的染色体桥和染色体断片经细胞分裂,会造成遗传物质的丢失,从而使生物体发生遗传性的畸变.或者在外源物刺激作用下,不引起染色体或DNA的损伤,而是影响有丝分裂周期,使DNA滞后或丢失,在细胞质中形成微核[12].蚕豆侧根是研究微核的理想材料.蚕豆侧根分裂相细胞所占比例高,一般在1个视野里可见数个不同期的分裂相细胞,有的压片部位在1个视野里可看到有丝分裂各期细胞[24].该试验中,可以明显看到随醋酸铅处理浓度、处理时间的增加,微核率呈升高趋势,说明蚕豆侧根根尖细胞受到的毒害随着醋酸铅处理浓度的升高和处理时间的延长而加深.本试验中观察的微核现象见图1.

图1 50 mg/L的醋酸铅威迫处理下蚕豆侧根根尖细胞微核现象
[1] YANG Kebing.Hg effect on monocotyledon and distribution at different pants[J].Environ Poll and Prot,1984(6):14.
[2] SHU Tao,TAO Liang.Synergistic effect of copper and lead uptake by fish[J].Ecotox Environ Safety,1999(44):190-195.
[3] LIU Dengyi,XIE Jianchun.Effects of copper mine tailings on gowth and physiological function of wheat[J].Chin J App Ecol,2001,12(1):52-56.
[4] LIU Dengyi,YANG ShiYong.Physiology and development of two Roegneria kamoii populations stressed by copper[J].Chin J App Ecol,2001,12(3):455-457.
[5] MENG Zhaofu,XUE Gengze,ZHANG Zengqiang. Assessment of combined pollution of heavy metals in soil[J].Argo-Environ Protec,1999,18(2):8791.
[6] 杨文玲,巩涛,刘莹莹,等.铅铬胁迫对小麦幼苗抗氧化酶活性和丙二醛含量的影响[J].中国农学通报,2015,31(6):45-50.
[7] 李佩华.铅镉胁迫对马铃薯叶绿素含量及细胞超微结构的影响[J].湖北农业科学,2015,54(16):3974-3977.
[8] 张雅莉,王林生.Pb胁迫对小麦种子萌发及幼苗生长的影响[J].河北农业科学,2015,19(4):6-9.
[9] 仪慧兰,秦海峰.环磷酰胺诱发蚕豆体细胞遗传损伤的研究[J].植物研究,2004,24(4):439-442.
[10] GRANT WF.Higher plant assays for the detection of chromosomal aberrations and gene mutationsa brief historical background on their use for screening and monitoring environmental chemicals[J].Mutation Research,1999(426):107-112.
[11] MATH.The international program on plant bioassays and the report of the follow up study after the handson workshop on China[J].Mutation Research,1999(426):103-106.
[12] YIHL,MENGZQ.Genotoxicity of hydrated sulfur dioxide in root tips of Vicia faba and Allium sativun[J].Mutation Research,2013(537):109-114.
[13] 熊亚.环境铅接触对健康的影响[J].微量元素与健康研究,2003,20(1):48-50.
[14] 何兰花,卢家现.用改良苯酚品红染液替代醋酸洋红染色液的研究[J].生物学杂志,2000(2):28-29.
[15] 杨铭,张利红.铅胁迫对蚕豆根尖有丝分裂染色体畸变的研究[J].宁夏农林科技,2015,54(9):58-59,71.
[16] 时丽冉.植物细胞有丝分裂实验最佳条件的探索[J].实验室科学,2004(4):51-52.
[17] 刘萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007:101-104.
[18] 苏正淑,张宪政.几种测定叶绿素含量的方法比较[J].植物生理学通讯,1989(5):77-78.
[19] 刘燕,高喜明.Cd胁迫对甘蓝型油菜种子萌发及幼苗生长的影响[J].种子,2007,26(9):16-20.
[20] 王友保,陈冬生.Cu、As单一及其复合污染对小麦种子萌发及幼苗生长的影响[J].安徽师范大学学报(自然科学版),2001,24(3):278-281.
[21] 朱连秋,祖晓明.白花泡桐对土壤重金属的积累与转运研究[J].安徽农业科学,2009,37(25):12063-12065.
[22] 于拴仓,刘立功.Cd、Pb及其相互作用对3种主要蔬菜胚根伸长的影响[J].种子,2005,24(1):61-63.
[23] 何晓宇.微核实验研究进展[J].国外医学·遗传学分册,1995,18(5):254-256.
[24] 周衍茂,叶澍.观察植物细胞有丝分裂的好材料——蚕豆侧根[J].生物学通报,2001,36(4):51.
Effects of heavy metals on seed germination and somatic cell division of broad bean
ZHAO Jinhui, WANG Zhiqiao, HUO Shaojie
(College of Life Science and Agronomy, Zhoukou Normal University, Zhoukou 466001, China)
Seeds and lateral roots of broad bean were treated with lead acetate stress to study the influence of different concentrations of lead acetate on lateral root germination, lateral root vigor, root tip cell micronucleus rate, lateral root morphology and color of broad bean seed and the chlorophyll content of broad bean seedling leaves and so on. The results showed that under the same concentration of lead acetate, with the extension of treatment time, the lateral root vigor of broad bean was reduced, the root tip cell micronucleus rate was increased, length increased range and incidence rate ascending range of lateral root were decreased, chlorophyll content in leaves was decreased, however the lateral root curvature was unchanged; Under the same treatment time, concentration of lead acetate was inversely proportional to lateral root vigor and chlorophyll content in leaves, conversely, treatment concentration of lead acetate in direct proportion to root tip cell micronucleus rate of lateral root. In addition, with extension of treatment time and increase of treatment concentration of lead acetate, the color of lateral root of broad bean seedling altered obviously and even appeared root rot. The above showed that different concentrations of lead acetate had varying effects on lateral root germination of broad bean seeds, root tip cell micronucleus rate, lateral root vigor, lateral root morphology and color and chlorophyll content of broad bean seedling leaves compared with the control.
broad bean;lead acetate stress;micronucleus rate;morphologic change;physiological indexes
2016-05-20;
2016-06-20
国家自然科学基金项目(No.41271280);周口师范学院2016年度大学生科研创新基金项目(No.zknuD201685)
赵锦慧(1979- ),女,河南周口人,硕士,讲师,主要从事生物技术及植物逆境生理研究工作.
X503.231;Q945.79
A
1671-9476(2016)05-0106-05
10.13450/j.cnki.jzknu.2016.05.028
