自体富血小板血浆凝胶双相接种法构建组织工程骨*
2016-10-17扈延龄王向阳张升波
扈延龄 王向阳 王 开 陈 峰 张升波 金 丹
(1青岛大学附属医院创伤外科,山东青岛266000;2南方医科大学南方医院创伤骨科,广州510515)
自体富血小板血浆凝胶双相接种法构建组织工程骨*
扈延龄1王向阳1王开1陈峰1张升波1金丹2**
(1青岛大学附属医院创伤外科,山东青岛266000;2南方医科大学南方医院创伤骨科,广州510515)
背景:使用富血小板血浆(PRP)等凝胶样物质作为接种介质的双相接种法可优化组织工程骨构建,但PRP的促成骨作用仍存在较大争议。目的:进一步探讨自体PRP凝胶用于双相接种法构建组织工程骨的可行性,及其促成骨性能。方法:实验组利用自体PRP凝胶接种骨髓间充质干细胞(MSCs)于β-磷酸三钙(β-TCP)支架构建组织工程骨,对照组采用常规的DMEM静态接种法构建。体外实验:通过MTT实验、碱性磷酸酶(ALP)活性检测、骨钙素(OC)放免测定,比较两种方法对细胞增殖和成骨分化影响。体内实验:将构建材料植入兔桡骨大段骨缺损,通过组织学观察、X线检查、单光子发射计算机断层检查比较两种方法构建材料的成骨性能。结果:体外实验表明PRP组MSCs显示良好的增殖和成骨分化能力,明显优于对照组。体内实验表明PRP组修复大段骨缺损的能力显著优于对照组。结论:自体PRP具有良好的促成骨性能,可有效构建组织工程骨。
富血小板血浆;骨髓间充质干细胞;组织工程;细胞接种;双相接种
【Abstract】Background:The platelet-rich plasma(PRP)gels used in the biphasic seeding can optimize the construction of tissue-engineered bone.However,osteogenic capacity of PRP is still in dispute.Objective:To explore the feasibility of constructing tissue-engineered bone by biphasic seeding with autologous PRP gels so as to give more insight to the contradictory osteogenic capacity of PRP.Methods:Autologous PRP gel was applied to inoculate mesenchymal stromal cells(MSCs)into β-tricalcium phosphate(β-TCP)scaffolds to construct tissue engineered bone in PRP group.In control group,tissue engineered bone was established by conventional static seeding using Dulbecco's modified Eagle's medium(DMEM)as cell seeding vehicle.In vitro,proliferation and osteogenic differentiation of MSCs on fabricated constructs were investigated by MTT assay,alkaline phosphatase(ALP)activity and osteocalcin(OC)content.The in vivo bone-forming capacity of the fabricated constructs in rabbit radius was determined by radiography,single photon emission computed tomography and histological analysis.Results:The MSCs in PRP group demonstrated great cell proliferation and osteogenic differentiation in vitro and superior bone formation in vivo as compared with control group.Conclusions:Autologous PRP has a good osteogenic capacity.The biphasic seeding with the use of autologous PRP gel can effectively reconstruct tissue-engineered bones.
【Key words】Platelet-rich plasma; Mesenchymal stromal cells; Tissue engineering; Cell seeding; Biphasic seeding
在组织工程骨构建技术中,使用胶原、纤维蛋白和富血小板血浆(PRP)作为细胞接种介质的双相接种法可实现细胞与支架即刻复合,还可获得高接种效率,并为细胞增殖分化提供良好的三维环境[1-4]。PRP是通过密度梯度离心从新鲜全血中分离出的含有高浓度血小板的血浆成分,其激活后形成含有大量生长因子的纤维蛋白凝胶[5],由于这些成分已被证实可促进组织再生和修复,故PRP成为骨再生和修复研究领域的热点。目前研究多支持PRP促成骨作用,且多项临床研究应用其促进修复骨缺损[6-9],但PRP的促成骨作用仍存在较大争议[10,11]。本实验应用兔自体PRP凝胶作为细胞接种媒介进行双相接种法构建组织工程骨,体内实验检测其对种子细胞的增殖分化影响,体内实验检测其构建物修复大段骨缺损的能力,以期进一步检测自体PRP凝胶用于双相接种法构建组织工程骨的可行性,并为PRP促成骨性能争议进一步提供实验依据。
1 材料与方法
1.1实验动物和支架材料
30只清洁级新西兰兔,6月龄,雌雄不限,体重2.0~2.5 kg,由青岛市动物实验中心提供[合格证号:SCXK(鲁)20090007]。6只用于体外实验,24只用于体内试验。β-磷酸三钙(β-TCP)支架由贝奥路生物材料有限公司提供,体外实验为立方体(5 mm×5 mm× 5 mm),体内实验为圆柱体(直径4 mm,长度12 mm),支架的孔隙率达75%±10%,且完全相通,平均孔隙直径为(530±50)μm。
1.2试剂与仪器
DMEM培养基(Hyclone,公司,美国);胎牛血清(Hyclone,公司,美国);二甲亚砜(Amresco公司,美国);四唑盐(MTT,Probe生物制品公司,中国);苏木素伊红(HE)染色试剂盒(碧云天生物技术研究所,中国);碱性磷酸酶(ALP)检测试剂盒(南京建成,中国);骨钙素(OC)放免试剂盒(北京东亚,中国);酶标仪(Meter Tech公司;日本);高速恒温离心机(Hitachi公司,日本);石蜡切片机(Leica,德国);Image-Pro Plus(IPP)图像处理分析软件(Media Cybernetics公司,美国)。
1.3实验方法
1.3.1体外实验
1.3.1.1兔骨髓间充质干细胞(MSCs)的分离扩增与诱导分化:取6只兔,分别从髂骨上各抽取5 ml骨髓,置于含15000 U肝素和10ml DMEM离心管中,离心过滤后接种入培养瓶内,加含10%胎牛血清的高糖DMEM培养基,置37℃、5%CO2细胞培养箱内培养,每3天换液,待原代细胞长至80%融合后,用0.25%胰酶分离细胞进行传代培养,取第3代细胞用于实验。不同兔来源的MSCs分别独立培养。
1.3.1.2自体PRP的制备:用装有1 ml 10%枸橼酸钠抗凝剂的注射器抽取同一只兔(取骨髓者)耳背中央动脉血10 ml,采用二次离心法制备PRP。20℃下800 r/m离心15 min,吸取上部血浆转移至另一离心管中,20℃下2000 r/m离心15 min,吸取上部含有极少量未沉降血小板的血浆层,剩余血浆及血细胞成份即为PRP。血小板计数检查示外周血血小板(201± 23)×103/μl,PRP血小板计数是(1056±106)×103/μl。
1.3.1.3细胞接种及体外培养:自体PRP凝胶双相接种法组(PRP组):将PRP、第3代MSCs细胞悬液(1× 107/ml),激活剂(含1000 U/ml凝血酶的10%氯化钙溶液)按体积比7:2:1混匀,制成细胞密度约为2×106/ml混合悬液,迅速以微量移液器在立方体β-TCP支架中滴入100 μl悬液,继续用成骨诱导培养液在37℃、5% CO2饱和湿度条件培养。常规静态接种法组(DMEM组)作为对照,于每块支架滴入100 μl相同细胞浓度的DMEM细胞悬液,培养条件同上。体外培养2周,每3天换液。
1.3.1.4.MTT试验:分别于培养后第1、7、14天弃原培养基,加入无血清DMEM 1 ml和5 mg/ml MTT100µl,在37℃、5%CO2培养箱中孵育4 h,小心吸去培养孔内的上清液,加入二甲基亚砜0.5 ml,振荡15 min。以酶标仪测570nm处吸光度值(OD值),参考波长630 nm。
1.3.1.5ALP活性检测:于培养后第1、7、14天弃原培养基,每孔加入200µl 1%Triton X-100,并反复冻融3次。取10µl的细胞裂解液至96孔板,双蒸水空白调零,按ALP试剂盒操作说明加入等量缓冲液和基质液,37℃水浴15 min,加显色剂,酶标仪测波长490 nm处吸光度值。根据公式算出ALP比活性:ALP(金氏单位/100ml)=测定管吸光度/标准管吸光度×标准管含酚的量(0.5µg)×100 ml/0.05 ml。
1.3.1.6 OC含量检测:于培养后第1、7、14天,按照OC放免试剂盒说明将细胞裂解液、125I标记OC抗体各100µl混合,4℃下放置24 h,加分离剂混匀后室温下放置20 min,4℃离心弃上清,检测沉淀物放射剂量。
1.3.2体内实验
1.3.2.1组织工程骨体外构建:取24只兔随机分为PRP组和DMEM组,每组根据取材时间再分为两个亚组:6周组和12周组。按照体外实验所述方法分离扩增兔MSCs及制备自体PRP。为进行成骨诱导分化,将第3代MSCs用DMEM条件培养基(含10%胎牛血清、1×10-8mol/L地塞米松、10 mmol/Lβ-甘油磷酸钠、50 mg/L抗坏血酸)诱导培养2周。PRP组使用自体PRP凝胶双相接种法接种成骨诱导分化MSCs于圆柱体β-TCP支架,DMEM组使用常规静态接种法作为对照。
1.3.2.2建立动物模型并植入构建组织工程骨:3%戊巴比妥钠(30 mg/kg)耳缘静脉注射麻醉,仰卧位固定,左前臂脱毛,2.5%碘酒消毒。于前臂桡侧中段纵行切口,逐层显露桡骨中段,线锯切除包括骨膜的长约12 mm骨质,将构建组织工程骨植入骨缺损处。为便于组织学取材,在构建复合体长轴中点处用7号线做标记。于术后第6和12周进行检测。
1.3.2.3 X线检查:行前上肢X线检查。透视条件:45 KV,125 mA,32 ms,距离100 cm。将获得X线片分析和评分。
1.3.2.4单光子发射计算机断层检查(SPECT):将剂量为20 MBq/kg的99mTc-MDP经兔耳缘静脉注入。4小时后,行SPECT检查,观察移植骨处和同侧肱骨中段成像,定量分析两个区域的99mTc-MDP摄取率。
1.3.2.5组织学观察:处死动物获得标本,行大体观察后常规固定脱钙、石蜡包埋。分别沿移植物长轴的1/4,1/2和3/4部位制备5 μm厚切片,行HE染色,经IPP图像处理分析系统计算新生骨面积百分比,将每块标本的3张切片所得的百分比取平均值。
1.4统计学分析
实验数据以均数±标准差表示,采用SPSS 13.0软件行独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1MTT 试验
两组吸光度随时间延长均增加,同一时间点PRP组吸光度显著性高于DMEM组(表1)。
表1 体外实验检测结果(,n=6)
注:与DMEM组比较,★P<0.05
时间OD值PRP组0.927±0.239★1.912±0.398★4.609±0.756★DMEM组0.663±0.107 1.012±0.195 2.043±0.1781 d 7 d 14 d ALP活性(u/ml)PRP组2.588±0.364★6.822±1.057★9.765±1.969★DMEM组1.334±0.157 2.592±0.553 3.571±1.041 OC含量(ng/ml)PRP组-5.781±1.261★11.063±1.898★DMEM组-2.206±0.607 5.278±1.461
2.2ALP 活性检测
培养第1天,两组ALP活性均无明显升高,第7,14天,ALP活性均逐渐升高,且同一时间点PRP组显著性高于DMEM组(表1)。
2.3OC 含量
培养第1天,两组均未测得骨钙素,在第7,14天,OC含量均逐渐升高,且同一时间点PRP组显著性高于DMEM组(表1)。
2.4X线检查
术后6周,两组骨缺损处均可见植入物高密度影,PRP组植入物与与截骨部间隙变模糊,DMEM组连接部位明显透光影,术后12周,PRP组见植入物与截骨两端骨性连接,而DMEM组愈合较差,连接部位模糊,但仍可分辨(图1)。两组影像学评分随时间增加而升高,且同一时间PRP组显著性高于DMEM组(表2)。
2.5SPECT 检查
在各时间点,PRP组植入物部位对99mTc-MDP摄取均显著性高于DMEM组(图2、表2)。
2.6组织学表现
大体观查:术后6周,见两组植入物表面有骨痂组织生成,但β-TCP材料仍外露,PRP组植入物两端新生骨组织多于DMEM组,术后12周可见PRP组植入物表面完全被骨痂包绕,两端与截骨部位骨性融合,界限不明显,DMEM组仍可见少量β-TCP材料外露,植入物两端新生骨组织明显较PRP组少。光镜观察:在术后6和12周,两组植入物均表现为同样的组织学过程,β-TCP渐降解,新生骨组织渐生成,但PRP组的新生骨生成速度和量明显高于DMEM组(图3,表2)。
3 讨论
种子细胞、支架材料和组织构建技术构成了组织工程三要素。其中组织构建技术是指如何将种子细胞接种于支架材料上并将其培育的技术。如何提高接种效率、提高组织块中细胞密度并改善细胞在支架中分布状况仍是组织工程骨制备中尚未很好解决的技术难题。尽管对接种方法进行了大量探索[12,13],但目前组织工程研究中最常用的接种方法为静态接种法,其优势在于适用于任何类别种子细胞和支架材料,且操作方法简单。但该方法也有不足之处,如接种效率不高造成种子细胞浪费。有研究报道使用胶原、纤维蛋白和PRP等物质进行双相接种,即将细胞-凝胶复合物接种到固态三维支架上,其渗透入支架内部后再用催化剂使其固化,获得细胞-凝胶-支架复合物。该方法可获得高接种效率和接种数量而改善静态接种法,并为细胞的增殖分化提供良好的三维环境。
富血小板血浆经激活后可形成具有立体网状结构的纤维蛋白凝胶,同时释放大量生长因子,包括血小板源性生长因子(PDGF)、转移生长因子(TGF)、血管内皮生长因子(VEGF)、表皮生长因子(EGF)等[6]。这些生长因子在PRP中浓度很高,约为体内正常浓度的几倍甚至几百倍,其中含量最多及最重要的是PDGF和TGF-β。研究证实纤维蛋白凝胶易于降解,生物相容性好,可以作为细胞或生长因子的理想载体。PDGF、TGF-β在骨折愈合中有重要作用,而VEGF有明显促进新生血管形成作用,均有利于骨组织的修复。目前体外实验已证实PRP可促进MSCs增殖,但PRP对MSCs的诱导分化作用仍有有争议。并且PRP对体内促进骨再生的作用亦未达成共识,尽管有学者认为PRP对骨缺损的修复作用并不显著[10,11],但大多数学者支持PRP促进骨再生作用,并且已有临床报道将PRP应用于促进骨再生[6-9]。
表2 体内实验检测结果(,n=6)
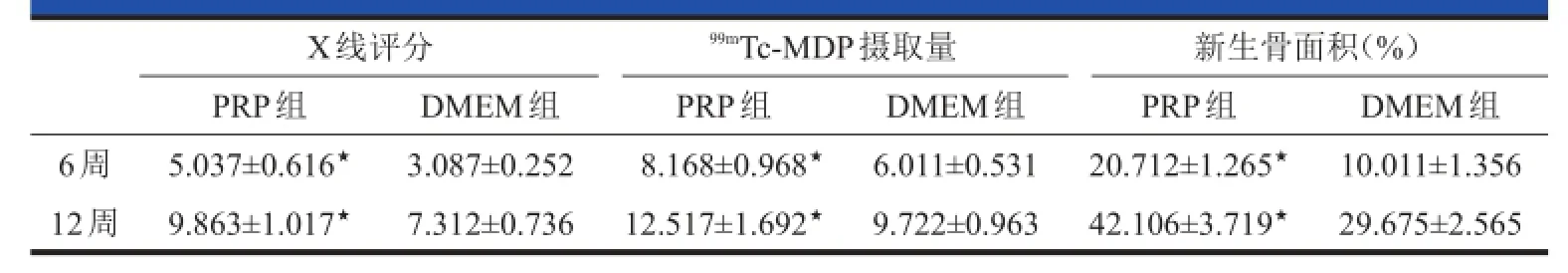
表2 体内实验检测结果(,n=6)
注:与DMEM组比较,★P<0.05
X线评分PRP组5.037±0.616★9.863±1.017★DMEM组3.087±0.252 7.312±0.7366周12周99mTc-MDP摄取量PRP组8.168±0.968★12.517±1.692★DMEM组6.011±0.531 9.722±0.963新生骨面积(%)PRP组20.712±1.265★42.106±3.719★DMEM组10.011±1.356 29.675±2.565
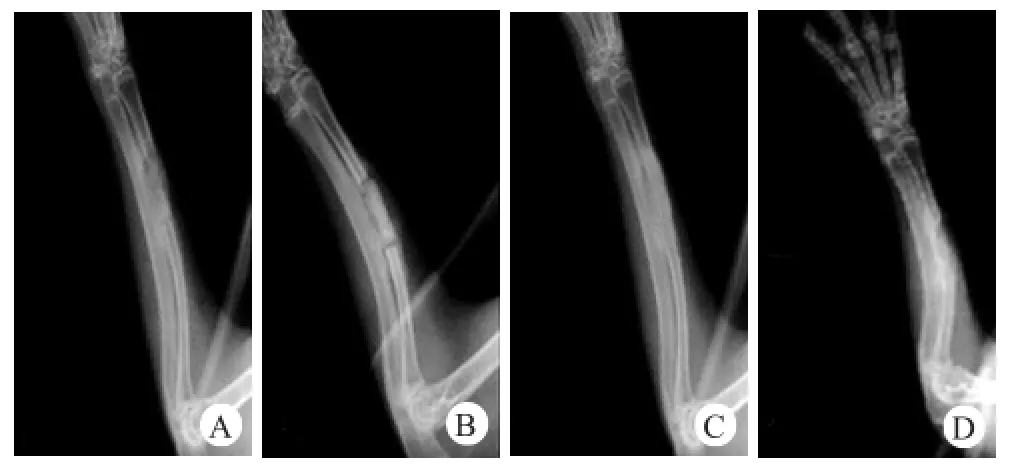
图1 PRP组(A、C)和DMEM组(B、D)在术后6周(A、B)和12周(C、D)修复骨缺损的X线检查
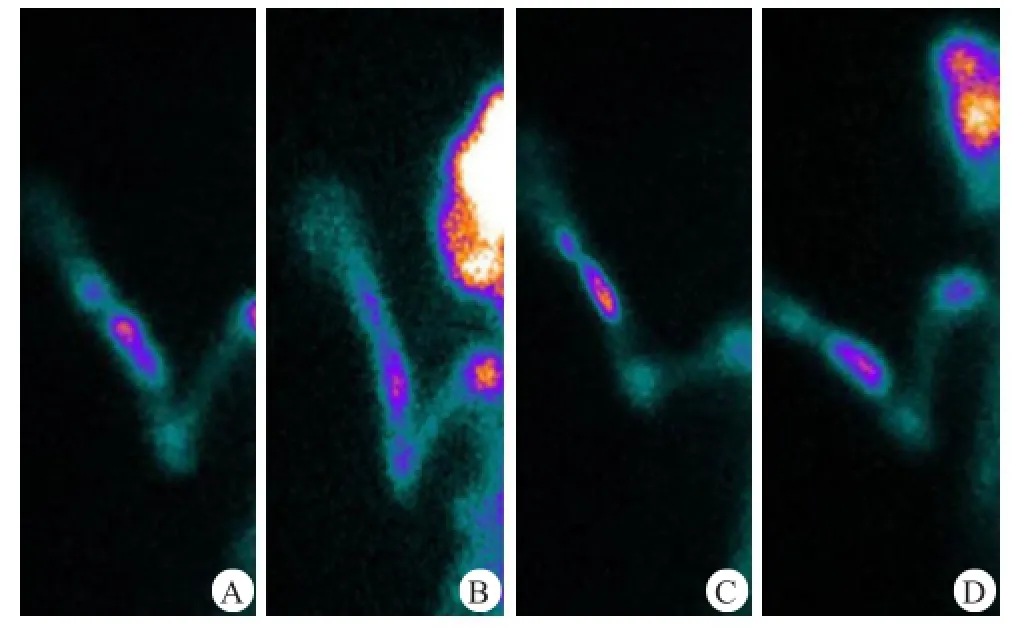
图2 PRP组(A、C)和DMEM组(B、D)在术后6周(A、B)和12周(C、D)的SPECT检查
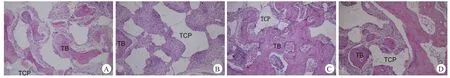
图3 PRP组(A、C)和DMEM组(B、D)在术后6周(A、B)和12周(C、D)的组织学观察(HE染色,×100,TB为新生骨组织,TCP为磷酸三钙材料)
本实验探讨采用自体PRP凝胶作为种子细胞接种媒介进行双相接种法构建组织工程骨。体外MTT检测显示细胞在PRP凝胶环境中增殖良好。ALP活性检测显示在PRP组细胞在本实验各检测时间点均明显优于DMEM组。对于OC测定,在培养1天时两组均未检测到,这与骨钙素为晚期成骨因子有关,在培养7和14天时PRP组骨钙素含量均明显优于DMEM组,这说明PRP凝胶可提供促进细胞成骨分化的微环境。对于体内成骨性能,本实验采用了大段骨缺损模型,X线、SPECT和组织学观察表明PRP组构建材料能加速骨折愈合和骨重建。
目前报道的PRP促成骨作用的实验研究结果不一致,其原因与PRP制备方法、实验动物模型、合用移植材料等因素有关。目前认为PRP中血小板浓度PRP与其生物活性关系密切,PRP制备方法决定PRP中血小板浓度。Weibrich等[14]指出,当PRP的血小板浓度大约1×106/μl时,其生物学效应最强。浓度较低,效果不佳,而高浓度的血小板则抑制MSCs的增殖与分化。理想的血小板浓度应为为基础浓度的3~5倍。在本研究中,PRP中血小板计数为(1056±106)× 103,浓缩倍数为(525±36)%,这也是本试验成功的重要因素。
生长因子在组织工程骨构建中的作用已得到众多研究证实[15,16]。但目前如何将保持活性的生长因子有效的复合在生物材料上仍是尚需解决的难点,并且现多用单一生长因子进行研究,无法发挥多种生长因子的协同作用。PRP凝胶具有可协同发挥作用的生长因子和纤维蛋白三维立体网架结构,可为种子细胞增殖、分化和功能表达的提供良好环境。使用自体PRP凝胶接种MSCs于多孔支架材料,构建组织工程骨具有骨传导性、骨诱导性和种子细胞,这些正是理想骨移植材料所要求的元素。此外本研究采用自体PRP,可排除免疫因素干扰,且制备简便,价格低廉。
综上所述,本实验结果表明自体PRP具有良好的促进成骨的性能,其凝胶可作为接种媒介用于双相接种法构建组织工程骨。
[1]吕仁发,周强,许建中,等.种子细胞双相接种技术促进组织工程骨体外成熟的研究.中华创伤杂志,2006,22(4):291-295.
[2]Gassling V,Hedderich J,Açil Y,et al.Comparison of platelet rich fibrin and collagen as osteoblast-seeded scaffolds for bone tissue engineering applications.Clin Oral Implants Res,2013,24(3):320-328.
[3]Li Z,Kupcsik L,Yao SJ,et al.Chondrogenesis of human bone marrow mesenchymal stem cells in fibrin-polyurethane composites.Tissue Eng Part A,2009,15(7):1729-1737.
[4]雷华,肖苒,曹蕊,等.富含血小板血浆双相接种法构建组织工程骨.中国美容医学,2011,20(3):402-406.
[5]Marx RE.Platelet-rich plasma(PRP):what is PRP and what is not PRP?Implant Dent,2001,10(4):225-228.
[6]Kitoh H,Kitakoji T,Tsuchiya H,et al.Transplantation of culture expanded bone marrow cells and platelet rich plasma in distraction osteogenesis of the long bones.Bone,2007,40(2):522-528.
[7]Simon Z,Friedlich J.The use of autogenous bone grafting with platelet-rich plasma for alveolar ridge reconstruction:a clinical report.J Calif DentAssoc,2006,34:895-899.
[8]施忠民,顾文奇,许同龙,等.HeppleⅤ型距骨骨软骨损伤的手术治疗.中华骨与关节外科杂志,2015,8(4):291-295.
[9]陈海峰,王健,胡勇,等.自体富血小板血浆与人工骨混合物治疗胫骨平台骨折合并骨缺损的临床应用.中国骨与关节外科,2014,7(3):213-214.
[10]Kanno T,Takahashi T,Tsujisawa T,et al.Platelet-rich plasma enhances human osteoblast-like cell proliferation and differentiation.Oral Maxillofac Surg,2005,63(3):362-369.
[11]Ogino Y,Ayukawa Y,Tsukiyama Y,et al.The effect of platelet-rich plasma on the cellular response of rat bone marrow cells in vitro.Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2005,100(3):302-307.
[12]王林,马真胜,雷伟,等.成骨细胞在四种多孔医用材料内的灌注性三维动态接种研究.中华创伤骨科杂志,16(3):242-245.
[13]扈延龄,王爱荣,宫海峰,等.自制双腔生物反应器构建组织工程骨软骨复合体的体外性能.中国组织工程研究,2012,19(16):2459-2492.
[14]Weibrich G,Hansen T,Kleis W,et al.Effect of platelet concentration in platelet-rich plasma on peri-implant bone regeneration.Bone,2004,34:665-671.
[15]Dyondi D,Webster TJ,Banerjee R.A nanoparticulate injectable hydrogel as a tissue engineering scaffold for multiple growth factor delivery for bone regeneration.Int J Nanomedicine,2013,8:47-59.
[16]纪经涛,胡永成,夏群,等.血管内皮生长因子和骨形态发生蛋白在骨组织工程中的作用.中国组织工程研究,2012,19(33):5356-5363.
Autologous platelet-rich plasma gel used in constructing tissue-engineered bone by biphasic seeding method*
HU Yanling1,WANG Xiangyang1,WANG Kai1,CHEN Feng1,ZHANG Shengbo1,JIN Dan2**
(1.Department of Trauma Surgery,Affiliated Hospital of Qingdao University,Qingdao 266000,Shandong;2.Department of Orthopedics and Traumatology,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China)
2095-9958(2016)04-0165-05
10.3969/j.issn.2095-9958.2016.02-16】Platelet-rich plasma;Mesenchymal stromal cells;Tissue engineering;Cell seeding;Biphasic seeding
山东省高等学校科技计划项目(No.J11LF22)
**
金丹,E-mail:nfjindan@126.com
