白藜芦醇对卵巢癌细胞株SKOV-3细胞周期的影响及诱导其凋亡的机制研究
2016-10-17唐锐先
唐锐先,张 颖,张 巍
(1.吉林医药学院直属医院,吉林 吉林 132013;2.永吉县医院,吉林 永吉 132200)
白藜芦醇对卵巢癌细胞株SKOV-3细胞周期的影响及诱导其凋亡的机制研究
唐锐先1,张 颖2,张 巍1
(1.吉林医药学院直属医院,吉林 吉林 132013;2.永吉县医院,吉林 永吉 132200)
目的 探讨白藜芦醇对人卵巢癌SKOV-3细胞的细胞周期及诱导其凋亡机制的影响;探讨白藜芦醇诱导人卵巢癌SKOV-3细胞凋亡的机制.方法 设置不同浓度的白藜芦醇实验组(20,40,80)μmol/L及细胞对照组,PI(碘化丙啶)单染后应用流式检测分析其凋亡细胞在细胞周期中不同阶段所占百分率;应用Annexin-v/PI双标记法染色后流式检测并通过散点图分析白藜芦醇诱导对人卵巢癌SKOV-3细胞凋亡情况;免疫组织化学法检测白藜芦醇对SKOV-3细胞中凋亡相关蛋白Caspase-3的表达影响.结果 PI(碘化丙啶)单染后流式检测结果提示:白藜芦醇可以将卵巢癌 SKOV-3 细胞周期阻滞于S期;三色散点图提示白藜芦醇可诱导SKOV-3细胞早期凋亡的增加,此作用与白藜芦醇浓度呈正相关性;白藜芦醇可使人卵巢癌 SKOV-3 细胞中的Caspase-3表达增加.结论 白藜芦醇可阻断SKOV-3细胞周期并诱导其早期凋亡;白藜芦醇诱导人卵巢癌 SKOV-3 细胞凋亡的发生可能与Caspase通路的激活有关.
白藜芦醇;SKOV-3细胞;凋亡;流式检测;免疫组织化学
【引用格式】唐锐先,张颖,张巍.白藜芦醇对卵巢癌细胞株SKOV-3细胞周期的影响及诱导其凋亡的机制研究[J].北华大学学报(自然科学版),2016,17(5):611-615.
卵巢癌是妇产科临床中最常见的恶性肿瘤之一,具有较高的致死率,其发病率也于近年来呈逐年上升趋势[1-2].本研究通过广泛存在于药用植物内的抗毒素——白藜芦醇对人类卵巢癌SKOV-3细胞核形态学、细胞周期、早期凋亡的影响,探讨白藜芦醇对人卵巢癌治疗作用的实验依据.
1 材料与方法
1.1 仪器和设备
HF90/HF240 CO2细胞培养箱(Heal Force公司);超净工作台(吉林医药学院实验中心);流式细胞仪(美国becton-Dickinson公司);投射式荧光显微镜(上海荼明光学仪器);96孔培养板(美国 Corning 公司);台式冷冻离心机(德国 Heraus 公司);低温冰箱(日本).
1.2 主要试剂
Annexin V-FITC/PI双染细胞凋亡检测试剂盒(碧云天生物技术);纯度99.85%白藜芦醇粉末(天津迈迪瑞康生物医药科技);Hoechst33258试剂盒(南京凯基生物工程研究所);细胞培养基 RPMI-1640(碧云天生物技术);胎牛血清(吉林血研所);DMSO(二甲基亚砜,淄博荣悦进出口公司);0.25%胰蛋白酶消化液(吉林医药学院实验中心);DAB试剂盒(碧云天生物技术);Caspase-3抗体(美国SANTA公司).
1.3 试剂的配置
1)白藜芦醇原液的配制:电光天平精确称取纯度99.85%的白藜芦醇粉末228 mg溶于DMSO 1 mL中,混合均匀后置于-80 ℃低温冰箱中保存.临用时再配制成所需工作浓度(原液浓度为1 mol/L).
2)FITC染液配制:Annexin V-FITC/PI细胞凋亡检测试剂盒中取(1×)binding buffer液200 μL,FITC 5 μL/管,将两者均匀混合后滴加EP管中,4 ℃避光保存备用.
3)PI(碘化丙啶)染液配制:PI(碘化丙啶)10 mg,triton X-1 000.5 mL,PBS缓冲液129.6 mL,枸橼酸钠200 mg,蒸馏水200 mL,调pH 7.4,4 ℃避光保存.
4)DAB试剂配制(使用前30 min):在1.5 mL EP管中先加入0.85 mL二次蒸馏水,严格按DAB试剂盒说明分别加入盒内A,B,C液各50 μL,混匀后即为1 mL DAB显色液.
1.4 实验方法
1.4.1 细胞的复苏、培养
人类卵巢癌细胞系(SKOV-3)(中科院上海研究所细胞库)由吉林医药学院科学实验室冻存.细胞培养于RPMI-1640培养液中,培养条件为在5%CO2、湿度95%.每2 d胰酶消化、重悬、更换1次培养液,分瓶培养,按1∶3传代.
1.4.2 实验中的加药方案
取浓度为100 mmol/L白藜芦醇4 μL加入到培养瓶中(瓶中原有5 mL混合培养液),使工作浓度达80 μmol/L;取浓度为25 mmol/L白藜芦醇8 μL加入到培养瓶中(瓶中原有5 mL混合培养液),使工作浓度达40 μmol/L;取浓度为25 mmol/L白藜芦醇4 μL加入到培养瓶中(瓶中原有5 mL混合培养液),使工作浓度达20 μmol/L.
1.4.3 实验分组
细胞对照组:设置RPMI-1640细胞培养液培养的SKOV-3细胞、二甲基亚砜(DMSO)100 μL,其中不加入白藜芦醇制剂,作为不同浓度白藜芦醇实验组的共同对照.
白藜芦醇实验组:将相同的细胞分瓶后,滴加不同浓度的白藜芦醇溶液(20,40,80)μmol/L(相同体积)继续培养24 h后实验.
1.4.4 PI单染流式细胞术(FCM)检测细胞周期的变化
取用不同浓度白藜芦醇药物(20,40,80)μmol/L处理的细胞3瓶及对照组细胞1瓶,PBS 缓冲液冲洗后分别加入胰蛋白酶消化5 min,离心后加入冰预冷的70%的乙醇固定(4 ℃)过夜(破膜).每瓶加入500 μL PI(碘化丙啶)染液后,于低温(4 ℃)孵育箱中孵育30 min.上机检测,碘化丙啶(PI)用氩离子以激光波长488 nm激发荧光,发射波长为632 nm.一般计数2.5万个细胞,结果用细胞周期拟和软件分析凋亡细胞所占百分率.根据凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%计算细胞凋亡率.1.4.5 Annexin-v/PI双标记法流式细胞术(FCM)检测
取用不同浓度白藜芦醇药物(20,40,80) μmol/L处理的细胞3瓶及对照组细胞1瓶,PBS 缓冲液冲洗后分别加入胰蛋白酶消化5 min,吹打细胞使之悬浮,弃上清.1 mL PBS缓冲液悬起细胞,转入1.5 m LEP管中离心,弃上清液.重悬后平均分配于1 mL EP管中,按200 μL/管及FITC 5 μL/管将两者均匀混合后滴加EP管中,避光染色50 min.每管再加入300 μL binding buffer后离心5 min,弃上清液,500 μL binding buffer冲洗两次细胞.每管加入300 μL binding buffer,将细胞悬起,并将其移入流式管中.各管加入Annexin V-FITC/PI细胞凋亡检测试剂盒中PI染液5 μL,立即上机检测.流式检测和分析:用流式细胞仪于激发波长为488 nm处检测彩色荧光,散点图检测细胞凋亡早、晚时期及坏死细胞所占比率.
1.4.6 免疫细胞化学法检测Caspase-3的表达
取40 μmol/L白藜芦醇处理组细胞及对照组细胞各1瓶,培养液PBS清洗2次.4%多聚甲醛4 ℃固定后清洗标本,3%H2O237 ℃孵育15 min.于0.01 mol柠檬酸缓冲液中加热15 min(95 ℃),自然冷却至室温.羊血清工作液封闭,弃去血清,不冲洗标本,加入稀释至1∶1 000的兔抗Caspase-3多克隆抗体于4 ℃过夜.滴加生物素标记羊抗兔IgG工作液,37 ℃孵育20 min后滴加链霉素-生物素-辣根过氧化物酶工作液.DAB显色,冲洗,脱水、透明、中性树脂封片.染色结果以细胞质或核内有棕黄色高出背景的细胞为阳性细胞.
1.5 统计学处理
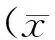
2 结 果
2.1 PI单染流式细胞术(FCM)检测细胞周期的变化实验结果
表1表明:以20,40,80 μmol/L浓度的白藜芦醇处理卵巢癌SKOV-3 细胞24 h后,随药物剂量的增加,各组细胞的凋亡率均显著增高;而且G1期细胞所占百分率降低,S 期细胞所占百分率上升,提示白藜芦醇可以将卵巢癌 SKOV-3 细胞周期阻滞于S期.
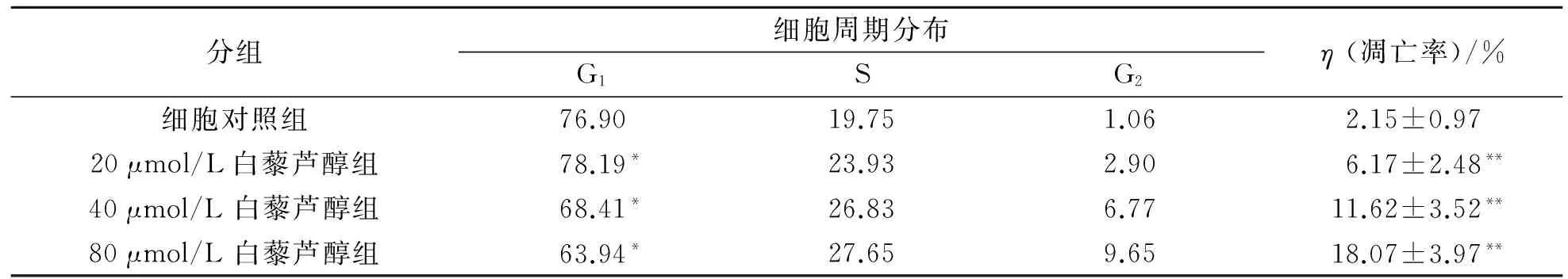
表1 不同浓度的白藜芦醇对 SKOV-3 细胞的平均凋亡率及细胞周期的影响
注:与细胞对照组比较,*:P<0.01;与各组间比较,**:P<0.05
2.2Annexin-v/PI双标记法流式细胞术(FCM)检测结果
不同浓度白藜芦醇处理组流式检测三色散点图说明:左下象限显示活细胞,为Annexin V-/PI-;右下象限为早期凋亡细胞,为Annexin V+/PI-;右上象限是凋亡晚期细胞,为Annexin V+/PI+;左上象限显示死亡细胞.见图1.
注:与细胞对照组比较,*:P<0.01;与各组间比较,△:P<0.05
不同工作浓度白藜芦醇作用于人卵巢癌SKOV-3细胞24 h后,经Annexin V-FITC/PI双染后流式细胞检测仪结果(见图1,表2)提示:经白藜芦醇处理后人卵巢癌SKOV-3细胞早期凋亡率明显增加(P<0.01),并随白藜芦醇工作浓度的递增,诱导人卵巢癌SKOV-3细胞作用越明显(P<0.05),且呈浓度依赖性.
2.3 免疫组化检测结果
结果显示:未加白藜芦醇细胞贴壁,排列紧密,呈长梭形.40 μmol/L白藜芦醇实验组细胞核着色加深(阳性结果胞核、胞质呈棕黄色细颗粒状).见图2.
3 讨 论
有研究[3-5]表明:卵巢癌的形成是由于机体内正常卵巢细胞在致癌因素的刺激下,于DNA水平上发生了碱基对的错配,使卵巢细胞畸形生长及生长失控,导致癌性细胞的急剧扩增,并获得侵袭和转移能力.本研究从白藜芦醇对卵巢癌细胞周期的影响、诱导其早期凋亡的作用及机制来探究将白藜芦醇应用于卵巢癌临床治疗的实验室依据.
在本研究的加药方案中,保证了溶剂及培养液中DMSO(二甲基亚砜)的浓度小于千分之一,从而消除并忽略DMSO对培养细胞的毒性作用及影响.此外,在实验操作中避免取样量的体积小于0.5 μL,从而避免了取样量的体积过小导致的误差.因此,本研究不再单独设立DMSO对细胞影响的空白对照组,从而达到简化实验步骤,同时保证研究结果的说服力及准确性[6].
碘化丙锭 (PI)可以嵌入凋亡晚期细胞及死亡细胞的双链DNA,并发出红色荧光,但PI不能通过细胞膜完整的细胞,如活细胞和早期凋亡细胞在标本制备时,必须先用乙醇或其他破膜剂增强细胞膜的通透性,才能使 PI进入细胞内,与细胞内的核酸结合[7].本研究通过流式检测技术检测经不同浓度白藜芦醇处理后的卵巢癌SKOV-3细胞周期中G1期细胞,其百分比随药物浓度增高而逐渐降低,S期细胞百分比逐渐增加,表明白藜芦醇抑制肿瘤细胞的增殖能力体现在可将卵巢癌SKOV-3细胞周期阻滞于S期,这与同类研究的成果相似[8-9].
此外本实验还应用Annexin V/PI双染色,利用流式检查技术来进一步研究白藜芦醇诱导卵巢癌SKOV-3细胞凋亡作用的相关情况,其原理是应用Annexin V与凋亡早期细胞的胞膜结合稳定的特性,利用Annexin V与PI匹配能更加准确地观测白藜芦醇对人卵巢癌 SKOV-3 细胞凋亡的影响[10-11].本研究选取20,40,80 μmol/L 3个不同浓度的白藜芦醇,利用流式检测技术进一步进行人卵巢癌SKOV-3 细胞凋亡实验.散点图结果显示:随白藜芦醇工作浓度的递增,其诱导人卵巢癌的早期凋亡率及总凋亡率逐渐上升,确切说明白藜芦醇诱导人卵巢癌SKOV-3细胞凋亡呈工作浓度依赖性.综上所述,白藜芦醇可明显改变人卵巢癌细胞SKOV-3的细胞核形态,诱导人卵巢癌SKOV-3 细胞凋亡,其作用主要是诱导其早期凋亡.
免疫组织化学法是细胞生物学研究中检测各种抗原物质(多肽、蛋白质、激素、酶、病原体、受体等)的新技术之一,它将显微镜的放大、直观作用与免疫反应的特异性及组织化学的可见性巧妙结合[12],消弭了免疫学可以定量、定性而不能定位的不足之处,并将形态学改变与代谢及功能结合起来[13].根据我们已发布的相关实验成果的结论即白藜芦醇诱导人卵巢癌SKOV-3凋亡的半数抑制浓度(IC50=37.81 μmol/L)[14-15],本研究选取与其接近的中间工作浓度40 μmol/L白藜芦醇来做免疫化学实验,以便能准确及客观地反映白藜芦醇诱导人卵巢癌SKOV-3 细胞凋亡的机制.实验结果发现:白藜芦醇可使人卵巢癌 SKOV-3 细胞中的Caspase-3表达增加.Caspase-3作为天冬氨酸特异性半胱氨酸蛋白依赖的细胞凋亡通路中的起始蛋白,其表达的增加说明白藜芦醇诱导人卵巢癌 SKOV-3细胞凋亡的发生可能与Caspase通路的激活而引起的不可逆的层叠级联反应相关联,这也与国外的研究报告相契合[16].但是其诱导卵巢癌SKOV-3细胞凋亡的过程中其他相关蛋白表达及变化规律还有待进一步研究与探讨.
[1] Bei L,John N,Carolyn R,etal.Ovarian cancer immu- notherapy:opportunities,progress and challenge[J].Hematology & Oncology,2010,3:7-11.
[2] 张雯碧.卵巢癌化疗耐药相关基因与预后的研究进展[J].国外医学:妇产科学分册,2007,34(3):193-196.[3] Zhang Y,Zhao F J,Chen L L,etal.MiR-373 targeting of the Rab22a oncogene suppresses tumor invasion and met- astasis in ovarian cancer[J].Oncotarget,2014,11(23):12291-12303.
[4] Huang X,Zhu H L.Reservatrol and its analogues:prom- ising antitumor agents[J].Anticancer Agents Med Chem,2011,11(5):479-490.
[5] Lu Z Y,Dong R,Li D,etal.SNAI1 overexpression induces stemness and promotes ovarian cancer cell invasion and metastasis[J].Oncol Rep,2012,27(5):1587-1591.
[6] 王振斌,马海乐,许文荣,等.有机溶剂对肿瘤细胞的细胞毒作用[J].江苏大学学报(医学版),2005,13(3):201-205.[7] 刘江惠,郭建文,王静,等.流式细胞术PI染色法检测胃蛋白酶消化时间对细胞凋亡的影响[J].第三军医大学学报,2007,11(22):2196-2197.
[8] Piotrowska H,Myszkowski K,Zikowska A,etal.Resv- eratrol analogue 3,4,4′,5-tetramethoxystilbene inhibits growth,arrests cell cycle and induces apoptosis in ovarian SKOV-3 and A-2780 cancer cells[J].Toxicol Appl Phar- macol,2012,263(1):53-60.
[9] 蓝鸿雁,张纪妍,陈杰,等.白藜芦醇诱导卵巢癌SKOV-3细胞凋亡的作用机制[J].山东医药,2014,54(1):32-39.[10] 张伟,梁智辉.Annexin V-FITC/PI 双标记与Hoechst 33342/PI 双标记流式细胞术检测细胞凋亡的比较[J].细胞与分子免疫学杂志,2014,30(11):1209-1212.[11] S M Bernier,Y Yamada.Modulation of Annexin-V during chondrocytic different iation in vitro[J].Annals of New York Academy Sciences,2008,28(6):212-214.
[12] Yang G,Zhang H,Liu Y,etal.Epigenetic and immu- nohistochemical characterization of the Clusterin gene in ovarian tumors[J].Archives of Gynecology and Obstetrics,2013,287(5):989-995.
[13] Sylvia M T,Kumar S,Dasari P.The expression of immu- nohistochemical markers estrogen receptor,progesterone receptor,Her-2-neu,p53 and Ki-67 in epithelial ovarian tumors and its correlation with clinic opathologic variables[J].Indian J Pathol Microbiol,2012,55(1):33-37.
[14] 唐锐先,张巍,赵行宇.白藜芦醇诱导卵巢癌细胞SKOV-3凋亡作用的研究[J].中成药,2015,37(10):2293-2296.
[15] 唐锐先,张颖,李伟,等.白藜芦醇对人卵巢癌SKOV-3细胞形态及增殖作用[J].吉林医药学院学报,2015,36(5):321-324.
[16] Rahman M A,Kim N H,Kim S H.anti-proliferative and cytotoxic effect of resveratrol in mitochondria-mediated apoptosis in rat b103 neuroblastoma cells[J].Korean J Physiology Pharmaco,2012,16(5):321-326.
【责任编辑:陈丽华】
On Effect of Resveratrol on the Cell Cycle of Ovarian Cancer Cell Strain SKOV-3 and the Apoptosis Mechanism Induced by Resveratrol
Tang Ruixian1,Zhang Ying2,Zhang Wei1
(1.Directly Subordinate Hospital of Jilin Medical Collage,Jilin 132013,China;2.Yongji County Hospital of Jilin City,Jilin 132200,China)
Objective To investigate the effects of resveratrol on the cell cycle of human ovarian cancer cell SKOV-3,and to explore the apoptosis mechanism of human ovarian cancer cell SKOV-3 induced by resveratrol.Method The experimental group treated with different concentrations of resveratrol (20,40 and 80 μmol/L) and the cell control group were set.The apoptosis rates of SKOV-3 at different stages in the cell cycles were analyzed by flow cytometry after PI (propidium iodide) single staining.The apoptosis of human ovarian cancer cell SKOV-3 induced by resveratrol was tested by flow cytometry (Annexin-v/PI double labeling staining) and analyzed by scatter plot.The effect of resveratrol on the expression of apoptosis-related protein Caspase-3 in SKOV-3 cells was detected by immunohistochemical method.ResultsAfter PI (propidium iodide) single staining,the flow cytometry results suggested that resveratrol could arrest the cell cycle of ovarian cancer SKOV-3 in S phase.Three scatter plot indicated that resveratrol could induce SKOV-3 early apoptosis,and this effect was positively correlated to the concentration of resveratrol.Resveratrol was able to increase the expression of Caspase-3 in human ovarian cancer SKOV-3 cells.Conclusion Resveratrol can block the cell cycle and induce the early apoptosis of SKOV-3,which may relate to the activation of caspase pathway.
Resveratrol;SKOV-3 cells;apoptosis;flow cytometry(FCM);immunohistochemistry
1009-4822(2016)05-0611-05
10.11713/j.issn.1009-4822.2016.05.011
2016-01-12
吉林省教育厅科学技术研究项目(2014364).
唐锐先(1971-),男,副主任医师,主要从事临床新药研发及应用研究,E-mail:370896632@qq.com;通信作者:张 巍(1970-),女,博士,副教授,主要从事抗肿瘤中药筛选研究,E-mail:jlmmczw@163.com.
R93,R737
A
