多方法组合分析脲诱导的淀粉液化芽孢杆菌α -淀粉酶去折叠和重折叠过程的构象转化
2016-10-16杨文慧边六交
杨文慧, 冀 旭, 边六交*
(西北大学生命科学学院,陕西西安 710069)
作为从分子水平上阐明生命奥秘的中心课题之一,蛋白质分子的去折叠和重折叠过程一直受到生物化学、生物物理学和结构生物学等领域研究者的高度关注。目前普遍认为完全的去折叠或重折叠过程往往不是一步就能达到的[1 - 5],而是存在一个或多个稳定的部分折叠中间态[6,7],它们对研究蛋白质分子的功能、自构、折叠和集聚等都具有重要意义[8 - 10]。
研究蛋白分子去折叠和重折叠过程时,常用细胞色素C、卵清溶菌酶[11,12]等分子量较小、结构比较紧凑的蛋白质以及牛碳酸酐酶B[13,14]作为模型蛋白分子。本实验室曾分别研究和比较了由变性剂诱导的结构更为复杂的猪胃蛋白酶[15]和牛血清白蛋白[16]分子的去折叠过程,并对这两种蛋白折叠中间态的分布和过渡进行了研究[17];也对盐酸胍诱导的分子量较大但结构又不过于复杂的淀粉液化芽孢杆菌α-淀粉酶分子的去折叠过程进行了研究[18]。在该研究基础上,本文利用变性和非变性电泳、体积排阻色谱、内源荧光发射光谱、荧光相图、荧光猝灭以及活性测定等组合分析方法研究了变性剂脲诱导的淀粉液化芽孢杆菌α-淀粉酶分子的去/重折叠过程,并与一般常用的分子量较小的蛋白分子的去/重折叠过程进行比较,为以后研究分子量更大、结构更为复杂的蛋白质分子的去/重折叠过程奠定基础。
1 实验部分
1.1 仪器和试剂
F-4500型荧光光谱仪、U-3310型紫外-可见分光光度计(日本,日立公司);LC-10A型高压液相色谱仪(日本,岛津公司);Mini-Protein®Ⅱ垂直板蛋白电泳仪(美国,Bio-Rad公司);凝胶成像系统(法国,Viber Lovrmat公司)。
淀粉液化芽孢杆菌α-淀粉酶(Bacillusamyloliquefaciensα-amylase)、脲和盐酸胍(纯度均>99%),均为Sigma公司产品;其余试剂为国产分析纯试剂。实验用水为二次去离子水。
1.2 实验方法
1.2.1去折叠及重折叠称取适量α-淀粉酶,分别溶于含不同浓度脲的pH=7.0的0.1 mol/L的磷酸盐缓冲液(PBS)中,使α-淀粉酶的终浓度为6.0 mg/L。室温下放置过夜使其不同程度去折叠;称取适量α-淀粉酶,溶于10.0 mol/L脲溶液中,放置过夜使其完全去折叠。将上述变性酶溶液稀释成含不同脲浓度的6.0 mg/L的α-淀粉酶溶液,放置过夜使其不同程度重折叠。同时,称取适量α-淀粉酶,溶于8.0 mol/L盐酸胍溶液中使其完全去折叠,将该变性α-淀粉酶溶液稀释成含不同盐酸胍浓度的6.0 mg/L的α-淀粉酶样品溶液,放置过夜使其不同程度重折叠。
1.2.2电泳通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),及非变性聚丙烯酰胺凝胶电泳(Native-PAGE),对上述脲诱导的α-淀粉酶的去折叠和重折叠过程以及盐酸胍诱导的酶分子重折叠过程进行电泳分析。分离胶浓度8%,浓缩胶浓度5%,考马斯亮蓝R-250染色。
1.2.3体积排阻色谱采用高效体积排阻色谱法,对上述脲诱导的α-淀粉酶分子的去折叠和重折叠过程,以及盐酸胍诱导的α-淀粉酶分子重折叠过程进行了体积排阻色谱分析。色谱柱为Shimadzu Shim-pack DIOL-300柱(25 cm×7.9 mm),流动相为含0.2 mol/L Na2SO4的10.0 mmol/L PBS(pH=7.0),流速1.0 mL/min,280 nm检测,上样50 μL。
1.2.4去折叠过程的内源荧光光谱和荧光相图扣除对照体系荧光后,测定上述不同变性程度α-淀粉酶的内源荧光发射光谱,及在320 nm和365 nm波长下的荧光强度I320和I365,绘制荧光相图。对照体系除不含α-淀粉酶外,其余成分和浓度均与上述变性样品溶液相同。仪器参数:激发波长295 nm,激发狭缝和发射狭缝宽度均为10 nm,扫描范围300~400 nm,扫描速度1 200 nm/min。
1.2.5重折叠过程的内源荧光光谱和荧光相图方法及仪器参数设置同1.2.4。
同时用此方法研究了盐酸胍诱导的变性α-淀粉酶分子重折叠过程的内源荧光光谱和荧光相图。
1.2.6去折叠和重折叠过程的荧光猝灭选择丙烯酰胺和KI作为α-淀粉酶分子的荧光猝灭剂。按照Lehrer[19]和Eftink[20]的方法,以丙烯酰胺为猝灭剂,将其加入到不同程度变性和复性的α-淀粉酶样品溶液中。样品中α-淀粉酶的浓度为1.0×10-6mol/L,丙烯酰胺的浓度分别为0.0、0.1、0.2、0.4、0.5、1.0 mol/L,室温放置2 h后进行光谱测定。扣除对照体系荧光后,取最大荧光发射强度,根据Stern-Volmer公式作图;而以KI作为猝灭剂时,用0.1 mol/L PBS(pH=7.0)配制5.0 mol/L的KI溶液(其中含2.0 mmol/L Na2S2O3,以防止I3-的生成),将其加入不同程度变性和复性的α-淀粉酶样品溶液中,样品中α-淀粉酶的浓度均为 1.0×10-6mol/L,KI的浓度分别为0.00、0.02、0.04、0.06、0.08 mol/L,放置2 h后进行光谱测定。扣除对照体系荧光后,取最大荧光发射强度,根据Stern-Volmer公式作图。仪器参数设置同1.2.4。
1.2.7去折叠和重折叠过程的生物活性测定称取适量α-淀粉酶,分别溶于含不同浓度脲的0.1 mol/L的PBS(pH=7.0)中,酶的终浓度为0.75 mg/L。室温下放置过夜使其不同程度去折叠。以1.0%(m/V)淀粉溶液为底物在540 nm下测定样品溶液吸光值来确定α-淀粉酶的生物活性。以天然酶活性为100%,以不同脲浓度下α-淀粉酶的残余活性率对脲浓度作图。脲诱导的α-淀粉酶分子重折叠过程的生物活性测定方法基本同上,只是要先将适量α-淀粉酶溶于含10.0 mol/L脲的0.1 mol/L PBS(pH=7.0)中放置过夜使其完全去折叠,然后将它们稀释到不同脲浓度下稀释复性后进行活性测定。盐酸胍诱导的α-淀粉酶去折叠和重折叠过程的生物活性测定方法同上,以7.0 mol/L盐酸胍变性过夜。
2 结果与讨论
2.1 去折叠和重折叠过程的电泳分析
图1和图2为变性α-淀粉酶复性液的SDS-PAGE和Native-PAGE图谱。SDS-PAGE结果表明α-淀粉酶的稀释复性液仅在分子量约50 kD处有一条带,这表明在α-淀粉酶的复性过程中,酶分子始终以单分子形式存在于溶液中,并没有任何形式的聚集体形成。我们同时对α-淀粉酶的稀释复性液进行了Native-PAGE分析,结果表明α-淀粉酶的稀释复性液中也仅仅存在一条单分子条带。α-淀粉酶的变性液电泳分析中,也得到了类似的结果。这表明在脲诱导的α-淀粉酶分子的变性过程和变性α-淀粉酶分子的稀释复性过程中,酶分子只以单分子状态存在,并没有通过非共价键作用产生任何形式的聚集或沉淀。同时,对盐酸胍诱导的α-淀粉酶分子重折叠过程的电泳分析也表明,在盐酸胍诱导的稀释复性过程中,酶分子同样是以单分子形式存在于缓冲溶液中,没有任何形式的聚集体形成。

图1 含不同浓度脲的α -淀粉酶复性液的SDS-PAGE图Fig.1 SDS-PAGE images of denatured Bacillus α -amylase in the renaturation solutions containing different concentrations of urea Lanes 1-2 and 4-8:urea concentrations are 1.0,2.0,3.0,4.0,5.0,6.0 and 8.0 mol/L,respectively;lane 3:protein molecular weight marker(from top to bottom,the molecular weights are 200.0,116.0,97.2,66.4 and 44.3 kD,respectively).

图2 含不同浓度脲的α -淀粉酶复性液的Native-PAGE图Fig.2 Native-PAGE images of denatured Bacillus α -amylase in the renaturation solutions containing different concentrations of urea Lanes 1-7:urea concentrations are 0.0,8.0,6.0,4.0,3.0,2.0 and 1.0 mol/L,respectively.
2.2 去折叠和重折叠过程的凝胶排阻色谱分析
图3仅给出了脲变性的α-淀粉酶分子分别在含8.0、4.0、1.0 mol/L脲的复性液中稀释复性的凝胶排阻色谱分析。可以看出,不同复性程度的α-淀粉酶分子都仅有一个主色谱峰,出现在约8.4 min,与天然态酶分子的出峰时间一致,且经Bradford法分析表明该峰为蛋白峰。在不同脲浓度的α-淀粉酶分子变性液中,样品的凝胶排阻色谱分析也出现类似结果。这表明在脲诱导的α-淀粉酶分子的去折叠和重折叠过程中,没有任何形式的α-淀粉酶分子间的聚集体出现。在盐酸胍诱导的变性α-淀粉酶分子的复性过程中,凝胶排阻色谱分析图谱也呈现类似结果。

图3 变性α -淀粉酶在含不同浓度脲的复性液中的体积排阻色谱分析Fig.3 Size-exclusion chromatograms of denatured Bacillus α -amylase in the renaturation solutions containing different concentrations of urea a,b and c:urea concentrations are 8.0,4.0 and 1.0 mol/L,respectively;d:native Bacillus α -amylase.
2.3 去折叠过程的内源荧光光谱和荧光相图
图4给出了脲诱导的α-淀粉酶去折叠过程的内源荧光发射图谱。可以看出,在脲浓度从0.0 mol/L逐渐增加到4.0 mol/L的过程中,随着脲浓度的增加,α-淀粉酶的最大荧光发射峰位置无明显变化,但其荧光发射强度迅速降低(4.0 mol/L脲时的荧光发射强度仅是天然态α-淀粉酶分子荧光发射强度的60%);而在脲浓度从4.0 mol/L继续增加到8.0 mol/L的过程中,随着脲浓度的增加,α-淀粉酶分子的最大荧光发射峰发生明显红移,由334 nm移至约355 nm处,且其荧光发射强度快速升高(8.0 mol/L脲时的荧光发射强度上升到天然态酶的80%)。图4结果表明随着溶液中脲浓度的逐渐增大,α-淀粉酶分子中色氨酸残基逐渐由其分子内部过渡到分子表面,并最终可能完全暴露于溶液中。由此推测,在脲诱导的α-淀粉酶分子变性过程中,随着溶液中脲浓度的逐渐增加,天然态α-淀粉酶分子逐步失去其三维立体结构;当脲浓度约为4.0 mol/L时,溶液中存在一个结构相对稳定的α-淀粉酶分子的部分折叠中间态。
为了进一步证实上述推断,我们同时研究了脲诱导的α-淀粉酶分子去折叠过程的荧光相图。由图5可以看出,脲诱导的该酶分子去折叠过程的荧光相图由两条斜率不同的直线组成,它们相交处的脲浓度约为4.0 mol/L。进一步表明脲诱导的该酶分子的去折叠过程是一个序变过程,在脲浓度约为4.0 mol/L时存在一个部分折叠中间态,其去折叠过程符合“三态模型”。

图4 脲诱导的α -淀粉酶去折叠过程的荧光发射光谱图Fig.4 Fluorescence emission spectra of Bacillus α -amylases during the urea-induced unfolding procedure Urea concentration values in mol/L were indicated for the corresponding emission spectral curves.

图5 脲诱导的α -淀粉酶去折叠过程的荧光相图Fig.5.Fluorescence phase diagram of Bacillus α -amylase during the urea-induced unfolding procedure Urea concentrations values in mol/L were indicated in the vicinity of the corresponding curves.
2.4 重折叠过程的内源荧光光谱和荧光相图
图6给出了脲变性α-淀粉酶分子重折叠过程的内源荧光发射图谱。可以看出,当溶液中脲浓度为8.0 mol/L时,完全变性的该酶分子的最大荧光发射波长接近于自由色氨酸在水溶液中的最大发射波长。随着脲浓度的降低,该酶的最大荧光发射波长无显著变化,但荧光强度迅速下降。当溶液中脲浓度降至4.0 mol/L时,α-淀粉酶的荧光强度降至最低;当溶液中脲浓度从4.0 mol/L进一步降低至0.1 mol/L时,该酶的最大荧光发射峰蓝移至334 nm左右,接近于天然态α-淀粉酶分子的最大荧光发射峰位,且荧光强度也迅速回升。该结果表明,随着溶液中脲浓度的逐渐降低,α-淀粉酶分子由原来松散、色氨酸残基完全暴露于溶液中的结构逐步进行折叠,色氨酸残基逐渐向分子内部过渡,并大部分埋入分子内的非极性区域。当溶液中脲浓度约为4.0 mol/L时,可能存在一个过渡态的、结构相对稳定的部分折叠中间态。
图7给出了脲诱导的α-淀粉酶分子重折叠过程的荧光相图。由图可以看出,脲诱导的α-淀粉酶分子重折叠过程的荧光相图中两条斜率不同的直线相交处脲浓度约为4.0 mol/L。这也进一步证实脲诱导的α-淀粉酶分子重折叠过程是一个序变过程,当溶液中脲浓度约为4.0 mol/L时存在一个α-淀粉酶分子的部分折叠中间态,其重折叠过程符合“三态模型”。

图6 脲诱导的变性α -淀粉酶重折叠过程的荧光发射光谱图Fig.6 Fluorescence emission spectra of denatured Bacillus α -amylase during the urea-induced refolding procedure Urea concentration values in mol/L were indicated for the corresponding emission spectra curves.

图7 脲诱导的变性α -淀粉酶重折叠过程的荧光相图Fig.7 Fluorescence phase diagram of denatured Bacillus α -amylase during the urea-induced refolding procedure Urea concentrations in mol/L were indicated in the vicinity of the corresponding curves.
通过比较脲诱导的α-淀粉酶分子去折叠和重折叠过程的内源荧光光谱和荧光相图,我们推测:脲诱导的α-淀粉酶分子的去折叠和重折叠过程可能是相互可逆的。此外,盐酸胍诱导的α-淀粉酶分子重折叠过程的荧光发射光谱和荧光相图显示:当溶液中盐酸胍浓度从7.0逐渐降低至1.0 mol/L时,α-淀粉酶分子从完全去折叠态逐渐转变成一个稳定的部分折叠中间态;当盐酸胍浓度进一步从1.0 mol/L逐渐减少到0.1 mol/L时,α-淀粉酶分子会进一步从这个部分折叠中间态逐渐折叠转变成近天然构象。这表明,盐酸胍诱导的α-淀粉酶分子的重折叠过程也符合“三态模型”,与它们的去折叠过程相同[18]。因此我们进一步推测,盐酸胍诱导的α-淀粉酶分子的去折叠和重折叠过程也可能是相互可逆的。
蛋白质分子在变性剂诱导变性后,其天然态分子所具有的致密空间结构遭到破坏,原来包埋于分子内部的疏水基团暴露,多肽链处于一种松散状态。随着溶液中变性剂浓度的降低,这些松散的多肽链在热力学驱动下会折叠形成一种熔球态,而熔球态大量的疏水残基暴露在溶剂中会使不同多肽链间的疏水作用力增强,这就有可能驱使中间体之间形成聚集。这里所选择的α-淀粉酶分子中不含二硫键和游离的半胱氨酸残基,这就保证了它们之间不会由于二硫键错配而形成分子聚集体。无论是盐酸胍或脲作为变性剂,在α-淀粉酶的去折叠和重折叠过程中都存在一个稳定的部分折叠中间态,即熔球态。但通过SDS-PAGE,Native-PAGE和高效凝胶排阻层析检测结果表明,α-淀粉酶分子并未形成聚集体。结合本实验室曾对脲诱导的猪胰腺α-淀粉酶分子稀释复性过程的研究结果[15],我们发现这两种不同来源的α-淀粉酶分子所形成的中间态均不会通过疏水作用而产生分子间聚集。
2.5 去折叠过程的荧光猝灭
在蛋白分子的荧光猝灭研究中,对于单个荧光基团的均一溶液体系,其猝灭过程可用Stern-Volmer公式(1)和(2)进行分析[21,22]:
(1)
(2)
其中,F0和F分别表示加入猝灭剂前后蛋白分子的荧光强度,[Q]为溶液中猝灭剂的浓度,K为可被猝灭剂所接近的分子发色基团的Stern-Volmer常数,KSV为猝灭剂的猝灭常数,其倒数1/KSV等于荧光物质50%荧光被猝灭时猝灭剂的浓度,fm为分子中可被猝灭剂接近的发色基团占总荧光发色基团的百分比。
在不同脲浓度下,取猝灭剂丙烯酰胺和KI对芽孢杆菌α-淀粉酶内源荧光猝灭图谱最大发射峰处的荧光强度,如公式(1)和(2)所示,分别以F0/F对[Q]和F0/(F0-F)对1/[Q]进行Stern-Volmer线性分析,从斜率和截距即可获得1/KSV和fm。表1总结了不同脲浓度下的Stern-Volmer线性分析参数KSV和fm。表1结果表明:(1)当溶液中存在猝灭剂丙烯酰胺或KI时,相比天然态酶分子的线性分析参数,诱导剂脲存在时且随脲浓度的增大KSV和fm均增大。这说明,在脲存在时α-淀粉酶分子中的色氨酸残基会逐渐暴露出来,且随着溶液中脲浓度的增大和α-淀粉酶分子去折叠程度的加深,丙烯酰胺和KI对α-淀粉酶的猝灭效率提高,猝灭程度增强;(2)当溶液中不存在脲时,酶分子中有14个色氨酸残基会被丙烯酰胺猝灭,其猝灭率约为83%;而当溶液中脲浓度为4.0和8.0 mol/L时,α-淀粉酶分子中被丙烯酰胺猝灭的色氨酸残基数均为15个,其猝灭率分别约为88%、90%。而该酶分子中共有17个色氨酸残基。这表明当溶液中脲浓度为8.0 mol/L时,该酶分子中仍有丙烯酰胺分子无法接近的区域;(3)当溶液中存在猝灭剂KI时,随着溶液中脲浓度的增大,α-淀粉酶分子中能够被KI猝灭的色氨酸残基数也逐渐增多,猝灭程度逐渐增强。这表明随着溶液中变性剂脲浓度的增加,α-淀粉酶分子的去折叠程度也在加深。
丙烯酰胺为不带电荷的非极性猝灭剂,既可能猝灭蛋白分子表面基团的荧光,也可能猝灭深埋于蛋白分子内部基团的荧光[23,24]。而KI为阴离子猝灭剂,因此,它只能猝灭位于蛋白分子表面或接近于分子表面的极性环境中的荧光基团[24,25]。通过比较表1中同一脲浓度下可被丙烯酰胺和KI猝灭的α-淀粉酶分子中的色氨酸残基数,我们认为KI在研究蛋白质分子构象改变和部分折叠中间体方面效果更好。
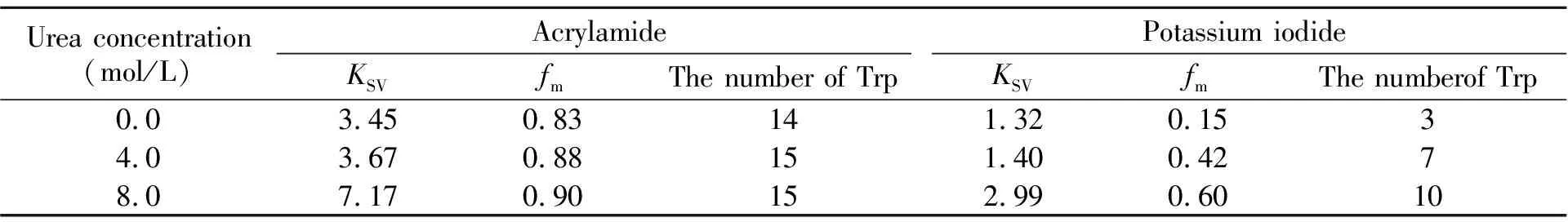
表1 丙烯酰胺和KI对不同浓度脲诱导的变性α -淀粉酶分子内源荧光猝灭的猝灭参数KSV和fm Table 1 Fluorescence quenching parameters KSV and fm of Bacillus α -amylase by acrylamide and KI in the denaturation solutions containing different concentrations of urea
2.6 重折叠过程的荧光猝灭
表2总结了丙烯酰胺和KI对脲诱导的不同程度重折叠α-淀粉酶分子内源荧光猝灭的猝灭参数KSV和fm。从表2可看出,在脲诱导的α-淀粉酶分子的重折叠过程中,随着溶液中脲浓度的降低,参数KSV和fm均逐渐减小,说明随着溶液中脲浓度的降低,丙烯酰胺和碘化钾对酶分子的猝灭效率降低,猝灭程度减弱。该结果表明在脲诱导的酶分子重折叠过程中,随着复性液中脲浓度的逐渐降低,酶分子中的色氨酸残基逐渐被包埋进分子内部。

表2 丙烯酰胺和KI对不同浓度脲诱导的复性α -淀粉酶分子内源荧光猝灭的猝灭参数KSV和fm

图8 不同浓度脲和盐酸胍下α -淀粉酶去折叠过程的残余活性率Fig.8 Residual activity rates of Bacillus α -amylase under different concentrations of urea and guanidine hydrochloride○:urea solution;△:guanidine hydrochloride solution.
比较表1和表2我们发现,在α-淀粉酶去折叠和重折叠过程中,无论猝灭剂为丙烯酰胺或KI,当脲诱导的α-淀粉酶分子变性液和复性液对应的脲浓度相同时,猝灭剂对酶分子的猝灭参数KSV和fm基本一致。进一步证实了前面有关脲诱导α-淀粉酶分子的去折叠和重折叠过程可能是互为可逆过程的推测。此外,对盐酸胍诱导的α-淀粉酶分子重折叠过程的内源荧光猝灭也进行了研究,并将结果与它们的去折叠过程[18]相比较,发现无论猝灭剂为丙烯酰胺或KI,当盐酸胍诱导的α-淀粉酶分子变性液和复性液对应的盐酸胍浓度相同时,猝灭剂对酶分子的猝灭参数KSV和fm基本一致。这也进一步证实了前面有关盐酸胍诱导的α-淀粉酶分子的去折叠和重折叠过程是互为可逆过程的推测。
2.7 去折叠和重折叠过程的生物活性
图8给出了脲和盐酸胍诱导的α-淀粉酶分子去折叠过程中的残余活性率(r)。由图8可知,随着变性剂浓度的增加,α-淀粉酶分子的残余活性均逐渐降低,且在盐酸胍中下降的更快。同时,实验结果表明,脲和盐酸胍诱导的α-淀粉酶分子重折叠过程的复性率图线几乎与其去折叠过程的残余活性率图线重合。这也进一步证实了前面有关脲和盐酸胍诱导的α-淀粉酶分子的去折叠和重折叠过程分别是一个可逆过程的推测。
3 结论
本研究及我们之前的工作表明,在脲和盐酸胍诱导的淀粉液化芽孢杆菌α-淀粉酶分子的去折叠和重折叠过程中,芽孢杆菌α-淀粉酶分子始终以单分子形式存在,且分别在4.0 mol/L脲和1.0 mol/L盐酸胍溶液中存在一个部分折叠中间态,它们的去折叠和重折叠过程均是可逆的三态过程。
