急性骨骼肌钝挫伤修复过程及MyoD、Myogenin变化的实验研究
2016-10-15刘宇肖卫华罗贝贝3陈佩杰
刘宇肖卫华罗贝贝,3陈佩杰
1上海体育学院运动科学学院(上海200438)2沈阳体育学院运动人体科学学院(辽宁沈阳110102)3中国人民解放军第二军医大学细胞生物学教研室(上海200433)
急性骨骼肌钝挫伤修复过程及MyoD、Myogenin变化的实验研究
刘宇1,2肖卫华1罗贝贝1,3陈佩杰1
1上海体育学院运动科学学院(上海200438)2沈阳体育学院运动人体科学学院(辽宁沈阳110102)3中国人民解放军第二军医大学细胞生物学教研室(上海200433)
目的:观察小鼠急性骨骼肌钝挫伤后骨骼肌动态修复过程,探讨伤后MyoD和Myogenin的作用。方法:以雄性C57BL/6小鼠为研究对象,制作腓肠肌钝挫伤模型,分为正常对照组和损伤后12 h、1 d、3 d、5 d、7 d、14 d组。经HE染色和Masson三色染色观察骨骼肌钝挫伤后再生和纤维化瘢痕愈合过程;经免疫蛋白印迹法与免疫组织化学法检测MyoD和Myogenin定量与定位表达变化。结果:(1)骨骼肌钝挫伤后3 d首次观察到新生肌细胞核,伤后5 d开始出现胶原纤维。(2)MyoD伤后1 d表达至高峰,随后下降,伤后14 d再次表达至第2高峰;MyoD阳性细胞核由正常肌细胞边缘逐渐迁移至受损骨骼肌周围聚集。(3)Myogenin伤后3 d开始表达至高峰;Myogenin阳性细胞核伤后3 d首次出现在新生成肌细胞核上,伤后5 d在新生肌管中表达,伤后7 d逐渐迁移至新生肌细胞边缘表达。结论:骨骼肌急性钝挫伤后MyoD和Myogenin表达具有时间规律性,新生肌纤维和纤维化共同完成骨骼肌钝挫伤后的愈合过程。
骨骼肌;钝挫伤;MyoD;Myogenin
流行病学调查显示骨骼肌损伤是运动医学领域的主要病种之一,骨骼肌伤后修复自然成为研究的热点问题。骨骼肌损伤后,肌膜破坏和变性,处于安静状态的肌卫星细胞被激活、增殖和分化,促使肌纤维再生。目前骨骼肌伤后修复过程的研究主要集中在运动性骨骼肌微损伤、撕裂伤、药物注射弥漫性损伤、冻伤和挤压综合征等方面,而对于骨骼肌常见的急性钝挫伤[1,2]的研究却较少。骨骼肌再生关键因子——肌卫星细胞,它的活化、增殖和分化主要依靠骨骼肌特异性转录因子MyoD和Myogenin的调节[3]。MyoD和Myogenin是胚胎和新生儿阶段骨骼肌形成的重要蛋白因子,并且在肌肉再生过程中也发挥重要作用[4]。MyoD在活化的肌卫星细胞里表达[5],Myogenin在胚胎期与肌纤维的形成有关,也可能参与成肌细胞的分化,特别是成肌细胞融合成肌管的阶段[6]。早有报道,MyoD和Myogenin分别参与成肌前体细胞的增殖和分化[7]。本研究采用骨骼肌急性钝挫伤模型,通过HE染色和Masson染色从形态学角度观察小鼠骨骼肌钝挫伤后再生修复和瘢痕愈合过程;通过免疫蛋白印迹法和免疫组织化学法分别从时间变化和空间分布角度探讨生肌调节因子MyoD、Myogenin在骨骼肌急性钝挫伤后的作用,进一步加深对骨骼肌钝挫伤后动态修复过程的理解。
1 材料和方法
1.1实验材料
1.1.1实验动物和分组
8~10周龄健康雄性C57BL/6小鼠56只,体重18. 2~22.9 g,购自第二军医大学实验动物中心,SYXK(沪)2013-0016。常规分笼饲养,每笼8只。饲养环境为21~25℃,湿度40%~50%,12 h光照︰12 h黑暗,自由饮食。随机选取8只作为正常对照组(C组),余下进行骨骼肌钝挫伤处置,分为伤后12 h、1 d、3 d、5 d、7 d、14 d组。
1.1.2骨骼肌钝挫伤模型
采用简便可重复性的骨骼肌钝挫伤造模方法[8,9],略有改动。小鼠行2.5%戊巴比妥钠腹腔注射麻醉后,固定于膝关节伸直0°,踝关节背伸90°位,一质量16.8 g、直径15.9 mm的实心不锈钢钢珠置于一透明管道顶端(高100 cm,内径16.0 mm)释放后垂直击中一打击装置,打击装置底端撞击小鼠双侧腓肠肌肌腹中段(打击面积28.26 mm2),伤后皮肤完整,无胫腓骨骨折,解剖证实损伤率100%。
1.1.3动物取材与称重
小鼠麻醉下颈椎脱位致死,迅速取双侧受损腓肠肌,对照组取相同部位腓肠肌,4℃生理盐水漂洗,滤纸吸干称重,其中每组右侧腓肠肌制作石蜡标本行组织形态学检测,左侧腓肠肌置于液氮中待行免疫蛋白印迹检测(n=8)。
1.2实验方法
1.2.1体重与肌肉湿重
用肌肉重量/体重来反映肌肉湿重的相对变化。
1.2.2骨骼肌组织HE染色
骨骼肌经4%多聚甲醛固定24小时后,石蜡包埋,于腓肠肌肌腹中段处横切3~4 μm厚的连续薄片,切片脱蜡复水,苏木精染色,1%盐酸-酒精分化,伊红染色,梯度酒精脱水,二甲苯透明,中性树胶封片。当肌细胞核从中间迁移到肌纤维边缘时,肌细胞成熟。将细胞核位于肌细胞中央的肌纤维作为新生未成熟的再生肌纤维。在HE染色中,计算20个随机视野(4张片子×5个视野)中再生肌纤维占整个肌纤维的比例。
1.2.3骨骼肌组织Masson染色
切片脱蜡复水,铁苏木素染色,酸性乙醇分化,氨水返蓝,丽春红品红染色,乙酸溶液洗,磷钼酸分化,梯度酒精脱水,二甲苯透明,中性树胶封片。Masson三色染色后肌纤维呈红色,胶原纤维成蓝色(苯胺蓝),主要用来区分肌纤维和胶原纤维,反映骨骼肌纤维化程度。在Masson染色中,计算20个随机视野(4张片子×5个视野)中胶原纤维占整个肌纤维的比例。
1.2.4骨骼肌组织免疫组化实验
制作常规石蜡切片脱蜡至水;柠檬酸三钠缓冲液(pH=6.0),抗原修复121℃,3 min;3%过氧化氢室温孵育15 min;血清室温封闭30 min;分别滴加一抗MyoD(兔抗小鼠1︰50,SAB4501947,Sigma公司)、Myogenin(兔抗小鼠1︰200,ab124800,abcam公司)湿盒4℃孵育过夜;滴加HRP标记的二抗(羊抗兔IgG,Jacskon公司)湿盒37℃孵育30 min;DAB室温显色;苏木精复染;常规脱水透明封片;PBS代替一抗做阴性对照;Olympus显微镜观察拍照。
1.2.5骨骼肌组织免疫蛋白印迹实验
从-80°冰箱中取出组织,切取80 g移入Ep管中,加入预冷蛋白裂解液,超声匀浆器低温匀浆;4℃离心机12000 rpm离心5 min,取上清液;BCA法测定每个蛋白样本浓度;SDS-PAGE电泳,5%浓缩胶,80 V恒压电泳30 min,12%分离胶,120 V恒压电泳90 min后转至PVDF膜上;将PVDF膜于5%脱脂牛奶(TBST)中室温封闭1 h;分别加入一抗MyoD(兔抗小鼠1︰200,SC304,Santa Cruz公司)、Myogenin(1︰1000)、GAPDH(兔抗小鼠1︰800,CST公司),4°过夜,TBST洗膜3次,加入HRP标记二抗(1︰3000,CST公司)室温孵育1小时,ECL发光法检测蛋白条带,采用Image J分析软件测定条带积分光密度值。
1.2.6实验结果统计处理方法
实验数据采用SPSS17.0软件处理,结果以均数±标准差(x¯±s)表示。腓肠肌湿重比、再生肌纤维和胶原纤维占总肌纤维比率采用卡方检验;MyoD和Myogenin蛋白水平比较采用One-way ANOVA和Tukey事后检验,以P<0.05为差异具有统计学意义。
2 结果
2.1骨骼肌钝挫伤后宏观表现
小鼠钝挫伤后,损伤部位即刻充血、水肿,麻醉苏醒后可见伤侧肢体跛行严重。这些病理体征1 d后逐渐恢复正常。与C组相比,伤后12 h、1 d腓肠肌相对湿重增加,差异有统计学意义(P<0.05和P<0.01;图1)。
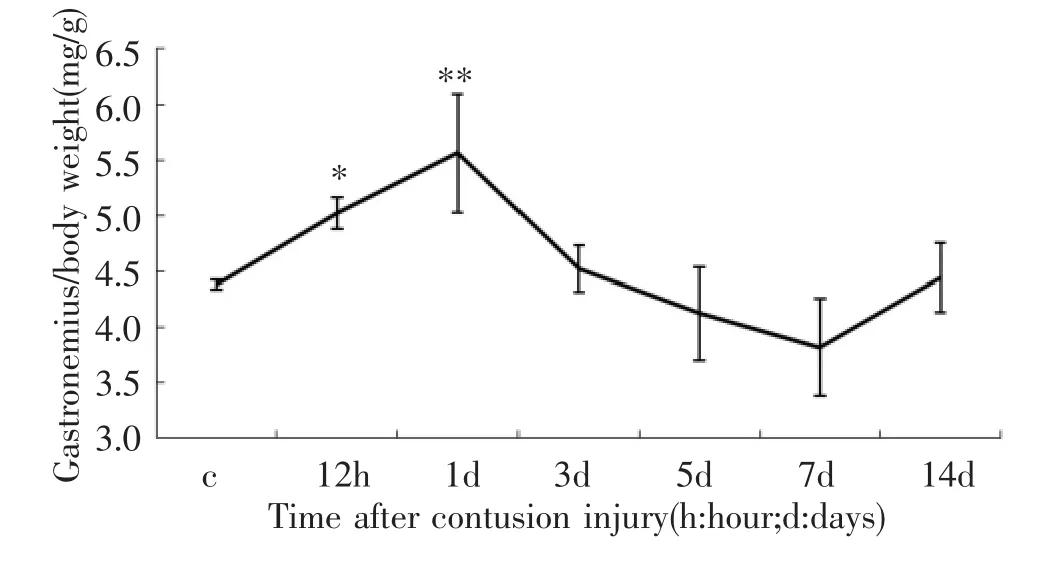
图1 钝挫伤后腓肠肌相对湿重变化
2.2骨骼肌钝挫伤后不同时间点HE染色
HE染色结果显示,钝挫伤后12 h,肌外膜完整性破坏、广泛出血、细胞间质水肿,血管周围大量炎性细胞渗出,损伤肌细胞变圆肥大,严重者可见肌纤维断裂。伤后1 d,炎性细胞继续渗出并迁移至挫伤部位发挥吞噬作用。肌细胞变性、坏死、细胞核消失,大部分肌细胞胞浆均质化,胞浆伊红淡染。伤后3 d,挫伤部坏死肌细胞及组织碎片逐渐被机体炎性细胞清除,出现大量新生的大小形态不一的成肌细胞,新生细胞核位于细胞中央。伤后5 d,成肌细胞进一步增殖分化,肌丝形成,体积逐渐增大,大量成肌细胞融合形成单核或多核肌小管。伤后7 d至14 d,一方面,在损伤部位,多核肌小管数量进一步增加,体积增大,细胞核逐渐从细胞中央迁移至细胞边缘,分化为成熟肌细胞;另一方面,成纤维细胞数量逐渐增多,形成结缔组织,纤维化增加(图2 A~G)。与伤后3 d相比,伤后5 d、7 d再生肌纤维占总肌纤维的比例均明显升高,差异有统计学意义(53.5%±7.9%、38.7%±6.8%vs.20.3%±3.6%,P<0. 05;图2 H)。

图2 骨骼肌钝挫伤后HE染色(×400)
2.3骨骼肌钝挫伤后不同时间点Masson染色
伤后5 d,少量蓝色胶原纤维出现,包绕于新生肌细胞肌间膜周围,损伤区结缔组织面积随损伤时间推移而逐渐增多,骨骼肌完全断裂处依靠纤维瘢痕愈合。伤后各时间点胶原纤维占总肌纤维的比例分别为:伤后5 d(1.5±0.9%)、7 d(2.9±1.4%)、14 d(6.4±3. 2%),各组间差异均有统计学意义(P<0.05;图3)。
2.4骨骼肌钝挫伤后不同时间点MyoD、Myogenin免疫蛋白印迹结果
MyoD和Myogenin的western blot检测结果显示,与对照组比较,伤后1 d MyoD蛋白水平升高至峰值(0. 94±0.12 vs.0.61±0.05,P<0.01),然后开始下降至正常水平,至伤后14 d再次攀升至第2峰值(0.99±0. 11)。伤后12 h至1 d,与对照组比较,Myogenin蛋白水平没有变化,伤后3 d,Myogenin蛋白水平迅速增加至峰值(1.04±0.06 vs.0.08±0.03,P<0.01),伤后5 d,Myogenin蛋白水平开始下降,但仍高于对照组(0.36± 0.1,P<0.05),至伤后14 d恢复到正常水平(图4)。
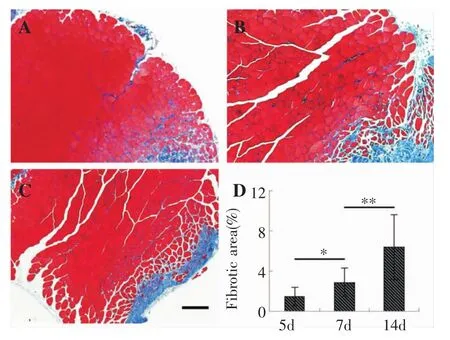
图3 骨骼肌钝挫伤后Masson三色染色结果(×40)
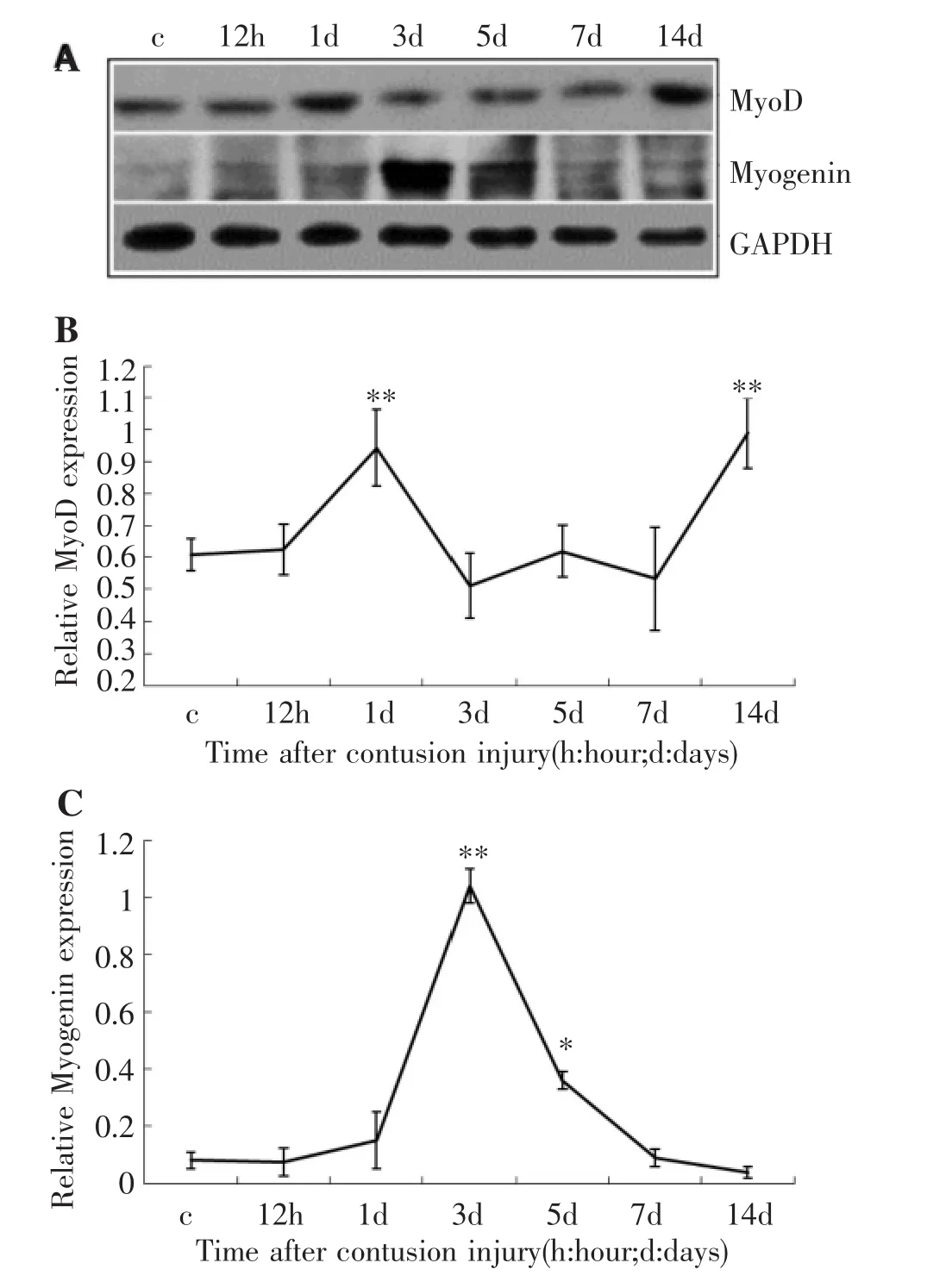
图4 骨骼肌钝挫伤后MyoD、Myogenin蛋白水平动态变化
2.5骨骼肌钝挫伤后不同时间点MyoD、Myogenin免疫组织化学结果
MyoD和Myogenin免疫反应阳性均呈棕黄色,定位表达于细胞核。正常对照组,少量MyoD阳性细胞核位于肌细胞边缘(图5A),伤后12 h,MyoD阳性细胞核主要在细胞外基质中表达(图5B),伤后1 d,大量MyoD阳性细胞核逐渐迁移、聚集于受损骨骼肌纤维周围(图5C),伤后3 d、5 d、7 d仅有散在几个MyoD阳性细胞核位于新生肌细胞周围,伤后14 d,大量MyoD阳性细胞核位于肌细胞边缘。正常对照组、伤后12 h、1 d和14 d均未观察到Myogenin的阳性表达,伤后3 d,出现大量Myogenin阳性细胞核,表达于新生成肌细胞核上(图6A),伤后5 d,Myogenin阳性细胞核主要在新生肌管中表达(图6B),伤后7 d,逐渐迁移至新生肌细胞边缘(图6C)。
3 讨论
3.1骨骼肌钝挫伤修复过程的形态学特征分析
体育运动中最常见的接触性损伤——钝挫伤,是在急性、强大压缩力的作用下发生的一种非侵入性损伤。本研究所采用的模型能够高度模拟这种闭合性损伤,可引起受损骨骼肌红细胞渗出、水肿、肌纤维断裂,大量炎性细胞渗出,肌卫星细胞激活,随后骨骼肌再生[10]。本实验以0.19 J的动能打击小鼠腓肠肌,伤后12 h至1 d可见受损部位肿胀、出血,患肢跛行,伤后3 d症状消失,这与腓肠肌相对湿重变化趋势相一致,与对照组比较,伤后12 h和1 d肌肉湿重分别增加了14.6%和26.9%,损伤3d后腓肠肌相对湿重恢复正常,提示本研究可诱导小鼠腓肠肌钝挫伤后再生修复模型。急性骨骼肌伤后修复是一个非完整性的功能修复,可分为三个阶段:损伤期、修复期和塑形期[11,12],三个过程紧密相连并有重叠时相[13]。本研究HE染色显示,伤后1 d损伤期内,骨骼肌超微结构和周围血管广泛破坏,导致肌肉内血肿形成,激发机体自身免疫机制,释放炎性细胞吞噬坏死肌纤维,随后进入伤后修复期。伤后3 d,开始出现大量新生成肌细胞,修复程度取决于肌肉前体细胞的激活、增殖以及分化形成多核的肌纤维,至伤后14 d,逐渐融合形成多核肌小管,最终转变为成熟肌细胞,然而,在骨骼肌再生修复过程中也伴随着纤维化的形成[14]。Masson三色染色观察到,在骨骼肌进行再生的同时,蓝染的胶原纤维从伤后5 d开始出现,并包绕在新生成肌细胞周围,至伤后14 d达到峰值,此时,新生肌纤维和纤维结缔组织形成微型肌—腱联合[15,16]。以上结果提示,再生肌纤维和瘢痕结缔组织二者共同完成骨骼肌钝挫伤后的组织塑形过程,而究竟哪种修复手段占优势,这可能与骨骼肌损伤类型及其周围神经血管的损伤程度有关[17]。
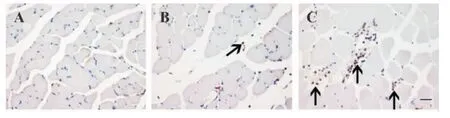
图5 骨骼肌钝挫伤后MyoD免疫组织化学染色结果(×400)

图6 骨骼肌钝挫伤后Myogenin免疫组织化学染色结果(×400)
3.2骨骼肌钝挫伤修复过程中MyoD、Myogenin的时空变化
本研究通过检测肌卫星细胞增殖和分化的标记物MyoD和Myogenin的分布和时间变化来研究骨骼肌急性钝挫伤后组织修复过程的时空特点。MyoD可以促使静止的肌卫星细胞活化,快速进入细胞周期“S”期,而MyoD基因敲除小鼠生肌前体细胞增殖能力减弱,肌肉再生不完全[18]。Myogenin在骨骼肌伤后修复尤其是最终肌细胞新生过程中起着至关重要的作用。有研究指出,损伤后,机体能够快速诱导受损肌肉MyoD mRNA表达并上调其蛋白水平,即肌肉前体细胞开始表达MyoD[19]。在本研究中,钝挫伤后12 h,MyoD蛋白水平未见明显增加,伤后1 d迅速增至第1个峰值,然后开始迅速下降,至伤后5 d逐渐恢复至正常水平。有研究显示,大负荷力竭运动、离心运动后,MyoD水平也出现相似的表达趋势,但是峰值出现的时间不同,这可能与损伤部位、损伤类型和损伤程度不同有关[20,21]。有报道显示处于激活增殖状态的肌卫星细胞从细胞周期撤退是其分化为成肌细胞的必经步骤,Zammit等的研究显示随着细胞周期的结束MyoD表达也消失[22]。本研究结果提示,MyoD蛋白表达开始下降时,伤后骨骼肌便由损伤阶段进入修复阶段,肌卫星细胞从增殖状态开始转变为分化状态,准备形成成肌细胞。其可能机制是,伤后3d,血管内皮细胞或者单核巨噬细胞分泌大量一氧化氮,抑制MyoD表达,促进Myogenin表达[23]。
伤后12 h,MyoD蛋白水平虽然未有变化,但是免疫组织化学结果显示,伤后12 h,MyoD由正常肌细胞边缘逐渐转移至细胞外基质中阳性表达,伤后1 d,MyoD阳性细胞核围绕受损骨骼肌细胞高度表达,提示肌卫星细胞在受损肌纤维残留的基板处开始增殖,与Srikuea等的观测结果相一致[24]。再者,本研究中MyoD蛋白水平在伤后14 d又迅速升高至最大值,呈现“双峰”特征。MyoD蛋白水平迅速降低而又反弹升高的现象有过相关报道[25]。至于MyoD在再增加阶段的作用,有学者指出MyoD水平的上调发生在失神经肌肉[26]和完好的老年肌组织[27]。Launay研究显示,失神经支配的肌肉组织中MyoD蛋白水平在伤后8 d再一次升高,表明此阶段MyoD可能在神经肌肉接点形成中发挥作用[28]。MyoD在骨骼肌恢复后期阶段的确切作用还不得而知,在本研究中,骨骼肌伤后再生后期阶段MyoD蛋白水平降低后再升高是否也参与神经肌肉接点处运动神经纤维的功能恢复,还有待本课题组的后续研究。
有报道显示Myogenin参与肌卫星细胞的分化,尤其是成肌细胞融合形成肌管的过程[29]。体外研究显示当Myogenin转录到达峰值时,肌管形成,出现肌球蛋白,随后,Myogenin开始迅速下降。本研究中,WB结果显示Myogenin蛋白表达的时间变化为,伤后12 h、1 d,Myogenin蛋白水平未有明显变化,伤后3 d到达峰值,随后逐渐下降至正常水平,并且Myogenin峰值出现时间与MyoD蛋白水平迅速下降时间相吻合,再一次证明肌卫星细胞由增殖阶段进入分化阶段。Myogenin蛋白水平迅速增多可能与巨噬细胞功能有关,研究证实,巨噬细胞可促进肌肉前体细胞“逃离”细胞凋亡,协助肌卫星细胞促进肌肉成长,并且通过与粘附分子结合更大程度上促进成肌细胞的分化[30]。
另外,免疫组织化学染色观察发现,伤后3 d,大量Myogenin阳性细胞核与新生成肌细胞核共表达,并且首次观测到含有两个或两个以上细胞核的再生肌细胞(肌管),伤后5 d,肌管开始广泛形成,同时,Myogenin转移至肌管中表达,随损伤时间的增加逐渐迁移到新生肌细胞边缘,至伤后14 d,Myogenin恢复至正常水平,检测不到,说明肌卫星细胞分化完全,重新回复到静息状态,完成骨骼肌再生塑形过程。
4 结论
急性骨骼肌钝挫伤后,新生肌纤维和纤维化瘢痕愈合共同完成修复过程。MyoD和Myogenin作为肌卫星细胞增殖和分化的标志物,二者参与挫伤后的修复过程,具有一定时空特点。MyoD在骨骼肌钝挫伤后再生后期阶段的确切作用,还有待进一步研究。
[1]Counsel P,Breidahl W.Muscle injuries of the lower leg[J]. Semin Musculoskelet Radiol,2010,14(2):162-175.
[2]Turner NJ,Badylak SF.Regeneration of skeletal muscle[J]. Cell Tissue Res.2012,347(3):759-74.
[3]Huard J,Li Y,Fu FH.Muscle injuries and repair:current trends in research[J].Journal of Bone&Joint Surgery American Volume,2002,84(5):822-832.
[4]Marsh DR,Criswell DS,Carson JA,et al.Myogenic regulatory factors during regeneration of skeletal muscle in young,adult,and old rats[J].Journal of Applied Physiology,1997,83(4):1270-1275.
[5]So-Ichiro F,Masahiko Y,Hiroki K,et al.Hesr1 and Hesr3 are essential to generate undifferentiated quiescent satellite cells and to maintain satellite cell numbers[J].Development,2011,138(21):4609-4619.
[6]Knapp JR,Davie JA,Meadows E,et al.Loss of myogenin in postnatal life leads to normal skeletal muscle but reduced body size[J].Development,2006,133(4):601-610.
[7]曾缨,张成,刘克玄,等.成肌调节因子MyoD与myogenin在肌肉损伤修复过程的动态变化[J].南方医科大学学报,2004,24(5):542-545.
[8]Wright T,Opolon P,Appell HJ,et al.Treatment of muscle injuriesbylocaladministrationofautologousconditioned serum:animal experiments using a muscle contusion model[J]. Int J Sports Med,2004,25(8):582-7.
[9]Channarong K,Jacques M,George S,et al.Development of approaches to improve the healing following muscle contusion[J].Cell Transplantation,1998,7(6):585-598.
[10]Nozaki M,Li Y,Zhu J,et al.Improved Muscle Healing After Contusion Injury by the Inhibitory Effect of Suramin on Myostatin,a Negative Regulator of Muscle Growth[J].Am J Sports Med,2008,36(12):2354-2362.
[11]Jarvinen TA,Jarvinen M,Kalimo H.Regeneration of injured skeletal muscle after the injury[J].Muscles Ligaments Tendons,2014,24,3(4):337-345.
[12]肖卫华,陈佩杰,刘宇.巨噬细胞在骨骼肌急性损伤修复中的作用研究进展[J].中国运动医学杂志,2014,33(3):269-274.
[13]刘宇,陈佩杰,肖卫华.中性粒细胞与骨骼肌损伤修复[J].沈阳体育学院学报,2014,33(3):92-95.
[14]Takeuchi K,Hatade T,Wakamiya S,et al.Heat stress promotes skeletal muscle regeneration after crush injury in rats[J].Acta Histochemica,2014,116(2):327-334.
[15]张健,陈世益,李云霞,等.黄芪皂甙、丹参酮ⅡA注射液对大鼠骨骼肌急性钝挫伤后骨骼肌组织形态的影响[J].中国运动医学杂志,2011,30(3):270-274.
[16]Jarvinen TA,Jarvinen TL,Kaariainen M,et al.Muscle injuries:biology and treatment[J].Am J Sports Med,2005,33(5):745-764.
[17]Turner NJ,Badylak SF.Regeneration of skeletal muscle[J]. Cell&Tissue Research,2011,347(3):759-774.
[18]Keman Zhang,Marian L.Harter.Activation of Cdc6 by MyoD is associated with the expansion of quiescent myogenic satellite cells.[J].J Cell Biol,2010,188(1):39-48.
[19]Legerlotz,Kirsten,Smith,Heather K.Role of MyoD in denervated,disused,and exercised muscle[J].Muscle&Nerve,2008,38(3):1087–1100.
[20]潘同斌,钱福鸿,韩天翼,等.大负荷运动后不同时相大鼠骨骼肌成肌调节因子MyoD、myogenin表达的变化[J].中国运动医学杂志,2011,30(10):926-930.
[21]Imaoka Y,Kawai M,Mori F,et al.Effect of eccentric contraction on satellite cell activation in human vastus lateralis muscle[J].J Physiol Sci.2015 Jun 27.
[22]Zammit PS,Golding JP,Yosuke N,et al.Muscle satellite cells adopt divergent fates:a mechanism for self-renewal[J]?J Cell Biology,2004,166(3):347-357.
[23]Sakurai T,Kashimura O,Kano Y,et al.Role of nitric oxide in muscle regeneration following eccentric muscle contractions in rat skeletal muscle[J].J Physiol Sci,2013,63(4):263-270.
[24]Srikuea R,Pholpramool C,Kitiyanant Y,et al.Satellite cell activity in muscle regeneration after contusion in rats[J].Clin Exp Pharmacol Physiol,2010,37(11):1078–1086.
[25]Hatade T,Takeuchi K,Fujita N,et al.Effect of heat stress soon after muscle injury on the expression of MyoD and myogenin during regeneration process[J].J Musculoskelet Neuronal Interact,2014 Sep;14(3):325-33.
[26]Russo TL,Peviani SM,Durigan JL Q,et al.Stretching and electrical stimulation reduce the accumulation of MyoD,myostatin and atrogin-1 in denervated rat skeletal muscle[J]. J Muscle Res Cell Motil,2010,31(1):45-57.
[27]Dedkov EI.MyoD and myogenin protein expressionin skeletal muscles of senile rats[J].Cell Tissue Res,2003,311(3):401-416.
[28]Launay T,Armand AS,Charbonnier F,et al.Expression and neural control of myogenic regulatory factor genes during regeneration of mouse soleus[J].J Histochem Cytochem, 2001,49(7):887-899.
[29]Knapp JR,Davie JK,Myer A,et al.Loss of myogenin in postnatal life leads to normal skeletal muscle but reduced body size[J].Development,2006,133(4):601-610.
[30]Takagi R.Influence of icing on muscle regeneration after crush injury to skeletal muscles in rats[J].J Appl Physiol,2011,110(2):382-388.
The Role of MyoD and Myogenin in the Healing Process of Acute Skeletal Muscle Contusion
Liu Yu1,2,Xiao Weihua1,Luo Beibei1,3,Chen Peijie1
1 College of Exercise and Sports Science,Shanghai University of Sport,Shanghai,China 200438 2 College of Exercise and Sport Science,Shenyang Sport University,Liaoning,China 110102 3 Department of cell biology,Second Military Medical University,Shanghai,China 200433 Corresponding Author:Chen Peijie,Email:chenpeijie@sus.edu.cn
Objective To observe the repairing process of skeletal muscles after acute contusion and the role of MyoD and myogenin during the process.Methods Acute contusion of gastrocnemius was established in 48 C57BL/6 mice(contusion group).Another 8 C57BL/6 mice were served as control group.Every 8 of the mice in contusion group were respectively sampled 12 hours,1 day,3 days,5 days,7 days and 14 days after the contusion.H.E.staining and Masson trichrome staining were used to observe the muscular regeneration and fibrosis formation process.Western Blotting and immunohistochemistry were applied to detect the changes in the level and expression of MyoD and myogenin.Results(1)Newly born myoblasts appeared 3 days and collagenous fibers appeared 5 days after the contusion.(2)The peak expression of MyoD was observed 1 day and 14 days after the contusion.MyoD-positive myonuclei expressed along the margin of the normal muscle cells,and gradually migrated into the injured fibers.(3)The peak expression of myogenin appeared 3 days after the contusion.Conclusions There is chronological expression of MyoD and myogenin after the acute contusion of skeletal muscles.Newly born centrally nucleated fibers and fibrosis are both involved in the skeletal muscle regeneration after contusion.
skeletal muscle,contusion,MyoD,myogenin
2015.07.01
国家自然科学基金项目(31271273,31300975);辽宁省教育厅科学研究一般项目(L2014465,L2014469);上海体育学院研究生教育创新项目(yjscx2015009)
陈佩杰,Email:chenpeijie@sus.edu.cn
