煤矸石合成沸石及其对碱性品红的吸附性能
2016-10-14尹娜卢新卫
尹娜 卢新卫

摘要:以煤矸石为原料,采用碱熔-水热合成法制备沸石分子筛,并考察了合成沸石分子筛对碱性品红模拟废水的吸附性能。结果表明,合成产物为X型沸石分子筛,晶体呈规则的八面体型,结晶度高;沸石分子筛能有效吸附碱性品红,对碱性品红的吸附率随温度的升高、沸石投加量的增加和吸附时间的延长而增大;随着初始浓度的增大,沸石对碱性品红的吸附量增大;准二级动力学和Freundlich等温吸附模型能更好地描述沸石对碱性品红的吸附行为。
关键词:煤矸石;沸石;碱性品红;吸附
中图分类号:X784文献标识号:A文章编号:1001-4942(2016)09-0098-05
AbstractThe X zeolite was synthesized with coal gangue by the hydrothermal method after alkali fusion. And the removal performance of basic fuchsin solution was investigated by adsorption process on X zeolite. The results showed that the synthesized sample was well crystallized as octahedral shape and the main phase was X zeolite. The basic fuchsin could be effectively adsorbed by the synthesized 13X zeolite, and the fuchsine discoloration ratios increased with the increase of temperature, synthesized sample dosage and contact time. The adsorption capacity of basic fuchsin could be significantly improved by increasing the basic fuchsin concentration. The adsorption process could be well fitted by the pseudo-second-order kinetics and the Freundlich isothermal adsorption model.
KeywordsCoal gangue; Zeolite; Basic fuchsin; Adsorption
煤矸石是煤层开采过程中产生的固体废弃物。大量煤矸石的产生、堆积,会带来严重的环境问题,例如侵占土地、污染土壤和地下水、破坏植被等。目前,煤矸石主要被用作建材原料、燃料、复垦回填材料以及制作陶瓷等,这些都是粗放型的利用方式,对煤矸石的利用率低[1]。煤矸石的主要成分为Al2O3和SiO2,与沸石的化学成分相同,可作为合成沸石分子筛的原料[2]。沸石分子筛是一种结晶硅铝酸盐的水合物,因其具有较大的比表面积、高水热稳定性以及丰富的孔道结构,可作为有效的吸附剂和离子交换剂[3-5]。大量研究表明,沸石分子筛可用来去除水中的重金属离子、净化氨氮、处理含氟废水、去除水体中的有机物等[6-15]。但是由于合成沸石的原料大多价格昂贵,工艺复杂,限制了沸石的大规模合成和应用。以固体废弃物煤矸石为原料合成沸石,可大大降低合成成本,还可达到固废资源化,实现以废治废的目的。
本研究以煤矸石为原料,采用碱熔-水热合成法[2],合成13X型沸石分子筛,并以碱性品红模拟废水为目标物,研究了合成沸石分子筛对碱性品红的吸附能力。
1材料与方法
1.1实验材料及仪器
试验用煤矸石取自陕西省韩城市下峪口煤矿,其SiO2和Al2O3的含量分别为32.85%和17.00%,烧失量为19.02%。碱性品红为分析纯,购自天津三环化学有限公司;盐酸,优级纯,购自国药集团化学试剂有限公司;氢氧化钠,分析纯,购自天津化学厂;超纯水,自制。
全自动X射线衍射仪,日本理学公司生产,D/Max2550VB+/PC,用于产物晶相分析;台式扫描电子显微镜,日立公司生产,TM3030,可鉴定样品表面形貌;紫外-可见分光光度计,北京普析通用仪器有限公司生产,TU-1901。
1.2沸石的合成
煤矸石经破碎、磨细、过300目筛后得到煤矸石粉体。粉体经过焙烧、酸浸等预处理手段以除去煤矸石中的铁、钛等影响合成沸石品质的元素,得到合成用的原料。合成原料于600℃下焙燒3 h,取出后以2.0∶1的烧碱/煤矸石质量比混合均匀,于700℃下碱熔2 h,取出磨细,以6 mL/g的液固比加水混合均匀,置于磁力搅拌器上60℃下搅拌2 h,离心取上清液,按照一定的Si/Al比添加适量硅源,室温下搅拌陈化6 h后,移入水热合成反应釜中,65℃预晶化3 h,105℃晶化12 h。产物经水洗涤至中性,干燥,最终制得白色粉末状产物。
1.3实验方法
本实验考察合成沸石用量(0.25~10 g/L)、吸附时间(10~720 min)、吸附温度(20~40℃)以及初始浓度(30~200 mg/L)等条件下合成沸石对碱性品红的吸附性能。具体操作为:在一定浓度的碱性品红溶液中,加入一定量合成沸石,置于振荡器上,一定温度下振荡一定时间后取出,离心,得到上清液,于544 nm波长处测定上清液中碱性品红的含量,计算废水中碱性品红的去除率和吸附量。计算方法[13,16]如下:
式中: Q为t时刻沸石对碱性品红的吸附量(mg/g),C0和Ct分别为初始和t时刻溶液中碱性品红浓度,V为溶液体积(L),m为沸石投加量(g)。
2结果与分析
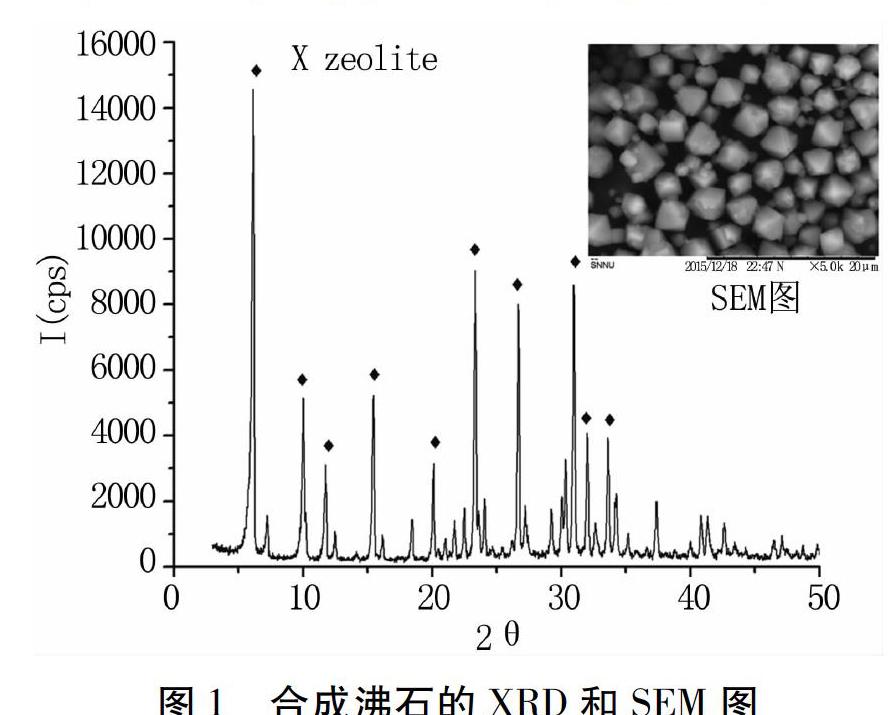
2.1合成沸石表征
为合成产物的XRD和SEM图。由XRD分析可知合成产物为X型沸石分子筛,且合成X型沸石的结晶度高。由SEM图可知,合成沸石为规则的八面体型,晶型好,且粒径均匀,结晶完全。表明实验成功合成出13X型沸石分子筛。
2.2沸石投加量对吸附的影响
浓度为50 mg/L碱性品红溶液中,加入一定量的合成沸石,在30℃下振荡300 min,取出测定碱性品红去除率。如图2所示,随着投加量增大,去除率增大,且增大速率逐渐减慢。当沸石投加量大于2.5 g/L时,去除率变化很小,说明此时溶液中的溶质基本被吸附完全。出现这种现象的原因是:溶液中溶质的量一定,开始沸石的投加量较小,吸附位点较少,对碱性品红的吸附能力较弱,随着沸石投加量不断增大,单位沸石投加量对碱性品红的吸附量逐渐减小,在投加量達2.0 g/L时沸石对碱性品红的去除率较高,为92.06%;吸附量较大,达23.02 mg/g。综合考虑,本实验选择沸石投加量为2.0 g/L。
2.3温度对吸附的影响
浓度为50 mg/L碱性品红溶液中,以2.0 g/L的比例加入合成沸石,在一定温度下振荡300 min,取出测定碱性品红去除率。在温度为20、30、40℃时,碱性品红的去除率分别为87.78%,93.28%和95.98%。表明,随着温度升高,碱性品红去除率增加,说明合成沸石吸附碱性品红为吸热反应,增加温度,有利于吸附反应的进行[13]。还可发现,20℃下去除率也可达到87.78%,即较低温度也可达到较好的去除效果。综合考虑选择30℃为吸附温度。
2.4吸附动力学
浓度为50 mg/L碱性品红溶液中,以2.0 g/L的比例加入合成沸石,在30℃下振荡一定时间,取出测定碱性品红去除率。
由图3可知,随着吸附时间的延长,去除率不断增大。开始的60 min内,吸附速率很快,随后逐渐减慢,300 min之后,碱性品红的去除率变化很小,趋于吸附饱和。这可能是因为沸石的吸附位点数量一定,吸附开始时,沸石的吸附位点较多,且溶液中的吸附质和沸石上的吸附质浓度差较大,吸附动力较强,因此吸附速度较快。而随着吸附的进行,不断有吸附质吸附到吸附剂上,沸石的空闲活性吸附位点减少,吸附剂和溶液中的碱性品红浓度差变小,吸附动力减弱,吸附速率降低,逐渐吸附达到饱和,这说明,吸附反应由活性位点数和底物浓度两者共同控制[2,17]。
去除率随时间的变化
吸附动力学研究可以帮助了解吸附作用的机制,得到吸附平衡所需要的时间。
准一级动力学模型:
lg(Qe-Qt)=lgQe-k12.303t(3)
式中:k1(min-1)为准一级吸附速率常数,Qe(mg/g)和Qt(mg/g)分别为平衡时与t时刻吸附剂对吸附质的吸附量。该模型认为吸附过程速率只由活性位点数和底物浓度二者之一决定。
准二级动力学模型:
tQt=1k2Qe2+1Qet (4)
式中:k2[g/(mg·min)]为准二级吸附速率常数,Qe(mg/g)和Qt(mg/g)分别为平衡时与t时刻吸附剂对吸附质的吸附量。该模型认为吸附过程速率由活性位点数和底物浓度同时控制。
准一级动力学模型和准二级动力学模型的模拟结果如图4所示,可知准二级动力学模型较准一级动力学模型能更好地拟合所有数据点,两者的相关系数分别为0.955和1.000,所以准二级动力学模型更符合吸附反应,而由准二级动力学模型得出Qe为23.42 mg/g,与实验结果相近。说明吸附反应由活性位点数和底物浓度两者共同决定,利用准二级动力学模型来估算平衡吸附量是合理的。
和二级动力学(B)特征
2.5等温吸附
一定浓度的碱性品红溶液中,以2.0 g/L的比例加入合成沸石,在一定温度下振荡300 min,取出测定碱性品红去除率。利用等温吸附线模型对平衡吸附数据进行拟合,可以阐释固液相之间的反应机制。常用的模型有两种:Langmuir等温线和Freundlich等温线模型,表达式分别为式(5)和(6)。
CeQe=1KLQm+CeQm (5)
lgQe=lgCen+lgKF (6)
式中:Ce和Qe分别代表吸附平衡时碱性品红的浓度(mg/L)和吸附量(mg/g),Qm为最大吸附量(mg/g),KL为Langmuir吸附常数(L/mg),KF和n都是Freundlich模型常数,其中KF代表与吸附量有关的常数(mg/g),n代表与吸附强度有关的参数。
由图5拟合结果可知,Freundlich方程和Langmuir方程两者拟合后的相关系数分别为0.996和0.987,所以合成沸石对碱性品红的吸附更适合Freundlich等温吸附模型,说明吸附反应不是单分子层的化学吸附,吸附过程较为复杂,是活性位吸附粒子后互相作用的表面吸附过程[18]。
的吸附等温线
根据Langmuir等温吸附模型,合成沸石对碱性品红的最大吸附量为96.15 mg/g。在Freundlich等温吸附模型中1/n为0.495<0.500,所以吸附反应以物理吸附为主且易于进行[18]。
2.6解吸实验
将饱和吸附了碱性品红的沸石样品加入到乙醇溶液中,室温下振荡洗脱4 h,置于马弗炉中300℃焙烧2 h,以除去碱性品红,使沸石得以再生。实验发现,经过一次、两次解吸再生的沸石在最佳的吸附条件下,吸附率分别为91.06%和89.91%,仍然具有很强的吸附能力,可达到很好的吸附效果。结果表明,合成的沸石可以通过解吸再生,实现吸附剂重复利用,降低成本。
3结论
以煤矸石为原料,采用碱熔-水热合成法合成出X型沸石,所得产物结晶度高,沸石呈规则八面体状,晶型完整。合成沸石在投加量为2.0 g/L,吸附时间为300 min,温度为30℃的条件下,对50 mg/L碱性品红溶液的吸附效果很好,去除率达92.06%,吸附量为23.02 mg/g。合成沸石吸附碱性品红的反应为吸热反应,升温有利于反应的进行,且吸附反应更符合Freundlich吸附等温线和准二级动力学模型,为易于进行的物理吸附过程,且吸附是由活性位点数和碱性品红的浓度两者共同决定。经过两次解吸再生后的沸石,对碱性品红仍具有较强吸附能力,可实现沸石重复利用。所以利用煤矸石合成沸石,不但可以降低其对环境的危害,實现固体废弃物资源化,还可以用来净化环境,达到以废治废的效果。
参考文献:
[1]左万庆, 奥尼斯, 付振娟. 煤矸石的综合利用[J]. 环境与发展, 2014, 26(4): 122-123.
[2]陈建龙, 卢新卫, 张萌萌, 等. 矸石基X型分子筛对Co2+、Cu2+、Cd2+和Cr3+的去除[J]. 环境工程学报, 2014, 8(9): 3625-3632.
[3]Gisvold B, Fllesdal M. Enhanced removal of ammonium by combined nitrification/adsorption in expanded clay aggregate filters [J]. Water Science and Technology, 2000, 41(4/5): 409-416.
[4]Pak D, Chang W, Hong S. Use of natural zeolite to enhance nitrification in bio-filter [J]. Environmental Engineer, 2002, 23(7): 791-798.
[5]胥焕岩, 李平, 李国栋, 等. 粉煤灰合成SOD型沸石及其吸附酸性品红的性能[J]. 北京工业大学学报, 2012, 38(3): 438-442.
[6]张家利, 张翠玲, 党瑞. 沸石在废水处理中的应用研究[J]. 环境科学与管理, 2013, 38(3): 75-79.
[7]金兰淑, 高湘骐, 刘洋, 等. 4A沸石对复合污染水体中 Pb2+、Cu2+和Cd2+的去除[J]. 环境工程学报, 2012, 6(5): 1599-1603.
[8]彭秀达, 张钢, 刘红, 等. 13X分子筛去除水中重金属离子Cr3+的研究[J]. 环境科学与技术, 2013, 36(7): 99-103.
[9]赵桂瑜, 周琪. 沸石吸附去除污水中磷的研究[J]. 水处理技术, 2007, 33(2): 34-37.
[10]张莉荣, 张娜, 杜展明, 等. 煤矸石沸石吸附氨氮废水实验研究[J]. 工业水处理, 2014, 34(7): 45-47.
[11]范春辉, 张颖超, 马宏瑞. 粉煤灰基沸石对亚甲基蓝和Cr(Ⅲ)的共吸附行为——Ⅱ.竞争吸附机制[J]. 环境工程学报, 2014, 8(3): 1025-1028.
[12]刘军奇, 王本红, 吕海亮, 等. 粉煤灰沸石对甲基橙的吸附研究[J]. 山东科技大学学报, 2010, 29(5): 89-94.
[13]翁晴. SOD改性沸石对碱性品红的吸附性能研究[J]. 广州化工, 2014, 39(4): 28-33.
[14]Panic V V, VelickovicS J. Removal of model cationic dye by adsorption onto poly (methacrylicacid)/zeolite hydrogel composites: kinetics, equilibrium study and image analysis [J]. Separation and Purification Technology, 2014, 122(10):384-394.
[15]Hernández-Montoya V, Pérez-Cruz M A, Mendoza-Castillo D I, et al. Competitive adsorption of dyes and heavy metals on zeolitic structures [J].
