黄绿绿僵菌悬乳剂与低剂量阿维菌素对Q型烟粉虱的联合防治作用
2016-10-14李茂业陈德鑫林华峰李世广吴圣勇
李茂业,陈德鑫,2,林华峰,李世广,潘 敬,吴圣勇
黄绿绿僵菌悬乳剂与低剂量阿维菌素对Q型烟粉虱的联合防治作用
李茂业1,陈德鑫1,2,林华峰1,李世广1,潘 敬1,吴圣勇3
(1安徽农业大学植物保护学院,合肥 230036;2中国烟草总公司青州烟草研究所,山东青岛 266001;3中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京100193)
【目的】烟粉虱()是重要的入侵农业害虫,已对众多常规杀虫剂产生了高度抗性。论文针对烟粉虱的高效治理问题,通过室内和田间联合应用昆虫病原真菌与化学农药,评价其是否对烟粉虱防治具有协同增效作用,为烟粉虱的有效防控提供新的途径。【方法】在前期试验已经筛选到一株对Q型烟粉虱毒力较高的黄绿绿僵菌()菌株Mf96基础上,先于实验室条件下采用喷雾法,在3个浓度梯度(1.0×108、1.0×107、1.0×106个孢子/mL)的黄绿绿僵菌(Mf96)分生孢子悬乳剂中添加1.8%阿维菌素WP,分别配制成含0、15、30、45和60 µg·mL-1剂量的1.8%阿维菌素WP溶液,并喷到Q型烟粉虱2龄若虫体表,检测其死亡率。在体视显微镜下记录单位面积内的孢子沉积数量。田间试验中,分别将黄绿绿僵菌Mf96菌株悬乳剂(1.0×108个孢子/mL)和1.8%阿维菌素WP(60 µg·mL-1)单用和混用后喷施于NC95烟草上,评价其对烟粉虱的防治效果。【结果】实验室条件下,Mf96菌株悬乳剂从第4 天到第8 天对“Q型”烟粉虱2龄若虫的LC50从1 376降至183个孢子/mm2。Mf96菌株与阿维菌素(60 µg·mL-1)混合作用7 d后,真菌LC50从378降至46个孢子/mm2。低剂量的阿维菌素对黄绿绿僵菌Mf96菌株的分生孢子和菌丝生长没有影响。不同浓度黄绿绿僵菌(低、中、高)孢子悬乳剂分别与不同浓度阿维菌素(0、15、30、45 和 60 µg·mL-1)复配处理后,Q型烟粉虱2龄若虫有不同僵虫率,其中以阿维菌素30 µg·mL-1与黄绿绿僵菌高浓度悬乳剂复配处理Q型烟粉虱2龄若虫产生的僵虫率最高,达86.8%。对照(悬乳剂基础配方)和单独喷施阿维菌素处理中未见到僵虫。田间喷施真菌孢子悬乳剂、药剂和菌药混剂后5 d和10 d,菌药混用的Q型烟粉虱若虫虫口减退率均最高,分别为53.6%和85.7%;5个随机抽查时间得到校正防效变化趋势与虫口减退率趋势一致,25 d菌药混用的校正防效在所有处理中最高,达88.9%;5个随机抽查时间得到的对照组虫口减退率均为负值。【结论】黄绿绿僵菌Mf96菌株与阿维菌素联合在实验室和田间防治Q型烟粉虱均具有协同增效作用。因此,利用黄绿绿僵菌Mf96分生孢子悬乳剂与低剂量1.8%阿维菌素WP联合防治Q型烟粉虱是一项新的有效措施。
Q型烟粉虱;黄绿绿僵菌;阿维菌素;协同作用;田间效果
0 引言
【研究意义】烟粉虱()是一种世界性超微型入侵农业害虫,其家族中B型和Q型烟粉虱危害最为严重[1]。在中国大部分农业生产中,长期应用化学农药防治烟粉虱致使该虫对市场上常用化学杀虫剂产生严重抗性[2]。自2000年以后,烟粉虱和其他刺吸式害虫已对吡虫啉、毒死蜱等杀虫剂产生较高水平抗性,导致防治效果显著降低,同时,随着化学药剂用量的增加,进一步加大了对环境的污染[3]。阿维菌素是一种兼具胃毒和触杀作用的微生物源杀虫剂,其作用机制为干扰神经生理活动,刺激释放-氨基丁酸,而氨基丁酸对节肢动物的神经传导有抑制作用[4]。随着Q型烟粉虱对阿维菌素的抗性逐渐增强,合理使用这种杀虫剂是延长其使用寿命的关键。将击倒快的低剂量杀虫剂与可持续起效的昆虫病原真菌(白僵菌、绿僵菌等)联合防治烟粉虱是一种新的替换防治策略。【前人研究进展】尽管很多昆虫病原真菌(蜡蚧轮枝菌、拟青霉、白僵菌、绿僵菌)对较多刺吸式害虫有很高的室内毒力,但防治烟粉虱达到预期防治效果的真菌资源依然缺乏[5-7]。在20世纪90年代,大量的昆虫病原真菌对烟粉虱毒力被测定,但死亡率很少高于80%[8]。真菌病原物在田间受环境条件限制较大,早期的田间试验结果很难达到控制烟粉虱的目的[9-10]。有学者研究发现,利用室内生物测定法筛选一株对褐飞虱高毒力的球孢白僵菌菌株,用其油剂孢子液分别结合低剂量(0.5、1.0和2.0 µg·mL-1)吡虫啉共同处理褐飞虱()时,其LC50从1 652个孢子/mm2降到503、135和26个孢子/mm2,表明菌药混用有协同增效作用[11]。Fitzgerald[12]利用球孢白僵菌分别与低剂量噻嗪酮、吡蚜酮、啶虫脒、吡螨胺联合防治草莓花象甲()、长毛草盲蝽()和草莓钉蚜(),结果表明菌药混用有协同增效作用,且对天敌智利小植绥螨()和草蛉()没有影响。【本研究切入点】前期试验已经筛选到两株对Q型烟粉虱毒力较高的黄绿绿僵菌菌株Mf96和Mf82[13]。另外,通过室内毒力测定和田间药效试验,发现1.8%阿维菌素可湿性粉剂(WP)对Q型烟粉虱成虫、2龄若虫和卵毒杀效果最好。目前,黄绿绿僵菌与微生物源杀虫剂阿维菌素有无协同增效作用尚未见报道。【拟解决的关键问题】针对已筛选对Q型烟粉虱高毒力的黄绿绿僵菌Mf96菌株,探究其与低剂量阿维菌素联合控制Q型烟粉虱是否具有协同增效作用。
1 材料与方法
烟粉虱生物测定试验在安徽农业大学植物保护学院完成;田间试验在安徽省农业科学院烟草与玉米研究所试验田完成。
1.1 供试昆虫
供试Q型烟粉虱虫源为2012年5月采自中国农业科学院青州烟草研究所(山东省青岛市)试验田内的烤烟型烟草K326植株上,通过mtDNA COI基因序列测序方法,鉴定其种型为Q型,并在安徽农业大学植物保护学院智能人工气候室内(温度(25±1)℃、光周期L﹕D= 16 h﹕8 h),利用2—3片展开叶的烟草幼苗上(品种为NC95,中国农业科学院青州烟草研究所提供)饲养繁殖2代以上,选择2龄若虫作为供试虫源。
1.2 供试菌株及分生孢子的制备
供试的黄绿绿僵菌Mf96菌株保存于安徽农业大学虫生真菌研究中心(安徽省微生物防治省重点实验室)菌种库。菌种以干燥分生孢子粉与灭菌后的白沙混合保存于-70℃超低温冰箱中。
利用熟糙米、花生壳等材料按比例配制成的培养基固相发酵生产Mf96分生孢子。先将供试菌株接种于含150 mL SDY液体培养基的300 mL锥形瓶里,置于(25±1)℃的光照摇床培养箱中(L﹕D= 12 h﹕12 h)培养3 d,作为发酵种子液,然后将其接种到有发酵培养基的有孔不锈钢托盘中(长×宽×高=50 cm×40 cm×5 cm),置于(25±1)℃的光照培养箱中(L﹕D=12 h﹕12 h)培养10 d,菌丝体充分产孢后,利用真空冷冻干燥器在(30±1)℃条件下对其干燥24 h,再利用收孢器收获分生孢子粉(高孢粉),并进一步利用真空干燥器干燥使湿度小于5%,保存于4℃冰箱,用于所有生测试验的分生孢子萌发率均大于90%。
1.3 供试菌株和阿维菌素对Q型烟粉虱若虫的生物测定
应用1.1方法准备供试Q型烟粉虱2龄若虫,按照林华峰等[14]的方法将Mf96菌株分生孢子粉配置成1.0×108、1.0×107、1.0×106个孢子/mL浓度的悬乳剂各10 mL。同时,向每种浓度的孢子悬乳剂中添加1.8%阿维菌素WP(广西桂林集琦生化有限公司生产),分别配制成含0、15、30、45和60 µg·mL-1剂量的1.8%阿维菌素WP的混合溶液各10 mL。试验共15个组合。利用手动喷雾器对分别有30—40头Q型烟粉虱2龄若虫的烟草叶片均匀喷施混合溶液,用悬乳剂基础配方(载体油、乳化剂和无菌水)作为对照。为了准确评估阿维菌素对Q型烟粉虱2龄若虫的致死效果,其浓度150、300 µg·mL-1的溶液各10 mL也分别用于生测试验。喷施时放置4块盖玻片(20 mm×20 mm)收集孢子,随机镜检5个视野并计数孢子数,以确定每mm2烟粉虱实际接收的孢子数。每个处理重复4次。喷雾后,将处理后的烟草置于(25±1)℃、RH 90%的光照培养箱中(L﹕D=12 h﹕12 h)。每日镜检并记录被Mf96菌株感染死亡的2龄若虫数,计算累积死亡率,在尼康NK-300型立体解剖镜下连续观察7 d。
1.4 田间试验
1.4.1 试验地点及概况 试验设在安徽省农业科学院烟草与玉米研究所试验田(合肥市),烟田土壤中等肥力水平,土质为砂壤土。所选田块地势较平坦,排灌方便。2015年2月30日播种,烟草品种为NC95(中国农业科学院烟草研究所提供),基本苗2 250—2 700株/hm2,按常规进行管理。各小区栽培管理条件一致,烟草长势基本一致。
1.4.2 试验设计及实施方法 供试药剂为黄绿绿僵菌Mf96菌株悬乳剂(1.0×108个孢子/mL)和1.8%阿维菌素WP(60 µg·mL-1)。试验前选取Q型烟粉虱危害程度一致的田块,并划分小区,小区面积100 m2。2种药剂的单用和混用(在1.0×108个孢子/mL的黄绿绿僵菌(Mf96)分生孢子悬乳剂中添加1.8%阿维菌素WP,配制成含60 µg·mL-1剂量的1.8%阿维菌素WP溶液),空白对照只喷清水,共4个处理,每个处理3次重复,共12个小区,随机区组排列,小区间有3.0 m宽的保护行。
1.4.3 施药时间及施药方法 于2015年5月30日下午进行田间施药,烟草当时正值旺长期,也是Q型烟粉虱卵孵化高峰期。施药时采用WBDY-16L型电动担架式喷雾器,喷孔口径1.0 mm。用水量750 kg·hm-2,小区内均匀喷雾,药液主要喷在烟草叶片背面。施药时天气多云,施药时间下午16:00—18:00,气温25—30℃,相对湿度70%—80%,风力3级。药后72 h内未有降雨。
1.4.4 调查及统计方法 施药前,采用5点式取样法,每点2株烟草,每株查3片叶片背面,每小区共调查10株烟草,确定Q型烟粉虱若虫虫口基数。施药后第5、10、15、20和25天,按同样的方法调查,虫口减退率和校正防效计算公式如下:
虫口减退率(%)= [(处理前活虫数-处理后活虫数)/处理前活虫数]×100;
校正防效(%)= [(处理区虫口减退率-对照区虫口减退率)/(1-对照区虫口减退率)]×100。
1.5 数据分析
数据记录和分析参照林华峰等[14]方法,用每天观察的平均活虫与死虫数计算各处理的死亡率,并以Abbott公式计算校正死亡率。
校正死亡率(%)= [(处理组死亡率-对照组死亡率)/(1-对照组死亡率) ]×100。
致死中浓度(LC50)和致死中时(LT50)等处理间各统计量通过方差分析和邓肯式新复极差法检测差异显著性。
采用时间-剂量-死亡率模型[15](简称TDM模型)对Mf96菌株悬乳剂的毒力测定数据进行模拟分析。该方法是将时间和剂量的效应集中到一个模型中,可考察时间、剂量效应的相互作用,从而体现出毒力测定数据的客观性和完整性。
所有计算与模拟过程均使用DPS数据处理系统软件完成。
2 结果
2.1 黄绿绿僵菌与低剂量阿维菌素联合应用对Q型烟粉虱若虫的室内效果
2.1.1 Mf96菌株不同浓度悬乳剂在Q型烟粉虱2龄若虫体表的孢子数 黄绿绿僵菌Mf96菌株分生孢子梯度悬乳剂1.0×108、1.0×107、1.0×106个孢子/mL在Q型烟粉虱2龄若虫体表的孢子数分别为46(41—47)、251(239—268)和1 073(1 043—1 109)个孢子/mm2。处理间虫体沉积的孢子数存在显著性差异(2, 42=1 936.2,<0.01),但不论是孢子液单独处理还是与阿维菌素混配处理内,虫体沉积的孢子数差异不显著(3, 56=2.1,=0.33)。
2.1.2 生物测定中的时间-剂量-死亡率趋势 Q型烟粉虱2龄若虫累计死亡率随孢子浓度或阿维菌素浓度增加和天数的增加而增大(图1)。所有生测试验中时间-剂量-死亡率数据经时间-剂量-死亡率模型生成参数估计值与模型非常匹配(>0.15,同质性测检适合度非常好)。生测结果表明,第4天到第8天菌株悬乳液对Q型烟粉虱2龄若虫的LC50(95%置信区间)从1 376(741—2 293)降到183(138—262)个孢子/mm2。低剂量阿维菌素和菌株复配液处理的LC50(95%置信区间)出现迅速下降的现象,例如,含60 µg·mL-1阿维菌素的孢子液,在相同时段,LC50(95%置信区间)由107(63—175)降到25(11—55)个孢子/mm2(图2)。复配液中含≤30 µg·mL-1阿维菌素处理LC50(95%置信区间)的趋势图部分重叠,所以不能显著降低菌株孢子液的LC50。
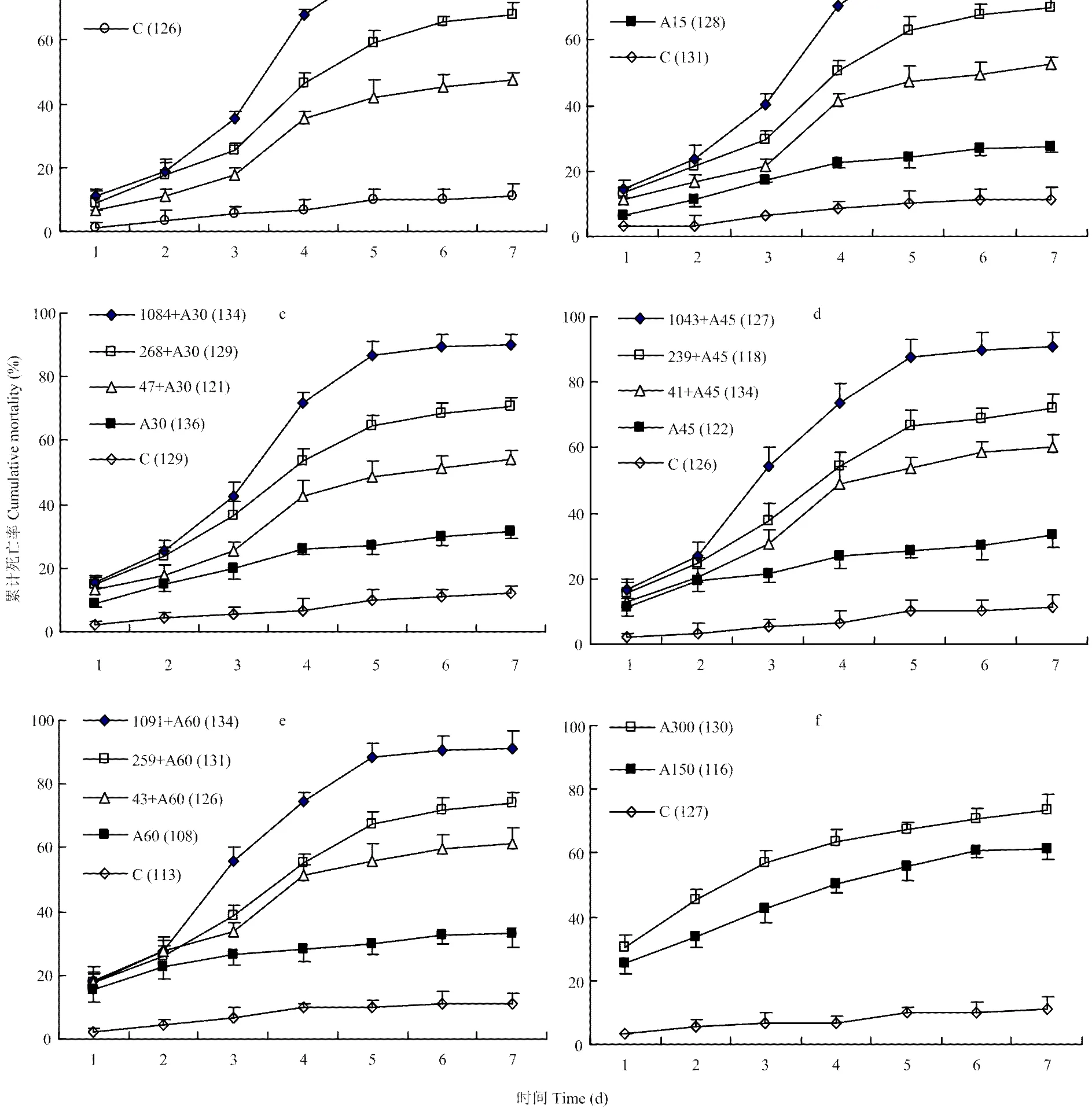
a:喷施不同浓度黄绿绿僵菌Mf96孢子悬乳剂Sprays gradient conidial concentrations of emulsifiable formulation M. flavoviride;b—e:每种浓度Mf96孢子悬乳剂分别与15、30、45和60 µg·mL-1阿维菌素复配喷雾(A15至A60) Fungal sprays containing 15, 30, 45 and 60 µg·mL-1 abamectin (A15 to A60), respectively;f:单独喷含量为150、300 µg·mL-1的阿维菌素Abamectin sprays at 150 and 300 µg·mL-1 (A150 and A300)。真菌浓度梯度为低、中和高(个孢子/mm2),C为对照;误差线为试验重复4次得到,图中括号内为每处理Q型烟粉虱若虫总数Symbols denoted low, median and high concentrations of fungal sprays (number of conidia/mm2) and blank control (C). Error bars: SEM from four replicates (with the total number of treated nymphs of B. tabaci Q biotype given in parentheses)
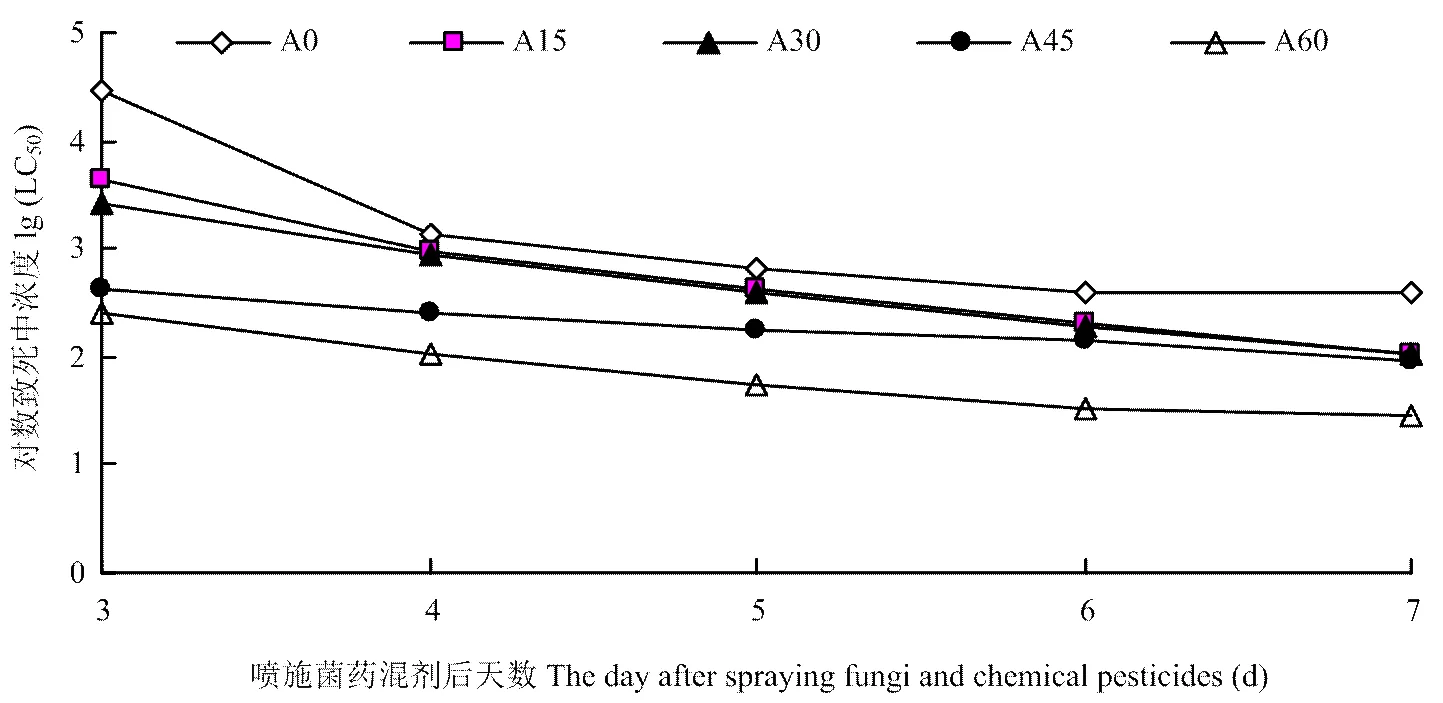
图2 不同浓度黄绿绿僵菌孢子悬乳剂与不同浓度1.8%阿维菌素WP复配处理Q型烟粉虱2龄若虫的对数致死中浓度
2.1.3 菌药联合应用对僵虫率的影响 不同浓度黄绿绿僵菌(1.0×108、1.0×107、1.0×106个孢子/mL)孢子悬乳剂分别与不同浓度阿维菌素(15、30、45 和60 µg·mL-1)复配处理后,Q型烟粉虱2龄若虫有不同僵虫率,其中以阿维菌素30 µg·mL-1与黄绿绿僵菌悬乳剂复配处理Q型烟粉虱2龄若虫产生的僵虫率最高,达86.8%(图3)。加入低剂量阿维菌素的不同浓度孢子悬乳剂产生的僵虫率差异显著。同时,在对照(悬乳剂基础配方)和单独喷施阿维菌素处理中未见僵虫。
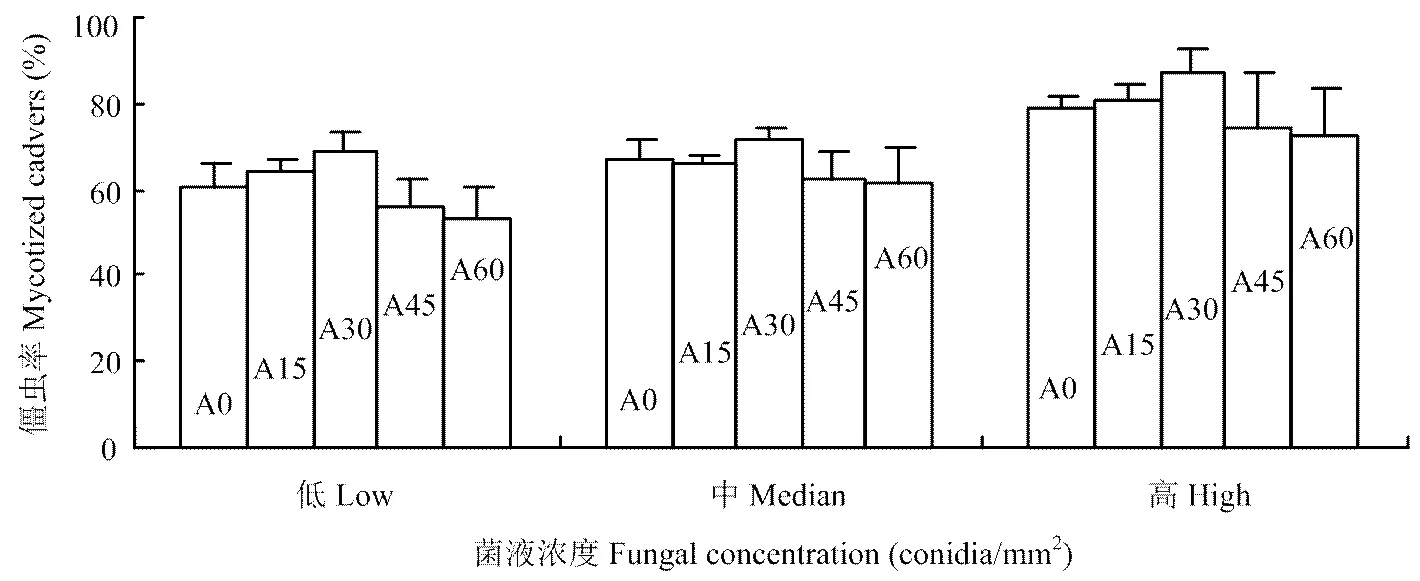
图3 不同浓度黄绿绿僵菌孢子悬乳剂分别与不同浓度1.8%阿维菌素WP复配处理Q型烟粉虱2龄若虫的僵虫率
2.2 黄绿绿僵菌与低剂量阿维菌素联合应用对Q型烟粉虱的田间防治效果
由表1可以看出,田间喷施真菌的孢子悬乳剂、药剂和菌药混剂后5 d和10 d,菌药混用的Q型烟粉虱若虫虫口减退率均最高,分别为53.6%和85.7%,其次是阿维菌素单用,且大于Mf96菌株单用;15、20和25 d,菌药混用的Q型烟粉虱若虫虫口减退率仍然均最高,分别为78.6%、82.1%和84.6%,其次是阿维菌素单用,且均大于Mf96菌株单用;同时,5个随机抽查时间得到校正防效变化趋势与虫口减退率变化趋势一致,菌药混用25 d的Q型烟粉虱若虫校正防效在所有处理中最高,达88.9%;5个随机抽查时间得到的对照虫口减退率均为负值。

表1 真菌的孢子悬乳剂、药剂和菌药混剂防治烟田Q型烟粉虱若虫的小区试验
同列数据后不同字母表示经Duncan多重比较后差异显著(<0.05)Different lowercases followed the values in the same column indicated significant differences according to Duncan’s multiple range test (<0.05)。DR:虫口减退率Decrease rate (%);CE:校正防效Corrected control effect (%);A:Abamectin (60 µg·mL-1)
3 讨论
通过室内生物测定和田间试验,黄绿绿僵菌Mf96菌株表现出对靶标害虫有较高毒力。Filho等[16]研究发现球孢白僵菌在室内和田间均对蚜虫具有较高的毒力,并将该菌株研制成为微生物农药;蒲蛰龙等[17]通过室内生测和林间试验,发现了对传播松材线虫病原的松墨天牛()具有较高毒力的白僵菌菌株,将该菌株研制成为微生物农药,利用无纺布成功将其控制在经济允许水平之下。本研究中,黄绿绿僵菌Mf96菌株室内以1.0×108个孢子/mL 的孢子液接种到Q型烟粉虱2龄若虫体表上,累计校正死亡率达89.5%,LT50为3.65 d。田间以1.0×108个孢子/mL的悬乳剂喷施,对Q型烟粉虱若虫的防效为61.3%,说明该菌株具有开发成微生物农药的潜力。
昆虫病原真菌与低剂量阿维菌素联合防治烟粉虱是一种新的替代防治方法。生物测定试验可以说明浓度和时间效应及两者内在关系,时间-剂量-死亡率模型能明确菌株和药剂单用与复配使用效果的优劣。Jin等[18]分别应用不同浓度未配置剂型的孢子液的绿僵菌Ma456菌株防治褐飞虱3龄若虫,时间-剂量-死亡率模型的第7天和第10天的LC50由731、284个孢子/mm2分别降至386、199个孢子/mm2。同时,得出金龟子绿僵菌与噻嗪酮复配不影响昆虫病原真菌对靶标昆虫的毒力效果;Feng等[11]应用时间-剂量-死亡率模型分析球孢白僵菌与吡虫啉复配防治褐飞虱的效果,结果表明两者之间具有协同增效作用;Zou等[19]将玫烟色拟青霉与4种化学药剂螺虫乙酯(SPI)、啶虫脒(ACE)、吡虫啉(IMI)和噻虫嗪(THI)分别混配防治温室白粉虱,结果表明混配后的玫烟色拟青霉孢子对白粉虱的毒力明显增高,表现出菌药之间的协同增效作用。本试验中,通过该模型分析表明,复配液中含30—60 µg·mL-11.8%阿维菌素WP能显著提高Mf96菌株的杀虫效果或加速其杀虫速度。因此,在田间可以应用60 µg·mL-11.8%阿维菌素WP与Mf96菌株分生孢子悬乳剂复配防治Q型烟粉虱。
昆虫病原真菌不但可以侵染致死烟粉虱成虫、若虫和卵,还具有显著降低雌成虫繁殖能力的潜力。Jin等[20]利用绿僵菌Ma456菌株侵染褐飞虱雌成虫发现被侵染雌成虫的繁殖力显著低于对照处理,同时发现被侵染雌成虫产下卵的孵化率比对照处理降低36%;Li等[21-22]研究黄绿绿僵菌Mf82防治褐飞虱成虫,发现该菌株对雌成虫的毒力大于雄虫,且被侵染的成虫产下的卵仍然能被其侵染,表明黄绿绿僵菌对寄主昆虫种群具有持续控制能力。本研究结果也表明菌药混用对烟粉虱的种群控制具有较长的持效期。
化学农药与昆虫病原真菌混用时,前者的用量比率较为重要。首先考虑的因素是化学农药的浓度不能大于对靶标害虫的亚致死浓度。如果两者混配使用过程中化学农药的量过大,结果无法显示昆虫病原真菌对靶标害虫的控制作用[23]。菌药混用联合防治靶标害虫,药剂的使用浓度应对环境中的天敌不能产生影响[24]。在100 g·kg-1吡虫啉WP商品标签上,建议防治假眼小绿叶蝉()等刺吸式害虫用量为300 g·hm-2。已有研究表明,向含1.0×1010个孢子/mL 的1 L溶液中加入30 g吡虫啉药剂并稀释1 000倍,田间喷雾防治叶蝉等刺吸式害虫的效果最好[25]。本研究中1.8%阿维菌素WP商品标签上,建议防治粉虱、蚜虫等刺吸式害虫用量为2 000 g·hm-2,田间试验采用60 µg·mL-11.8%阿维菌素WP与黄绿绿僵菌Mf96混配防治Q型烟粉虱,防治效果达88.9%,可有效控制烟粉虱的种群。
4 结论
黄绿绿僵菌Mf96与阿维菌素联合防治Q型烟粉虱具有协同增效作用,并且低剂量1.8%阿维菌素WP对Mf96菌株生长的影响较小。因此,黄绿绿僵菌Mf96分生孢子悬乳剂与低剂量1.8%阿维菌素WP联合利用是一项新的防治Q型烟粉虱有效措施。
References:
[1] Batta Y A. Production and testing of novel formulations of the entomopathogenic fungus(Metschinkoff) Sorokin (Deuteromycotina: Hyphomycetes)., 2003, 22(2): 415-422.
[2] Guo L T, Xie W, Wang S L, Wu Q J, Li R M, Yang N N, Yang X, Pan H P, Zhang Y J. Detoxification enzymes ofB and Q: biochemical characteristics and gene expression profiles., 2015, 70(10): 1588-1594.
[3] Yuan LZ, Wang SL, Zhou JC, DU Y Z, ZHANG Y J, WANG J J. Status of insecticide resistance and associated mutations in Q-biotype of whitefly,, from eastern China., 2012, 31(1): 67-71.
[4] Yang X F, Luo J H, Li S H, Liu C H. Evaluation of nine pesticide residues in three minor tropical fruits from southern China., 2016, 60: 677-682.
[5] Li M Y, Li S G, Xu A M, Lin H F, Chen D X, Wang H. Selection of(Hyphomycetes) isolates pathogenic to adults of., 2014, 14: Article 32.
[6] Faria M, Wraight S P. Biological control ofwith fungi., 2001, 20(9): 767-778.
[7] OLSON D L, OETTING R D. Compatibility of insect growth regulators and(Balsamo) Vuillemin in controlling green peach aphid (Homoptera: Aphididae) on greenhouse chrysanthemums., 1999, 34: 286-294.
[8] Cuthbertson A G S, Blackburn L F, Eyre D P, Cannon R J C, Miller J, Northing P.: The current situation in the UK and the prospect of developing strategies for eradication using entomopathogens., 2011, 18(1): 1-10.
[9] Cuthbertson A G S, WALTERS K F A, DEPPE C. Compatibility of the entomopathogenic fungusand insecticides for eradication of sweetpotato whitefly,., 2005, 160: 35-41.
[10] 孟瑞霞, 张青文, 刘小侠. 烟粉虱生物防治应用现状. 中国生物防治, 2008, 24(1): 80-84.
Meng R X, Zhang Q W, Liu X X. Progress in the application of biological control of., 2008, 24(1): 80-84. (in Chinese)
[11] Feng MG, Pu XY. Time-concentration-mortality modeling of the synergistic interaction ofand imidacloprid against., 2005, 61(4): 363-370.
[12] Fitzgerald J. Laboratory bioassays and field evaluation of insecticides for the control of,and, and effects on beneficial species, in UK strawberry production., 2004, 23(9): 801-809.
[13] 李茂业, 陈德鑫, 李世广, 刘苏, 李毅, 钱萧萧, 林华峰. 绿僵菌对“Q型”烟粉虱2龄若虫的致病性及与毒力关联的培养性状研究. 中国生物防治学报, 2015, 31(1): 71-77.
Li M Y, Chen D X, Li S G, Liu S, Li Y, Qian X X, Lin H F. Cultural characteristics and virulence ofspp. to the 2nd instar nymphs of., 2015, 31(1): 71-77. (in Chinese)
[14] 林华峰, 张松影, 李茂业, 李世广, 冯明峰. 黄绿绿僵菌Mf82悬乳剂对褐飞虱作用的时间-剂量-死亡率模型分析. 菌物学报, 2013, 32(2): 239-247.
Lin H F, Zhang S Y, Li M Y, Li S G, Feng M F. Analyses of time-dose-mortality model of the emulsifiable formulation ofMf82 against., 2013, 32(2): 239-247. (in Chinese)
[15] Nowierski R M, Zeng Z, Jaronski S, Delgado F, Swearingen W. Analysis and modeling of time-dose-mortality of,, and(Othoptera: Acrididae) from,, andisolates from Madagascar., 1996, 67(3): 236-252.
[16] Filho M M, Oliveira S O D, de Liz R S, Faria M. Cage and field assessments ofbased mycoinsecticides forSulzer (Hemiptera: Aphididae) control in cabbage., 2011, 40(4): 470-476.
[17] 蒲蛰龙, 李增智. 昆虫真菌学. 合肥: 安徽科学技术出版社, 1996: 53-60.
Pu Z L, Li Z Z.. Hefei: Anhui Science and Technology Press, 1996: 53-60. (in Chinese)
[18] Jin SF, Feng MG, Ying SH, Mu W J, Chen J Q. Evaluation of alternative rice planthopper control by the combined action of oil-formulatedand low-rate buprofezin., 2011, 67(1): 36-43.
[19] Zou C, Li L, Dong T, Zhang B, HuQ. Joint action of the entomopathogenic fungusand four chemical insecticides against the whitefly., 2014, 24(3): 315-324.
[20] Jin S F, Feng M G, Chen J Q. Selection of globalisolates for the control of the rice pest(Homoptera: Delphacidae)., 2008, 64(10): 1008-1014.
[21] Li M Y, Lin H F, Li S G, Chen P R, Jin L, Yang J. Virulence of entomopathogenic fungi to adults and eggs ofStal (Homopera: Delphacidae)., 2012, 7 (14): 2183-2190.
[22] 李茂业, 林华峰, 金立, 张松影. 黄绿绿僵菌对褐飞虱侵染过程的扫描电镜观察. 应用昆虫学报, 2011, 48(5): 1412-1416.
Li M Y, Lin H F, Jin L, Zhang S Y. Observation on infection process oftousing scanning electron microscope., 2011, 48(5): 1412-1416. (in Chinese)
[23] Ujjan A A, Khanzada M A, Mahar A Q, Shahzad S. Efficiency ofspp. (Sorokin) strains and insecticides against cotton mealybug(Tinsley)., 2015, 47(2): 351-360.
[24] Frewin A J, Schaafsma A W, Hallett R H. Susceptibility ofto foliar-applied insecticides currently or potentially registered for soybean aphid control., 2012, 68(2): 202-208.
[25] Feng MG, Pu X Y, Ying SH, WangY G. Field trials of an oil-based emulsifiable formulation ofconidiaand low application rates of imidacloprid for control of false eye leafhopperin southern China,2004, 23(6): 489-496.
(责任编辑 岳梅)
Integration of Emulsifiable Formulationwith Low-Rate Abamectin for Control ofQ Biotype
LI Mao-ye1, CHEN De-xin1,2, LIN Hua-feng1, LI Shi-guang1, PAN Jing1, WU Sheng-yong3
(1School of Plant Protection, Anhui Agricultural University, Hefei 230036;2Qingzhou Tobacco Research Institute, China National Tobacco Corporation, Qingdao 266001, Shandong;3State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural Sciences, Beijing 100193)
【Objective】, an important invasion insect pest in agriculture, has displayed a high resistance to many conventional pesticides. The objective of this study is to evaluate the synergistic effect of joint application of entomopathogenic fungi and chemical pesticides againstin laboratory and field, and to provide a new approach for effective control of. 【Method】Based on the previous study that a highly virulent ofstrain (Mf96) was screened for control ofQ biotype, three gradient emulsifiable formulation of Mf96 (1.0×108, 1.0×107, 1.0×106conidia/mL), which were combined with five low doses of abamectin EC (0, 15, 30, 45 and 60 µg·mL-1) were separately sprayed to the body surface of 2ndinstar nymphs ofQ biotype in laboratory, and the mortalities were tested. The number of conidia deposited on the unit surface was counted under stereomicroscope. Single agent and their equal volume mixture of the suspension emulsion of Mf96 strain (1.0×108conidia/mL) and 1.8% abamectin WP (60 µg·mL-1) were separately sprayed to controlQ biotype on tobacco in the field, and the control efficacies were evaluated. 【Result】 LC50of Mf96 against 2nd instar nymphs ofQ biotype decreased from 1 376 to 183 conidia/mm2during 4th to 8th day. After 7 days, LC50of the fungus combined with abamectin (60 µg·mL-1) decreased from 378 to 46 conidia/mm2. Abamectin had no significant effect on the fungal outgrowths and infection to 2nd instar nymphs ofQ biotype at the low spray rates. The mixture suspension of different concentrations of fungus (low, medial and high) with abamectin (15, 30, 45 and 60 µg·mL-1) resulted in different rates of mycotized cadavers, and high concentration of fungal mixture suspension with 30 µg·mL-1of abamectin caused 86.8% mortality of. No cadavers were observed in untreated control and single abamectin spray. Fungal conidia suspension emulsion, abamectin and their mixture were separately sprayed in the field, and the decline rates in nymphae ofQbiotype population was the highest (53.6% and 85.7%) when the mixture was sprayed after 5 d and 10 d. Meanwhile, the changing trends of corrected control efficacies and population decline rate ofQ biotype were similar at 5 random checks, the corrected control efficacy of the mixture was the highest (88.9%) after 25 d. The population decline rateofQ biotype in untreated control was negative value.【Conclusion】The combined ofwith abamectin showed synergistic interaction, with additive effects on Q biotype. Therefore, it is an effective approach to controlby combiningwith abamectin at low spray rate.
Q biotype;; abamectin; synergistic effects; field control efficacy
2016-02-02;接受日期:2016-04-22
安徽省自然科学基金(1408085QC52)、中国烟草总公司科技重点项目(110201202003)、国家烟草行业烟草病虫害监测与综合治理重点实验室项目(IPM-201411)、安徽省高校自然科学基金(03087060)
李茂业,E-mail:sj412bq@163.com。陈德鑫,E-mail:cdxycs@gmail.com。李茂业和陈德鑫为同等贡献作者。通信作者吴圣勇,E-mail:sywu@ippcaas.cn
