环境因子对马铃薯致病立枯丝核菌AG-3融合群生长的影响
2016-10-14闵凡祥高云飞王文重董学志吕典秋
杨 帅, 闵凡祥, 高云飞, 郭 梅, 王文重, 魏 琪, 董学志, 吕典秋*
(1. 黑龙江省农业科学院植物脱毒苗木研究所,黑龙江哈尔滨 150030;2. 黑龙江省农业科学院博士后工作站,黑龙江哈尔滨 150001)
环境因子对马铃薯致病立枯丝核菌AG-3融合群生长的影响
杨 帅1,2, 闵凡祥1, 高云飞1, 郭 梅1, 王文重1, 魏 琪1, 董学志1, 吕典秋1,2*
(1. 黑龙江省农业科学院植物脱毒苗木研究所,黑龙江哈尔滨 150030;2. 黑龙江省农业科学院博士后工作站,黑龙江哈尔滨 150001)
[目的] 研究环境因子对马铃薯致病立枯丝核菌AG-3融合群生长状况的影响,以明确黑龙江省马铃薯立枯丝核菌的环境适应性,为该病害的防治提供理论依据。[方法] 采用生长速率法对立枯丝核菌菌丝在不同温度、pH、光暗条件下的生长状况进行测定。[结果] 菌丝在4 ℃条件下不能生长,适宜温度为19~25 ℃,全暗和全光条件下最适生长温度分别为22 和25 ℃,黑暗条件有利于菌丝生长;在pH 4~11时 菌丝均能生长,以pH 6~7时菌丝生长速度较快;当热激20 min以上时,其致死温度为50 ℃。[结论] 综合评价了环境因子对立枯丝核菌AG-3融合群生长的影响,同时耐热性测定表明短暂热激对菌丝生长有一定的促进作用,但当时间过长或温度过高时会严重抑制菌丝的生长。
马铃薯;立枯丝核菌;环境因子;生长
由立枯丝核菌(RhizoctoniasolaniKühn)引起的马铃薯溃疡病和黑痣病是马铃薯生产上最具威胁的土传病害之一[1-2],该病不仅在马铃薯苗期对芽眼、匍匐茎、地下茎等多个部位造成危害,引起溃疡等症状,降低产量,而且可以在块茎表面形成黑痣、裂口等症状,严重影响其后期的商品性,造成巨大经济损失[3]。近年来,随着种植效益的提高和面积的不断扩大,马铃薯种植区重迎茬问题、缺少或忽视检疫规范把关的种薯随意调运等问题,导致了该土传病害在我国普遍发生,且危害逐年加重,严重影响着马铃薯产业的发展。
在我国,曾于1922和1932年分别在台湾和广东陆续发现过立枯丝核菌病[4],但由于对马铃薯危害不重,并未引起人们的重视。之后,吉林、河北、内蒙古、甘肃等省区虽也有过该病发生危害的记载,但未曾有过对该病的系统研究报道。近年来,国内外对该病原菌的研究较多,包括生物学特性[5]、融合群类型[6],以及病害流行、防治[7-8]等方面。目前,在代表着立枯丝核菌复合种中独立进化发展的融合群研究方面,国际公认的已知融合群类型有14种,被命名为AG-1~AG-13和AG-BI[9-10]。其中,研究表明AG-3融合群是引起马铃薯立枯丝核菌病害的优势融合群[11-12],田间发病率在大发生年份可达70%以上[13]。鉴于黑龙江省作为我国马铃薯种薯和商品薯生产基地的重要地位,以及马铃薯立枯丝核菌病害研究匮乏的现状,笔者选取马铃薯主要致病融合群AG-3,研究温度、光照和pH 3个环境因子对其生长状况的影响,以明确黑龙江省马铃薯丝核菌的生长条件与环境的关系,为进一步开展相关研究奠定理论基础。
1 材料与方法
1.1试验材料供试病菌的分离与鉴定:2014~2015年于黑龙江省马铃薯主要生产田采集马铃薯溃疡病和黑痣病样品,采用常规组织分离法获得病原立枯丝核菌,分别采用玻片对峙法和ITS区特异性引物PCR法进行融合群测定后,选取部分纯化的AG-3融合群菌株保存于4 ℃的PDA试管斜面上,备用。
供试菌饼的制备:将保存于斜面的供试菌种接种于PDA平板上,置于25 ℃恒温培养至直径约7 cm时,用直径8 mm的打孔器切取菌落外缘制备成菌饼备用。
1.2试验方法
1.2.1不同温度对菌丝生长的影响。在生长良好的菌落边缘用直径8 mm的打孔器打取菌丝块,接种于PDA平板上,设置4、7、10、13、16、19、22、25、28、31、34 ℃共计11个温度梯度,将打孔器制备好的5 mm菌饼接种于PDA培养基中心处,分别在全光和全暗条件下,于恒温光照培养箱内培养2 d后,采用十字交叉法测量菌落直径。每处理3次重复。
1.2.2不同pH对菌丝生长的影响。将PDA培养基灭菌后,在无菌条件下用NaOH和HCl溶液将PDA培养基的pH分别调节至3、4、5、6、7、8、9、10、11、12共计10个pH梯度,将打孔器制备好的8 mm菌饼(25 ℃)接种于上述PDA培养基中心处,分别在全光和全暗条件下,于恒温光照培养箱内培养2 d后,采用十字交叉法测量菌落直径。每处理3次重复。
1.2.3不同光照对菌丝生长的影响。在生长良好的菌落边缘用直径8 mm的打孔器打取菌丝块,接种于PDA平板上,置于全光照、12 h光暗交替、全黑暗3种条件下,分别于19、22、25 ℃恒温培养,2 d后用十字交叉法测量菌落直径。每处理3次重复。
1.2.4综合环境因子对菌丝生长的影响。选取7个温度梯度(13、16、19、22、 25、28、31 ℃)和5个pH(6、7、8、 9、10)的处理组合,在连续光照和连续黑暗条件下于恒温光照培养箱内对立枯丝核菌的生长情况进行测定。菌饼制备和培养方法同上。当菌饼被培养2 d后,采用十字交叉法测量菌落直径。每处理3次重复。
1.2.5菌丝致死温度的测定。用8 mm打孔器在活化好的菌落边缘打孔,将菌丝块置于5 mL无菌离心管中,加入2 mL无菌水,分别在35、40、45、50、55、60和65 ℃共7个温度设置的水浴锅中处理10、15、20 min后取出离心管迅速冷却,在25 ℃无菌条件下将菌丝块取出置于PDA平板上培养,3 d后观察其生长情况。每处理3次重复。1.2.6数据分析。选用DPS 7.05和Excel 2010进行数据处理,并采用Duncan新复极差法进行多重比较。相关计算公式为:菌丝生长量=处理菌丝直径-接种菌饼直径
相对生长量=处理菌丝直径-对照菌丝直径
2 结果与分析
2.1不同温度对菌丝生长的影响由图1可知,在全暗培养条件下,除4 ℃时菌丝不生长外,7~34 ℃时菌丝均能生长,其中13~28 ℃时生长较快,22 ℃时生长最快,菌丝生长量为49.5 mm。在全光培养条件下,菌丝在4和34 ℃时均不生长,16~25 ℃时生长快速,25 ℃时生长最快,28 ℃时生长速度明显降低。
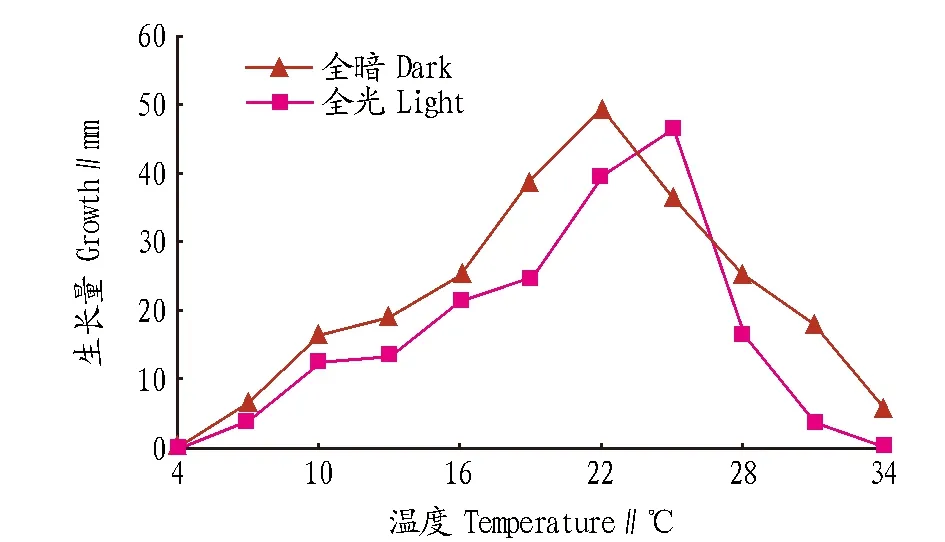
图1 不同温度对菌丝生长的影响Fig.1 Effects of temperature on mycelial growth of Rhizoctonia solani
2.2不同pH对菌丝生长的影响由图2可知,除pH为3和12时,菌丝不能生长外,在pH 4~11时菌丝生长情况差异明显,在pH为6~8时菌丝生长速度相对较快。在全暗和全光条件下,2 d后菌落直径分别达到36.5~44.5 和41.5~46.5 mm。总体来说,中性及偏碱性条件较有利于菌丝生长。
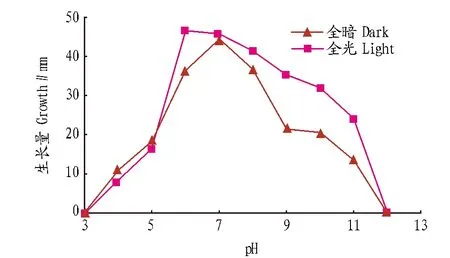
图2 不同pH对菌丝生长的影响Fig.2 Effects of pH value on mycelial growth of Rhizoctonia solani
2.3不同光照对菌丝生长的影响由图3可知,除25 ℃全暗条件下菌丝生长较慢外,均为全暗处理生长最快,其次是光暗交替处理,最后是全光处理。除22 ℃条件下,全光处理和光暗交替处理多重比较差异不显著外,其他处理在0.05水平均差异显著。
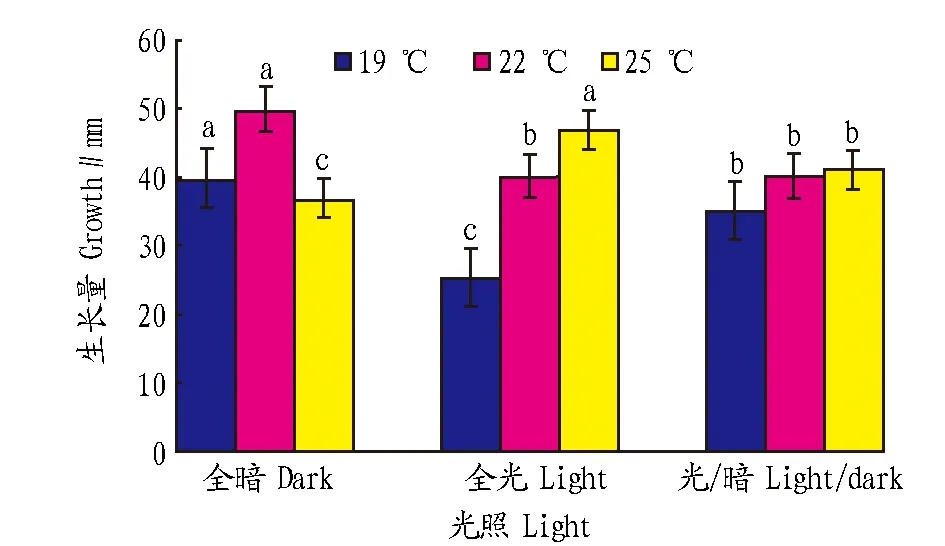
图3 不同光照对菌丝生长的影响Fig.3 Effects of different light condition on mycelial growth of Rhizoctonia solani
2.4综合环境因子对菌丝生长的影响由图4可知,在所设温度范围内,总体上pH 6、7和8条件下菌丝生长量要高于其他pH处理,最佳生长pH为6和7,多重比较差异显著(图4-A和4-C,P<0.05)。同时,在设定pH条件下,菌丝生长测定结果表明,31 ℃处理的菌丝生长最为缓慢,在全暗条件下较好的生长温度为19和22 ℃(图4-B,P<0.05),在全光条件下较好的生长温度为22和25 ℃(图4-D,P<0.05)。综上,当温度为19~25 ℃、pH在6~7 时,是菌丝生长较佳的环境条件。

注:图中(A)和(B)分别为全暗条件下温度和pH对菌丝生长的影响,(C)和(D)分别为全光条件下温度和pH对菌丝生长的影响。图中不同的小写字母为多重比较结果(P < 0.05)。Note: (A) and (B) were the mycelial growth influenced by temperature and pH under dark condition, (C) and (D) were the mycelial growth influenced by temperature and pH under light condition. Different lowercases were the results of multiple comparisons (P<0.05). 图4 综合环境因子对菌丝生长的影响Fig. 4 Effects of environmental factors on mycelial growth of Rhizoctonia solani
2.5菌丝生长致死温度的测定结果从设定温度处理分析,55~65 ℃热激条件下,菌丝均不能生长。从设定热激时长分析,在热激20 min条件下,菌丝经50 ℃处理2 d后不能生长,其他热激时长下,菌丝经35~50 ℃处理后均能在25 ℃条件下生长。由图5-A和5-B可知,除50 ℃菌丝生长速度受到抑制外,短暂热激10~15 min对菌丝生长均有不同程度的促进作用,菌丝生长速度超过对照,不同菌株之间生长量不同。由图5-C可知,在热激20 min以上时,不同菌株间菌丝生长均变缓慢。
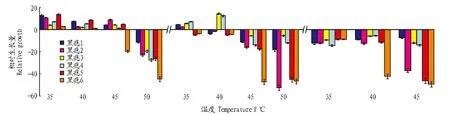
注:图中(A)、(B)和(C)分别为热激10、15和20 min时不同温度下菌丝的相对生长量。Note: (A), (B) and (C) were the relative mycelial growthes affected by different temperatures under the condition of 10, 15, 20 min respectively.图5 不同热激时长下温度处理对立枯丝核菌菌丝生长的影响Fig. 5 Effects of different heat shock time and temperature on mycelial growth of Rhizoctonia solani
3 结论与讨论
立枯丝核菌作为世界性分布的一种土壤习居菌,因具有侵染范围广、腐生竞争能力强、存活时间长且难于防治等特点,一直以来都被认为是最具破坏性的土传植物病原菌之一。目前关于立枯丝核菌生物学特性研究的报道很多,但主要集中在20世纪80~90年代,且国内外所得结果并不一致。如尤国信等[14]认为禾谷丝核菌生长温度在2.5~34.0 ℃,最适温度为23.0 ℃,但赵桂东等[15]对侵染大豆、水稻、玉米、大麦、棉花的丝核菌的菌丝最适生长温度研究表明,上述5种丝核菌的最适生长温度均不相同。同时,张穗[16]对不同融合群丝核菌生长温度的研究表明,不同融合群类型对温度的适应性不同,最适生长温度也相差较大。在马铃薯丝核菌的生物学研究方面,李乾坤等[5]研究得出丝核菌生长温度范围是4~34 ℃,最适生长温度为23 ℃,而日本学者Moromizato等[17]研究表明丝核菌生长温度为5~40 ℃,最适生长温度为25 ℃。因此,有针对性地开展生物学特性研究有助于明确黑龙江省优势致病融合群的生长条件与环境的关系,为进一步开展相关研究奠定理论基础。
生存环境是病原菌赖以生存的前提基础,对环境条件的适应性和耐受性也是决定着病原菌能否顺利完成侵染、流行的关键因素。笔者针对温度、pH和光照对马铃薯致病立枯丝核菌AG-3融合群菌丝生长的影响开展研究,结果表明,在不同光照条件下,菌丝生长状况略有不同,全暗条件更有利于菌丝生长,除4 ℃时菌丝不生长外,其他温度条件下均能生长,适宜温度为19~25 ℃。这一结果与前人研究结果基本一致,如Anguiz等[18]和Ritchie等[19]分别于1989和2009年报道的AG-3融合群在试管和培养皿中的最适生长温度均为20~25 ℃。同时,在pH研究方面,该试验结果表明pH为4~11时,菌丝能够生长但不同pH间差异明显,其中pH为6~7时菌丝生长速度相对较快,是AG-3融合群菌丝生长的适宜条件。这一结果与刘宝玉等[20]的研究结果一致,但相对于Ritchie等[19]报道的最适pH为5.6要略高一点。
在立枯丝核菌耐热性研究方面,国内外的相关报道较少。其中,刘志恒等[21-22]对甜瓜果腐病病原立枯丝核菌的生物学特性研究表明,在10 min热激条件下其致死温度为50 ℃。台莲梅等[23]报道的马铃薯立枯丝核菌在10 min热激条件下的菌丝致死温度为49 ℃。笔者等也针对菌丝的耐热性开展了初步研究,结果表明,菌丝在50 ℃条件下热激10和15 min时菌丝仍可以生长,只是与对照相比非常缓慢,只有在热激20 min时50 ℃才成为其致死温度。因此,该研究发现短暂热激在一定程度上有促进菌丝生长的作用,当时间过长或温度过高时会对菌丝生长产生严重的抑制作用。该研究结果在热激时间上与前人报道存在差异,可能与试验菌株来源不同有关。因长期处于不同的生态环境,为了更好地适应不同的生态环境,不同融合群之间以及同一融合群的不同菌株间可能通过生理生化、表观遗传等方式造成它们在生物学特性方面的各种差异,这部分工作还有待于进一步研究。
[1] JEGER M J, HIDE G A, VAN DEN BOOGERT P H J F, et al. Soilborne fungal pathogens of potato[J] .Potato research,1996, 39: 437-469.
[2] BANVILLE G B, CARLING D E.Rhizoctoniacanker and black scurf[C]// STEVENSON W R,LORIA R,FRANC G, et al. Compendium of potato diseases. St Paul, MN:APS Press, 2001:36-37.
[3] LEAH T. Biology, epidemiology and management ofRhizoctoniasolanion potato[J]. Journal of phytopathology, 2010, 158: 649-658.
[4] 陈万利.马铃薯黑痣病的研究进展[J].中国马铃薯,2012,26(1):49-51.
[5] 李乾坤,孙顺娣,李敏权.马铃薯立枯丝核菌病的研究[J].中国马铃薯,1988,2(2):79-84.
[6] YANG Y G , ZHAO C, GUO Z J, et al. Anastomosis group and pathogenicity ofRhizoctoniasolaniassociated with stem canker and black scurf of potato in China[J]. European journal of plant pathology, 2015, 143(1):99-111.
[7] 谭宗九,郝淑芝.马铃薯丝核菌溃疡病及其防治[J].中国马铃薯,2007,21(2):108-109.
[8] 常来,王文桥,朱杰华.北方一季作区马铃薯黑痣病的发生及防控策略[J].安徽农学通报,2010,16(7):116-117.
[9] CARLING D E, KUNINAGA S, BRAINARD K A. Hyphal anastomosis reactions, rDNA-internal transcribed spacer sequences, and virulence levels among sunsets ofRhizoctoniasolanianastomosis group-2(AG-2) and AG BI[J]. Phytopathology, 2002, 92: 43-50.
[10] SHARON M, KUNINAGA S, HYAKUMACHI M, et al. Classification ofRhizoctoniaspp. using rDNA-ITS sequence analysis supports the genetic basis of the classical anastomosis grouping[J]. Mycoscience, 2008, 49: 93-114.
[11] 田晓燕,蒙美莲,张笑宇,等.马铃薯黑痣病菌菌丝融合群的鉴定[J].中国马铃薯,2011,25(5):298-301.
[12] 王宇,杨志辉,秦宇轩,等.马铃薯黑痣病菌AG2-1和AG3融合群分析[J].农业生物技术学报,2013,21(2):230-237.
[13] VIRTGEN C G, OLALDE-PORTUGAL V, CARLING D E. Anastomosis group ofRhizoctoniasolanion potato in central Mexico and potential for biological and chemical control[J]. American journal of potato research, 2000, 77(4): 219-224.
[14] 尤国信.禾谷丝核菌生物学的研究II:温度和光照对生长的影响[J].信阳师范学院学报,1986(2):83-88.
[15] 赵桂东,朱海波,周玉梅,等.大麦纹枯病菌与其轮作物丝核菌的生物学特性及致病力比较研究[J].大麦科学,1999(1):37-39.
[16] 张穗.丝核菌融合群种类、寄生专化性及与温度的关系[J].生态学杂志,1999,18(1):9-14.
[17] MOROMIZATO Z, ISHIZAKI F, TADARA K. The effects of phosphorus and magnesium on sclerotium formation inRhizoctoniasolaniKühn[J]. Annals of the phytopathological society of Japan, 1991, 57: 649-656.
[18] ANGUIZ P, MARTIN C. Anastomosis groups, pathogenicity, and other characteristics ofRhizoctoniasolaniisolated from potatoes in Peru[J]. Plant disease, 1989, 73: 199-201.
[19] RITCHIE F, BAIN R A, MCQUILKEN M P. Effects of nutrient status, temperature and pH on mycelial growth, sclerotial production and germination ofRhizoctoniasolanifrom potato[J]. Journal of plant pathology, 2009, 91(3): 589-596.
[20] 刘宝玉,胡俊,蒙美莲,等.马铃薯黑痣病病原菌分子鉴定及其生物学特性[J].植物保护学报,2011,38(4):379-380.
[21] 刘志恒,侯悦,胡积祥,等.辽宁省甜瓜果腐病病原菌鉴定及生物学特性初探[J].园艺学报,2013,40(1):89-97.
[22] 侯悦,刘志恒,曹友文,等.辽宁省甜瓜新病害:果腐病病原菌生物学特性研究[J].中国蔬菜,2013(6):74-80.
[23] 台莲梅,赵巧兰,靳学慧,等.马铃薯立枯丝核菌生物学特性研究[J].植物保护,2015,41(1):89-92.
Influence of Environmental Factors on Growth Status of AG-3 for Potato PathogenicRhizoctoniasolani
YANG Shuai1,2, MIN Fan-xiang1, GAO Yun-fei1, LV Dian-qiu1,2*et al
(1. Virus-free Seedling Research Institute, Heilongjiang Academy of Agricultural Sciences, Harbin, Heilongjiang 150030; 2. Heilongjiang Academy of Agricultural Sciences Postdoctoral Programme, Harbin, Heilongjiang 150001)
[Objective] The aim was to study effects of environmental factors on the growth status of anastomosis group AG-3, to determine environmental adaptation ofRhizoctoniasolanifrom Heilongjiang Province, which provides a theoretical basis for control of the disease. [Method] The growth status ofRhizoctoniasolaniunder different conditions of temperature, pH and light was determined by growth rate method. [Result] The mycelium could grow under the setting temperature except 4 ℃, the optimal temperature was 19-25 ℃, and the fastest growth under the condition of dark and light was 22 and 25 ℃ respectively, and the growth of mycelia was accelerated by darkness. The range of pH was 4-11, and the optimal pH for growth was 6-7. Meanwhile, the lethal temperature was 50 ℃ after heat shocking more than 20 minutes. [Conclusion] The effect of environmental factors on the mycelial growth of AG-3 is comprehensively evaluated, and determination of heat resistance indicates that there is a promotion on mycelial growth by heat shocking when the time and temperature is not too long or too high.
Potato;Rhizoctoniasolani; Environmental factors; Growth
科技部“十二五”农村领域国家科技计划研究项目(2012BAD06B02);国际合作项目“中挪马铃薯土传有害生物监控技术合作研究”(2013DFA31970);黑龙江省农科院“引进博士人才科研启动金”项目(201507-15)。
杨帅(1982- ),男,黑龙江牡丹江人,助理研究员,博士,从事马铃薯真菌病害研究。*通讯作者,研究员,从事马铃薯栽培生理和生物技术研究。
2016-07-13
S 435.32
A
0517-6611(2016)24-151-04
