弱碱三元复合驱钙镁硅混合成垢的微观考察
2016-10-14赵晓非张晓阳杨腾飞张振超
赵晓非,张晓阳,范 蕾,杨腾飞,张振超
(1.东北石油大学化学化工学院石油与天然气化工省重点实验室,大庆 163318;2.中国石油大学重质油加工国家重点实验室,青岛 266000)
弱碱三元复合驱钙镁硅混合成垢的微观考察
赵晓非1,张晓阳1,范蕾1,杨腾飞2,张振超1
(1.东北石油大学化学化工学院石油与天然气化工省重点实验室,大庆163318;2.中国石油大学重质油加工国家重点实验室,青岛266000)
笔者通过对大庆采油五厂返排液水质分析,配置实验模拟液,对弱碱三元复合驱钙镁硅混合垢生长的微观过程进行了研究,并总结钙镁硅混合垢微观成垢机理。实验表明,碳酸盐与硅酸自聚成垢之间是相互影响的,单独钙镁体系或者硅酸成垢率低,成垢速率缓慢;低浓度比体系中硅酸对钙离子成垢有加速作用,1 h混合体系钙离子成垢率为87%,高浓度比体系中硅酸对钙离子成垢有一定的减速作用,10 h时钙离子成垢率为50%,但二者均未影响钙离子的最终成垢率,24 h后钙成垢率均为98%;混合体系中镁离子成垢显著增加,低浓度比体系中影响尤为明显,1 h后低浓度比体系中镁离子成垢率已达94%;钙镁离子对硅酸聚合有明显的促进作用,低浓度比体系72 h后硅酸成垢率为95%,而但纯硅酸体系72 h的成垢率仅为5%,高浓度比体系,钙镁离子对硅酸最终成垢率无太大影响,但对其聚合速率影响颇大。偏光显微镜观察,纯碳酸盐溶液中,混合垢以立方体型碳酸钙和棒状三水合碳酸镁组成,碳酸钙吸附在棒状三水合碳酸镁晶须两端;加入硅酸后,生成球状三水合碳酸镁,絮状硅酸吸附在碳酸盐晶体上。利用电子扫描显微镜观察得到,钙镁硅混合垢微观形态为“核壳包被”结构,即以碳酸盐为晶核,多聚硅酸为壳的球形混合垢。
弱碱三元复合驱; 钙镁硅混合垢; 微观成垢机理; 核壳包被结构
1 引 言
垢的形成过程大致为:水溶液→过饱和溶液→晶体析出→晶体生长→结垢[1]。随着三元复合驱技术的推广应用,结垢问题越来越引起人们的关注。三元复合驱中的碱剂注入地层后,由于温度、压力的变化,与油藏内的流体、泥岩作用,产生泥质垢、钙垢、镁垢及硅铝垢,随着驱替液的流动,在孔喉处停下,堵塞喉道[2,3]。成垢物质会粘附在地层、储蓄器、生产管道表面或设备表面[4],同时结垢还导致生产时间的缩短,设备损坏,能源消耗增加造成额外的经济损失[5]。
研究表明,含硅体系对碳酸垢有较大影响,油井中的碳酸成垢体系与硅酸成垢体系相互作用,形成更为复杂的钙镁硅混合垢,这种垢的成分复杂,黏连紧密往往更难去除,对单一垢质的研究已不足已应对目前油井结垢的困境,因此对混合垢的去除研究已迫在眉睫。
纯碳酸钙的常见形态有立方状、纺锤形、球形、针状、片状、链状、无定形等[6-9]。方卫民、郑岚等[10,11]研究发现反应温度、反应物浓度和CO2流速等因素决定立方体碳酸钙的形成,并利用间歇碳化法制备了平均粒径为45 nm的立方形超细CaCO3。Hu等[12]利用可溶性钙盐制备了文石型针状和菊花状碳酸钙粒子。Wang等[13]利用改性碳化法制备了片状碳酸钙粒子,并探讨了反应温度、溶液pH值、电导率随时间的变化规律。弱碱三元复合驱中镁离子主要以三水合碳酸镁及三硅酸镁的形式存在,Cheng等[14]研究表明在283~313 K之间,可得到棒状MgCO3·3H2O,当温度升高到323 K时,变为球形碱式碳酸镁;吴丹等[15]研究表明,反应温度在40~50 ℃,pH=8.8~9之间时最易形成MgCO3·3H2O晶须。当前对MgCO3·3H2O已有较多的研究,Kloprogge等[16]用MgCl2·6H2O和Na2CO3反应,通过调节共沉淀过程中反应温度、搅拌时间和陈化时间,合成了针状和聚合物状的MgCO3·3H2O。Mitsuhashi等[17]利用CO2的碳酸化作用与 Mg(OH)2水溶液反应生成MgCO3·3H2O晶体,重点考察了碱性溶液NaOH加入量和温度对晶体晶型的影响。
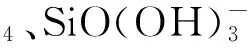
Mn++nH3SiO4-=M(H3SiO4)n
(1)
Mn++1/2nH2SiO42-=M(H2SiO4)n/2
(2)
n>1时,形成的硅酸盐难溶于水。
2 实 验
2.1实验原料
硅酸钠、EDTA,分析纯,天津市永大化学试剂有限公司;钼酸铵,分析纯,天津市大茂化学试剂厂;氢氟酸,分析纯,天津市瑞金特化学品有限公司;CaCl2、MgCl2,分析纯,天津石英钟厂霸州市化工厂;AlCl3·6H2O,分析纯,上海化学试剂采购供应站经销。
2.2剩余硅含量的测定
本文采用硅钼黄吸光度法SS-6-2-84[20],测剩余全硅含量。在全聚乙烯塑料实验装置条件下,取适量水样酸化后,加HF并于沸水浴中处理,将水中各类非活性硅转化为氟硅酸,冷却后加入氯化铝,解离氟硅酸并掩蔽过剩的氢氟酸,加入乙醇、丙酮稳定剂,最后与钼酸铵反应显色,与波长410 nm处,使用1 cm玻璃比色皿测定其吸光度,并与全硅标准曲线对照,测得水样中的剩余硅含量。
2.3结果分析
采用722型光栅分光光度计,在410 nm处,测量剩余硅含量; YYP-330E型偏光显微镜,随反应时间观察混合垢微观结构变化;JSM-IT300型日本电子扫描电镜,观察垢晶生长的微观变化;D/MAX-2200PC型X衍射仪,分析混合垢样品。
3 结果与讨论
实验室根据大庆采油五厂污水水质分析,配置模拟成垢水,其中矿化度为4300 mg/L,调pH为8.36,以下实验均在水浴45 ℃条件下完成。
3.1硅酸与碳酸盐低浓度比体系中混合成垢考察
3.1.1混合成垢成垢速率
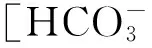
图1 低浓度比混合体系与单独体系结垢对比 (A混合体系硅酸自聚曲线;a纯硅体系硅 自聚曲线;B混合体系剩余钙含量; b碳酸盐体系剩余钙含量;C混合体系 剩余镁含量;c碳酸盐体系剩余镁含量)Fig.1 The scale rate contrast between low concentration ratio of mixed system and single system
由图1可知,混合体系较之单独体系,钙离子成垢速率明显加快,1 h后碳酸盐体系中钙离子组剩余量为38 mg/L(成垢率87%),混合体系中剩余钙含量为16.03 mg/L(成垢率95%),但24 h后两体系中钙的最终成垢率基本一致,成垢率均为98%;混入硅酸后镁离子成垢速率陡然增高,30 min碳酸盐体系中剩余镁含量为82 mg/L(成垢率18%),而混合体系中则仅有6 mg/L(成垢率94%),72 h后前者剩余镁含量为66 mg/L(成垢率34%),后者剩余量仅为1.4 mg/L(成垢率98%),基本已全部成垢;混合体系中硅酸自聚速率明显升高,单独硅酸体系72 h硅酸剩余含量仍为94.56 mg/L(成垢率5%),而混合体系中1 h硅酸剩余量为70 mg/L(成垢率30%),10 h为42 mg/L(成垢率58%),72 h仅剩5 mg/L(成垢率95%),一方面这是由于溶液中含有金属离子硅酸自聚速率变快,更主要的是,体系中的钙、镁离子与单硅酸反应生成硅酸盐沉淀。
3.1.2混合成垢微观过程
将上述两体系制成垢片,对比观察垢样晶型的生长情况,如图2所示,其中左侧为碳酸盐体系,右侧为钙镁硅混合体系。
由图2可知,碳酸盐独立体系成垢微观结构与钙镁硅混合体系成垢存在明显的不同之处。对比发现,碳酸盐独立体系反应1 h后,如图2A所示,溶液出现文石型菊花状碳酸钙,此时无镁晶成形,体系中垢量较少,垢样分散;反应3 h后,如图2B所示,结垢量明显增多,垢样中出现三水合碳酸镁棒状晶须、立方体晶型的碳酸钙,二者相互粘连,粘连部位主要集中在棒状三水合碳酸镁晶须的两端;5 h后,如图2C所示,垢样大量生成,分布相对集中,棒状镁须两端附着的碳酸钙作为粘合剂将三水合碳酸镁彼此连接,形成大的钙镁混合垢;10 h后,如图2D所示,垢样已初步聚结,生成大量的立方体晶型的碳酸钙,三水合碳酸镁棒状晶须与立方体晶型的碳酸钙相互聚结并形成网状结构。
将低浓度比混合体系中的垢样制成垢片,观察垢晶的生长情况,如图2所示,最初形成的碳酸钙晶吸附在三水合碳酸镁晶须两端,少量絮状多聚硅酸吸附在钙镁垢晶之上(图2a),随着时间的增加,多聚硅酸逐渐增多(图2b),并发生聚合、脱水的现象(图2c)。在室温下放置20 d后观察,形成脱水硅胶(图2d)。
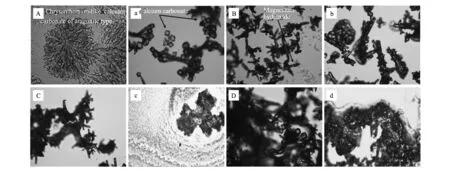
图2 低浓度比混合体系与单独体系成垢微观结构对比(A)400×(1 h);(B)250×(3 h);(C)250×(5 h); (D)400×(10 h);(a)400×(1 h);(b)250×(5 h);(c)250×(10 h);(d)400×(24 h)Fig.2 Contrast of scale's microstructure between low concentration ratio of mixed system and single system.Left:single system
3.2硅酸与碳酸盐高浓度比体系中混合成垢考察
3.2.1混合体系成垢速率
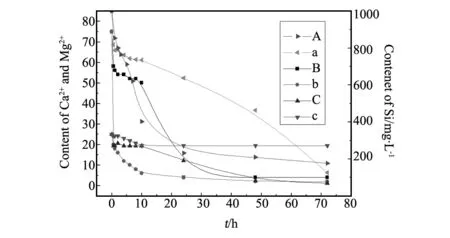
图3 高浓度比混合体系与单独体系结垢对比 (A混合体系硅酸自聚曲线;a纯硅体系硅自聚曲线; B混合体系剩余钙含量;b碳酸盐体系剩余钙含量; C混合体系剩余镁含量;c碳酸盐体系剩余镁含量)Fig.3 The scale rate contrast between high concentration ratio of mixed system and single system
由图3可知,与3.1.1低浓度比体系不同,此混合体系中,钙离子成垢速率明显变慢,其中10 h时,混合体系剩余钙含量为50 mg/L(成垢率为50%),而低浓度比体系剩余钙含量为10 mg/L(成垢率为96%),单独碳酸盐体系平均成垢率为93%,但此混合体系不影响钙离子的最终成垢率,24 h后三者剩余钙含量均为4 mg/L(成垢率为98%)左右;与低浓度比组相似,混合体系镁离子成垢率增大,10 h前对比不明显,48 h后此混合体系剩余镁离子为3 mg/L(成垢率为88%),单独碳酸盐体系剩余镁含量19 mg/L(成垢率为24%);对于硅酸,混合体系较之纯硅酸溶液,其自聚速率慢,总成垢率基本一致,72 h后混合体系剩余硅酸浓度为128 mg/L(成垢率为87%),纯硅酸体系剩余硅酸浓度为176 mg/L(成垢率为82%)。
对比3.1.1与3.2.1成垢速率结果分析可知,低浓度比体系(3.1.1),由于胶体电性中和作用,带有负电荷的聚硅酸会与正电荷碳酸盐垢相互中和吸附,成垢颗粒逐渐长大,硅酸与盐酸盐相互促进垢的形成;当硅酸含量较高时,反应初期,硅酸自身聚合趋势明显,自聚速率较高,且带有负电荷的硅酸离子与碳酸根竞争吸附钙镁离子,阻碍了溶液中钙镁离子与碳酸根离子成垢,同时硅酸自聚形成的网状絮体结构,悬浮、充斥在溶液中使碳酸垢粒分散,无法聚集长大,也在一定程度上抑制了碳酸垢的形成,反应10 h后混合体系中硅酸含量降低(10 h剩余[SiO2]=650 mg/L),对钙镁离子的络合几率降低,碳酸根又占主导与钙镁离子结合成碳酸垢。
对于混合体系中镁离子明显结垢的解释为,碱性条件下,部分镁离子在水中水化形成氧化镁、氢氧化镁的复杂分子结构,氢氧化镁分子部分解离进入溶液,由此形成了周围被OH-离子包围的带正电荷的复杂胶体粒子。水中以不同形态存在的硅酸化合物可以与氢氧化镁胶体粒子进行离子交换,从而形成了难溶的硅酸镁化合物。
3.2.2混合体系成垢速率
混合体系反应1 h后,裸眼观察体系中生成絮状硅垢,瓶底有少量颗粒状垢块生成。用显微镜观察如图4a所示。垢样以粒状垢为晶核,絮状垢吸附之上。其中立方体型晶体为碳酸钙,不规则晶体为三硅酸镁[17],包裹絮状物为硅垢。反应5 h后,裸眼观察,垢样以大团絮状硅垢为主,悬浮于溶液下层,瓶底颗粒状垢样逐渐板结成块,如图4b所示,垢样基本无明显变化,仅表现为硅酸絮状垢体开始有脱水现象,并随时间增加,脱水现象越明显,如图4c、4d分别为结垢10 h、24 h垢样照片。

图4 高浓度比体系混合成垢的微观结构Fig.4 The contrast of scale’s microstructure of high concentration ratio of mixed system (a)400×(1 h);(b)400×(5 h);(c)250×(10 h);(d)250× (24 h)
3.2.3电镜照片
将上述条件下形成的硅垢过滤,干燥,研磨。采用扫描电镜观察硅垢的微观结构。扫描图像如下图5a、图5b。将硅垢放大1000倍,可以观察垢样多以球形为主(如图5a)。将垢样中独立的球形部位放大10万倍(如图5b),可以明显看到有立方体碳酸钙晶体与絮状聚硅酸吸附、包被。碳酸盐由钙镁二价阳离子构成,并且成晶速率快,硅酸自聚生成带有负电荷的多聚硅酸,自聚速率较慢。
3.2.4混合垢XRD分析
取混合垢样品烘干、研磨,利用X射线衍射仪对样品分析,扫描范围从15°到70°,如图6所示。
由XRD图分析可知:高浓度比混合体系中,钙离子以碳酸钙、硅酸钙垢为主,其中CaCO3的PDF为17-0763,CaSiO3的PDF为31-0300,镁离子则与硅酸形成非晶态晶像结构的三硅酸镁及硅酸镁,其中在15°~40°出现了一个弥散的衍射峰为三硅酸镁[21],MgSiO3的PFD为39-0300;低浓度比体系中绝大多数的钙离子以CaCO3成垢(PDF为47-1743),并有少量Ca2SiO4(PDF为24-0034)生成,镁离子则以MgCO3·3H2O(PDF为20-0669)的形式存在。

图5 高浓度比混合垢电镜扫描结构(a)1000×;(b)100000×Fig.5 Scanning electron microscope images of mixed scale of the high concentration ratio of mixed system
4 结 论
(1)对比硅酸与碳酸盐不同浓度比体系的结垢速率可知,由于硅酸胶体电性中和作用,导致高浓度比体系中钙离子成垢速率低,但未影响其最终成垢率;体系中加入硅酸,明显增大了镁离子的成垢率,两种浓度比体系中镁离子72 h后成垢率均增大了60%;低浓度比体系中,钙镁离子促进了硅酸自聚,混合体系72 h,硅酸成垢率较之纯硅酸体系增长了90%;
(2)单独碳酸盐结垢在成垢初期较为分散,先是出现球形菊花状碳酸钙晶体,3 h时棒状三水合碳酸镁晶体出现,同时出现立方体形碳酸钙晶体并吸附在棒状镁须的两端。低浓度([SiO2]=100 mg/L)体系中,絮状多聚硅酸以碳酸钙镁垢为晶核,吸附之上,随着时间的增加,吸附量变大,并有脱水现象产生;高浓度比([SiO2]=1000 mg/L)体系中,混合垢以硅酸自聚为主,并与镁离子生成三硅酸镁,吸附在碳酸钙垢晶之上,随着时间的增加,混合垢逐渐发生聚合、脱水,室温放置20 d后形成脱水硅胶;
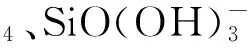
[1] 王玉普,程杰成.三元复合驱过程中的结垢特点和机采方式适应性[J].大庆石油学院学报.2003,02(27):20-22.
[2] 巨全义,罗春勋,武平仓.油田注水地层结垢机理及分布特征[J].试采技术,1995, 16(3):44-48.
[3] 路遥,陈立滇.油田水结垢问题[J].油田化学,1995,12(3):281-286.
[4] Charles J.Hinrichsen,Texaco Inc.Preventing scale deposition in oil production: anIndustry review[N].CORROSION,March22-27,1998,61.
[5] Nasser W N A,Ruwaie A H A,Hounslow M J,et al.Influence of electronic antifouling on agglomeration of calcium carbonate[J].PowderTechnology,2011,206(1-2):201-207.
[6] Wen Y,Xiang L.Synthesis of plate-like calcium carbonate via carbonation route[J].MaterialsLetters,2003,57(16-17):2565-2571.
[7] Pach L,Duncan S.Morphological control of precipitated calcium carbonate and phosphates by colloidal additives[J].MaterialsSieienee,1996,31(24):6565-6569.
[8] Clemente R R,Morales J G.Microwave precipitation of CaCO3from homogeneous solutions[J].CrystalGrowth,1996,169(2):39-346.
[9] Kitamura M,Konno H.Controlling factors and mechanism of reactive crystallization of calcium carbonate polymorphs from calcium hydroxide suspensions[J].CrystalGrowth,2002,236(l-3):323-332.
[10] 方卫民,沈富立.方体状沉淀碳酸钙工艺条件的选择[J].化学世界,1999, 40(3):126-129.
[11] 郑岚,卫志贤.立方形超细碳酸钙的制备研究[J].无机盐工业,1998, 30(6):5-7.
[12] Hu Z S,Deng Y L.Supersaturation control in aragonite synthesis using sparingly soluble calcium sulfate as reactants[J].ColloidandInterfaceScience,2003, 266(2):359-365.
[13] Wang C Y,Sheng Y.Synthesis of hydrophobic CaCO3nanoparticles[J].MaterialsLetters,2006,60(6):854-857.
[14] Cheng W T,Li Z B,George P D. Effects of temperature on the preparation of magnesium carbonate hydrates by reaction of MgCl2with Na2CO3[J].ChineseJournalofChemicalEngineering,2009,17(4):661-666.
[15] Kloprogge J L,Martens W N,Nothdurft L,et al.Low temperature synthesis and characterization of nesquehonite[J].JournalofMaterialsScienceLetters,2003,22(11) : 825-829.
[16] Mitsuhashi K,Tagami N,Tanabe K,et al.Synthesis of micro tubes with a surface of "house of cards" structure via needlelike particles and control of their pore size[J].Langmuir,2005,21: 3659-3663.
[17] 闫平科,田海山,高玉娟,等.高长径比三水碳酸镁晶须的合成研究[J]. 人工晶体学报,2012,41(1) : 158-164.
[18] Caullet P,Guth J L.Zeolite Synthesis[M].Washington,DC,1989: 83-97.
[19] 季明德.多价离子对硅酸聚合速度的影响[J].江西大学学报(自然科学版).1982,4:71-76.
[20] 田利,王广珠,孙巍伟,等.《SS-6-2-84全硅的测定》中存在的问题与改进[J].热力发电,2006,(07):49-51.
[21] 冯凌,李敏,刘国强,等.共沉淀法合成三硅酸镁及其微观分析[J].北京科技大学学报,2009,12(31):1600-1604.
Microcosmic Investigation on the Scale Formation of Calcium Magnesium and Silicon in the Weak Alkalescent Alkaline/Surfactant/Polymer Flooding
ZHAOXiao-fei1,ZHANGXiao-yang1,FANLei1,YANGTeng-fei2,ZHANGZhen-chao1
(1.Chemistry and Chemical Engineering of Northeast Petroleum University,Daqing 163318,China;2.China University of Petroleum,Qingdao 266000,China)
After analyzing the water quality of flowback liquid from Daqing’s No.5 oil production company, the author confects the experimental modelling liquid, researches on the micro process of the scale formation of calcium magnesium and silicon in the weak base ternary compound oil displacement wells, and finally summarizes the micro mechanism about how the calcium magnesium and silicon mix into scale. Experiments show that during the separate process of scale formation, the carbonate and silicate are interacted with each other. In addition, the scale formation rate of separate calcium magnesium or silicic acid is low, and the speed of it is rather slow.In the low concentration system, silicic acid has increased effects on calcium ion, and the scale formation rate of calcium ion in mixed system for 1 h is 87%. In the high concentration system, silicic acid has decreased effects on calcium ion, and the scale formation rate of calcium ion in mixed system for 10 h is 50%. But the above two conditions both have no impacts on the final scale formation rate of calcium ions, the scale formation rate of calcium ion after 24 h is 98%. In the mixed system, the scale formation of magnesium ions increased significantly, especially in the low concentration system, and the scale formation rate of magnesium ions in the low concentration system is 94% after 1 h. Calcium and magnesium ions have obvious effects on the polymerization reaction of silicic acid, and the scale formation rate of silicic acid in the low concentration system is 95% after 72 h. While in the pure silicate system, the scale formation rate for 72 h is only 5%, and in the high concentration system, calcium and magnesium ions have no influence on the ultimate scale formation rate of silicate. However, it has quite big influence on the polymerization rate. Using the micropolariscope, we can see in the pure carbonate solution, the mixing scale is made up of the cubic calcium carbonate and baculine magnesium hydroxide, and the calcium carbonate is adsorbed on both ends of cat whisker from the rod-shaped magnesium hydroxide. After adding silicic acid, it generates ballshaped trihydrate magnesium carbonate, and the flocculent silicic acid is absorbed on the carbonate crystals. By scanning electron microscopy, we can also observe that the microstate of calcium magnesium and silicon mixed scale is core-and-shell package, namely the ballshaped mixed scale treats carbonate as the crystal nucleus and polymer silicic acid as shell.
three compound combination flooding;mixing scale of calcium magnesium and silicon;the microcosmic investigation;core-and-shell package
赵晓非(1967-),男,博士,教授.主要从事油田化学添加剂的开发与其现场应用方面的研究.
张晓阳,硕士研究生.
O69
A
1001-1625(2016)07-2264-06
