葡萄抗白粉病相关基因γVPE的克隆与表达分析
2016-10-14王晏青张小莹宋珈凝王跃进张朝红
王晏青, 张小莹,宋珈凝,王跃进, 张朝红
(西北农林科技大学 园艺学院,旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,陕西杨陵712100)
葡萄抗白粉病相关基因γVPE的克隆与表达分析
王晏青, 张小莹,宋珈凝,王跃进, 张朝红*
(西北农林科技大学 园艺学院,旱区作物逆境生物学国家重点实验室,农业部西北地区园艺作物生物学与种质创制重点实验室,陕西杨陵712100)
该研究采用RT-PCR技术,从抗病的中国野生华东葡萄‘白河-35-1’和感病的欧洲葡萄‘佳丽酿’中克隆了液泡加工酶基因(γVPE),分别命名为VpγVPE和VvCγVPE。克隆的2个γVPE基因cDNA长度均为1 624 bp,ORF为1 482 bp,编码493个氨基酸。氨基酸多序列对比分析发现,‘白河-35-1’、‘佳丽酿’、‘无核白’和‘黑比诺’葡萄中的γVPE基因底物结合口袋域的3个关键氨基酸之一的丝氨酸(Ser395)均变为丙氨酸(Ala),与其他植物的VPE基因底物口袋结合域有所不同。实时荧光定量PCR表明,在白粉菌诱导后的不同时期内,γVPE基因在感病葡萄和抗病葡萄中的表达模式不同,抗病株系中VpγVPE基因的表达量在诱导后的前期(4 h和48 h)和后期(168 h)均有所增加,而感病株系中VvCγVPE基因在诱导后4 h表达量最高,随后降低。γVPE基因在白粉菌诱导后不同时期内表达量的变化,表明γVPE基因在一定程度上与葡萄的抗性相关。研究结果为进一步揭示γVPE基因在抗病过程中的分子机理奠定了基础。
葡萄;γVPE;基因克隆;白粉病;表达分析
植物在长期的进化历程中形成了严密而复杂的防御体系,使植物能够抵抗病原菌的入侵和其他因子造成的危害,从而更好地适应周围的生活环境并不断地繁衍后代[1]。植物的抗病基因作为植物防御体系中最重要的组成部分,在抵抗病原菌入侵的过程中发挥着重要的作用。寄主植物可通过相关抗性基因的表达来抵抗病原菌的入侵,当抗性基因正常表达时,寄主植物出现细胞壁加固增厚、受体细胞内吞等现象,以此来阻止病原菌的生长[2]。在寄主受病原菌侵染部位常出现局部坏死,阻止菌丝向正常组织扩散。坏死斑形态多种多样,可以是单个细胞死亡,也可以是多个细胞死亡造成较大的坏死区域,这种坏死反应即为超敏反应(Hypersensitive Response,HR)[3]。超敏反应是一种具有高度组织性的细胞程序性死亡(Programmed Cell Death,PCD)过程[4],是一种自发的有序性死亡[5],γVPE基因与PCD密切相关并且在营养器官中的表达量相对较高[6]。在植物中,液泡加工酶(Vacuolar Processing Enzyme,VPE)的缺失可阻止HR反应和胚胎发育早期因细胞层不足而引起的细胞死亡[7]。因此,VPE基因与植物抵抗病原菌入侵的防御体系密切相关。
1987年,Hara-Nishimura 和Nishimura在成熟南瓜种子的储存蛋白中第一次发现了一种半胱氨酸蛋白酶,并将其命名为液泡加工酶[8-9]。动物中的天冬氨酸特异性半胱氨酸蛋白酶(caspase)是调控动物细胞程序性死亡的关键开关,一旦开启将不可逆的执行细胞死亡程序。1998年,从烟草中检测到了一个具有底物蛋白酶活性的半胱氨酸蛋白酶——类caspase酶,该酶是病毒诱导的PCD过程所需要的[10-11],诸多研究已证实VPE蛋白为植物中具有调控细胞程序性死亡的caspase酶[12]。
VPE蛋白能合成不活跃的蛋白前体,且不需要其他的因子来激活,就能够通过自身催化来切断暴露在蛋白前体表面的天冬酰胺残基和天冬氨酸残基而形成相应的成熟蛋白[8-9,13-17]。VPE蛋白具有caspase-1活性,并且VPE蛋白的成熟的过程与caspase-1的活化过程相似[16,18-19]。前体蛋白通过自身催化转为功能性VPE蛋白后会对液泡中的蛋白酶进行加工,从而发挥类似于动物细胞中caspase调控细胞程序性死亡(PCD)的功能[20]。VPE蛋白在病毒诱导的过敏性细胞死亡早期过程中是必不可少的,而HR涉及两个独立的过程,即PCD和防御蛋白的诱导,并且VPE蛋白是在PCD过程中发挥作用的[6]。
研究发现γVPE基因具有类caspase活性,并在防御病原菌入侵的过程中起作用,如:经丁香假单胞菌(Pseudomonassyringae)、灰葡萄孢菌(Botrytiscinerea)和芜菁花叶病毒(Turnipmosaicvirus)的诱导后,拟南芥中γVPE基因的表达量显著增加;同时,γVPE基因过量表达的拟南芥植株感染丁香假单胞菌过程中,植株出现大量离子渗透现象,表明在植物与病原菌互作的过程中,γVPE基因可能参与植物PCD的调控过程;此外,caspase-1抑制剂能够阻断VPE基因的自激活和及其下游酶的活化[21]。试验表明,拟南芥VPE的四突变缺失体(αVPE/βVPE/γVPE/δVPE)既没有VPE蛋白的活性也没有类caspase-1蛋白的活性[18]。此外,γVPE重组体能够识别一个Km为30.3 μmol/L 的VPE底物和一个Km为44.2 μmol/L 的caspase-1底物[18]。有关拟南芥VPE活性探针的研究发现,在活体营养型卵菌(Hyaloperonosporaarabidopsidis)侵染拟南芥的过程中,γVPE蛋白的活性有所增加,并且拟南芥四突变体中的卵菌孢子数有所减少,说明γVPE基因与卵菌的致病性密切相关。此外,这种抗性增强的效应仅发生在γVPE基因单突变体上,而其他的VPE基因能够促进卵菌孢子的形成[22]。
目前,已在葡萄基因组中共发现了3个VPE成员:βVPE、γVPE和δVPE,并分别在‘无核白’和‘黑比诺’葡萄中克隆了γVPE基因,发现γVPE基因与VPE家族的其他成员相比,底物结合口袋域的3个关键氨基酸中的丝氨酸(Ser347)被丙氨酸(Ala)取代[22]。本研究在此基础上,从中国野生华东葡萄‘白河-35-1’及欧洲葡萄‘佳丽酿’全长cDNA文库中克隆获得了γVPE基因,并通过生物信息学分析和白粉菌诱导后不同时期γVPE基因的表达情况,来探究感抗葡萄中γVPE基因在抵抗白粉菌入侵过程中的作用,为培育新型抗病葡萄品种提供参考价值。
1 材料和方法
1.1 植物材料
中国野生华东葡萄‘白河-35-1’(Vitispseudoreticulataaccession.‘Baihe-35-1’)和欧洲葡萄‘佳丽酿’(Vitisviniferacv. Carinena)种植于西北农林科技大学园艺学院种质资源圃,葡萄白粉菌{ErysiphenecatorSchw. [syn.Uncinulanecator(Schw.) Burr.]}取自资源圃中欧洲葡萄‘赤霞珠’(Vitisviniferacv. ‘Cabernet Sauvignon’)。
1.2 方 法
1.2.1 白粉菌接种与观察 采用压片法[23],将赤霞珠叶片上的白粉菌接种于生长状况良好的‘白河-35-1’与‘佳丽酿’植株的新鲜叶片上,在经白粉菌诱导(PM)和未经白粉菌诱导(CK)的‘白河-35-1’与‘佳丽酿’植株上分别采集0、4、8、12、24、48、72及168 h 共 8个时期的葡萄叶片,将采集的叶片经液氮迅速冷冻后置于-80 ℃保存。
1.2.2 葡萄抗白粉病相关基因γVPE的克隆 使用Omega Plant RNA Kit 试剂盒分别提取经白粉菌诱导(PM)和未经白粉菌诱导(CK)的‘白河-35-1’共8个时期的叶片RNA,使用Prime ScriptTMRT reagent Kit试剂盒进行反转录合成cDNA第一链,获得白粉菌诱导后不同时期内中国野生华东葡萄‘白河-35-1’、欧洲葡萄‘佳丽酿’的cDNA。
以‘无核白’葡萄(Vitisviniferacv.Thompson Seedless)(登陆号为KU240054)γVPE基因的序列为参考,使用Primer premier 5.0 软件设计引物γVPE-F(5′-GGCTCCGATGACTATCTTTCCG-3′)和γVPE-R(5′-GGAGCAACCAGTAGAAGCAGCA-3′),以白粉菌诱导的‘白河-35-1’与‘佳丽酿’cDNA为模板,使用LATaq酶(TaRaKa)扩增γVPE基因。RT-PCR反应体系为:模板50 ng,引物各1 μL(10 μmol/L),10×LA PCR Buffer(含Mg2+)3 μL,dNTP 2.5 μL,LATaqDNA聚合酶1.5U,加ddH2O补齐至30 μL。RT-PCR反应程序为:94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸2 min 30 s,34个循环;72 ℃延伸10 min,4 ℃保存。PCR产物经1.5% 琼脂糖凝胶电泳检测后,将PCR产物回收并连接至克隆载体pMD19-T上,再将连接产物转化至大肠杆菌(E.coli)感受态细胞Top10中,通过蓝白斑筛选挑取白斑单菌落进行菌落PCR检测,获得阳性菌株后送至奥科公司测序。
1.2.3γVPE基因的序列分析 将测序获得的γVPE基因的cDNA序列在NCBI数据库中进行核苷酸和氨基酸序列比对,在ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf/)中找出目标序列的最大开放阅读框。使用Expasy中的Protparam程序(http://web.expasy.org/protparam/)分析γVPE基因的理化性质,通过ProtScale程序(http://web.expasy.org/protscale/)对γVPE蛋白的疏水性进行分析,用TMHMM 2.0程序 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)分析γVPE蛋白是否具有跨膜区域。用MEGA 6.0软件进行进化树分析。用DNAMAN软件,将‘白河-35-1’和‘佳丽酿’γVPE基因的氨基酸序列与拟南芥、‘无核白’和‘黑比诺’VPE基因家族所有成员的氨基酸序列进行对比分析。用SWISS-MODEL (http://swissmodel.expasy.org/)同源建模法构建VpγVPE蛋白的三级结构图,并在图中标注底物结合口袋的3个关键氨基酸位点的位置。
1.2.4 葡萄白粉菌诱导后γVPE基因的表达分析 根据γVPE基因的cDNA序列设计实时荧光定量引物,qRT-PCR-γVPE-F(5′-CAACCTGCGGACTGAAACG-3′)和qRT-PCR-γVPE-R(5′-TGTTGAGACTTAGATCACCATATTGC-3′)。以‘白河-35-1’和‘佳丽酿’植株8个时期的叶片cDNA为模板,以葡萄18S rRNA为内参基因,引物序列qRT-PCR-18S rRNA-F(5′-CAACAAACCCCGACTTCTG-3′)和qRT-PCR-18S rRNA-R(5′-TGTCACTACCTCCCCGTGTC-3′),根据实时荧光定量试剂盒SYBR Premix ExTaqTM Ⅱ(TaRaKa)说明书进行qRT-PCR。qRT-PCR反映体系为:cDNA 1 μL,引物各0.8 μL(10 μmol/L),2×SYBR 10 μL,ddH2O 7.4 μL。PCR反应程序:95 ℃ 3 min;95 ℃ 5 s,58 ℃ 30 s,45个循环;58 ℃ 15 s,75个循环。每个反应重复3次,用The iQ5 Real-Time PCR Detiction System仪器进行实时荧光定量PCR反应,用Excel处理数据并生成图表。
2 结果与分析
2.1 葡萄抗白粉病相关基因γVPE的克隆
以γVPE-F和γVPE-R为引物,以经白粉菌诱导的‘白河-35-1‘和’佳丽酿‘的叶片cDNA为模板,用LATaq酶扩增γVPE基因。获得长约1 700 bp目的片段(图1)。测序结果显示,‘白河-35-1’和‘佳丽酿’葡萄中γVPE基因cDNA序列长度均为1 624 bp,ORF为1 482 bp,编码493个氨基酸,分别命名为VpγVPE和VvCγVPE。可以看出葡萄属不同种间的γVPE基因序列的保守性很高。
2.2 葡萄 γVPE基因序列分析
经ProtParam程序预测,‘白河-35-1’的VpγVPE基因编码493个氨基酸,分子量约为54 041.6 Da,理论等电点为5.28,不稳定指数为43.51,‘佳丽酿’VvCγVPE基因编码493个氨基酸,分子量约为54 056.6 Da,理论等电点为5.17,不稳定指数为43.62,‘白河-35-1’与‘佳丽酿’得出的结果相类似,推测γVPE为不稳定的酸性蛋白。用ProtScale程序对γVPE蛋白进行疏水性分析,结果表明该蛋白拥有多个亲水和疏水区域,在10 aa左右存在一个强的亲水区域。经TMHMM 2.0程序分析γVPE蛋白的跨膜区域,结果表明该蛋白不存在跨膜结构域,γVPE为典型的非跨膜蛋白。
图1 葡萄γVPE基因的扩增M1. DL 2000; 1. VpγVPE; M2. DNA marker Ⅲ; 2. VvCγVPEFig. 1 Amplification of γVPE gene in grape
使用MEGA 6.0进行群体多序列对比,构建系统发育进化树(图2)。依据拟南芥VPE基因与其他物种中已鉴定出的VPE基因的同源性,将其分为3个亚家族,即营养型、种子型和未知型,发现‘白河-35-1’、‘佳丽酿’葡萄的γVPE基因处于同一分支,属于营养型亚家族;3个低等植物地衣、苔藓和绿藻中仅仅SmoVPE1、SmoVPE2基因与高等植物中种子型亚家族亲缘关系较近,其余VPE基因均未与高等植物的VPE基因分到同一亚家族中,说明VPE基因在低等植物与高等植物中的进化过程可能差异较大。
采用DNAMAN软件,将获得的‘白河-35-1’、‘佳丽酿’γVPE基因的氨基酸序列与拟南芥、‘无核白’和‘黑比诺’VPE基因家族的所有成员进行氨基酸多序列比对分析(图3),发现与拟南芥中的4个VPE基因和葡萄中的βVPE、δVPE基因相比,‘白河-35-1’、‘佳丽酿’、‘无核白’和‘黑比诺’的γVPE基因在395位点的丝氨酸(Ser)均变为丙氨酸(Ala),该氨基酸是VPE结构中底物结合口袋域的3个关键氨基酸中的一个。

▲. ‘白河-35-1’VpγVPE基因;●. ‘佳丽酿’VvCγVPE基因;分支上的数字表示1000次重复抽样中符合聚类的百分数图2 葡萄VpγVPE和VvCγVPE基因的进化树分析▲. VpγVPE gene in Vitis pseudoreticulata accession.‘Baihe-35-1’;●. VvCγVPE gene in Vitis vinifera cv. ‘Carinena’;The numbers on the branches represent the percentages of times that the species are grouped together in bootstrap analysis for 1 000 replicatesFig. 2 Phylogenetic trees of VpγVPE gene and VvCγVPE gene of grape

At. 拟南芥;VvPN. 黑比诺;VvTS. 无核白;Vp. 白河-35-1;VvC. 佳丽酿;▲. 2个催化二联体;◆. 3个关键氨基酸;*.表示突变位点图3 葡萄VpVPE、VvCVPE基因和其他VPE基因的氨基酸序列比对分析At. Arabidopsis thaliana; VvPN. Vitis vinifera.Pinot Noir; VvTS. Vitis vinifera.Thompson Seedless; Vp. Vitis pseudoreticulata accession. Baihe-35-1; VvC. Vitis vinifera cv. Carinena; ▲. Catalytic dyad; ◆. Three key amino acids; *. The mutation siteFig. 3 Alignment of the amino acid sequences of VpγVPE, VvCγVPE gene in grape with other VPE genes
在SWISS-MODEL服务器中,与VpγVPE基因的氨基酸序列相似度最高的是哺乳动物中的天冬酰胺内肽酶(Asparaginyl Endopeptidase,AEP),相似度达44.09%。底物结合口袋的3个关键氨基酸中,精氨酸(Arg111)处在无规则卷曲区域,精氨酸(Arg389)和丙氨酸(Ala395)位于α螺旋区域(图4)。
2.3 白粉菌诱导后γVPE基因在不同时期的表达
通过实时荧光定量PCR技术,分析经白粉菌诱导(PM)和未经白粉菌诱导(CK)的‘白河-35-1’和‘佳丽酿’植株叶片在不同时期内γVPE基因的表达量(图5),发现‘白河-35-1’中γVPE基因在白粉菌诱导后的24 h内,VpγVPE基因的表达量变化不大,仅在诱导后的4 h有所增长,并在随后的20 h内逐渐下降,在诱导后的48 hVpγVPE基因的表达量显著增长并达到整个诱导过程的最高水平,随后又逐渐下降并在诱导后的168 h达到另一个高峰。与未经白粉菌诱导的对照组相比,VpγVPE基因经白粉菌诱导后在最高峰48 h的表达量约为前者的2.5倍。‘佳丽酿’的VvCγVPE基因在白粉菌诱导后的4 h内表达量显著增加,随后降低,在24与72 h 也略有增加,但是在4 h表达量最显著约为未经处理对照组的2倍。结果表明γVPE基因的表达量的变化与葡萄白粉菌的诱导相关。

红色表示α螺旋;黄色表示β折叠;蓝色表示无规则卷曲;箭头所指为底物结合口袋的3个关键氨基酸图4 葡萄VpγVPE蛋白的三级结构预测Red represents alpha helix; yellow represents beta turn; blue represents random coil; The arrow represents three key amino acids for the substrate pocketFig. 4 Prediction of tertiary structure of VpγVPE protein in grape
3 讨 论
VPE的结构最初是从蓖麻种子VPE的cDNA序列中推导出来[16]。VPE蛋白与半胱氨酸蛋白酶caspase-1类似,包含一个催化二联体(由1个组氨酸His和1个半胱氨酸Cys构成)和一个由3个氨基酸(2个精氨酸和1个丝氨酸)构成的底物结合口袋域。本研究将获得的VpγVPE、VvCγVPE基因的氨基酸序列和其他物种的VPE基因的氨基酸序列进行聚类分析,构建系统发育进化树,结果表明,‘白河-35-1’、‘佳丽酿’、‘无核白’和‘黑比诺’的γVPE基因处于同一营养型分支。且多序列氨基酸分析表明葡萄γVPE基因底物结合口袋域的3个关键氨基酸之一的丝氨酸(Ser395)均变为丙氨酸(Ala),这表明葡萄的底物口袋结合域与caspase-1蛋白的底物口袋结合域有所不同。研究发现,羧肽酶Y(carboxypeptidase Y ,CPY)是γVPE蛋白的直接底物[24],湖北海棠γVPE基因底物结合口袋域中的丝氨酸(Ser)被苏氨酸(Thr396)取代后,γVPE基因的底物结合口袋域形成了一个活性位点,并与类羧肽酶(carboxypeptidase-like,CPYL)互作后形成完美的受体-配体互作模型“诱导契合-锁钥”[25],该模型指的是酶与其底物在互作前二者的结构具有互补性,有利于酶促反应的发生[26-27]。这些研究表明植物γVPE基因底物结合口袋域的3个关键氨基酸之一的丝氨酸(Ser395)有可能因物种不同而发生变化。本研究中葡萄γVPE基因的底物结合口袋域发生的变化是否会与某些酶促反应相关,这还有待进一步研究。因为葡萄γVPE基因的底物仍然未知,不过其底物应该是液泡中一些与衰老、机械损伤、各种胁迫有关的蛋白。若能找到这些蛋白,对进一步研究γVPE基因的各种功能将会提供极大的帮助。
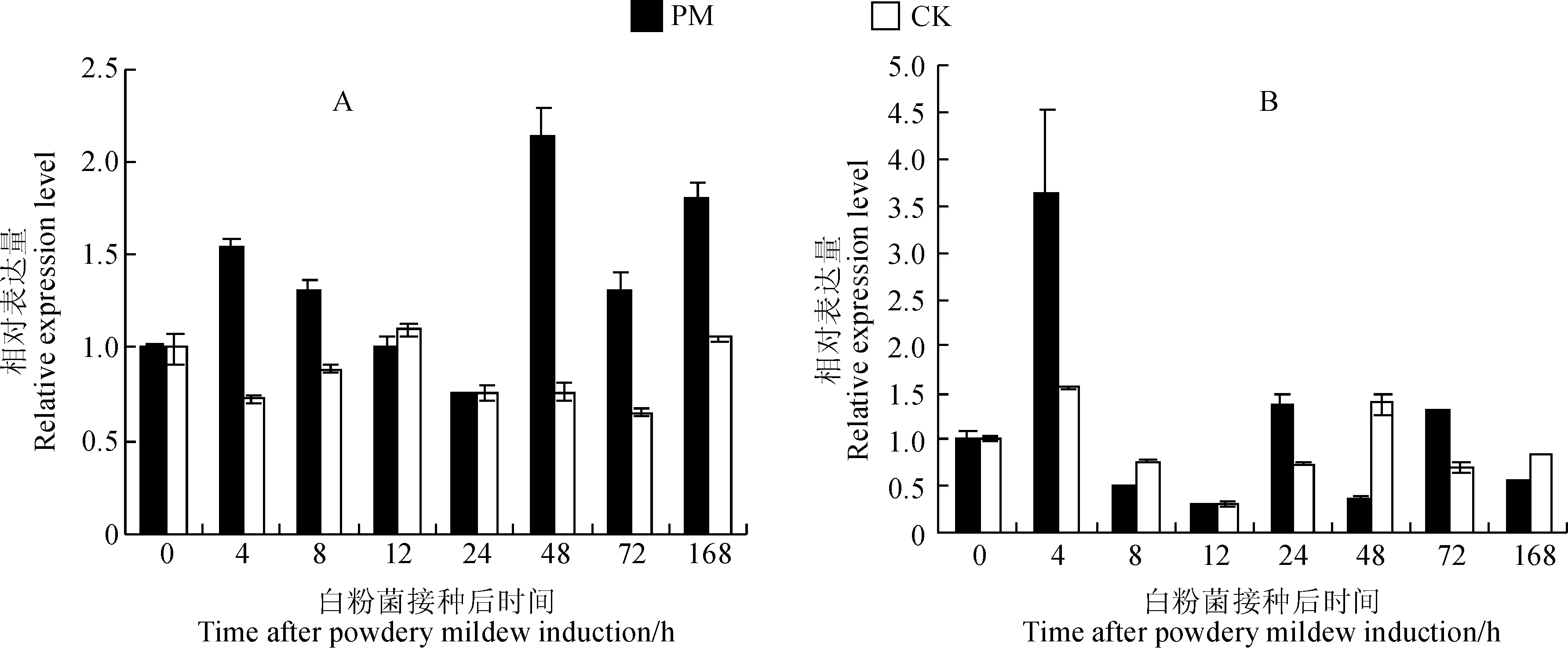
PM.处理组;CK.对照组;Vp. 白河-35-1,VvC. 佳丽酿图5 葡萄VpγVPE (A) 和VvCγVPE (B) 基因在白粉菌诱导后不同时期内的表达量PM. Experiment groups; CK. Control groups; Vp. Vitis pseudoreticulata accession.Baihe-35-1; VvC. Vitis vinifera cv. CarinenaFig. 5 Expression profile of VpγVPE (A) and VvCγVPE (B) gene after powdery mildew induced in different periods in grape
VPE家族是一种很重要的半胱氨酸蛋白酶,在植物发育进程中它在PCD和超敏反应中起着关键的作用[16,28]。Hatsugai通过病毒诱导基因沉默技术使烟草中的VPE基因沉默,当烟草花叶病毒侵染未沉默VPE基因的植株时,在24 h后可以观察到明显的病变,但是当烟草花叶病毒侵染已经沉默了VPE基因的植株时,在24 h后未观察到明显的病变,说明VPE基因在病毒诱导的超敏反应中起重要作用[9]。研究还发现,当用乙烯、水杨酸、机械损伤处理拟南芥植株时γVPE基因的表达上调,而且在12、24和48 h响应均比较明显[29]。抗病苹果品种(MaluspumilaMill. cv. Free Redstar)在接种解淀粉欧氏菌(Erwiniaamylovora)后,VPE基因的表达量在诱导后的30 min和36 h有所增加[30]。相似的结果在花生的感抗品种中也发现了,用黑斑病菌侵染花生叶片,24 hAdVPE基因在抗病品种中的表达量是感病品种中的9倍左右[31]。而本研究中VpγVPE基因、VvCγVPE基因在白粉菌诱导后不同时期内的表达量也有所不同,VpγVPE基因的表达量在诱导后的前期(4和48 h)和后期(168 h)均有所增加,VvCγVPE基因在诱导后4 h的表达量最高,随后降低。同时接种白粉菌后‘佳丽酿’、‘白河-35-1’,均出现不同程度的病斑,通过细胞坏死来抵抗白粉菌的侵染。因为2种葡萄抗性不同,所以γVPE基因在白粉菌诱导后出现了不同的表达模式。但是γVPE基因与白粉菌之间的具体互作模式还有待进一步研究。
综上所述,葡萄中的γVPE基因底物结合口袋域中3个关键氨基酸之一的丝氨酸(Ser395)变为丙氨酸(Ala),并且γVPE基因是与葡萄抗性相关的基因,因此下一步应是将γVPE基因敲除或通过转基因技术得到转基因拟南芥或烟草,进一步研究γVPE基因的抗病性。为今后通过杂交育种和转基因技术定向改良欧洲葡萄的抗性提供依据。
[1] JONATHAN D G, DANGL J L. The plant immune system[J].Nature, 2006, 444(7 117): 323-329.
[2] GABRIEL D W, ROLFE B G. Working models of specific recognition in plant-microbe interactions[J].AnnualReviewofPhytopathology, 1990, 28(1): 365-391.
[3] HEATH M C. Hypersensitive response-related death[J].PlantMolecularBiology, 2000, 44(3): 321-334.
[4] GREENBERG J T. Programmed cell death in plant-pathogen interactions[J].AnnualReviewofPlantBiology, 1997, 48(1): 525-545.
[5] KACPRZYK J, DALY C T, MCCABE P F. Chapter 4-The botanical dance of death: programmed cell death in plants[J].AdvancesinBotanicalResearch, 2011, 60: 169-261.
[6] KINOSHITA T, NISHIMURA M, HARA-NISHIMURA I. The sequence and expression of the γ-VPE gene, one member of a family of three genes for vacuolar processing enzymes inArabidopsisthaliana[J].PlantandCellPhysiology, 1995, 36(8): 1 555-1 562.
[7] HARA-NISHIMURA I, HATSUGAI N, NAKAUNE S,etal. Vacuolar processing enzyme: an executor of plant cell death[J].CurrentOpinioninPlantBiology, 2005, 8(4): 404-408.
[8] HARA -NISHIMURA I, INOUE K, NISHIMURA M. A unique vacuolar processing enzyme responsible for conversion of several proprotein precursors into the mature forms[J].FEBSLetters, 1991, 294(1): 89-93.
[9] HARA-NISHIMURA I, NISHIMURA M. Proglobulin processing enzyme in vacuoles isolated from developing pumpkin cotyledons[J].PlantPhysiology, 1987, 85(2): 440-445.
[10] DEL P O, LAM E. Caspases and programmed cell death in the hypersensitive response of plants to pathogens[J].CurrentBiology, 1998, 8(20): 1 129-1 132.
[11] HATSUGAI N, KUROYANAGI M, YAMADA K,etal. A plant vacuolar protease, VPE, mediates virus-induced hypersensitive cell death[J].Science, 2004, 305(5 685): 855-858.
[12] 冉 昆,马怀宇,杨洪强.植物细胞程序性死亡中的类胱天蛋白酶研究进展[J].西北植物学报, 2008, 28(12):2 564-2 570.
RAN K, MA H Y, YANG H Q. Recent advance in the study of caspase-like proteases involved in plant programmed cell death[J].ActaBotanicaBoreali-OccidentaliaSinica, 2008, 28(12):2 564-2 570.
[13] BECKER C, SHUTOV A D, NONG V H,etal. Purification, cDNA cloning and characterization of proteinase B, an asparagine-specific endopeptidase from germinating vetch (ViciasativaL.) seeds[J].EuropeanJournalofBiochemistry, 1995, 228(2): 456-462.
[14] HARA-NISHIMURA I. Asparaginyl endopeptidase[M]. Pittsburgh: Handbook of Proteolytic Enzymes, 1998: 746-749.
[15] HARA -NISHIMURA I, TAKEUCHI Y, NISHIMURA M. Molecular characterization of a vacuolar processing enzyme related to a putative cysteine proteinase of Schistosoma mansoni[J].ThePlantCell, 1993, 5(11): 1 651-1 659.
[16] HIRAIWA N, NISHIMURA M, HARA-NISHIMURA I. Vacuolar processing enzyme is self-catalytically activated by sequential removal of the C-terminal and N-terminal propeptides[J].FEBSLetters, 1999, 447(2): 213-216.
[17] KUROYANAGI M, NISHIMURA M, HARA-NISHIMURA I. Activation ofArabidopsisvacuolar processing enzyme by self-catalytic removal of an auto-inhibitory domain of the C-terminal propeptide[J].PlantandCellPhysiology, 2002, 43(2): 143-151.
[18] KUROYANAGI M, YAMADA K, HATSUGAI N,etal. Vacuolar processing enzyme is essential for mycotoxin-induced cell death inArabidopsisthaliana[J].JournalofBiologicalChemistry, 2005, 280(38): 32 914-32 920.
[19] NICHOLSON D W. Caspase structure, proteolytic substrates, and function during apoptotic cell death[J].CellDeathandDifferentiation, 1999, 6(11): 1 028-1 042.
[20] ROJO E, MARTIN R, CARTER C,etal. VPEγ exhibits a caspase-like activity that contributes to defense against pathogens[J].CurrentBiology, 2004, 14(21): 1 897-1 906.
[21] MISAS-VILLAMIL J C, TOENGES G, KOLODZIEJEK I,etal. Activity profiling of vacuolar processing enzymes reveals a role for VPE during oomycete infection[J].ThePlantJournal, 2013, 73(4): 689-700.
[22] 李树秀.无核葡萄胚株败育过程差异表达基因和VPE家族的克隆与分析[D].陕西杨凌: 西北农林科技大学, 2012.
[23] WANG Y, LIU Y, HE P,etal. Evaluation of foliar resistance toUncinulanecatorin Chinese wildVitisspecies[J].Vitis, 1995, 34(3): 159-164.
[24] ROJO E, ZOUHAR J, CARTER C,etal. A unique mechanism for protein processing and degradation inArabidopsisthaliana[J].ProceedingsoftheNationalAcademyofSciences, 2003, 100(12): 7 389-7 394.
[25] RAN K, YANG H, SUN X,etal. Isolation, characterization, and structure analysis of a vacuolar processing enzyme gene (MhVPEγ) fromMalushupehensis(Pamp) Rehd[J].AppliedBiochemistryandBiotechnology, 2014, 173(2): 579-595.
[26] HATSUGAI N, KUROYANAGI M, NISHIMURA M,etal. A cellular suicide strategy of plants: vacuole-mediated cell death[J].Apoptosis, 2006, 11(6): 905-911.
[27] KOSHLAND J D. Application of a theory of enzyme specificity to protein synthesis[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 1958, 44(2): 98.
[28] 张子剑,潘 荣,周 园,等.酶促反应的“诱导契合-锁钥”模式[J].生物化学与生物物理进展, 2011, 38(5):418-426.
ZHANG Z J, PAN R, ZHOU Y,etal. “Induced Fit-Lock and Key” Model in enzymic reactions[J].ProgressinBiochemistryandBiophysics, 2011, 38(5): 418-426.
[29] KINOSHITA T K, HIRAIWA N, KONDO M,etal. Vacuolar processing enzyme is up-regulated in the lytic vacuoles of vegetative tissues during senescence and under various stressed conditions[J].PlantJournal,1999, 19(1): 43-53.
[30] IAKIMOVA E T, SOBICZEWSKI P, MICHALCZUK L,etal. Morphological and biochemical characterization ofErwiniaamylovora-induced hypersensitive cell death in apple leaves[J].PlantPhysiologyandBiochemistry, 2013, 63(4): 292-305.
[31] KUMAR D, RAMPURIA S, SINGH N K,etal. Characterization of a vacuolar processing enzyme expressed inArachisdiogoiin resistance responses against late leaf spot pathogen,Phaeoisariopsispersonata[J].PlantMolecularBiology, 2015, 88(1/2): 3 078-3 083.
(编辑:宋亚珍)
Clonging and Expression Analysis ofγVPEGene Related to Powdery Mildew Resistance in Grapevine
WANG Yanqing, ZHANG Xiaoying, SONG Jianing, WANG Yuejin, ZHANG Chaohong*
(College of Horticulture, Northwest A&F University, State Key Laboratory of Crop Stress Biology in Arid Areas, Key Laboratory Biology and Genetic Improvement of Horticulture Crops, Ministry of Agriculture, Yangling, Shaanxi 712100,China)
Vacuolar processing enzyme (γVPE) was cloned from Chinese wildVitispseudoreticulataaccession.‘Baihe-35-1’ andVitisviniferacv.‘Carinena’ by RT-PCR. They were namedVpγVPEandVvCγVPE. The full length ofVpγVPEandVvCγVPEcDNA are 1 624 bp, and the open reading frame are 1 482 bp, encoding 493 amino acid. The alignment of the amino acid sequence revealed that Ser 395, one key amino acid in substrate pocket, was replaced by Ala inVitispseudoreticulataaccession.‘Baihe-35-1’,Vitisviniferacv.‘Carinena’,Vitisviniferacv.‘Thompson seedless’ , andVitisviniferacv.‘Pinot Noir’. The different expression profile ofVpγVPEgene andVvCγVPEgene in different periods after powdery mildew induced were analyzed by Real-time fluorescent quantitative PCR. After induction the expression ofVpγVPEgene increase slightly in 4 h, 48 h, 168 h and theVvCγVPEgene shows predominant expression in 4 h after that it decreases slowly. The study shows thatγVPEis related to resistant to powdery mildew. The study provides reference value to the molecular mechanism ofγVPEgene in disease resistance.
grape,γVPE, gene clone, expression analysis, powdery mildew
1000-4025(2016)08-1507-08
10.7606/j.issn.1000-4025.2016.08.1507
2016-04-07;修改稿收到日期:2016-06-02
国家自然科学基金(31171926);国家现代农业产业技术体系建设专项(CARS-30-yz-7);杨凌示范区农业科技示范推广项目(2015-TS-10)
王晏青(1989-),女,硕士,主要从事果树育种及生物技术研究。E-mail:876908609@qq.com
*通信作者:张朝红,副教授,硕士生导师,主要从事葡萄种质资源与生物技术育种研究工作。E-mail:zhangchaohong@nwsuaf.edu.cn
Q785; Q786
A
